É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um conjunto de técnicas de triagem para uma rápida visão geral da função dos neutrófilos
Neste Artigo
Resumo
Este protocolo apresenta um conjunto de ensaios funcionais de neutrófilos para ser usado como um método de triagem para cobrir funções de diferentes vias de sinalização. O protocolo inclui uma avaliação inicial e simples da viabilidade celular, pureza, produção de espécies reativas de oxigênio, migração em tempo real, fagocitose e uma sugestão preliminar de armadilhas extracelulares para neutrófilos.
Resumo
Os neutrófilos são conhecidos como uma das primeiras linhas de defesa da resposta imune inata e podem desempenhar muitas funções celulares particulares, como quimiotaxia, migração reversa, fagocitose, degranulação de enzimas e metabólitos citotóxicos e liberação de DNA como armadilhas extracelulares de neutrófilos (NETs). Os neutrófilos não só têm sinalização fortemente regulada, mas também participam da regulação de outros componentes do sistema imunológico. Como os neutrófilos frescos são terminalmente diferenciados, de curta duração e altamente variáveis entre os indivíduos, é importante aproveitar ao máximo as amostras coletadas. Os pesquisadores muitas vezes precisam realizar ensaios de triagem para avaliar uma visão geral das muitas funções dos neutrófilos que podem ser afetadas por condições específicas sob avaliação. Um conjunto de testes seguindo um único processo de isolamento de neutrófilos de densidade normal foi desenvolvido para atender a essa necessidade, buscando um equilíbrio entre rapidez, abrangência, custo e acurácia. Os resultados podem ser usados para fundamentar e orientar estudos de seguimento aprofundados. Este procedimento pode ser realizado em um tempo médio de 4 h e inclui a avaliação da viabilidade celular, produção de espécies reativas de oxigênio (EROs), migração em tempo real e fagocitose de leveduras em lâminas de vidro, deixando células suficientes para abordagens mais detalhadas, como estudos ômicos. Além disso, o procedimento inclui uma maneira de observar facilmente uma sugestão preliminar de TNEs após coloração panóptica rápida observada por microscopia de luz, com falta de marcadores específicos, embora suficientes para indicar se esforços adicionais nesse sentido valeriam a pena. A diversidade de funções testadas combina pontos comuns entre os testes, reduzindo o tempo e os gastos da análise. O procedimento foi denominado NeutroFun Screen e, apesar de apresentar limitações, equilibra os fatores supracitados. Além disso, o objetivo deste trabalho não é um conjunto de testes definido, mas sim uma diretriz que possa ser facilmente ajustada aos recursos e demandas de cada laboratório.
Introdução
Os neutrófilos são as células imunes inatas mais abundantes no sangue humano e são conhecidos por desempenhar um papel importante na infecção e inflamação, sendo os primeiros respondedores a chegar ao local do dano tecidual1. Nos últimos anos, tem havido um crescente reconhecimento do papel crucial que os neutrófilos desempenham em uma variedade de doenças e no suporte da homeostase2. Os neutrófilos não só têm sinalização fortemente regulada, mas também participam da regulação de outros componentes do sistema imune 3,4,5. Portanto, investigar os neutrófilos e suas diversas funções celulares incomuns, como quimiotaxia, migraçãoreversa6, fagocitose7, burst respiratório8 e liberação de armadilhas extracelulares de neutrófilos (NETs)7, é imperativo em inúmeros contextos de pesquisa onde é necessário avaliar as potenciais alterações funcionais, morfológicas ou moleculares dos neutrófilos desencadeadas por condições específicas em análise.
Os neutrófilos recém-isolados são terminalmente diferenciados, de curta duração, altamente dinâmicos e facilmente ativados9. No entanto, um método de armazenamento eficiente que não afete as respostas dos neutrófilos ainda não foi alcançado, tornando desafiadora a realização de múltiplos ensaios que devem ser ininterruptos. Além disso, análises funcionais previamentedescritas10,11, baseadas em ensaios que requerem citometria e/ou coloração fluorescente, podem não ser uma escolha viável quando uma avaliação ampla e inicial dos neutrófilos é necessária.
Para resolver essas questões, este protocolo descreve um conjunto de testes que podem ser realizados após um único processo de isolamento, incluindo a avaliação da viabilidade celular, produção de espécies reativas de oxigênio (EROs), migração em tempo real e fagocitose de Saccharomyces cerevisiae, cujos resultados podem ser usados para fundamentar estudos de seguimento aprofundados. Este procedimento, denominado NeutroFun Screen, foi projetado para abranger as principais atividades efetoras, exceto a degranulação, e pode ser concluído em um tempo médio de 4 h, incluindo 1 h de ativação. Além disso, as células remanescentes podem ser usadas para abordagens mais detalhadas, como estudos ômicos. A vantagem desse método está no equilíbrio entre rapidez, abrangência, custo e precisão.
Além disso, há uma maneira de observar facilmente uma sugestão preliminar de NETs, sem marcadores específicos, mas o suficiente para indicar se mais esforços nessa direção valeriam a pena. A diversidade de funções testadas visa combinar pontos comuns entre os testes, reduzindo o tempo de análise e os gastos. O principal objetivo deste método é fornecer uma análise funcional equilibrada em relação à velocidade, abrangência, custo e acurácia que permita uma visão geral da resposta dos neutrófilos, tornando-se um passo inicial útil na investigação dos efeitos de novos estímulos sobre os neutrófilos de densidade normal.
Protocolo
Todos os experimentos seguiram rigorosamente as diretrizes éticas estabelecidas pelo Comitê de Ética em Pesquisa da Universidade de Brasília (processo 13364819.0.0000.5558), e as amostras foram identificadas por códigos para garantir o anonimato dos doadores. As células foram obtidas de doadores normais do sexo masculino, saudáveis, com idade entre 18 e 35 anos, que assinaram o termo de consentimento livre e esclarecido e preencheram os seguintes critérios de elegibilidade: não fumantes/vapers, sem condições crônicas de saúde e sem história de condições inflamatórias nos últimos 14 dias.
1. Coleta de sangue
- Coloque assepticamente 0,3 mL de 5.000 UI/mL de heparina (ver Tabela de Materiais) em uma seringa estéril de 20 mL para heparinizá-la.
- Aplicar um torniquete venoso cerca de 4 pontos acima do local da punção e identificar a veia cubital ou cefálica mediana para punção venosa.
NOTA: Certifique-se de que o tempo total de torniquete não exceda 1 min. - Limpar o local da punção com álcool a 70% e realizar a punção venosa.
- Inverta suavemente a seringa três ou quatro vezes depois de coletar o sangue para misturar o sangue e a heparina corretamente.
2. Isolamento de neutrófilos
NOTA: Leucócitos polimorfonucleares (PMNs) são isolados por centrifugação por gradiente de densidade seguido de lise hipotônica das hemácias remanescentes (RBC), como descritoanteriormente11 com algumas alterações. Este método não é obrigatório para a realização dos ensaios de triagem, podendo ser substituído desde que o método escolhido resulte em uma viabilidade de >97%, priming ou ativação de <3% dos PMNs, e produza células suficientes para todos os ensaios, réplicas e condições. A realização dessas etapas em condições assépticas e o uso de soluções livres de endotoxinas são mandatórios para evitar a ativação celular.
- Fazer diluições de 12 mL de meios de separação de 60% e 70% (comercialmente disponíveis; ver Tabela de Materiais) em tubos cônicos de 50 mL.
- Prepare o gradiente de baixo para cima adicionando 4 mL de cada vez a diluição de 60% sobre a diluição de 70%, usando uma pipeta de 5 mL. Faça isso suavemente para evitar misturar a interface.
- Colocar cuidadosamente 12 mL de sangue heparinizado sobre o gradiente de densidade. Centrifugar a 200 x g durante 15 min à temperatura ambiente.
OBS: A partir desta etapa, até a ativação do PMN, todos os reagentes e tubos utilizados devem ser mantidos em um resfriador cheio de gelo. - Descarte a camada de plasma/células mononucleares e, em seguida, transfira suavemente a camada acima da pastilha de eritrócitos para dois tubos cônicos de 15 mL com aproximadamente 7,5 mL em cada. Completar o volume do tubo com solução salina balanceada de Hank (HBSS; ver Tabela de Materiais).
- Centrifugar a 300 x g durante 5 min a 19 °C.
- Lave o pellet de célula com HBSS.
- Descarte o sobrenadante despejando o tubo e ressuspenda suavemente o pellet em 7 mL de HBSS.
- Centrifugar a 300 x g durante 5 minutos a 19 °C para remover todos os meios de separação.
- Realizar lise hipotônica das hemácias remanescentes.
- Descarte o sobrenadante e combine os pellets em um único tubo.
- Ressuspender a pastilha de CH/PMN em 3 mL de H2O estéril e adicionar 3 mL de HBSS (2x) dentro de 25 s para restaurar a osmolaridade. Em seguida, centrifugar a 300 x g por 5 min a 19 °C.
- Repita os passos 2.8.1 e 2.8.2 para uma pastilha branca e sem eritrócitos.
NOTA: O sobrenadante deve ser removido o mais rapidamente possível para minimizar o contacto dos neutrófilos com os produtos de degradação das hemácias. Alternativamente, a segunda lise hipotônica pode ser substituída ressuspendendo suavemente a camada residual de hemácias e removendo todo o sobrenadante, pois as hemácias restantes sedimentarão acima da pelota de PMN.
- Descarte o sobrenadante despejando o tubo, ressuspenda suavemente os PMNs no buffer restante e transfira-os para um microtubo gelado.
NOTA: Certifique-se de anotar o volume durante a transferência das células ressuspensas com uma micropipeta. - Transferir 3 x 1 μL da suspensão celular para uma lâmina de vidro limpa (três poços de 1 μL cada) e corar com panóptica rápida (ver Tabela de Materiais) para avaliação da morfologia e pureza12.
- Para coloração com panóptica rápida, imergir a lâmina cinco vezes no fixador panóptico n° 1, seis vezes em eosina n° 2 e duas vezes em hematoxilina n° 3, com duração de 1 s cada imersão.
- Lave suavemente a lâmina de vidro com água destilada.
- Deixe escorrer e secar ao ar.
- Observar ao microscópio e contar 300 células aleatórias em cada poço, diferenciando os neutrófilos dos demais granulócitos.
- Transferir 1 μL da suspensão celular para 49 μL do corante azul de tripano a 0,2%13 e contar as células usando uma câmara de Neubauer, distinguindo entre células mortas e viáveis.
- Ajustar a concentração celular para 6.667 células/μL utilizando uma solução de plasma autólogo a 50% e HBSS a 50% suplementada com cálcio e magnésio. Dividir uniformemente a suspensão de 6.667 células/μL entre os microtubos correspondentes às condições a serem testadas, incluindo o controle negativo.
NOTA: Qualquer concentração celular semelhante aos neutrófilos circulantes no organismo modelo pode ser usada, mas é importante usar a mesma concentração celular em todos os experimentos para reprodutibilidade.
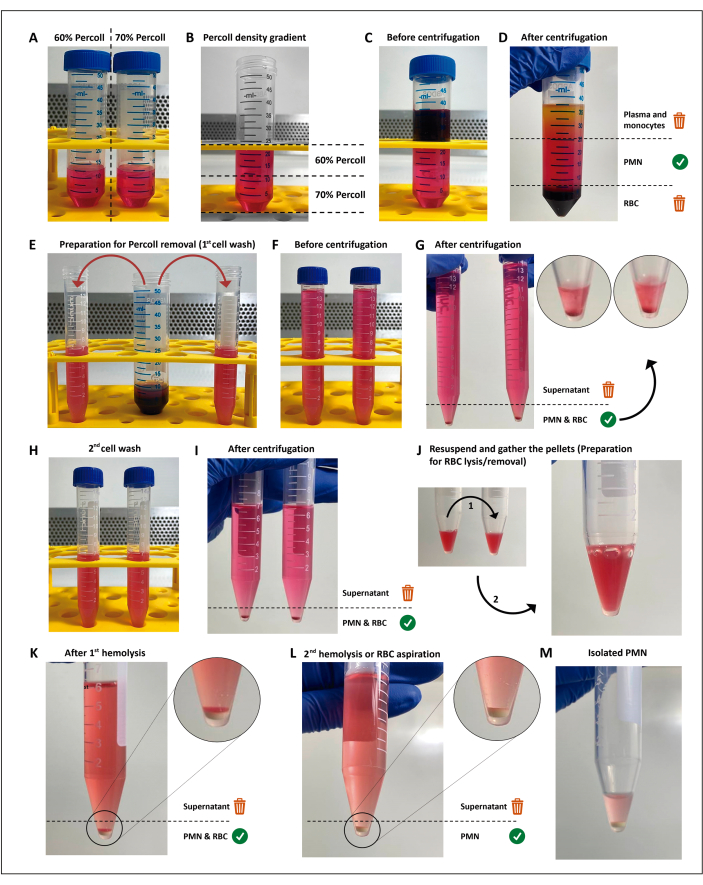
Figura 1: Protocolo de isolamento de neutrófilos. Duas concentrações do meio de separação (percoll) (A) são empilhadas (B), então o sangue é colocado em camadas no topo do gradiente de separação (C). Após a centrifugação, o PMN fica na camada central (D), que é dividida em dois tubos de 15 mL (E). A suspensão celular é lavada duas vezes em HBSS e centrifugada (G-I) para remover o meio, em seguida, as células são ressuspensas e as hemácias residuais são submetidas a duas rodadas de lise hipotônica (J-M). Clique aqui para ver uma versão maior desta figura.
3. Preparação para ativação de neutrófilos
- Em microtubos de 1,5 mL, preparar um sistema de ativação para cada condição de modo que a concentração celular final seja de 6.600 células/μL. Por exemplo, para testar os efeitos de 100 nM fMLP (N-formil-metionil-leucil-fenilalanina; ver Tabela de Materiais), adicione 5 μL de 10 μM fMLP a 495 μL da suspensão de 6.667 células/μL. Para o controle negativo (não estimulado), adicionar HBSS contendo Ca2+ e Mg2+.
NOTA: Para demonstrar esta metodologia, foram utilizadas as seguintes concentrações finais dos estímulos: 100 nM fMLP, 16 μM de falaxin, um peptídeo antimicrobiano de ocorrência natural14, e 100 nM PMA (phorbol 12-miristato 13-acetato) (ver Tabela de Materiais). - Incubar a 37 °C sem rotação.
NOTA: Todas as alíquotas para ensaios funcionais são retiradas desta suspensão celular, doravante denominada sistema de ativação.
4. Ensaio de cloreto de azul de nitrotetrazólio (NBT) para avaliação da produção de ROS
- Preparação da solução de trabalho NBT: Para cada condição experimental, prepare uma solução de trabalho NBT (ver Tabela de Materiais) de 6 mM usando as seguintes etapas:
- Dissolver 0,0005 g de NBT em 10 μL de dimetilsulfóxido (DMSO) e vórtice por pelo menos 15 min.
- Adicionar 90 μL de HBSS Ca2+Mg2+ e vórtice até 2 min.
OBS: Todas as etapas que envolvem o NBT devem ser realizadas no escuro.
- Realizar teste de lâminas NBT.
- Após 20 minutos de ativação celular, misture suavemente a suspensão celular e transfira cuidadosamente 2 μL de PMN para uma lâmina de vidro limpa. Incubar durante 20 min numa câmara humidificada a 37 °C.
OBS: Não espalhe muito a suspensão da célula sobre a lâmina; caso contrário, pode secar antes da incubação. - Adicionar 1 μL da solução de trabalho NBT sobre as células e incubar durante 20 minutos protegido da luz.
- Seque a lâmina com ar quente e fixe-a com uma gota de metanol em cada poço por 1 min. Coloração com 0,03% de safranina (ver Tabela de Materiais) por 1 min.
- Lave suavemente a lâmina de vidro com água destilada.
- Deixe a lâmina secar ao ar e observe ao microscópio.
- Contar 100 células aleatórias em cada poço, diferenciando neutrófilos com e sem depósitos de formazana.
- Após 20 minutos de ativação celular, misture suavemente a suspensão celular e transfira cuidadosamente 2 μL de PMN para uma lâmina de vidro limpa. Incubar durante 20 min numa câmara humidificada a 37 °C.
- Realizar ensaio de espectrofotometria NBT.
- Após 40 min de ativação celular, misture suavemente a suspensão celular e transfira 90 μL de PMNs do sistema de ativação para um microtubo limpo. Em seguida, adicione cuidadosamente 20 μL da solução NBT 6 mM. Incubar no escuro durante 20 minutos a 37 °C.
- Adicionar 100 μL de dodecil sulfato de sódio a 10% (SDS; ver Tabela de Materiais) e vórtice.
- Sonicate usando um sonicator de ponta a uma amplitude de 60%, cinco ciclos de 15 s cada com intervalos de 15 s. Centrifugar a 12.000 x g por 5 min.
- Transferir 60 μL do sobrenadante para uma placa de fundo claro de 96 poços e medir a absorbância do produto formazan a 570 nm.
5. Ensaio de fagocitose
- Prepare uma suspensão de 33.000 leveduras/μL para cada condição, conforme descrito abaixo:
- Adicionar aproximadamente 0,75 mg de levedura seca (Saccharomyces cerevisiae; ver Tabela de Materiais) a 200 μL de HBSS Ca2+Mg2+ e incubar num termomisturador a 100 °C com 500 rpm durante, pelo menos, 15 min.
- Homogeneizar a mistura por vórtice e transferir 5 μL de suspensão de levedura para 45 μL de corante azul de tripano a 0,2%. Conte as leveduras usando uma câmara de Neubauer.
- Ajustar a concentração da suspensão inicial para 33.000 células de levedura/μL utilizando HBSS Ca2+Mg2+. Mantenha a suspensão no gelo até o uso.
- Após 20 min de ativação celular, misturar suavemente a suspensão celular e transferir 5 μL do sistema de ativação para 5 μL da suspensão de 33.000 leveduras/μL de Saccharomyces cerevisiae em um novo microtubo estéril.
NOTA: A relação neutrófilo/levedura é de 1:5 (PMN:levedura). - Transferir imediatamente 6 μL da suspensão PMN/levedura para três poços de uma lâmina de vidro limpa (2 μL cada) e incubar a lâmina em uma câmara umidificada por 40 min.
OBS: Não espalhe muito a suspensão da célula sobre a lâmina; caso contrário, pode secar antes da incubação. - Secar a lâmina sob ar quente e manchar com panóptica rápida, conforme descrito no passo 2.9 acima.
NOTA: O terceiro passo da coloração panóptica rápida é fundamental para a análise microscópica da lâmina. A coloração da lâmina por ≥3 s nesta etapa pode torná-la imprópria para análise, uma vez que será difícil diferenciar leveduras de lobos nucleares de neutrófilos. - Observar as lâminas ao microscópio, contando 100 neutrófilos aleatórios de cada poço e discriminando entre PMNs positivos e negativos para fagocitose.
NOTA: Pelo menos uma partícula de levedura dentro ou em contato direto com a membrana celular PMN indica um PMN positivo para fagocitose. Se estiver interessado na relação levedura/neutrófilo, conte também o número de partículas de levedura engolfadas.
6. Ensaio de quimiotaxia PMN em tempo real
OBS: O ensaio de migração é realizado de forma semelhante ao protocolo descrito anteriormente15, com as seguintes adaptações:
- Prepare o gradiente quimiotático adicionando 160 μL de quimioatrativo (por exemplo, fMLP, IL-8, C5 ou LTB4; ver Tabela de Materiais) à câmara inferior de uma placa de análise de células em tempo real (RTCA) baseada em impedância. Para controles negativos e brancos, adicionar 160 μL de HBSS Ca2+Mg2+.
- Fixar a câmara superior e adicionar 25 μL de HBSS Ca2+Mg2+. Incubar à temperatura ambiente durante pelo menos 1 h para formar o gradiente quimiotático.
- Após 60 min de ativação celular, misturar suavemente a suspensão celular e colocar 60 μL de suspensão celular na câmara superior. Adicionar 60 μL de HBSS Ca2+Mg2+ ao branco.
- Coloque a placa RTCA e programe o software RTCA para medir o índice celular (IC) a cada 60 s por 2 h.
NOTA: As placas de ATR podem ser lavadas para reutilização conforme descrito anteriormente16. Em resumo, lave as câmaras e eletrodos de ATR com solução salina buferred de fosfato (PBS) três vezes, depois com água ultrapura tipo I duas vezes. Incubar a câmara inferior e superior com tripsina 0,25% 0,53 mM ácido etilenodiaminotetracético (EDTA) por 40 min. Lave com água ultrapura três vezes.
7. Ensaio sugestivo de NET
- Após 10 min de ativação celular, misturar suavemente a suspensão celular e transferir 4 μL dos PMNs de cada sistema de ativação sob avaliação, divididos em dois poços de uma lâmina de vidro limpa. Incubar numa câmara humidificada a 37 °C durante 30 min.
- Adicionar 1 μL de DNAse I a um dos poços e incubar durante 20 min a 37 °C (numa câmara húmida).
- Secar a lâmina e corar com panóptica rápida, conforme descrito anteriormente no passo 2.9 da seção "isolamento de neutrófilos".
- Avalie as lâminas ao microscópio.
Observação : procure qualquer indicação de versão NET, caracterizada pela presença de estruturas semelhantes à Web. Uma vez identificado, confirme se o tratamento com DNAse I foi capaz de remover tais estruturas. Este ensaio é sugestivo de formação de NET, uma vez que testes adicionais são necessários para confirmar sua presença.
Resultados
O método de isolamento baseado em densidade utilizado neste estudo (Figura 1) atendeu aos critérios para os experimentos propostos. Os parâmetros neutrófilos obtidos por esse método incluíram viabilidade ≥98%, pureza ≥94% e rendimento celular ≥1,5 x 107, sem ativação detectável pelos testes de triagem. Duas etapas relevantes no isolamento dos PMNs são a anticoagulação e a remoção das hemácias. Manter o tubo de sangue anticoagulado ou a seringa em um balanço s...
Discussão
Os neutrófilos são células altamente dinâmicas e responsivas, de curta duração e ainda não podem ser criopreservados19, o que torna as investigações sobre sua biologia desafiadoras. Portanto, é essencial seguir passos cuidadosos para obter neutrófilos viáveis, enriquecidos e em repouso11,20. Este estudo empregou uma técnica de isolamento baseada em densidade que enfatiza a manipulação suave e mínima, bem como o uso de baixa...
Divulgações
Os autores declaram a inexistência de conflitos de interesse.
Agradecimentos
As agências de fomento FAPDF, CNPq, CAPES, UnB, FINEP e FINATEC são reconhecidas pelos autores.
Materiais
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
Referências
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados