A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סדרה של טכניקות סינון לסקירה מהירה של פונקציית נויטרופיל
In This Article
Summary
פרוטוקול זה כולל סדרה של בדיקות פונקציונליות נויטרופילים שישמשו כשיטת סינון לכיסוי פונקציות ממסלולי איתות שונים. הפרוטוקול כולל הערכה ראשונית ופשוטה של כדאיות התא, טוהר, ייצור מיני חמצן תגובתי, נדידה בזמן אמת, פגוציטוזה, והצעה ראשונית של מלכודות חוץ-תאיות של נויטרופילים.
Abstract
נויטרופילים ידועים כאחד מקווי ההגנה הראשונים בתגובה החיסונית המולדת ויכולים לבצע תפקודים תאיים מסוימים רבים, כגון כימוטקסיס, הגירה הפוכה, פגוציטוזה, פירוק אנזימים ציטוטוקסיים ומטבוליטים, ושחרור דנ"א כמלכודות חוץ-תאיות של נויטרופילים (NET). נויטרופילים לא רק יש איתות מוסדר היטב עצמם, אלא גם להשתתף ברגולציה של רכיבים אחרים של המערכת החיסונית. מכיוון שנויטרופילים טריים נבדלים זה מזה, קצרי חיים ומשתנים מאוד בין אנשים, חשוב להפיק את המרב מהדגימות שנאספו. חוקרים לעתים קרובות צריכים לבצע בדיקות סקר כדי להעריך סקירה כללית של פונקציות נויטרופילים רבים שעשויים להיות מושפעים מתנאים ספציפיים תחת הערכה. סדרה של בדיקות בעקבות תהליך בידוד יחיד של נויטרופילים בצפיפות נורמלית פותחה כדי לענות על צורך זה, בחיפוש אחר איזון בין מהירות, מקיף, עלות ודיוק. התוצאות יכולות לשמש כדי לנמק ולהנחות מחקרי מעקב מעמיקים. הליך זה יכול להתבצע בזמן ממוצע של 4 שעות וכולל הערכה של כדאיות התא, ייצור מיני חמצן תגובתי (ROS), נדידה בזמן אמת ופאגוציטוזה של שמרים על שקופיות זכוכית, מה שמשאיר מספיק תאים לגישות מפורטות יותר כמו מחקרי אומיקס. יתר על כן, ההליך כולל דרך לצפות בקלות בהצעה ראשונית של NETs לאחר צביעה פנאופטית מהירה שנצפתה במיקרוסקופ אור, עם היעדר סמנים ספציפיים, אם כי מספיק כדי לציין אם מאמצים נוספים בדרך זו יהיו כדאיים. מגוון הפונקציות שנבדקו משלב נקודות משותפות בין הבדיקות, ומקטין את זמן הניתוח וההוצאות. ההליך נקרא NeutroFun Screen, ולמרות שיש לו מגבלות, הוא מאזן את הגורמים הנ"ל. יתר על כן, מטרת עבודה זו אינה סט בדיקות מוגדר, אלא קו מנחה שניתן להתאים בקלות למשאבים ולדרישות של כל מעבדה.
Introduction
נויטרופילים הם תאי החיסון המולדים הנפוצים ביותר בדם האנושי וידועים כממלאים תפקיד מרכזי בזיהום ובדלקת, בהיותם המגיבים הראשונים שהגיעו לאתר של נזק לרקמות1. בשנים האחרונות גוברת ההכרה בתפקיד המכריע שממלאים נויטרופילים במגוון מחלות ובתמיכה בהומאוסטזיס2. נויטרופילים לא רק יש איתות מוסדר היטב עצמם, אלא גם להשתתף ברגולציה של רכיבים אחרים של המערכת החיסונית 3,4,5. לכן, חקירת נויטרופילים ותפקודיהם התאיים יוצאי הדופן הרבים, כגון כימוטקסיס, נדידה הפוכה6, פגוציטוזה7, התפרצות נשימתית8 ושחרור מלכודות נויטרופילים חוץ-תאיות (NETs)7, היא הכרחית בהקשרים מחקריים רבים שבהם יש צורך להעריך את השינויים הפונקציונליים, המורפולוגיים או המולקולריים הפוטנציאליים של נויטרופילים המופעלים על ידי תנאים ספציפיים הנבדקים.
נויטרופילים מבודדים טריים הם בעלי התמיינות סופנית, קצרי מועד, דינמיים מאוד ומופעלים בקלות9. עם זאת, שיטת אחסון יעילה שאינה משפיעה על תגובות הנויטרופילים טרם הושגה, מה שהופך את ביצוע בדיקות מרובות למאתגרות שחייבות להיות רצופות. יתר על כן, ניתוחים פונקציונליים10,11 שתוארו קודם לכן, המבוססים על בדיקות הדורשות ציטומטריה ו / או צביעה פלואורסצנטית, עשויים שלא להיות בחירה מעשית כאשר יש צורך בהערכה רחבה וראשונית של הנויטרופיל.
כדי לטפל בבעיות אלה, פרוטוקול זה מתאר סדרה של בדיקות שניתן לבצע לאחר תהליך בידוד יחיד, כולל הערכת כדאיות התא, ייצור מיני חמצן תגובתי (ROS), נדידה בזמן אמת ופאגוציטוזה של שמרי אפייה (Saccharomyces cerevisiae), שתוצאותיהם יכולות לשמש להנמקת מחקרי מעקב מעמיקים. הליך זה, שנקרא NeutroFun Screen, תוכנן להקיף את פעילויות האפקט המובילות, למעט degranulation, וניתן להשלים בזמן ממוצע של 4 שעות, כולל 1 שעה של הפעלה. בנוסף, התאים הנותרים יכולים לשמש לגישות מפורטות יותר כמו מחקרי אומיקס. יתרונה של שיטה זו טמון באיזון בין מהירות, מקיף, עלות ודיוק.
יתר על כן, יש דרך להתבונן בקלות בהצעה ראשונית של NETs, ללא סמנים ספציפיים, אך מספיק כדי לציין אם מאמצים נוספים בכיוון זה יהיו כדאיים. מגוון הפונקציות שנבדקו נועד לשלב נקודות משותפות בין המבחנים, ולצמצם את זמן הניתוח וההוצאות. המטרה העיקרית של שיטה זו היא לספק ניתוח מאוזן ופונקציונלי לגבי מהירות, מקיף, עלות ודיוק המאפשר סקירה כללית של תגובת הנויטרופילים, מה שהופך אותה לצעד ראשוני שימושי בחקירת ההשפעות של גירויים חדשים על נויטרופילים בצפיפות נורמלית.
Protocol
כל הניסויים עקבו בקפדנות אחר ההנחיות האתיות שנקבעו על ידי ועדת הביקורת המוסדית באוניברסיטת ברזיליה (תהליך 13364819.0.0000.5558), והדגימות זוהו על ידי קודים כדי להבטיח את אנונימיות התורם. התאים נלקחו מתורמים זכרים בריאים רגילים בגילאי 18-35 שנים, שחתמו על ההסכמה מדעת ועמדו בתנאי הזכאות הבאים: לא מעשנים/מאדים, ללא מחלות כרוניות וללא היסטוריה של מצבים דלקתיים ב-14 הימים האחרונים.
1. איסוף דם
- יש להניח 0.3 מ"ל של 5,000 IU/mL הפרין (ראה טבלת חומרים) במזרק סטרילי של 20 מ"ל כדי להפריד אותו.
- יש למרוח חוסם עורקים ורידי כ-12 ס"מ מעל אתר הניקוב ולזהות את הווריד הקוביטלי החציוני או הווריד הצפלי לניקוב.
הערה: יש לוודא שזמן חוסם העורקים הכולל אינו עולה על דקה. - נקו את אתר הניקוב עם 70% אלכוהול ובצעו את הניקוב.
- הפוך בעדינות את המזרק שלוש או ארבע פעמים לאחר איסוף הדם כדי לערבב את הדם ואת הפרין כראוי.
2. בידוד נויטרופילים
הערה: לויקוציטים פולימורפו-גרעיניים (PMNs) מבודדים באמצעות צנטריפוגה הדרגתית צפיפות ואחריה ליזה היפוטונית של תאי הדם האדומים הנותרים (RBC), כפי שתואר קודם לכן11 עם כמה שינויים. שיטה זו אינה חובה לביצוע בדיקות המיון, וניתן להחליפה כל עוד השיטה שנבחרה מביאה לכדאיות של >97%, פרימה או הפעלה של <3% מה- PMNs, ומניבה מספיק תאים לכל הבדיקות, ההעתקים והתנאים. ביצוע שלבים אלה בתנאים אספטיים ושימוש בתמיסות נטולות אנדוטוקסין הם חובה כדי למנוע הפעלת תאים.
- בצע דילול של 12 מ"ל של חומרי הפרדה של 60% ו-70% (זמין מסחרית; ראה טבלת חומרים) בצינורות חרוטיים של 50 מ"ל.
- מכינים את השיפוע מלמטה למעלה על ידי הוספת 4 מ"ל בכל פעם של דילול של 60% מעל דילול של 70%, באמצעות פיפטה של 5 מ"ל. עשה זאת בעדינות כדי למנוע ערבוב הממשק.
- בזהירות שכבה 12 מ"ל של דם heparinized על גבי שיפוע הצפיפות. צנטריפוגה ב 200 x גרם במשך 15 דקות בטמפרטורת החדר.
הערה: משלב זה ואילך, עד להפעלת PMN, יש לשמור את כל הריאגנטים והצינורות המשמשים בצידנית מלאה בקרח. - השליכו את שכבת הפלזמה/תא חד-גרעיני, ולאחר מכן העבירו בעדינות את השכבה שמעל גלולת כדורית כדורית הדם לשני צינורות חרוטיים של 15 מ"ל עם כ-7.5 מ"ל בכל אחד. הרכיבו את נפח הצינור עם תמיסת המלח המאוזנת של האנק (HBSS; ראו טבלת חומרים).
- צנטריפוגה ב 300 x גרם במשך 5 דקות ב 19 ° C.
- שטפו את גלולת התא עם HBSS.
- השליכו את הסופרנאטנט על ידי מזיגת הצינור והשהו מחדש בעדינות את הגלולה ב-7 מ"ל HBSS.
- צנטריפוגה במהירות 300 x גרם למשך 5 דקות ב-19°C להסרת כל אמצעי ההפרדה.
- בצע ליזה היפוטונית של RBCs הנותרים.
- יש להשליך את הסופרנאטנט ולערבב את הכדוריות בצינור אחד.
- השהה מחדש את גלולת RBC/PMN ב-3 מ"ל של H2O סטרילי והוסף 3 מ"ל HBSS (2x) תוך 25 שניות כדי לשחזר את האוסמולריות. לאחר מכן, צנטריפוגה ב 300 x גרם במשך 5 דקות ב 19 ° C.
- חזור על שלבים 2.8.1 ו- 2.8.2 לקבלת גלולה לבנה ללא אריתרוציטים.
הערה: יש להסיר את הסופרנאטנט בהקדם האפשרי כדי למזער את המגע של נויטרופילים עם תוצרי פירוק RBC. לחלופין, ניתן להחליף את הליזה ההיפוטונית השנייה על ידי השעיה עדינה מחדש של שכבת RBC השיורית והסרת כל הסופרנטנט, מכיוון שהמשקעים הנותרים של RBC ישקעו מעל גלולת PMN.
- השליכו את הסופרנאטנט על ידי מזיגת הצינור, השהו מחדש בעדינות את ה-PMN במאגר הנותר, והעבירו אותם למיקרו-צינור קר כקרח.
הערה: הקפד להוסיף ביאורים לעוצמת הקול בעת העברת התאים המרחפים מחדש באמצעות מיקרופיפטה. - מעבירים 3 x 1 μL של תרחיף התא למגלשת זכוכית נקייה (שלוש בארות של 1 μL כל אחת) וכתם עם פנאופטיקה מהירה (ראה טבלת חומרים) להערכת מורפולוגיה וטוהר12.
- כדי להכתים בפנאופטי מהיר, יש לטבול את המגלשה חמש פעמים ב-panoptic fixative n° 1, שש פעמים ב-eosin n° 2 ופעמיים ב-hematoxylin n° 3, כאשר כל טבילה נמשכת שנייה אחת.
- שטפו בעדינות את מגלשת הזכוכית במים מזוקקים.
- יש לנקז ולייבש באוויר.
- התבוננו תחת מיקרוסקופ וספרו 300 תאים אקראיים בכל באר, ובכך הבדילו את הנויטרופילים מגרנולוציטים אחרים.
- מעבירים 1 μL של תרחיף התא ל-49 μL של 0.2% צבע כחול טריפאן13 וסופרים את התאים באמצעות תא נויבאואר, תוך הבחנה בין תאים מתים לתאים בני קיימא.
- התאימו את ריכוז התאים ל-6,667 תאים/מיקרוליטר באמצעות תמיסה של 50% פלזמה אוטולוגית ו-50% HBSS בתוספת סידן ומגנזיום. חלק את התרחיף של 6,667 תאים/μL באופן שווה בין המיקרו-צינורות המתאימים לתנאים שיש לבדוק, כולל הבקרה השלילית.
הערה: ניתן להשתמש בכל ריכוז תאים הדומה לנויטרופילים המסתובבים באורגניזם המודל, אך חשוב להשתמש באותו ריכוז תאים בכל הניסויים לצורך שחזור.
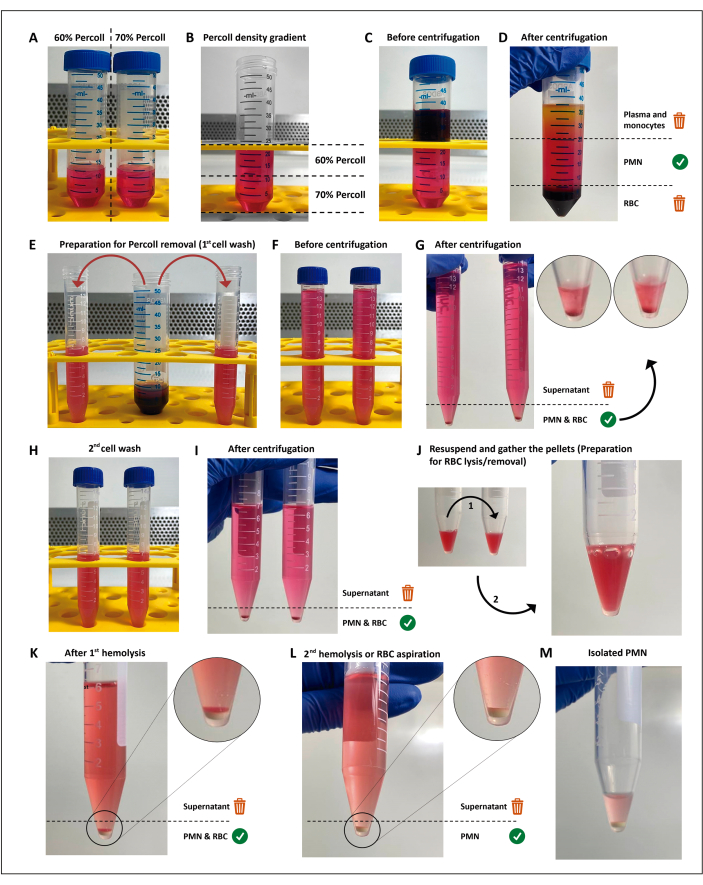
איור 1: פרוטוקול בידוד הנויטרופילים. שני ריכוזים של מצע ההפרדה (פרקול) (A) מוערמים (B), ואז הדם מונח בשכבות על גבי שיפוע ההפרדה (C). לאחר הצנטריפוגה, PMN נמצא בשכבה המרכזית (D), המחולקת לשני צינורות 15 מ"ל (E). תרחיף התא נשטף פעמיים ב- HBSS ובצנטריפוגה (G-I) כדי להסיר את המדיה, ואז התאים מושהים מחדש, ושאריות RBCs נשלחות לשני סבבים של ליזה היפוטונית (J-M). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הכנה להפעלת נויטרופילים
- במיקרו-צינוריות של 1.5 מ"ל, הכינו מערכת הפעלה לכל מצב כך שריכוז התא הסופי יהיה 6,600 תאים/μL. לדוגמה, כדי לבדוק את ההשפעות של 100 nM fMLP (N-formyl-methionyl-leucyl-phenylalanine; ראה טבלה של חומרים), להוסיף 5 μL של 10 μM fMLP ל 495 μL של 6,667 תאים / μL תרחיף. עבור הבקרה השלילית (ללא גירוי), הוסף HBSS המכיל Ca2+ ו- Mg2+.
הערה: כדי להדגים מתודולוגיה זו, נעשה שימוש בריכוזים הסופיים הבאים של הגירויים: 100 nM fMLP, 16 μM של fallaxin, פפטיד אנטי-מיקרוביאלי טבעי14, ו-100 nM PMA (phorbol 12-myristate 13-acetate) (ראה טבלת חומרים). - לדגור ב 37 ° C ללא סיבוב.
הערה: כל ה- aliquots עבור בדיקות פונקציונליות נלקחים מהשעיית תא זו, המכונה להלן מערכת ההפעלה.
4. בדיקת Nitrotetrazolium Blue Chloride (NBT) להערכת ייצור ROS
- הכנת פתרון עבודה NBT: עבור כל תנאי ניסוי, הכינו פתרון עבודה NBT (ראה טבלת חומרים) של 6 מילימטר באמצעות השלבים הבאים:
- יש להמיס 0.0005 גרם של NBT ב-10 מיקרוליטר של דימתיל סולפוקסיד (DMSO) ומערבולת למשך 15 דקות לפחות.
- מוסיפים 90 μL של HBSS Ca2+Mg2+ ומערבלים עד 2 דקות.
הערה: יש לבצע את כל השלבים הקשורים ל-NBT בחושך.
- בצע בדיקת שקופיות NBT.
- לאחר 20 דקות של הפעלת התא, ערבבו בעדינות את מתלה התא והעבירו בזהירות 2 μL של PMN למגלשת זכוכית נקייה. יש לדגור במשך 20 דקות בתא לח בטמפרטורה של 37°C.
הערה: אין לפזר את מתלה התא יותר מדי על המגלשה; אחרת הוא עלול להתייבש לפני הדגירה. - הוסף 1 μL של תמיסת העבודה NBT מעל התאים ודגרה נוספת במשך 20 דקות מוגן מפני אור.
- יבש את המגלשה עם אוויר חם לתקן אותו עם טיפה מתנול בכל באר במשך 1 דקה. מכתים עם 0.03% ספרנין (ראו טבלת חומרים) למשך דקה.
- שטפו בעדינות את מגלשת הזכוכית במים מזוקקים.
- הניחו למגלשה להתייבש באוויר והתבוננו תחת מיקרוסקופ.
- ספרו 100 תאים אקראיים בכל באר, והבינו נויטרופילים עם וללא משקעי פורמזן.
- לאחר 20 דקות של הפעלת התא, ערבבו בעדינות את מתלה התא והעבירו בזהירות 2 μL של PMN למגלשת זכוכית נקייה. יש לדגור במשך 20 דקות בתא לח בטמפרטורה של 37°C.
- בצע בדיקת ספקטרופוטומטריה של NBT.
- לאחר 40 דקות של הפעלת התא, ערבבו בעדינות את תרחיף התא והעבירו 90 מיקרוליטר של PMN ממערכת ההפעלה למיקרו-צינורית נקייה. לאחר מכן, הוסף בזהירות 20 μL של תמיסת NBT 6 mM. לדגור בחושך במשך 20 דקות ב 37 ° C.
- הוסף 100 μL של 10% נתרן דודציל סולפט (SDS; ראה טבלה של חומרים) ומערבולת.
- סוניק באמצעות קצה סוניקטור באמפליטודה של 60%, חמישה מחזורים של 15 שניות כל אחד עם מרווחים של 15 שניות. צנטריפוגה ב 12,000 x גרם במשך 5 דקות.
- מעבירים 60 מיקרוליטר של הסופרנאטנט לצלחת בעלת תחתית שקופה של 96 בארות ומודדים את ספיגת תוצר הפורמזן ב-570 ננומטר.
5. בדיקת פגוציטוזה
- הכינו תרחיף של 33,000 שמרים/מיקרוליטר לכל מצב, כמתואר להלן:
- הוסיפו כ-0.75 מ"ג שמרים יבשים (Saccharomyces cerevisiae; ראו טבלת חומרים) ל-200 מיקרוליטר של HBSS Ca2+Mg2+ ודגרו בתרמומיקסר בטמפרטורה של 100°C עם 500 סל"ד למשך 15 דקות לפחות.
- הומוגניזציה של התערובת על ידי ערבול והעברת 5 μL של תרחיף שמרים ל 45 μL של 0.2% צבע כחול טריפאן. ספרו את השמרים באמצעות תא נויבאואר.
- התאימו את ריכוז התרחיף הראשוני ל-33,000 תאי שמרים/μL באמצעות HBSS Ca2+Mg2+. יש לשמור את המתלים על קרח עד לשימוש.
- לאחר 20 דקות של הפעלת התא, ערבבו בעדינות את תרחיף התא והעבירו 5 μL של מערכת ההפעלה ל-5 μL מתוך 33,000 השמרים/μL Saccharomyces cerevisiae suspension במיקרו-צינורית סטרילית חדשה.
הערה: יחס הנויטרופילים לשמרים הוא 1:5 (PMN:שמרים). - העבירו מיד 6 μL של תרחיף PMN/שמרים לשלוש בארות של מגלשת זכוכית נקייה (2 μL כל אחת) ודגרו על המגלשה בתא לח למשך 40 דקות.
הערה: אין לפזר את מתלה התא יותר מדי על המגלשה; אחרת, הוא עלול להתייבש לפני הדגירה. - יבש את המגלשה תחת אוויר חם והכתים עם פנאופטיקה מהירה, כמתואר בשלב 2.9 לעיל.
הערה: השלב השלישי של הצביעה הפנופטית המהירה הוא קריטי לניתוח המיקרוסקופ של השקופית. צביעת השקופית במשך ≥3 שניות בשלב זה עלולה להפוך אותה ללא ראויה לניתוח, מכיוון שיהיה קשה להבדיל בין שמרים לאונות גרעיניות של נויטרופילים. - התבוננו בשקופיות מתחת למיקרוסקופ, ספרו 100 נויטרופילים אקראיים מכל באר והבחינו בין PMN חיובי ושלילי לפאגוציטוזה.
הערה: לפחות חלקיק שמרים אחד בתוך או במגע ישיר עם קרום תא PMN מצביע על PMN חיובי לפאגוציטוזה. אם אתם מעוניינים ביחס שמרים/נויטרופילים, ספרו גם את מספר חלקיקי השמרים שנבלעו.
6. בדיקת כימוטקסיס PMN בזמן אמת
הערה: בדיקת ההעברה מבוצעת באופן דומה לפרוטוקול המתואר previoulsy15, עם ההתאמות הבאות:
- הכינו את השיפוע הכימוטקטי על ידי הוספת 160 מיקרוליטר של כימואטרקנט (למשל, fMLP, IL-8, C5 או LTB4; ראו טבלת חומרים) לתא התחתון של צלחת מנתח תאים בזמן אמת (RTCA) מבוסס עכבה. עבור בקרות שליליות וחסרים, הוסף 160 μL של HBSS Ca2+Mg2+.
- חבר את החדר העליון והוסף 25 μL של HBSS Ca2+Mg2+. יש לדגור בטמפרטורת החדר למשך שעה לפחות כדי ליצור את השיפוע הכימוטקטי.
- לאחר 60 דקות של הפעלת התא, ערבבו בעדינות את מתלה התא והניחו 60 מיקרוליטר של תרחיף התא בתא העליון. הוסף 60 μL של HBSS Ca2+Mg2+ לריק.
- הניחו את צלחת RTCA ותכנתו את תוכנת RTCA למדוד את אינדקס התא (CI) כל 60 שניות למשך שעתיים.
הערה: ניתן לשטוף את לוחות RTCA לשימוש חוזר כמתואר16. לסיכום, שטפו את תאי RTCA והאלקטרודות עם מי מלח פוספט-בופר (PBS) שלוש פעמים, ולאחר מכן עם מים אולטרה-טהורים מסוג I פעמיים. יש לדגור על החדר התחתון והעליון עם 0.25% טריפסין 0.53 mM ethylenediaminetetraacetic acid (EDTA) למשך 40 דקות. יש לשטוף במים טהורים במיוחד שלוש פעמים.
7. בדיקה סוגסטיבית נטו
- לאחר 10 דקות של הפעלת התא, ערבבו בעדינות את תרחיף התא והעבירו 4 μL של PMN מכל מערכת הפעלה תחת הערכה, המחולקים לשתי בארות של מגלשת זכוכית נקייה. יש לדגור בתא לח בטמפרטורה של 37°C למשך 30 דקות.
- הוסף 1 μL של DNAse I לאחת הבארות ודגר במשך 20 דקות ב 37 ° C (בתא רטוב).
- יבש את המגלשה ואת הכתם עם panoptic מהיר, כפי שתואר קודם בשלב 2.9 של סעיף "בידוד נויטרופילים".
- הערך את השקופיות תחת מיקרוסקופ.
הערה: חפש כל אינדיקציה לשחרור נטו, המאופיינת בנוכחות של מבנים דמויי אינטרנט. לאחר הזיהוי, ודא אם הטיפול ב- DNAse I היה מסוגל להסיר מבנים כאלה. בדיקה זו מרמזת על היווצרות NET, שכן נדרשות בדיקות נוספות כדי לאשר את נוכחותם.
תוצאות
שיטת הבידוד מבוססת הצפיפות ששימשה במחקר זה (איור 1) עמדה בקריטריונים של הניסויים המוצעים. פרמטרים נויטרופילים שהתקבלו משיטה זו כללו כדאיות ≥98%, טוהר ≥94%, ותפוקת תאים ≥1.5 x 107, ללא הפעלה שניתן לזהות על ידי בדיקות הסינון. שני שלבים רלוונטיים בבידוד PMN הם נוגדי קרישה והסרת ...
Discussion
נויטרופילים הם תאים דינמיים ומגיבים מאוד, קצרי חיים שעדיין לא ניתן לשמר אותםבהקפאה 19, מה שהופך את חקירת הביולוגיה שלהם למאתגרת. לכן, חיוני לעקוב אחר צעדים זהירים כדי להשיג נויטרופילים קיימא, מועשר ומנוחה11,20. במחקר זה נעשה שימוש בטכניקת בידוד מב?...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
המחברים מודים לסוכנויות המימון הבאות: FAPDF, CNPq, CAPES, UnB, FINEP ו-FINATEC.
Materials
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
References
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved