JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
호중구 기능에 대한 간략한 개요를 위한 일련의 스크리닝 기법
요약
이 프로토콜은 다양한 신호 전달 경로의 기능을 포괄하는 스크리닝 방법으로 사용되는 호중구 기능 분석 세트를 특징으로 합니다. 이 프로토콜에는 세포 생존율, 순도, 활성 산소 종 생산, 실시간 이동, 식세포작용 및 호중구 세포외 트랩에 대한 예비 제안에 대한 초기 및 간단한 평가가 포함됩니다.
초록
호중구는 선천성 면역 반응의 첫 번째 방어선 중 하나로 알려져 있으며 화학주성, 역이동, 식세포작용, 세포독성 효소 및 대사 산물의 탈과립화, 호중구 세포외 트랩(NET)으로서의 DNA 방출과 같은 많은 특정 세포 기능을 수행할 수 있습니다. 호중구는 스스로 신호를 엄격하게 조절할 뿐만 아니라 면역 체계의 다른 구성 요소를 조절하는 데에도 참여합니다. 신선한 호중구는 말기에서 분화되고, 수명이 짧으며, 개인마다 매우 다양하기 때문에 수집된 샘플을 최대한 활용하는 것이 중요합니다. 연구자들은 종종 평가 중인 특정 조건의 영향을 받을 수 있는 많은 호중구 기능의 개요를 평가하기 위해 스크리닝 분석을 수행해야 합니다. 정상 밀도 호중구의 단일 분리 공정에 따른 일련의 테스트는 속도, 포괄성, 비용 및 정확성 간의 균형을 추구하여 이러한 요구를 해결하기 위해 개발되었습니다. 결과는 심층적인 후속 연구를 추론하고 안내하는 데 사용할 수 있습니다. 이 절차는 평균 4시간 내에 수행할 수 있으며 세포 생존율, 활성 산소종(ROS) 생산, 실시간 이동 및 유리 슬라이드에서 효모의 식균작용 평가가 포함되어 오믹스 연구와 같은 보다 자세한 접근 방식을 위한 충분한 세포를 남깁니다. 더욱이, 이 절차에는 광학 현미경으로 관찰된 빠른 panoptic 염색 후 NET의 예비 제안을 쉽게 관찰할 수 있는 방법이 포함되어 있으며, 특정 마커가 부족하지만 이러한 방식으로 추가 노력을 기울일 가치가 있는지 여부를 나타내기에 충분합니다. 테스트된 기능의 다양성은 테스트 간의 공통점을 결합하여 분석 시간과 비용을 줄입니다. 이 절차는 NeutroFun Screen으로 명명되었으며 한계가 있지만 앞서 언급한 요소의 균형을 맞춥니다. 또한 이 작업의 목적은 명확한 테스트 세트가 아니라 각 실험실의 리소스와 요구 사항에 맞게 쉽게 조정할 수 있는 지침입니다.
서문
호중구는 인간의 혈액에서 가장 풍부한 선천성 면역 세포로, 감염과 염증에 중요한 역할을 하는 것으로 알려져 있으며, 조직 손상 부위에 가장 먼저 도착한다1. 최근 몇 년 동안 호중구가 다양한 질병과 항상성을 지원하는 데 중요한 역할을 한다는 인식이 높아지고있습니다 2. 호중구는 스스로 신호를 엄격하게 조절할 뿐만 아니라 면역 체계의 다른 구성 요소의 조절에도 참여합니다 3,4,5. 따라서 호중구와 호중구의 많은 특이한 세포 기능(예: 화학주성, 역이동6, 식세포작용7, 호흡파열8, 호중구 세포외 트랩(NET)7 방출)을 조사하는 것은 분석 중인 특정 조건에 의해 유발되는 잠재적인 호중구의 기능적, 형태학적 또는 분자적 변화를 평가해야 하는 수많은 연구 상황에서 필수적입니다.
갓 분리된 호중구는 말기 분화되고, 수명이 짧으며, 매우 역동적이고, 쉽게 활성화된다9. 그러나 호중구 반응에 영향을 미치지 않는 효율적인 보관 방법은 아직 달성되지 않았기 때문에 중단 없이 여러 분석을 수행하는 것이 어렵습니다. 더욱이, 세포 분석 및/또는 형광 염색을 필요로 하는 분석에 기초한 이전에 기술된 기능 분석(10,11)은 호중구의 광범위하고 초기 평가가 필요한 경우 실행 가능한 선택이 아닐 수 있다.
이러한 문제를 해결하기 위해 이 프로토콜은 세포 생존율, 활성산소종(ROS) 생산, 실시간 이동 및 맥주효모균의 식세포작용 평가를 포함하여 단일 분리 프로세스 후에 수행할 수 있는 일련의 테스트를 설명하며, 그 결과는 심층 후속 연구를 추론하는 데 사용할 수 있습니다. NeutroFun Screen이라고 명명된 이 절차는 탈과립을 제외한 주요 이펙터 활동을 포함하도록 설계되었으며 활성화 1시간을 포함하여 평균 4시간 내에 완료할 수 있습니다. 또한 나머지 세포는 오믹스 연구와 같은 보다 상세한 접근 방식에 사용할 수 있습니다. 이 방법의 장점은 속도, 포괄성, 비용 및 정확성 간의 균형에 있습니다.
또한 특정 마커 없이 NET의 예비 제안을 쉽게 관찰할 수 있는 방법이 있지만 해당 방향으로의 추가 노력이 가치가 있는지 여부를 나타내기에 충분합니다. 테스트되는 기능의 다양성은 테스트 간의 공통점을 결합하여 분석 시간과 비용을 줄이는 것을 목표로 합니다. 이 방법의 주요 목표는 호중구의 반응에 대한 개요를 허용하는 속도, 포괄성, 비용 및 정확도에 관한 균형 잡힌 기능적 분석을 제공하여 정상 밀도 호중구에 대한 새로운 자극의 영향을 조사하는 데 유용한 초기 단계가 되는 것입니다.
프로토콜
모든 실험은 브라질리아 대학의 기관 검토 위원회에서 정한 윤리 지침(프로세스 13364819.0.0000.5558)을 엄격히 따랐으며, 샘플은 기증자의 익명성을 보장하기 위해 코드로 식별되었습니다. 세포는 정보에 입각한 동의서에 서명하고 비흡연자/베이퍼, 만성 질환 없음, 지난 14일 동안 염증성 질환 병력이 없는 18-35세의 건강한 남성 기증자로부터 얻었습니다.
1. 채혈
- 5,000IU/mL 헤파린 0.3mL( 재료 표 참조)를 멸균 20mL 주사기에 무균 상태로 넣어 헤파린화합니다.
- 천자 부위 위쪽에 약 4인치의 정맥 지혈대를 적용하고 정맥 천자를 위해 정중 입방체 또는 두부 정맥을 식별합니다.
알림: 총 지혈대 시간이 1분을 초과하지 않는지 확인하십시오. - 70% 알코올로 펑크 부위를 청소하고 정맥 천자를 수행합니다.
- 혈액을 채취한 후 주사기를 서너 번 부드럽게 뒤집어 혈액과 헤파린을 적절히 섞습니다.
2. 호중구 분리
참고: 다형핵 백혈구(PMN)는 밀도 구배 원심분리 후 나머지 적혈구(RBC)의 저긴장 용해를 통해 분리되며, 앞서 설명한바와 같이 11 에서 약간의 변화가 있습니다. 이 방법은 스크리닝 분석을 수행하는 데 필수는 아니며, 선택한 방법이 >97%의 생존율, PMN의 <3%의 프라이밍 또는 활성화, 모든 분석, 복제 및 조건에 충분한 세포를 생성하는 한 대체할 수 있습니다. 세포 활성화를 피하기 위해 무균 조건에서 이러한 단계를 수행하고 내독소가 없는 용액을 사용하는 것이 필수입니다.
- 50mL 코니컬 튜브에 60% 및 70% 분리 배지(시판, 재료 표 참조)를 12mL 희석합니다.
- 5mL 피펫을 사용하여 70% 희석액에 대해 60% 희석할 때 한 번에 4mL를 추가하여 아래에서 위로 그래디언트를 준비합니다. 인터페이스가 섞이지 않도록 부드럽게 수행하십시오.
- 밀도 구배 위에 헤파린화된 혈액 12mL를 조심스럽게 겹쳐 놓습니다. 실온에서 200 x g 에서 15분 동안 원심분리합니다.
알림: 이 단계부터 PMN이 활성화될 때까지 사용된 모든 시약과 튜브는 얼음으로 채워진 쿨러에 보관해야 합니다. - 혈장/단핵 세포층을 폐기한 다음 적혈구 펠릿 위의 층을 각각 약 7.5mL가 들어 있는 두 개의 15mL 원뿔형 튜브로 부드럽게 옮깁니다. Hank의 균형 잡힌 소금 용액(HBSS, 재료 표 참조)으로 튜브 부피를 구성합니다.
- 300 x g 에서 19°C에서 5분 동안 원심분리합니다.
- HBSS로 세포 펠릿을 세척하십시오.
- 튜브를 부어 상층액을 버리고 펠릿을 7mL의 HBSS에 부드럽게 재현탁시킵니다.
- 19°C에서 5분 동안 300 x g 으로 원심분리하여 모든 분리 매질을 제거합니다.
- 나머지 적혈구의 저긴장성 용해를 수행합니다.
- 상층액을 버리고 펠릿을 단일 튜브에 결합합니다.
- 멸균 H2O3mL에 RBC/PMN 펠릿을 재현탁하고 25초 이내에 HBSS 3mL(2x)를 추가하여 삼투압을 복원합니다. 그런 다음 300 x g 에서 19°C에서 5분 동안 원심분리합니다.
- 적혈구가 없는 흰색 펠릿에 대해 2.8.1 및 2.8.2단계를 반복합니다.
알림: 호중구와 RBC 분해 산물의 접촉을 최소화하기 위해 상층액을 가능한 한 빨리 제거해야 합니다. 대안적으로, 두 번째 저긴장성 용해는 잔류 적혈구층을 부드럽게 재현탁하고 모든 상층액을 제거함으로써 대체될 수 있는데, 이는 나머지 적혈구가 PMN 펠릿 위에 침전되기 때문이다.
- 튜브를 부어 상층액을 버리고 남은 완충액에 PMN을 부드럽게 재현탁시킨 다음 얼음처럼 차가운 마이크로 튜브로 옮깁니다.
알림: 마이크로피펫으로 재현탁 세포를 옮기는 동안 부피에 주석을 달아야 합니다. - 셀 현탁액 3 x 1μL를 깨끗한 유리 슬라이드(각각 1μL의 웰 3개)로 옮기고 형태 및 순도 평가를 위해 빠른 파놉틱( 재료 표 참조)으로 염색합니다12.
- 빠른 파놉틱으로 염색하려면 슬라이드를 파놉틱 고정제 1번에, 에오신 2번에, 헤마톡실린 3번에 2번, 침지할 때마다 1초 동안 지속됩니다.
- 유리 슬라이드를 증류수로 부드럽게 씻으십시오.
- 물기를 빼고 자연 건조하십시오.
- 현미경으로 관찰하고 각 웰에서 300개의 무작위 세포를 세어 호중구를 다른 과립구와 구별합니다.
- 세포 현탁액 1μL를 0.2% 트리판 블루 염료13의 49μL로 옮기고 Neubauer 챔버를 사용하여 세포를 계수하여 죽은 세포와 생존 가능한 세포를 구별합니다.
- 칼슘과 마그네슘이 보충된 50% 자가 혈장과 50% HBSS 용액을 사용하여 세포 농도를 6,667 cells/μL로 조정합니다. 6,667 cells/μL 현탁액을 음성 대조군을 포함하여 테스트할 조건에 해당하는 마이크로튜브 간에 균등하게 나눕니다.
참고: 모델 유기체의 순환 호중구와 유사한 모든 세포 농도를 사용할 수 있지만 재현성을 위해 모든 실험에서 동일한 세포 농도를 사용하는 것이 중요합니다.
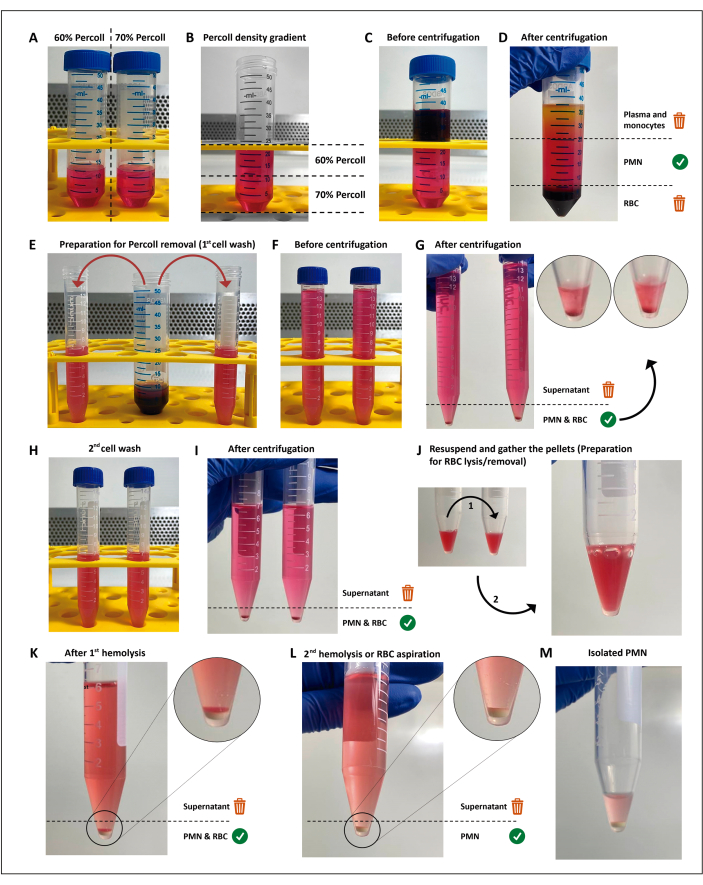
그림 1: 호중구 분리 프로토콜. 두 농도의 분리 배지(percoll)(A)를 적층한 다음(B) 분리 구배(C) 위에 혈액을 층상합니다. 원심분리 후 PMN은 두 개의 15mL 튜브(E)로 나뉘는 중앙층(D)에 있습니다. 세포 현탁액을 HBSS에서 두 번 세척하고 원심분리(G-I)하여 배지를 제거한 다음 세포를 재현탁시키고 잔류 적혈구를 두 차례의 저긴장성 용해(J-M)에 제출합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 호중구 활성화를 위한 준비
- 1.5mL 마이크로튜브에서 최종 세포 농도가 6,600 cells/μL가 되도록 각 조건에 대한 활성화 시스템을 준비합니다. 예를 들어, 100nM fMLP(N-포르밀-메티오닐-류실-페닐알라닌, 재료 표 참조)의 효과를 테스트하려면 6,667 cell/μL 현탁액의 495μL에 10μM fMLP 5μL를 추가합니다. 음성(자극되지 않은) 대조군의 경우 Ca2+ 및 Mg2+를 함유한 HBSS를 추가합니다.
참고: 이 방법론을 입증하기 위해 100nM fMLP, 16μM의 팔락신, 자연 발생 항균 펩타이드14 및 100nM PMA(phorbol 12-myristate 13-acetate)와 같은 자극의 최종 농도를 사용했습니다( 재료 표 참조). - 회전 없이 37°C에서 배양합니다.
참고: 기능적 분석을 위한 모든 부분 표본은 이 세포 현탁액에서 채취되며, 이하 활성화 시스템이라고 합니다.
4. ROS 생산 평가를 위한 니트로테트라졸륨 블루 클로라이드(NBT) 분석
- NBT 작업 용액 준비: 각 실험 조건에 대해 다음 단계를 사용하여 6mM의 NBT( 재료 표 참조) 작업 용액을 준비합니다.
- 0.0005g의 NBT를 10μL의 디메틸설폭사이드(DMSO)에 녹이고 최소 15분 동안 소용돌이에 넣습니다.
- 90μL의 HBSS Ca2+Mg2+ 를 넣고 최대 2분 동안 소용돌이칩니다.
알림: NBT와 관련된 모든 단계는 어두운 곳에서 수행해야 합니다.
- NBT 슬라이드 테스트를 수행합니다.
- 20분 동안 세포를 활성화한 후 세포 현탁액을 부드럽게 혼합하고 2μL의 PMN을 깨끗한 유리 슬라이드에 조심스럽게 옮깁니다. 37°C의 가습 챔버에서 20분 동안 배양합니다.
알림: 셀 서스펜션을 슬라이드 위에 너무 많이 펴지 마십시오. 그렇지 않으면 배양 전에 건조될 수 있습니다. - 세포 위에 NBT 작업 용액 1μL를 추가하고 빛으로부터 보호된 상태에서 20분 동안 추가로 배양합니다.
- 뜨거운 공기로 슬라이드를 말리고 각 웰에 메탄올 한 방울로 1분 동안 고정합니다. 0.03% 사프라닌( 재료 표 참조)으로 1분 동안 염색합니다.
- 유리 슬라이드를 증류수로 부드럽게 씻으십시오.
- 슬라이드를 자연 건조시키고 현미경으로 관찰하십시오.
- 각 웰에서 100개의 무작위 세포를 세어 포름마잔 침전물이 있는 호중구와 없는 호중구를 구별합니다.
- 20분 동안 세포를 활성화한 후 세포 현탁액을 부드럽게 혼합하고 2μL의 PMN을 깨끗한 유리 슬라이드에 조심스럽게 옮깁니다. 37°C의 가습 챔버에서 20분 동안 배양합니다.
- NBT 분광광도계 분석을 수행합니다.
- 세포 활성화 40분 후 세포 현탁액을 부드럽게 혼합하고 활성화 시스템에서 깨끗한 마이크로튜브로 90μL의 PMN을 전달합니다. 그런 다음 6mM NBT 용액 20μL를 조심스럽게 추가합니다. 37°C에서 20분 동안 어두운 곳에서 배양합니다.
- 100μL의 10% 소듐 도데실 설페이트(SDS, 재료 표 참조)와 와류를 추가합니다.
- 진폭 60 %에서 팁 초음파 발생기를 사용하여 초음파 처리, 각각 15 초 간격으로 15 초의 5 사이클. 12,000 x g 에서 5분 동안 원심분리기
- 상층액 60μL를 투명한 바닥 96웰 플레이트로 옮기고 570nm에서 포르마잔 생성물의 흡광도를 측정합니다.
5. 식세포작용 분석
- 아래 설명에 따라 각 조건에 대해 33,000 yeasts/μL 현탁액을 준비합니다.
- 약 0.75mg의 건조 효모 (Saccharomyces cerevisiae, 재료 표 참조)를 200μL의 HBSS Ca2+Mg2+ 에 넣고 100°C의 열혼합기에서 500rpm으로 최소 15분 동안 배양합니다.
- 와류에 의해 혼합물을 균질화하고 5 μL의 효모 현탁액을 0.2 % 트리판 블루 염료의 45 μL로 옮깁니다. Neubauer 챔버를 사용하여 효모를 계산합니다.
- HBSS Ca2+Mg2+를 사용하여 초기 현탁액의 농도를 33,000 효모 세포/μL로 조정합니다. 사용할 때까지 서스펜션을 얼음 위에 두십시오.
- 세포 활성화 20분 후 세포 현탁액을 부드럽게 혼합하고 활성화 시스템의 5μL를 33,000 yeast/μL 맥주효모 균 현탁액 5μL로 새로운 멸균 마이크로튜브에 전달합니다.
알림: 호중구 대 효모 비율은 1:5(PMN:효모)입니다. - PMN/효모 현탁액 6μL를 깨끗한 유리 슬라이드(각각 2μL)의 웰 3개에 즉시 옮기고 가습 챔버에서 40분 동안 슬라이드를 배양합니다.
알림: 셀 서스펜션을 슬라이드 위에 너무 많이 펴지 마십시오. 그렇지 않으면 배양 전에 건조될 수 있습니다. - 위의 2.9단계에서 설명한 대로 뜨거운 공기로 슬라이드를 건조시키고 빠른 파놉틱으로 염색합니다.
참고: 빠른 판옵틱 염색의 세 번째 단계는 슬라이드의 현미경 분석에 매우 중요합니다. 이 단계에서 슬라이드를 ≥3초 동안 염색하면 효모와 호중구 핵엽을 구별하기 어렵기 때문에 분석에 적합하지 않을 수 있습니다. - 현미경으로 슬라이드를 관찰하여 각 웰의 무작위 호중구 100개를 세고 식세포작용에 대한 PMN 양성과 음성을 구별합니다.
참고: PMN 세포막 내 또는 PMN 세포막과 직접 접촉하는 하나 이상의 효모 입자는 식세포작용에 대한 PMN 양성을 나타냅니다. 효모/호중구 비율에 관심이 있는 경우 삼킨 효모 입자의 수도 계산하십시오.
6. 실시간 PMN 화학주성 분석
참고: 이동 분석은15 이전에 설명된 프로토콜과 유사하게 수행되며 다음과 같은 조정이 있습니다.
- 임피던스 기반 실시간 세포 분석기(RTCA) 플레이트의 하부 챔버에 160μL의 화학 유인제(예: fMLP, IL-8, C5 또는 LTB4, 재료 표 참조)를 추가하여 화학주성 그래디언트를 준비합니다. 음성 대조군 및 블랭크의 경우 160μL의 HBSS Ca2+Mg2+를 추가합니다.
- 상부 챔버를 부착하고 25μL의 HBSS Ca2+Mg2+를 추가합니다. 화학주성 그래디언트를 형성하기 위해 실온에서 최소 1시간 동안 배양합니다.
- 세포 활성화 60분 후 세포 현탁액을 부드럽게 혼합하고 60μL의 세포 현탁액을 상부 챔버에 놓습니다. 블랭크에 HBSS Ca2+Mg2+ 60μL를 추가합니다.
- RTCA 플레이트를 놓고 60시간 동안 2초마다 세포 지수(CI)를 측정하도록 RTCA 소프트웨어를 프로그래밍합니다.
알림: RTCA 플레이트는 앞서 설명한 대로 재사용을 위해 세척할 수 있습니다16. 요약하면, RTCA 챔버와 전극을 인산염 부퍼 식염수(PBS)로 세 번 세척한 다음 유형 I 초순수로 두 번 세척합니다. 하부 및 상부 챔버를 0.25% 트립신 0.53mM 에틸렌디아민테트라아세트산(EDTA)으로 40분 동안 배양합니다. 초순수로 세 번 씻으십시오.
7. NET 암시 분석
- 세포 활성화 10분 후 세포 현탁액을 부드럽게 혼합하고 평가 중인 각 활성화 시스템에서 4μL의 PMN을 깨끗한 유리 슬라이드의 두 웰로 나눠 전달합니다. 37°C의 가습 챔버에서 30분 동안 배양합니다.
- 웰 중 하나에 1μL의 DNAse I를 추가하고 37°C(습식 챔버)에서 20분 동안 배양합니다.
- 슬라이드를 건조시키고 이전에 "호중구 분리" 섹션의 2.9단계에서 설명한 대로 빠른 파놉틱으로 염색합니다.
- 현미경으로 슬라이드를 평가합니다.
참고: 거미줄과 같은 구조가 있는 NET 릴리스의 징후를 찾습니다. 일단 확인되면 DNAse I 처리가 이러한 구조를 제거할 수 있는지 확인합니다. 이 분석은 존재를 확인하기 위해 추가 테스트가 필요하기 때문에 NET 형성을 시사합니다.
결과
이 연구에서 사용된 밀도 기반 분리 방법(그림 1)은 제안된 실험의 기준을 충족했습니다. 이 방법에서 얻은 호중구 매개변수에는 생존율≥98%, 순도 ≥94% 및 세포 수율 ≥1.5 x 107이 포함되었으며 스크리닝 테스트로 활성화가 감지되지 않았습니다. PMN 분리의 두 가지 관련 단계는 항응고와 적혈구 제거입니다. 밀도 구배 위에 겹겹이 쌓이기 전에 항응고 혈액 튜브 또는 ...
토론
호중구는 수명이 짧고 아직 냉동 보존할 수 없는 매우 역동적이고 반응성이 뛰어난 세포입니다19 따라서 생물학에 대한 조사가 어렵습니다. 그러므로, 생존 가능하고, 풍부하고, 안정된 호중구를 얻기 위해 신중한 단계를 따르는 것이 필수적이다11,20. 이 연구는 부드럽고 최소한의 조작과 활성화 단계까지 저온의 사용을 강조하는 밀도...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
저자는 FAPDF, CNPq, CAPES, UnB, FINEP 및 FINATEC과 같은 자금 지원 기관을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
참고문헌
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유