Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un ensemble de techniques de dépistage pour un aperçu rapide de la fonction des neutrophiles
Dans cet article
Résumé
Ce protocole comprend un ensemble de tests fonctionnels des neutrophiles à utiliser comme méthode de criblage pour couvrir les fonctions de différentes voies de signalisation. Le protocole comprend une évaluation initiale et simple de la viabilité cellulaire, de la pureté, de la production d’espèces réactives de l’oxygène, de la migration en temps réel, de la phagocytose et d’une suggestion préliminaire de pièges extracellulaires à neutrophiles.
Résumé
Les neutrophiles sont connus comme l’une des premières lignes de défense de la réponse immunitaire innée et peuvent remplir de nombreuses fonctions cellulaires particulières, telles que la chimiotaxie, la migration inverse, la phagocytose, la dégranulation des enzymes et des métabolites cytotoxiques et la libération d’ADN sous forme de pièges extracellulaires neutrophiles (TNE). Les neutrophiles ont non seulement une signalisation étroitement régulée, mais participent également à la régulation d’autres composants du système immunitaire. Comme les neutrophiles frais sont différenciés en phase terminale, de courte durée de vie et très variables d’un individu à l’autre, il est important de tirer le meilleur parti des échantillons collectés. Les chercheurs doivent souvent effectuer des tests de dépistage pour avoir une vue d’ensemble des nombreuses fonctions des neutrophiles qui peuvent être affectées par des conditions spécifiques en cours d’évaluation. Une série de tests suivant un seul processus d’isolement de neutrophiles de densité normale a été développée pour répondre à ce besoin, en recherchant un équilibre entre la rapidité, l’exhaustivité, le coût et la précision. Les résultats peuvent être utilisés pour raisonner et guider des études de suivi approfondies. Cette procédure peut être réalisée dans un temps moyen de 4 h et comprend l’évaluation de la viabilité cellulaire, de la production d’espèces réactives de l’oxygène (ROS), de la migration en temps réel et de la phagocytose de la levure sur des lames de verre, laissant suffisamment de cellules pour des approches plus détaillées telles que les études omiques. De plus, la procédure comprend un moyen d’observer facilement une suggestion préliminaire de TNE après une coloration panoptique rapide observée par microscopie optique, avec un manque de marqueurs spécifiques, mais suffisamment pour indiquer si des efforts supplémentaires dans ce sens en vaudraient la peine. La diversité des fonctions testées combine des points communs entre les tests, réduisant ainsi le temps et les coûts d’analyse. La procédure a été nommée NeutroFun Screen, et bien qu’elle ait des limites, elle équilibre les facteurs susmentionnés. De plus, l’objectif de ce travail n’est pas d’établir un ensemble de tests défini, mais plutôt une ligne directrice qui peut être facilement adaptée aux ressources et aux exigences de chaque laboratoire.
Introduction
Les neutrophiles sont les cellules immunitaires innées les plus abondantes dans le sang humain et sont connues pour jouer un rôle majeur dans l’infection et l’inflammation, étant les premiers intervenants à arriver sur le site des lésions tissulaires1. Ces dernières années, il y a eu une reconnaissance croissante du rôle crucial que jouent les neutrophiles dans une variété de maladies et dans le soutien de l’homéostasie2. Les neutrophiles ont non seulement une signalisation étroitement régulée, mais participent également à la régulation d’autres composants du système immunitaire 3,4,5. Par conséquent, l’étude des neutrophiles et de leurs nombreuses fonctions cellulaires inhabituelles, telles que la chimiotaxie, la migration inverse6, la phagocytose7, l’explosion respiratoire8 et la libération de pièges extracellulaires neutrophiles (TNE)7, est impérative dans de nombreux contextes de recherche où il est nécessaire d’évaluer les changements fonctionnels, morphologiques ou moléculaires potentiels des neutrophiles déclenchés par des conditions spécifiques en cours d’analyse.
Les neutrophiles fraîchement isolés sont différenciés en phase terminale, de courte durée, très dynamiques et facilement activés9. Cependant, une méthode de stockage efficace qui n’affecte pas les réponses des neutrophiles n’a pas encore été mise au point, ce qui rend difficile la réalisation de plusieurs tests qui doivent être ininterrompus. De plus, les analyses fonctionnelles décrites précédemment10,11, basées sur des tests qui nécessitent une cytométrie et/ou une coloration fluorescente, peuvent ne pas être un choix viable lorsqu’une évaluation large et initiale du neutrophile est nécessaire.
Pour répondre à ces questions, ce protocole décrit un ensemble de tests qui peuvent être effectués à la suite d’un seul processus d’isolement, y compris l’évaluation de la viabilité cellulaire, la production d’espèces réactives de l’oxygène (ROS), la migration en temps réel et la phagocytose de Saccharomyces cerevisiae, dont les résultats peuvent être utilisés pour raisonner des études de suivi approfondies. Cette procédure, baptisée NeutroFun Screen, a été conçue pour englober les principales activités effectrices, à l’exception de la dégranulation, et peut être réalisée en un temps moyen de 4 h, dont 1 h d’activation. De plus, les cellules restantes peuvent être utilisées pour des approches plus détaillées telles que des études omiques. L’avantage de cette méthode réside dans son équilibre entre la rapidité, l’exhaustivité, le coût et la précision.
De plus, il existe un moyen d’observer facilement une suggestion préliminaire de TNE, sans marqueurs spécifiques, mais suffisamment pour indiquer si des efforts supplémentaires dans cette direction en vaudraient la peine. La diversité des fonctions testées vise à combiner les points communs entre les tests, réduisant ainsi le temps et les coûts d’analyse. L’objectif principal de cette méthode est de fournir une analyse fonctionnelle équilibrée en ce qui concerne la vitesse, l’exhaustivité, le coût et la précision qui permet d’avoir une vue d’ensemble de la réponse du neutrophile, ce qui en fait une première étape utile dans l’étude des effets de nouveaux stimuli sur les neutrophiles de densité normale.
Protocole
Toutes les expériences ont strictement suivi les directives éthiques établies par le comité d’examen institutionnel de l’Université de Brasilia (processus 13364819.0.0000.5558), et les échantillons ont été identifiés par des codes pour garantir l’anonymat des donneurs. Les cellules ont été obtenues auprès de donneurs masculins normaux en bonne santé âgés de 18 à 35 ans, qui ont signé le consentement éclairé et répondaient aux critères d’admissibilité suivants : non-fumeurs/vapoteurs, aucun problème de santé chronique et aucun antécédent de troubles inflammatoires au cours des 14 derniers jours.
1. Prélèvement sanguin
- Placer de manière aseptique 0,3 mL d’héparine à 5 000 UI/mL (voir le tableau des matériaux) dans une seringue stérile de 20 mL pour l’hépariniser.
- Appliquez un garrot veineux à environ 4 pouces au-dessus du site de ponction et identifiez la veine cubitale ou céphalique médiane pour la ponction veineuse.
REMARQUE : Assurez-vous que le temps total du garrot ne dépasse pas 1 min. - Nettoyez le site de ponction avec de l’alcool à 70% et effectuez la ponction veineuse.
- Retournez doucement la seringue trois ou quatre fois après avoir recueilli le sang pour bien mélanger le sang et l’héparine.
2. Isolement des neutrophiles
NOTE : Les leucocytes polymorphonucléaires (PMN) sont isolés par centrifugation par gradient de densité suivie d’une lyse hypotonique des globules rouges (GR) restants, comme décrit précédemment11 avec quelques modifications. Cette méthode n’est pas obligatoire pour effectuer les tests de criblage et peut être remplacée tant que la méthode choisie permet d’obtenir une viabilité de >97 %, un amorçage ou une activation de <3 % des PMN, et qu’elle donne suffisamment de cellules pour tous les essais, répétitions et conditions. Il est obligatoire d’effectuer ces étapes dans des conditions aseptiques et d’utiliser des solutions exemptes d’endotoxines pour éviter l’activation cellulaire.
- Faire des dilutions de 12 mL de milieux de séparation à 60 % et à 70 % (disponibles dans le commerce ; voir le tableau des matériaux) dans des tubes coniques de 50 mL.
- Préparez le gradient de bas en haut en ajoutant 4 mL à la fois de la dilution de 60 % sur la dilution de 70 %, à l’aide d’une pipette de 5 mL. Faites-le doucement pour éviter de mélanger l’interface.
- Déposer délicatement 12 ml de sang hépariné sur le gradient de densité. Centrifuger à 200 x g pendant 15 min à température ambiante.
REMARQUE : À partir de cette étape, jusqu’à l’activation du PMN, tous les réactifs et tubes utilisés doivent être conservés dans une glacière remplie de glace. - Jeter la couche de plasma/cellule mononucléée, puis transférer délicatement la couche au-dessus de la pastille érythrocytaire dans deux tubes coniques de 15 ml d’environ 7,5 ml chacun. Complétez le volume du tube avec la solution saline équilibrée de Hank (HBSS ; voir le tableau des matériaux).
- Centrifuger à 300 x g pendant 5 min à 19 °C.
- Lavez la pastille cellulaire avec HBSS.
- Jeter le surnageant en versant le tube et remettre délicatement la pastille en suspension dans 7 mL de HBSS.
- Centrifuger à 300 x g pendant 5 min à 19 °C pour éliminer tous les milieux de séparation.
- Effectuer une lyse hypotonique des globules rouges restants.
- Jetez le surnageant et mélangez les granulés dans un seul tube.
- Remettre en suspension la pastille de globules rouges/PMN dans 3 mL de H2O stérile et ajouter 3 mL d’HBSS (2x) dans les 25 s pour rétablir l’osmolarité. Ensuite, centrifuger à 300 x g pendant 5 min à 19 °C.
- Répétez les étapes 2.8.1 et 2.8.2 pour obtenir une pastille blanche sans érythrocytes.
REMARQUE : Le surnageant doit être retiré dès que possible afin de minimiser le contact des neutrophiles avec les produits de dégradation des globules rouges. Alternativement, la deuxième lyse hypotonique peut être remplacée en remettant doucement en suspension la couche résiduelle de globules rouges et en enlevant tout le surnageant, car les globules rouges restants sédimenteront au-dessus de la pastille de PMN.
- Jetez le surnageant en versant le tube, remettez doucement en suspension les PMN dans le tampon restant et transférez-les dans un microtube glacé.
REMARQUE : Assurez-vous d’annoter le volume lors du transfert des cellules remises en suspension à l’aide d’une micropipette. - Transférer 3 x 1 μL de la suspension cellulaire sur une lame de verre propre (trois puits de 1 μL chacun) et colorer avec des panoptiques rapides (voir le tableau des matériaux) pour l’évaluation de la morphologie et de la pureté12.
- Pour colorer avec le panoptique rapide, immergez la lame cinq fois dans le fixateur panoptique n° 1, six fois dans l’éosine n° 2 et deux fois dans l’hématoxyline n° 3, chaque immersion durant 1 s.
- Lavez délicatement la lame en verre avec de l’eau distillée.
- Laisser égoutter et sécher à l’air libre.
- Observez au microscope et comptez 300 cellules aléatoires dans chaque puits, différenciant ainsi les neutrophiles des autres granulocytes.
- Transférer 1 μL de la suspension cellulaire sur 49 μL de colorant bleu de trypan à 0,2 %13 et compter les cellules à l’aide d’une chambre de Neubauer, en distinguant les cellules mortes des cellules viables.
- Ajustez la concentration cellulaire à 6 667 cellules/μL à l’aide d’une solution de plasma autologue à 50 % et d’HBSS à 50 % complétée par du calcium et du magnésium. Répartir uniformément les 6 667 cellules/μL de suspension entre les microtubes correspondant aux conditions à tester, y compris le témoin négatif.
REMARQUE : Toute concentration cellulaire similaire aux neutrophiles circulants dans l’organisme modèle peut être utilisée, mais il est important d’utiliser la même concentration cellulaire dans toutes les expériences pour la reproductibilité.
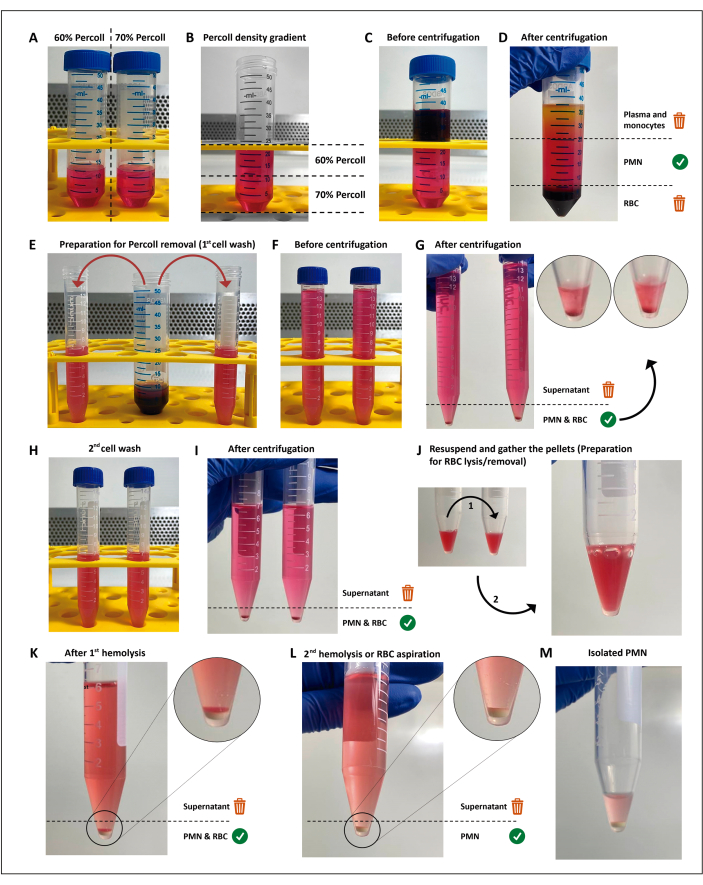
Figure 1 : Protocole d’isolement des neutrophiles. Deux concentrations du milieu de séparation (percoll) (A) sont empilées (B), puis le sang est superposé au-dessus du gradient de séparation (C). Après centrifugation, le PMN se trouve dans la couche centrale (D), qui est divisée en deux tubes de 15 ml (E). La suspension cellulaire est lavée deux fois dans HBSS et centrifugée (G-I) pour éliminer le milieu, puis les cellules sont remises en suspension et les globules rouges résiduels sont soumis à deux cycles de lyse hypotonique (J-M). Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparation à l’activation des neutrophiles
- Dans des microtubes de 1,5 mL, préparer un système d’activation pour chaque condition de manière à ce que la concentration cellulaire finale soit de 6 600 cellules/μL. Par exemple, pour tester les effets de 100 nM de fMLP (N-formyl-méthionyl-leucyl-phénylalanine ; voir le tableau des matériaux), ajoutez 5 μL de 10 μM fMLP à 495 μL de la suspension de 6 667 cellules/μL. Pour le témoin négatif (non stimulé), ajouter de l’HBSS contenant du Ca2+ et du Mg2+.
NOTA : Pour démontrer cette méthodologie, les concentrations finales suivantes des stimuli ont été utilisées : 100 nM de fMLP, 16 μM de fallaxine, un peptide antimicrobien naturel14, et 100 nM de PMA (phorbol 12-myristate 13-acétate) (voir le tableau des matériaux). - Incuber à 37 °C sans rotation.
NOTA : Toutes les aliquotes pour les essais fonctionnels sont prélevées sur cette suspension cellulaire, ci-après dénommée le système d’activation.
4. Dosage du chlorure de bleu de nitrotétrazolium (NBT) pour l’évaluation de la production de ROS
- Préparation de la solution de travail NBT : Pour chaque condition expérimentale, préparer une solution de travail NBT ( voir le tableau des matériaux) de 6 mM en suivant les étapes suivantes :
- Dissoudre 0,0005 g de NBT dans 10 μL de diméthylsulfoxyde (DMSO) et de vortex pendant au moins 15 minutes.
- Ajouter 90 μL de HBSS Ca2+Mg2+ et vortex jusqu’à 2 min.
REMARQUE : Toutes les étapes impliquant la NBT doivent être effectuées dans l’obscurité.
- Effectuez un test de glissement NBT.
- Après 20 min d’activation cellulaire, mélangez délicatement la suspension cellulaire et transférez soigneusement 2 μL de PMN sur une lame de verre propre. Incuber pendant 20 min dans une chambre humidifiée à 37 °C.
REMARQUE : N’étalez pas trop la suspension de cellules sur la lame ; sinon, il risque de se dessécher avant l’incubation. - Ajouter 1 μL de la solution de travail NBT sur les cellules et incuber pendant 20 minutes à l’abri de la lumière.
- Séchez la lame à l’air chaud et fixez-la avec une goutte de méthanol dans chaque puits pendant 1 min. Colorer avec 0,03 % de safranine (voir tableau des matériaux) pendant 1 min.
- Lavez délicatement la lame en verre avec de l’eau distillée.
- Laissez la lame sécher à l’air libre et observez-la au microscope.
- Comptez 100 cellules aléatoires dans chaque puits, en différenciant les neutrophiles avec et sans dépôts de formazan.
- Après 20 min d’activation cellulaire, mélangez délicatement la suspension cellulaire et transférez soigneusement 2 μL de PMN sur une lame de verre propre. Incuber pendant 20 min dans une chambre humidifiée à 37 °C.
- Effectuer un test de spectrophotométrie NBT.
- Après 40 min d’activation cellulaire, mélangez délicatement la suspension cellulaire et transférez 90 μL de PMN du système d’activation vers un microtube propre. Ensuite, ajoutez délicatement 20 μL de la solution NBT de 6 mM. Incuber dans l’obscurité pendant 20 min à 37 °C.
- Ajouter 100 μL de dodécylsulfate de sodium à 10 % (FDS ; voir le tableau des matériaux) et le vortex.
- Soniser à l’aide d’un sonicateur à pointe à une amplitude de 60%, cinq cycles de 15 s chacun avec des intervalles de 15 s. Centrifuger à 12 000 x g pendant 5 min.
- Transférer 60 μL du surnageant dans une plaque à fond transparent à 96 puits et mesurer l’absorbance du produit formazan à 570 nm.
5. Test de phagocytose
- Préparez une suspension de 33 000 levures/μL pour chaque condition, comme décrit ci-dessous :
- Ajouter environ 0,75 mg de levure sèche (Saccharomyces cerevisiae ; voir le tableau des matériaux) à 200 μL de HBSS Ca2+Mg2+ et incuber dans un thermomélangeur à 100 °C à 500 tr/min pendant au moins 15 min.
- Homogénéiser le mélange par vortex et transférer 5 μL de suspension de levure à 45 μL de colorant bleu trypan à 0,2 %. Comptez les levures à l’aide d’une chambre Neubauer.
- Ajustez la concentration de la suspension initiale à 33 000 cellules de levure/μL à l’aide de HBSS Ca2+Mg2+. Gardez la suspension sur la glace jusqu’à utilisation.
- Après 20 min d’activation cellulaire, mélangez délicatement la suspension cellulaire et transférez 5 μL du système d’activation à 5 μL de la suspension de 33 000 levures/μL de Saccharomyces cerevisiae dans un nouveau microtube stérile.
REMARQUE : Le rapport neutrophiles/levure est de 1 :5 (PMN :levure). - Transférez immédiatement 6 μL de la suspension PMN/levure dans trois puits d’une lame de verre propre (2 μL chacun) et incubez la lame dans une chambre humidifiée pendant 40 min.
REMARQUE : N’étalez pas trop la suspension de cellules sur la lame ; sinon, il risque de se dessécher avant l’incubation. - Séchez la lame sous l’air chaud et teignez-la avec un panoptique rapide, comme décrit à l’étape 2.9 ci-dessus.
REMARQUE : La troisième étape de la coloration panoptique rapide est essentielle à l’analyse microscopique de la lame. La coloration de la lame pendant ≥3 s à cette étape peut la rendre impropre à l’analyse, car il sera difficile de différencier la levure des lobes nucléaires des neutrophiles. - Observez les lames au microscope, en comptant 100 neutrophiles aléatoires de chaque puits et en faisant la distinction entre les PMN positifs et négatifs pour la phagocytose.
REMARQUE : Au moins une particule de levure à l’intérieur ou en contact direct avec la membrane cellulaire PMN indique un PMN positif pour la phagocytose. Si vous vous intéressez au rapport levure/neutrophile, comptez également le nombre de particules de levure englouties.
6. Test de chimiotaxie PMN en temps réel
NOTE : L’essai de migration est effectué de la même manière que le protocole décrit ci-dessus15, avec les adaptations suivantes :
- Préparez le gradient chimiotactique en ajoutant 160 μL de chimioattractant (p. ex., fMLP, IL-8, C5 ou LTB4 ; voir le tableau des matériaux) dans la chambre inférieure d’une plaque d’analyseur de cellules en temps réel (RTCA) à impédance. Pour les témoins négatifs et les blancs, ajouter 160 μL d’HBSS Ca2+Mg2+.
- Fixez la chambre supérieure et ajoutez 25 μL de HBSS Ca2+Mg2+. Incuber à température ambiante pendant au moins 1 h pour former le gradient chimiotactique.
- Après 60 min d’activation cellulaire, mélangez délicatement la suspension cellulaire et placez 60 μL de suspension cellulaire dans la chambre supérieure. Ajouter 60 μL de HBSS Ca2+Mg2+ dans le blanc.
- Placez la plaque RTCA et programmez le logiciel RTCA pour mesurer l’indice cellulaire (IC) toutes les 60 s pendant 2 h.
REMARQUE : Les plaques RTCA peuvent être lavées pour être réutilisées comme décrit précédemment16. En résumé, lavez les chambres et les électrodes RTCA avec une solution saline phosphatée (PBS) trois fois, puis deux fois avec de l’eau ultrapure de type I. Incuber la chambre inférieure et la chambre supérieure avec 0,25 % de trypsine 0,53 mM d’acide éthylènediaminetétraacétique (EDTA) pendant 40 min. Laver trois fois à l’eau ultra-pure.
7. Essai suggestif NET
- Après 10 min d’activation cellulaire, mélanger délicatement la suspension cellulaire et transférer 4 μL de PMN de chaque système d’activation évalué, divisés en deux puits d’une lame de verre propre. Incuber dans une chambre humidifiée à 37 °C pendant 30 min.
- Ajouter 1 μL d’ADN I dans l’un des puits et incuber pendant 20 min à 37 °C (dans une chambre humide).
- Séchez la lame et colorez avec un panoptique rapide, comme décrit précédemment à l’étape 2.9 de la section « Isolation des neutrophiles ».
- Évaluez les lames au microscope.
REMARQUE : Recherchez toute indication de libération de NET, caractérisée par la présence de structures en forme de toile. Une fois identifié, confirmez si le traitement à l’ADN I était capable d’éliminer de telles structures. Ce test suggère la formation de TNET, car des tests supplémentaires sont nécessaires pour confirmer leur présence.
Résultats
La méthode d’isolement basée sur la densité utilisée dans cette étude (figure 1) répondait aux critères des expériences proposées. Les paramètres des neutrophiles obtenus par cette méthode comprenaient la viabilité ≥98 %, la pureté ≥94 %) et le rendement cellulaire ≥1,5 x 107, sans activation détectable par les tests de dépistage. Deux étapes pertinentes dans l’isolement des NMP sont l’anticoagulation et l’élimination des globules rouges. Le fait de ...
Discussion
Les neutrophiles sont des cellules très dynamiques et réactives qui ont une courte durée de vie et ne peuvent pas encore être cryoconservées19, ce qui rend difficile l’étude de leur biologie. Par conséquent, il est essentiel de suivre des étapes minutieuses pour obtenir des neutrophiles viables, enrichis et au repos11,20. Cette étude a utilisé une technique d’isolement basée sur la densité qui met l’accent sur une manipul...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs remercient les organismes subventionnaires suivants : FAPDF, CNPq, CAPES, UnB, FINEP et FINATEC.
matériels
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
Références
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon