A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نسخة واحدة من تنقية الكروماتين لموضع الجين في Saccharomyces cerevisiae
In This Article
Summary
يقدم هذا البروتوكول طريقة عزل الكروماتين الخاصة بالموقع بناء على إعادة التركيب الخاصة بالموقع لتنقية موضع جين أحادي النسخة مهم في سياق الكروماتين الأصلي من الخميرة الناشئة ، Saccharomyces cerevisiae.
Abstract
الوحدة التنظيمية الأساسية للكروماتين حقيقي النواة هي جسيم النواة الأساسي (NCP) ، والذي يشتمل على الحمض النووي ملفوف ~ 1.7 مرة حول أوكتامير هستون. يعرف الكروماتين بأنه كيان NCPs والعديد من مجمعات البروتين الأخرى ، بما في ذلك عوامل النسخ وإعادة تشكيل الكروماتين وتعديل الإنزيمات. لا يزال من غير الواضح كيف يتم تنظيم تفاعلات البروتين والحمض النووي هذه على مستوى مواقع جينومية محددة خلال مراحل مختلفة من دورة الخلية. ويرجع ذلك أساسا إلى القيود التقنية الحالية ، والتي تجعل من الصعب الحصول على قياسات دقيقة لمثل هذه التفاعلات الديناميكية. هنا ، نصف طريقة محسنة تجمع بين إعادة التركيب الخاصة بالموقع وبروتوكول تنقية تقارب فعال أحادي الخطوة لعزل موضع جين أحادي النسخة مهم في حالة الكروماتين الأصلية. تسمح هذه الطريقة بالتخصيب القوي للموضع المستهدف على الكروماتين الجينومي ، مما يجعل هذه التقنية استراتيجية فعالة لتحديد وقياس تفاعلات البروتين بطريقة غير متحيزة ومنهجية ، على سبيل المثال عن طريق قياس الطيف الكتلي. بالإضافة إلى هذه التحليلات التركيبية ، من المحتمل أن يعكس الكروماتين الأصلي المنقى بهذه الطريقة الوضع في الجسم الحي فيما يتعلق بتحديد موضع النيوكليوسوم وتعديلات الهستون ، وبالتالي فهو قابل لمزيد من التحليلات الهيكلية والكيميائية الحيوية للكروماتين المشتق من أي موضع جينومي تقريبا في الخميرة.
Introduction
إن التنظيم الديناميكي للجينومات حقيقية النواة في الكروماتين يضغط الحمض النووي ليتناسب مع حدود النواة مع ضمان ديناميكيات كافية للتعبير الجيني وإمكانية الوصول إلى العوامل التنظيمية. جزئيا ، يتم التوسط في هذا التنوع بواسطة النيوكليوسوم ، الوحدة الأساسية للكروماتين ، والتي تضم جسيما أساسيا يحتوي على 147 نقطة أساس من الحمض النووي ملفوفة ~ 1.7 مرة حول أوكتامير هيستون1. النيوكليوسوم هو هيكل ديناميكي للغاية فيما يتعلق بتكوينه ، مع العديد من متغيرات الهستون وتعديلات ما بعد الترجمة (PTMs) على ذيول هيستون N- و C-terminal. علاوة على ذلك ، يتفاعل الكروماتين حقيقي النواة مع العديد من المكونات الأساسية الأخرى ، مثل عوامل النسخ ، وآلات معالجة الحمض النووي والحمض النووي الريبي ، والبروتينات المعمارية ، والإنزيمات المشاركة في إعادة تشكيل الكروماتين وتعديله ، وجزيئات الحمض النووي الريبي المرتبطة بالكروماتين. تتطلب جميع هذه الأجهزة الحاسمة المشاركة في النسخ والتكرار والإصلاح الوصول إلى الكروماتين ، والذي يعمل كركيزة طبيعية لهذه العمليات. وبالتالي ، فإن فهم الآليات الجزيئية الكامنة وراء معاملات الحمض النووي هذه يتطلب تعريفا دقيقا للتغيرات الجماعية في بنية الكروماتين في المناطق الجينومية المحددة حيث تتلاقى هذه الأجهزة وتسهل التفاعلات البيولوجية.
على الرغم من تحديد العديد من عوامل الكروماتين من خلال دراسات الوراثة والتفاعل بين البروتين والبروتين ، فإن إجراء تحليلات مباشرة وغير متحيزة وشاملة لتفاعلات الكروماتين في مواقع جينومية معينة ظل يمثل عقبة كبيرة 2,3. في البداية ، يمكن فقط عزل المناطق الوفيرة للغاية من الجينوم (أي المواقع المتكررة) أو البلازميدات متعددة النسخ بكميات كافية ونقاء لتحديد مطياف الكتلة للبروتينات المرتبطة4،5،6،7. بدأت سلسلة من الأساليب الجديدة القائمة على التهجين المباشر لمجسات الالتقاط إلى الحمض النووي المصبوغ بالكروماتين ، أو البيوتينيل القريب باستخدام نظام CRISPR-dCas9 ، أو ربط بروتينات المحولات الخاصة بالتسلسل بموضع الاهتمام في كشف بروتين المواقع أحادية النسخة من جينومات الخميرة والثدييات8،9،10. ومع ذلك ، تتطلب كل هذه الطرق تشابك الفورمالديهايد لتحقيق الاستقرار في تفاعلات البروتين والحمض النووي وصوتنة لإذابة الكروماتين للتنقية اللاحقة. معا ، يستبعد كلا التلاعب إمكانية إجراء دراسات هيكلية ووظيفية لاحقة للكروماتين المنقى.
للتغلب على هذه القيود ، ابتكرنا سابقا منهجية تستخدم إعادة التركيب الخاصة بالموقع لاستخراج المجالات الكروموسومية المستهدفة من الخميرة11,12. في جوهرها ، فإن المنطقة الجينومية ذات الأهمية محاطة بمواقع التعرف (RS) ل R-recombinase الخاص بالموقع من Zygosaccharomyces rouxi مع دمج مجموعة من ثلاثة مواقع ربط الحمض النووي في نفس الوقت لبروتين LexA الخامع للنسخ بدائي النواة (LexA) داخل نفس المنطقة. تحتوي خلايا الخميرة على شريط تعبير للتعبير المتزامن ل R-recombinase وبروتين LexA مدمج في علامة تنقية التقارب الترادفي (TAP). بعد تحريض R-recombinase ، يقوم الإنزيم بكفاءة باستئصال المنطقة المستهدفة من الكروموسوم في شكل مجال كروماتين دائري. يمكن تنقية هذا المجال عبر بروتين محول LexA-TAP ، الذي يرتبط بمواقع ربط الحمض النووي LexA ، بالإضافة إلى دعم التقارب. تم استخدام هذه الطريقة مؤخرا لعزل مجالات الكروماتين المتميزة التي تحتوي على أصول تكرار مختارة لكروموسوم الخميرة III13.
تتمثل إحدى المزايا الرئيسية لهذا النهج خارج الجسم الحي في أنه يسمح بإجراء تحليلات وظيفية للمادة المعزولة. على سبيل المثال ، يمكن إخضاع مجالات أصل النسخ المتماثل المنقاة بهذه الطريقة لمقايسات النسخ المتماثل في المختبر لتقييم كفاءة إطلاق الأصل في أنبوب اختبار من قوالب الكروماتين المجمعة الأصلية في الجسم الحي . في نهاية المطاف ، قد يسمح التوصيف الكيميائي الحيوي والوظيفي للمادة المعزولة بإعادة تكوين العمليات النووية باستخدام البروتينات النقية جنبا إلى جنب مع قالب الكروماتين الأصلي. باختصار ، تفتح هذه المنهجية طريقا مثيرا في أبحاث الكروماتين ، حيث سيكون من الممكن متابعة التغيرات التركيبية والهيكلية الجماعية للكروماتين لمنطقة جينومية معينة تخضع لمعاملة كروموسومية معينة.
Protocol
انظر جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والأدوات المستخدمة في هذا البروتوكول. انظر الجدول 1 للحصول على قائمة بالحلول والمخازن المؤقتة والوسائط المستخدمة.
1. بناء سلالة الخميرة المؤتلفة
- لبناء سلالة خميرة مختصة بإعادة التركيب ، قم بتحويل البلازميد K238 المهضوم SbfI إلى سلالة خميرة مع مواقع ربط LexA متكاملة ومواقع إعادة تركيب RS في موضع الاهتمام13,14.
ملاحظة: يحتوي جزء تقييد SbfI المحول على شريط التعبير المطلوب للتعبير التأسيسي لبروتين الاندماج LexA-TAP و R-recombinase مع تسلسلات متماثلة لكروموسوم الخميرة I للتكامل الجيني لكاسيت التعبير عن طريق إعادة التركيب المتماثل (الشكل 1). - لبناء سلالة تحكم ، خذ سلالة خميرة متساوية المنشأ تفتقر إلى مواقع ربط RS و LexA المتكاملة ، وقم بتحويلها باستخدام بلازميد K238 المهضوم SbfI في ظل نفس الظروف المستخدمة في السلالة المختصة بإعادة التركيب.
- حدد خلايا الخميرة المختصة بناء على علامة اختيار LEU2 على ألواح أجار SCD-LEU14.
2. اقتران الأجسام المضادة IgG بالخرز المغناطيسي المنشط بالإيبوكسي
ملاحظة: قم بإقران الأجسام المضادة IgG للخرز المغناطيسي المنشط بالإيبوكسي وفقا للبروتوكولالمنشور التالي 11.
- تعليق 300 ملغ من الخرز المنشط الايبوكسي في 10 مل من الأسيتون 50٪ (300 ملغ يتوافق مع ~ 5.1 × 1010 حبات) في أنبوب مخروطي 50 مل. يهز بقوة على خلاط دوامة.
- جهاز طرد مركزي الأنبوب الذي يحتوي على الخرز عند 820 × جم و 4 درجات مئوية لمدة 2 دقيقة. إزالة الطاف.
- اغسل الخرزات 3x مع 20 مل من محلول فوسفات الصوديوم 0.1 متر (درجة الحموضة 7.4). قم بإزالة المادة الطافية بعد كل خطوة غسيل عن طريق الطرد المركزي كما هو موضح في الخطوة 2.2.
- الخرزات في 16 مل من محلول فوسفات الصوديوم 0.1 متر (درجة الحموضة 7.4) ، وقم بتدويرها برفق في فرن التهجين لمدة 5 دقائق في درجة حرارة الغرفة.
- قم بإذابة الأرنب IgGs (100 مجم) في 7 مل من dH2O (التركيز النهائي: 14 مجم / مل).
- أجهزة الطرد المركزي تعليق IgG عند 13000 × جم و 4 درجات مئوية لمدة 10 دقائق لتوضيح التعليق.
- نقل 3.5 مل من المادة الطافية (المقابلة ل 50 ملغ من IgGs الأرانب) إلى أنبوب مخروطي جديد سعة 50 مل.
- قم بتخفيف محلول IgG ب 9.85 مل من 0.1 M من فوسفات الصوديوم العازلة (الرقم الهيدروجيني 7.4) ، متبوعا بإضافة 6.65 مل من 3 M كبريتات الأمونيوم في 0.1 M فوسفات الصوديوم (درجة الحموضة 7.4) تحت الخلط اللطيف.
ملاحظة: تجنب إضافة كبريتات الأمونيوم بسرعة إلى المحلول لأن التركيز المحلي العالي للملح سيؤدي إلى ترسيب IgGs للأرانب. - قم بطرد محلول IgG عند 820 × جم و 4 درجات مئوية لمدة 3 دقائق ، وأضف المادة الطافية الناتجة إلى تعليق الخرزة المغناطيسية.
- احتضان الأنبوب طوال الليل أو على الأقل لمدة 18 ساعة عند 30 درجة مئوية مع دوران لطيف في فرن التهجين.
- قم بإزالة المادة الطافية كما هو موضح في الخطوة 2.2.
- اغسل الخرزات ب 20 مل من 100 مللي مول من الجلايسين-حمض الهيدروكلوريك (درجة الحموضة 2.5). قم بإزالة المحلول بسرعة كما هو موضح في الخطوة 2.2 لتجنب تمسخ عديد الببتيدات IgG.
- اغسل الخرزات مرة واحدة باستخدام 20 مل من 10 مللي متر Tris-HCl (درجة الحموضة 8.8). نضح المادة الطافية كما هو موضح في الخطوة 2.2.
- أضف 20 مل من محلول ثلاثي إيثيل أمين 0.1 متر لمدة 5-10 دقائق تحت دوران لطيف لتعطيل مجموعات الإيبوكسي التفاعلية المتبقية. قم بإزالة المادة الطافية كما هو موضح في الخطوة 2.2.
- اغسل الخرزات 4x مع 20 مل من PBS (درجة الحموضة 7.4) لمدة 5 دقائق مع دوران لطيف. قم بإزالة المادة الطافية كما هو موضح في الخطوة 2.2 بعد كل خطوة غسيل.
- اغسل الخرزات 2x مع 20 مل من PBS (درجة الحموضة 7.4) مع 0.5٪ Triton X-100 (w / v) لمدة 5 دقائق و 15 دقيقة لكل منهما تحت دوران لطيف في فرن التهجين. قم بإزالة المادة الطافية كما هو موضح في الخطوة 2.2.
- الخرزات في حجم نهائي قدره 16 مل من PBS (درجة الحموضة 7.4) مع 0.02٪ أزيد الصوديوم (w / v). يخزن في شكل 1 مل من القسمة على حرارة 4 درجات مئوية حتى الاستخدام.
3. زراعة خلايا الخميرة والحصاد
- تلقيح سلالات الخميرة المختصة وإعادة تركيبها من ألواح YPD في 5 مل من وسط YPR ، واحتضانها طوال الليل عند 30 درجة مئوية و 200 دورة في الدقيقة.
- تلقيح 2 مل من هذه المزرعة في 100 مل من وسط YPR ، واحتضانها طوال الليل عند 30 درجة مئوية و 200 دورة في الدقيقة.
- لكل سلالة ، قم بتوزيع 1800 مل من وسط YP المعقم و 200 مل من محلول رافينوز المعقم (20٪ وزن / حجم) في كل من قارورتين من 5 لتر Erlenmeyer (4 لتر من وسط الاستزراع في المجموع لكل سلالة ، مقسمة إلى قارورين).
- تلقيح خلايا الخميرة النامية عند OD600 0.2 في وسطها الخاص ، واحتضانها كما هو موضح في الخطوة 3.1 لمدة 6 ساعات تقريبا أو حتى تصل الخلايا إلى OD600 المطلوب من 1.0. لضمان النمو الطبيعي للخلايا ، خالية من أي تلوث ، تحقق من OD على فترات 2 ساعة.
- أضف 200 مل من الجالاكتوز (20٪ وزن / حجم) للحث على إعادة التركيب الخاصة بالموقع.
- أضف 110 ميكرولتر (50 نانوغرام / مل) من YMFA (في نفس الوقت مع الجالاكتوز ، الخطوة 3.5) لإيقاف الخلايا في المرحلة G1 ، واحتضانها لمدة 2 ساعة.
ملاحظة: تعتمد إضافة YMFA إلى الخلايا على الظروف التجريبية والسؤال البيولوجي الذي يجب معالجته. على وجه التحديد ، في هذه التجربة ، يتم القبض على الخلايا في المرحلة G1 للحصول على مجموعة خلايا متجانسة ذات أصول تكرار مرخصة. في هذه العملية ، يرتبط المركب قبل النسخ المتماثل بالأصول في المرحلة G1 قبل بدء تكرار الحمض النووي في المرحلة S. - انقل تعليق الخلية إلى دلاء أجهزة طرد مركزي سعة 1 لتر ، وأجهزة طرد مركزي عند 6000 × جم و 4 درجات مئوية لمدة 10 دقائق. تخلص من المادة الطافية ، وأعد تعليق كريات الخلية بحجم إجمالي يتراوح بين 10 و 15 مل من dH2O.
- أغلق حقنة سعة 25 مل بسدادة Luer ، وضعها داخل أنبوب مخروطي سعة 50 مل مملوء بالماء. نقل تعليق الخلية إلى مجموعة المحقنة ، وأجهزة الطرد المركزي عند 2397 × جم لمدة 10 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية.
- قم بإزالة سدادة Luer من المحقنة ، وقم ببثق الخلايا إلى نيتروجين سائل لتشكيل "معكرونة" للخلية.
ملاحظة: يوفر استخدام 4 لتر من وسط الاستزراع وزنا رطبا لكريات الخلايا النهائية من 7-10 جم. - انقل السباغيتي الخلوية المجمدة إلى أنبوب مخروطي سعة 50 مل ، واحفظه في درجة حرارة -80 درجة مئوية حتى الاستخدام مرة أخرى.
4. تنقية موضع الكروماتين
ملاحظة: انظر الشكل 2 للحصول على نظرة عامة تخطيطية للخطوات المتضمنة في بروتوكول تنقية الكروماتين الخاص بالموضع.
- قم بتبريد مطحنة القهوة التجارية عن طريق طحن 30-50 جم من الثلج الجاف عن طريق هز مطحنة القهوة بقوة 2x لمدة 30 ثانية في كل مرة. بمجرد أن يبرد ، تخلص من مسحوق الثلج الجاف.
- امزج 3 جم من معكرونة خلايا الخميرة المجمدة مع ~ 30-50 جم من الثلج الجاف في مطحنة القهوة المبردة مسبقا.
- أغلق التقاطع بين الغطاء والمطحنة باستخدام بارافيلم لمنع فقدان مسحوق خلايا الخميرة أثناء الطحن.
- طحن مزيج الثلج الجاف بخلايا الخميرة 10x لمدة 30 ثانية في كل مرة ، مع فترات 30 ثانية بين كل جولة (تقدير الوقت الإجمالي: ~ 10 دقائق). لتجنب التصاق الثلج الجاف ومسحوق الخلايا بجدران مطحنة القهوة ، اضغط على جوانب مطحنة القهوة باستمرار أثناء الطحن.
- انقل مسحوق الثلج الجاف بخلايا الخميرة الناتج إلى دورق بلاستيكي باستخدام ملعقة نظيفة وجافة.
- احتفظ بالأكواب الزجاجية في درجة حرارة الغرفة لتبخر الثلج الجاف.
- بمجرد أن يتبخر الثلج الجاف ، أضف 2.25 مل من المخزن المؤقت MB مع 1x مثبطات الأنزيم البروتيني والفوسفاتيز (750 ميكرولتر / جم من خلايا الخميرة) إلى مسحوق خلية الخميرة.
- ماصة خليط الخلية العازلة بقوة لضمان التعليق الكامل للخلايا مع المخزن المؤقت ، ونقلها إلى أنبوب مخروطي 15 مل.
- خذ عينات لتحليل الحمض النووي (0.1٪) والبروتين (0.05٪) من معلق الخلية الناتج (مستخلصات الخلايا الخام [CCE]). يخزن في درجة حرارة -20 درجة مئوية حتى تتم المعالجة الإضافية (الموصوفة في القسم 7).
- انقل معلق الخلية إلى أنابيب تفاعل منخفضة الارتباط سعة 2 مل ، وأجهزة طرد مركزي عند 21130 × جم لمدة 30 دقيقة عند 4 درجات مئوية لفصل حطام الخلية عن الخلية الخام المحللة.
- اجمع المواد الطافية من جميع الأنابيب في أنبوب مخروطي واحد سعة 15 مل.
- خذ عينات من المادة الطافية (الإدخال [IN]) للحمض النووي (0.1٪) وتحليل البروتين (0.05٪). يخزن في درجة حرارة -20 درجة مئوية حتى تتم المعالجة الإضافية (الموصوفة في القسم 7).
- قم بموازنة 500 ميكرولتر من ملاط الخرزة المغناطيسية المقترنة ب IgG (لكل سلالة خميرة) عن طريق غسل 2x ب 500 ميكرولتر من المخزن المؤقت MB البارد مع 1x مثبطات الأنزيم البروتيني والفوسفاتيز لمدة 5 دقائق لكل منهما عند 4 درجات مئوية عند الدوران عند 20 دورة في الدقيقة. تخلص من المادة الطافية من الخرز باستخدام رف مغناطيسي بعد كل خطوة غسيل.
- احتضان الحبيبات المغناطيسية المقترنة ب IgG في 500 ميكرولتر من المخزن المؤقت MB البارد مع مثبطات الأنزيم البروتيني والفوسفاتيز 1x لمدة 1 ساعة عند 4 درجات مئوية عند الدوران عند 20 دورة في الدقيقة. تخلص من المادة الطافية من الخرز باستخدام رف مغناطيسي.
- امزج ملاط الخرزة المغناطيسية المتوازن مع محلول الخلية ، واحتضانه بالدوران عند 20 دورة في الدقيقة لمدة 2 ساعة عند 4 درجات مئوية.
- انقل معلق محللات خلية الخرزة المغناطيسية الكامل إلى أنابيب تفاعل منخفضة الربط.
- افصل الحبيبات المغناطيسية ، التي تحمل الآن حلقات الكروماتين ذات الأهمية ، عن الخلية المحللة باستخدام رف مغناطيسي.
- انقل التدفق المتبقي (FT) من كل أنبوب إلى أنبوب مخروطي جديد سعة 15 مل ، وأخذ عينات لتحليل الحمض النووي (0.1٪) والبروتين (0.05٪). يخزن في درجة حرارة -20 درجة مئوية حتى تتم المعالجة الإضافية (الموصوفة في القسم 7).
- قم بتعليق الخرزات المغناطيسية من كل أنبوب في 300 ميكرولتر من المخزن المؤقت MB البارد ، وقم بتجميع الخرزات في أنبوب تفاعل واحد. اغسل 5 مرات لمدة 10 دقائق لكل منها ب 750 ميكرولتر من المخزن المؤقت البارد MB مع 1x بروتياز ومثبطات الفوسفاتيز عند 4 درجات مئوية عند الدوران عند 20 دورة في الدقيقة. قم بإجراء الغسيل النهائي باستخدام 750 ميكرولتر من المخزن المؤقت البارد MB بدون مثبطات الأنزيم البروتيني والفوسفاتيز.
- الخرزات في 40 ميكرولتر من المخزن المؤقت MB البارد بدون مثبطات الأنزيم البروتيني والفوسفاتيز.
ملاحظة: يمكن تعديل الحجم النهائي للشطف وفقا لتطبيق المصب المتوقع. عادة ما يعمل شطف TEV بكفاءة في نطاق 100-300 ميكرولتر.
5. الشطف بوساطة البروتياز TEV
- لتحرير معقدات حلقة الكروماتين LexA-CBP من الخرز ، احتضن الحبيبات ب 2 ميكرولتر من البروتياز TEV المؤتلف 6x الموسوم طوال الليل عند 4 درجات مئوية و 450 دورة في الدقيقة في خلاط حراري.
- افصل الخرزات عن الشطف النهائي باستخدام رف مغناطيسي. انقل الشطف ، الذي يحتوي على حلقات كروماتين مشقوقة ، إلى أنبوب تفاعل جديد سعة 1.5 mL.
- احتفظ بالأنابيب على رف مغناطيسي مرة أخرى لفصل أي خرز متبقي عن الشطف النهائي.
- أعد تعليق الخرزات (TB) في 750 ميكرولتر من محلول التيار المتردد البارد ، وأخذ عينات لتحليل الحمض النووي (0.1٪) والبروتين (0.05٪). يخزن في درجة حرارة -20 درجة مئوية حتى تتم المعالجة الإضافية (الموصوفة في القسم 7).
- من الشطف النهائي (TE) ، خذ عينات لتحليل الحمض النووي (0.5٪) والبروتين (0.25٪). يخزن في درجة حرارة -20 درجة مئوية حتى تتم المعالجة الإضافية (الموصوفة في القسم 7).
ملاحظة: نظرا لانخفاض حجم الشطف النهائي ، يتم زيادة النسبة المئوية للعينات التي تم جمعها لتحليل الحمض النووي والبروتين للحصول على تمثيل أفضل لمحتوى البروتين والحمض النووي أثناء التحليل.
6. الشطف تمسخ
- اغسل الخرزات 2x في 750 ميكرولتر من المخزن المؤقت للتيار المتردد البارد لمدة 20 دقيقة في كل مرة عند 4 درجات مئوية عند الدوران عند 20 دورة في الدقيقة.
- لاستخراج معقدات LexA-chromatin المتبقية ، قم بإجراء شطف تمسخ بإضافة 500 ميكرولتر من 0.5M NH4OH إلى الخرز ، واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة.
- افصل الخرزات عن التعليق باستخدام رف مغناطيسي ، وانقل الشطف إلى أنبوب تفاعل منخفض الربط.
- احتضان الخرز مرة أخرى كما في الخطوة 6.2 لاستعادة الحد الأقصى لمواضع الكروماتين في الشحم.
- افصل الخرزات عن التعليق باستخدام رف مغناطيسي ، وقم بتجميع الشطف الناتج في نفس الأنبوب الذي يحتوي على الشطف من الخطوة 6.3.
- أعد تعليق الخرزات (DB) في 750 ميكرولتر من dH2O ، وأخذ عينات لتحليل الحمض النووي (0.1٪) والبروتين (0.05٪).
- من الشطف النهائي (DE) ، خذ عينات لتحليل الحمض النووي (0.5٪) والبروتين (0.25٪).
7. تحليل الحمض النووي والبروتين
- تحليل الحمض النووي
- إعداد العينة
- إلى عينات الحمض النووي ، أضف 100 ميكرولتر من المخزن المؤقت IRN ، وقم بزيادة الحجم باستخدام dH2O إلى الحجم النهائي البالغ 200 ميكرولتر.
- أضف 1 نانوغرام من الحمض النووي البلازميد K071.
- أضف 1 ميكرولتر من RNAse A (10 مجم / مل) ، واحتضن عند 37 درجة مئوية لمدة 1 ساعة.
- أضف 5 ميكرولتر من البروتيناز K (10 مجم / مل) و 10 ميكرولتر من SDS (20٪) ، واحتضان لمدة 1 ساعة عند 56 درجة مئوية.
- أضف 200 ميكرولتر من كحول الفينول / الكلوروفورم / الأيزوبروبيل (25:24: 1) ، ودوامة جيدا 2x لمدة 10 ثوان في كل مرة.
- أجهزة الطرد المركزي العينات عند 21130 × جم لمدة 7 دقائق لفصل المرحلتين العضوية والمائية.
- انقل المادة الطافية إلى أنابيب جديدة سعة 1.5 مل تحتوي على 1.5 ميكرولتر من الجليكوجين (5 مجم / مل) و 2.5 × 100٪ إيثانول.
- احتضان الأنابيب عند -20 درجة مئوية لمدة لا تقل عن 2 ساعة وبحد أقصى بين عشية وضحاها لترسيب الحمض النووي.
- أجهزة الطرد المركزي عند 21130 × جم ، 4 درجات مئوية لمدة 45 دقيقة. تخلص من المادة الطافية.
- أضف 150 ميكرولتر من الإيثانول بنسبة 70٪ دون تعليق حبيبات الحمض النووي ، وأجهزة الطرد المركزي مرة أخرى عند 21130 × جم عند 4 درجات مئوية لمدة 10 دقائق.
- جفف كريات الحمض النووي في درجة حرارة الغرفة لمدة 10-15 دقيقة ، وأعد تعليقها في 40 ميكرولتر من dH2O.
- قم بإجراء هضم إنزيم القطع لخطي الحمض النووي المعزول في الخطوة 7.1.1.11 باستخدام نوكلياز تقييد HpaI. للحصول على مزيج تفاعل 50 ميكرولتر ، احتضان 40 ميكرولتر من الحمض النووي المعزول + 2 ميكرولتر من إنزيم HpaI + 5 ميكرولتر من محلول إنزيم التقييد + 3 ميكرولتر من dH2O طوال الليل عند 37 درجة مئوية.
- تحليل qPCR
- قم بتخفيف الحمض النووي المهضوم المقيد بنسبة 1: 5 (10 ميكرولتر من الحمض النووي المهضوم المقيد الذي تم الحصول عليه من الخطوة 7.1.1.12 في 40 ميكرولتر من dH2O).
- استخدم أزواج التمهيدي المصممة لمنطقة ARS316 و PDC1 والحمض النووي البلازميد السنبلة.
- قم بتشغيل qPCR باستخدام البرنامج الوارد في الجدول 2.
- تحليل نتائج qPCR عن طريق القياس الكمي النسبي باستخدام منطقة ARS316 والحمض النووي البلازميد السنبلي كأهداف و PDC1 (أو أي جين أو منطقة جينومية أخرى) كموضع مرجعي.
- قم بتقييم النسبة المئوية لاستعادة موضع ARS316 على PDC1 عن طريق تطبيع قيم القياس الكمي النسبي الأولي ARS316 و PDC1 من خلال النسبة المئوية لحجم الكسر المأخوذ لكل عينة. على سبيل المثال ، اضرب 0.1٪ للتدفق بعامل 1,000 و 0.5٪ ل TEV يسحب بعامل 200.
- تطبيع نسب استرداد ARS316 و PDC1 مع قيم القياس الكمي النسبي للحمض النووي البلازميد المرتفع.
- تقييم إثراء موضع ARS316 على الكروماتين الكلي من خلال تقييم القيم المستهدفة / المرجعية للتقدير الكمي النسبي التي تم الحصول عليها باستخدام المعادلة (1).
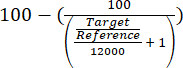 (1)
(1)
- تحليل اللطخة الجنوبية
- إلى 20 ميكرولتر من عينة الحمض النووي المهضومة بالإنزيم ، أضف 5 ميكرولتر من صبغة تحميل الهلام.
- قم بتشغيل العينات في هلام أغاروز 1٪ عند 110 فولت لمدة ~ 3 ساعات.
- انقل الجل إلى صينية ، وانقعه في محلول إزالة التطهير مع رج لطيف لمدة 20 دقيقة.
- شطف الجل مع dH2O ، ونقعها في محلول تمسخ لمدة 15 دقيقة مع الهز. تخلص من محلول التمسخ.
- انقع الجل في محلول تمسخ لمدة 15 دقيقة مع رج لطيف.
- اشطف الجل ب dH2O ، واغسله 2x لمدة 15 دقيقة في كل مرة باستخدام المخزن المؤقت للنقل مع رج لطيف.
- املأ صينية ب 1-1.5 لتر من المخزن المؤقت للنقل ، وضعها على منصة ثابتة.
- اقطع قطعة طويلة من ورق Whatman ، وضعها على المنصة بحيث يتم نقع طرفي الورق في المخزن المؤقت للنقل.
- قطع شريط واحد من غشاء النايلون الإيجابي وأربعة شرائط من ورقة Whatman تساوي حجم الجل.
- ضع قطعتين من ورق Whatman منقوعة في المخزن المؤقت للنقل على المنصة.
- ضع الجل ووجهه لأسفل فوق قطع ورق Whatman.
- في الجزء العلوي من الجل ، ضع غشاء النايلون الموجب ، متبوعا بالقطعتين المتبقيتين من ورق Whatman المنقوع في محلول النقل. تأكد من إبقاء المكدس رطبا باستخدام المخزن المؤقت للنقل.
- قم بإزالة أي فقاعات هواء محاصرة عن طريق دحرجتها باستخدام قضيب زجاجي.
- ضع كومة من المناشف الورقية فوق المكدس المجمع ، متبوعا بجسم 0.5 كجم (على سبيل المثال ، زجاجة زجاجية).
- اترك التجميع لنقله طوال الليل في درجة حرارة الغرفة.
- بعد النقل ، تقوم الأشعة فوق البنفسجية بربط الغشاء بإجمالي إنتاج طاقة يبلغ 1200 جول / سم2.
- للكشف عن موضع ARS316 ، قم بإجراء تهجين اللطخة الجنوبية باستخدام مجسات مشعة تم تصنيعها باستخدام نظام وضع العلامات على الحمض النووي المشار إليه.
ملاحظة: قم بتنفيذ جميع الخطوات فيما بعد على الجليد حتى يذكر خلاف ذلك. - في أنبوب تفاعل منخفض الارتباط ، قم بتخفيف 25-40 نانوغرام من جزء PCR (مسبار) في 19 ميكرولتر من dH2O ، واحتضانه عند 95 درجة مئوية لمدة 5 دقائق. تبرد على الفور على الجليد.
- أضف 1 ميكرولتر لكل من 500 ميكرومتر dCTP و 500 ميكرومتر dGTP و 500 ميكرومتر dTTP إلى الأنبوب.
- أضف 20 ميكرولتر من المخزن المؤقت الذي يحتوي على سداسيات النوكليوتيدات العشوائية المرفقة مع المجموعة.
- أضف 5 ميكرولتر من النوكليوتيدات الموسومة إشعاعيا [α-32P] dATP إلى الأنبوب. نفذ جميع الخطوات التي تتضمن المواد الموسومة إشعاعيا في بيئة واقية معتمدة من النشاط الإشعاعي.
- أضف 1 ميكرولتر من جزء Klenow ، واحتضانه عند 37 درجة مئوية على خلاط حراري لمدة 15 دقيقة لتخليق الحمض النووي أحادي الشريط.
- أضف 5 ميكرولتر من المخزن المؤقت لإيقاف التفاعل.
- جهاز طرد مركزي عمود استبعاد الحجم لمدة 2 دقيقة عند 1500 × جم لإزالة المخزن المؤقت للتخزين. تخلص من التدفق ، وضع العمود في أنبوب جديد.
- مرر خليط المسبار عبر العمود لإزالة النيوكليوتيدات المشعة غير المدمجة. جهاز طرد مركزي لمدة 30 ثانية عند 1500 × جم لجمع المسبار.
- أضف 150 ميكرولتر من الحمض النووي للحيوانات المنوية لسمك السلمون (1: 100) لمنع الارتباط غير المحدد للمسبار بالغشاء.
- احتضن خليط المسبار على حرارة 95 درجة مئوية لمدة 5 دقائق لتشويه الحمض النووي المزدوج الذي تقطعت به السبل.
- قم بالتجميد المفاجئ على الجليد لبضع ثوان ، وأجهزة الطرد المركزي لبضع ثوان عند 500 × جم لإسقاط قطرات الماء المكثفة على الغطاء.
- اغسل لفترة وجيزة غشاء اللطخة الجنوبي باستخدام المخزن المؤقت للتهجين لمدة 5-10 دقائق مع الدوران.
- قم بتهجين الغشاء مسبقا باستخدام مخزن التهجين لمدة 1 ساعة عند 55 درجة مئوية مع الدوران. تخلص من المخزن المؤقت للتهجين.
- أضف 15 مل من محلول التهجين الطازج (تم تسخينه مسبقا عند 55 درجة مئوية) إلى الغشاء مع المسبار المحضر. احتضان الغشاء بين عشية وضحاها عند 55 درجة مئوية مع الدوران.
- قم بإجراء غسلات ما بعد التهجين 2x لمدة 15 دقيقة لكل منهما باستخدام 0.3x SSC ، 0.1٪ SDS عند 55 درجة مئوية مع الدوران.
- قم بإجراء غسلات ما بعد التهجين 2x لمدة 15 دقيقة لكل منهما باستخدام 0.1x SSC ، 0.1٪ SDS عند 55 درجة مئوية مع الدوران.
- قم بإجراء غسلات ما بعد التهجين 2x لمدة 15 دقيقة لكل منهما باستخدام 0.1x SSC ، 1.5٪ SDS عند 55 درجة مئوية مع الدوران.
- قم بإزالة الغشاء من أنبوب التهجين ، وتعريض الغشاء لشاشة تصوير الفوسفور لمدة تصل إلى 3 أيام للحصول على البصمات المشعة على الفيلم.
- الحصول على صور للفيلم باستخدام نظام المسح الضوئي بالليزر للفسفرة.
- إعداد العينة
- تحليل البروتين
- إعداد العينة
- اضبط جميع عينات البروتين على أحجامها النهائية (200 ميكرولتر ، 100 ميكرولتر ، 100 ميكرولتر ، 20 ميكرولتر ، و 20 ميكرولتر لاستخراج الخلايا الخام ، والمدخلات ، والتدفق ، والخرز ، وعينات الشطف ، على التوالي) عن طريق إضافة 1 ميكرولتر من β-mercaptoethanol ، ومخزن عينة PAGE LDS (1x) ، و dH2O.
- قم بتشويه العينات عند 95 درجة مئوية لمدة 5 دقائق.
- تحليل اللطخة الغربية
ملاحظة: قم بإجراء SDS-PAGE والنشاف الغربي باستخدام البروتوكولات القياسية15,16.- قم بتحميل 15 ميكرولتر من كل عينة في كل بئر من جل SDS-PAGE مقاس 1.5 مم.
- إجراء تلطيخ مناعي للبقع باستخدام الأجسام المضادة PAP (1: 2,000) و LexA (1: 1,000) مع الحضانة الليلية عند 4 درجات مئوية. تمييع في 5٪ الحليب الجاف / محلول PBST.
ملاحظة: بعد تحليل PAP ، يمكن تجريد اللطخة باستخدام بروتوكول تجريد خفيف17 قبل تلطيخ المناعة بالجسم المضاد الثاني LexA.
- إعداد العينة
النتائج
تم تنقية مجال الكروماتين ARS316 ~ 1.4 كيلو بايت بواسطة بروتين محول LexA-TAP المعبر عنه بشكل أساسي. لتكون بمثابة عنصر تحكم سلبي ، أجرينا عمليات تنقية باستخدام سلالة متساوية المنشأ تعبر عن LexA-TAP ولكنها لا تحتوي على مواقع ربط RS و LexA مدمجة. يوضح الشكل 3 نتائج تحليل الحمض النووي من تجربة ت?...
Discussion
لا يزال تحديد العوامل ومشهد الكروماتين لمنطقة جينومية مستهدفة محددة يشكل تحديا كبيرا في أبحاث الكروماتين18. يصف هذا البروتوكول نظاما فعالا لاستئصال وتنقية مجالات الكروماتين المميزة على وجه التحديد من كروموسومات الخميرة. على حد علمنا ، فإن نقاء وإنتاجية هذا التنقية أحادية ال...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم العمل في مختبر S.H. من قبل DFG من خلال SFB1064 (معرف المشروع 213249687) ، ومجلس البحوث الأوروبي (ERC Start Grant 852798 ConflictResolution) ، و Helmholtz Gesellschaft.
Materials
| Name | Company | Catalog Number | Comments |
| Yeast strains | |||
| Control Strain: MATa; ura3Δ0; leu2Δ0; his3Δ1; met15Δ0; bar1::kanMX4; Chr I 212kb::LEU2 pTEF2-LEXA-TAP pGAL1-10 RecR | Section 1, see references 13 and 14 | ||
| Recombination Strain: MATa; ura3Δ0; leu2Δ0; his3Δ1; met15Δ0; bar1::kanMX4; RS_LEXA_NS-3_ARS316_NS+3_RS; Chr I 212kb::LEU2 pTEF2-LEXA-TAP pGAL1-10 RecR | Section 1, see reference 13 and 14 | ||
| Plasmid | |||
| K238 plasmid | Section 1, see reference 13 Storage: Store at -20 °C | ||
| K071 Spike-in plasmid DNA | Section 7.1, see reference 13 Storage: Store at -20 °C | ||
| Reagents | |||
| Acetone | Carl Roth | 5025.1 | Section 2 Storage: Store at room temperature |
| Ammonium acetate (NH4Ac) | Sigma Aldrich | A7262 | Section 6 and 7.1 Storage: Store at room temperature |
| Ammonium solution (NH4OH) 25% | Merck Millipore | 533003 | Section 6 Storage: Store at room temperature |
| Ammonium sulfate | Santa Cruz | Sc-29085 | Section 2 Storage: Store at room temperature |
| Bacto agar | BD (VWR) | 90000-760 | Section 3 Storage: Store at room temperature |
| Bacto peptone | BD (VWR) | 211820 | Section 3 Storage: Store at room temperature |
| β-Mercaptoethanol | Sigma Aldrich | 07604 | Section 7.2 Storage: Store at 4 °C |
| Chemiluminescent substrate kit | ThermoFisher | 34580 | Section 7.2 Storage: Store at 4 °C |
| Di-Sodium Hydrogen phosphate dodecahydrate | Merck | 1.06579.1000 | Section 2 and 7.1 Storage: Store at room temperature |
| Dithiothreitol (DTT) | ThermoFisher | 15508013 | Section 4 Storage: Store at 4 °C |
| Ethanol | Merck | 100983 | Section 7.1 Storage: Store at room temperature |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma Aldrich | ED | Section 7.1 Storage: Store at room temperature |
| Galactose (20% (w/v) stock) | Sigma Aldrich | G0625-1KG / 5KG | Section 3 Storage: Store at room temperature |
| Gel loading dye (6x) | BioLabs | B7024A | Section 7.1 Storage: Store at -20 °C |
| Glusose | Sigma-Aldrich | G8270 | Section Storage: Store at room temperature |
| Glycine | Carl Roth | .0079.4 | Section 2 Storage: Store at room temperature |
| Glycogen (5 mg/mL) | Invitrogen | AM9510 | Section 7.1 Storage: Store at -20 °C |
| Hydrochloric acid (HCl) | PanReac AppliChem | 182109.1211 | Section 2, 4 and 7.1 Storage: Store at room temperature |
| Magnesium Acetate (MgAc) | Bernd Kraft | 15274.2600/C035 | Section 4 Storage: Store at room temperature |
| Magnesium chloride (MgCl2) | Sigma Aldrich | M8266 | Section 6 Storage: Store at room temperature |
| Nu PAGE LDS sample buffer (4x) | Invitrogen | 2399549 | Section 7.2 Storage: Store at room temperature |
| Phenol/Chloroform/Isoamyl alcohol (25:24:1 v/v) | Invitrogen | 15593-031 | Section 7.1 Storage: Store at 4 °C |
| Potassium chloride (KCl) | Sigma | P9541 | Section 4 Storage: Store at room temperature |
| Radioactively labeled α-32P dATP (3,000 Ci/mmol, 10 mCi/mL) | Hartmann Analytic | SRP-203 | Section 7.1 Storage: Store at 4 °C |
| RadPrime labeling system | ThermoFisher | 18428-011 | Section 7.1 Storage: Store at -20 °C |
| Raffinose (20% (w/v) stock) | SERVA | 34140.03 | Section 3 Storage: Store at room temperature |
| Sodium chloride (NaCl) | Merck | K53710504142 | Section 7.1 Storage: Store at room temperature |
| Sodium citrate (Na3C6H5O7) | Sigma-Aldrich | 71402 | Section 7.1 Storage: Store at room temperature |
| Sodium hydroxide (NaOH) | Sigma Aldrich | S5881 | Section 7.1 Storage: Store at room temperature |
| Sodium n-dodecyl sulfate (SDS) (5% stock (w/v) ) | Alfa Aesar | A11183 | Section 7.1 Storage: Store at room temperature |
| Sodium phosphate monobasic | Sigma-Aldrich | 71496 | Section 2 and 7.1 Storage: Store at room temperature |
| Sodium azide | Santa Cruz Biotechnology | sc-208393 | Section 2 Storage: Store at -20 °C |
| Triethylamine | Sigma Aldrich | 90340 | Section 2 Storage: Store at room temperature |
| Tris base | Chem Cruz | SC-3715B | Section 2 and 4 Storage: Store at room temperature |
| Triton X-100 | Sigma Aldrich | X100 | Section 2 and 4 Storage: Store at room temperature |
| Tween-20 | Bernd Kraft | 18014332 | Section 4 Storage: Store at room temperature |
| Yeast extract | BD (VWR) | 212720 | Section 3 Storage: Store at room temperature |
| Yeast mating factor alpha (1 µg/mL stock ) | Biomol | Y2016.5 | Section 3 Storage: Store at -20 °C |
| Yeast Synthetic Drop-out medium Supplements without LEUCINE | Sigma Aldrich | Y1376 | Section 1, see reference 14 |
| Enzymes | |||
| HpaI restriction enzyme (5,000 U/mL) | NEB | R0105S | Section 7.1 Storage: Store at -20 °C |
| Protease and Phosphatase Inhibitor Cocktail (100x) | ThermoFisher Scientific | 78446 | Section 4 Storage: Store at4 °C |
| Proteinase K (10 mg/mL) | SERVA | 33756 | Section 7.1 Storage: Store at -20 °C |
| RNase A (10 mg/mL) | ThermoFisher | EN0531 | Section 7.1 Storage: Store at -20 °C |
| TEV protease (10000 U/µL) | NEB | P8112S | Section 5 Storage: Store at -20 °C |
| Materials | |||
| BcMag Epoxy-Activated Magnetic Beads | Bioclone Inc. | FC-102 | Section 2 Storage: Store at 4 °C |
| Dry ice | Section 4 | ||
| Low-binding centrifuge tubes 2.0 mL | Eppendorf | 22431102 | Section 4 |
| Microspin G-25 Columns | Cytiva | 27-5325-01 | Section 7.1 Storage: Store at room temperature |
| Parafilm | Merck | P7793 | Section 4 |
| Positive nylon membrane | Biozol | 11MEMP0001 | Section 7.1 Storage: Store at room temperature |
| PVDF transfer membrane | Immobilon-Merck Millipore | IPVH00010 | Section 7.2 Storage: Store at room temperature |
| SDS-PAGE gel 4-12% bis-tris (15 well, 1.5 mm) | Invitrogen | NP0336BOX | Section 7.2 Storage: Store at 4 °C |
| Syringe (25 mL) with luer fitting | Henke Sass Wolf | 4200-000V0 | Section 3 |
| Whatman paper (Grade 3MM CHR Cellulose Western Blotting Paper Sheet) | Cytiva | 3030-917 | Section 7.1 Storage: Store at room temperature |
| Antibodies | |||
| Anti-LexA, rabbit polyclonal IgG, DNA binding region antibody | Merck Millipore | 06-719 | Section 7.2 Storage: Store at -20 °C |
| Goat Anti-Rabbit IgG (H+L), Horseradish peroxidase conjugate | Invitrogen | G21234 | Section 7.2 Storage: Store at -20 °C |
| Peroxidase Anti-Peroxidase (PAP) antibody produced in rabbit for the detection of TAP-tagged proteins | Sigma Aldrich | P1291-500UL | Section 7.2 Storage: Store at -20 °C |
| Rabbit IgG antibodies | Sigma | I5006-100MG | Section 2 Storage: Store at 4 °C |
| Primers (10 µM) | |||
| ARS316: fwd 5'- CGGCATTATCGTACACAACCT, rev 5'- GTTCTTCGTTGCCTACATTTTCT | Section 7.1 | ||
| K071 Spike-in plasmid DNA: fwd: 5'-TTTTCGCTGCTTGTCCTTTT, rev 5'- CATTTTCGTCCTCCCAACAT | Section 7.1 | ||
| PCR fragment from yeast genomic DNA as a template for ARS316 amplification (for southern blot): fwd 5’- AAATTCTGCCCTTGATTCGT rev 5’- TTTGTTTATCTCATCACTAAT | Section 7.1 | ||
| PDC1: fwd 5'- CATGATCAGATGGGGCTTCA, rev 5'-ACCGGTGGTAGCGACTCTGT | Section 7.1 | ||
| Equipment | |||
| Coffee grinder | Gastroback | 42601 | Section 4 |
| Dewar flask | NAL GENE | 4150-2000 | Section 3 |
| DynaMag TM-2 magnetic rack | Invitrogen | 12321D | Section 4, 5 and 6 |
| Hybridization oven | Hybaid Mini10 | Ri418 | Section 2 |
| Microcentrifuge | Eppendorf | 5424R | Section 4 and 7.1 |
| UV-crosslinker | Analytikjena | 95-0174-02 | Section 7.1 |
References
- Kornberg, R. D., Lorch, Y. Twenty-five years of the nucleosome, fundamental particle of the eukaryote chromosome. Cell. 98 (3), 285-294 (1999).
- Gauchier, M., van Mierlo, G., Vermeulen, M., Déjardin, J. Purification and enrichment of specific chromatin loci. Nature Methods. 17 (4), 380-389 (2020).
- Korthout, T., et al. Decoding the chromatin proteome of a single genomic locus by DNA sequencing. PLoS Biology. 16 (7), e2005542 (2018).
- Antão, J. M., Mason, J. M., Déjardin, J., Kingston, R. E. Protein landscape at Drosophila melanogaster telomere-associated sequence repeats. Molecular and Cellular Biology. 32 (12), 2170-2182 (2012).
- Déjardin, J., Kingston, R. E. Purification of proteins associated with specific genomic loci. Cell. 136 (1), 175-186 (2009).
- Ide, S., Dejardin, J. End-targeting proteomics of isolated chromatin segments of a mammalian ribosomal RNA gene promoter. Nature Communications. 6, 6674 (2015).
- Unnikrishnan, A., Gafken, P. R., Tsukiyama, T. Dynamic changes in histone acetylation regulate origins of DNA replication. Nature Structural & Molecular Biology. 17 (4), 430 (2010).
- Buxton, K. E., et al. Elucidating protein-DNA interactions in human alphoid chromatin via hybridization capture and mass spectrometry. Journal of Proteome Research. 16 (9), 3433-3442 (2017).
- Kennedy-Darling, J., et al. Discovery of chromatin-associated proteins via sequence-specific capture and mass spectrometric protein identification in Saccharomyces cerevisiae. Journal of Proteome Research. 13 (8), 3810-3825 (2014).
- Liu, S. J., et al. CRISPRi-based genome-scale identification of functional long noncoding RNA loci in human cells. Science. 355, 7111 (2017).
- Hamperl, S., et al. Purification of specific chromatin domains from single-copy gene loci in Saccharomyces cerevisiae. Functional Analysis of DNA and Chromatin. 1094, 329-341 (2014).
- Hamperl, S., et al. Compositional and structural analysis of selected chromosomal domains from Saccharomyces cerevisiae. Nucleic Acids Research. 42 (1), 2 (2014).
- Weiβ, M. Single-copy locus proteomics of early- and late-firing DNA replication origins identifies a role of Ask1/DASH complex in replication timing control. Cell Reports. 42 (2), 112045 (2023).
- Gietz, R. D., Schiestl, R. H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nature Protocols. 2 (1), 31-34 (2007).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of America. 76 (9), 4350-4354 (1979).
- Western blot membrane stripping for restaining protocol. Abcam Available from: https://www.abcam.com/protocols/western-blot-membrane-stripping-for-restaining-protocol (2023)
- Vermeulen, M., Déjardin, J. Locus-specific chromatin isolation. Nature Reviews. Molecular Cell Biology. 21 (5), 249-250 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved