このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
出芽酵母(Saccharomyces cerevisiae)におけるシングルコピー遺伝子座クロマチン精製
要約
このプロトコルは出芽のイースト、Saccharomycesのcerevisiaeからの原産のchromatinの文脈の興味の単一コピー遺伝子座を浄化するために場所特定の組換えに基づいて位置特定のchromatinの隔離方法を示す。
要約
真核生物のクロマチンの基本的な組織単位はヌクレオソームコア粒子(NCP)であり、ヒストン八量体に~1.7倍巻き付けられたDNAで構成されています。クロマチンは、NCPや、転写因子、クロマチンリモデリング、修飾酵素など、他の多くのタンパク質複合体の実体として定義されています。これらのタンパク質-DNA相互作用が、細胞周期のさまざまな段階で特定のゲノム遺伝子座のレベルでどのように調整されるかはまだ不明です。これは主に、このような動的相互作用の正確な測定値を得ることが困難になっている現在の技術的制限によるものです。ここでは、サイト特異的組換えと効率的なシングルステップアフィニティー精製プロトコルを組み合わせて、ネイティブクロマチン状態で目的の単一コピー遺伝子座を単離する改良された方法について説明します。この分析法は、ゲノムクロマチン上の標的遺伝子座の強固な濃縮を可能にするため、この手法は、質量分析などによって、偏りのない体系的な方法でタンパク質相互作用を同定および定量するための効果的な戦略となります。このような組成分析に加えて、この方法で精製された天然クロマチンは、ヌクレオソームの位置とヒストン修飾に関する in vivo の状況を反映している可能性が高いため、酵母のほぼすべてのゲノム遺伝子座に由来するクロマチンのさらなる構造および生化学的分析に適しています。
概要
真核生物のゲノムをクロマチンに動的に組織化することで、DNAが核の範囲内に収められるように圧縮され、遺伝子発現に十分な動態と調節因子へのアクセス性が確保されます。この汎用性の一部は、クロマチンの基本単位であるヌクレオソームによって媒介されており、このヌクレオソームは、ヒストン八量体1の周囲に1~1.7倍のDNAが包まれたコア粒子で構成されています。ヌクレオソームは、その組成に関して非常にダイナミックな構造であり、N末端およびC末端のヒストンテールに多数のヒストン変異体と翻訳後修飾(PTM)があります。さらに、真核生物のクロマチンは、転写因子、DNAおよびRNAプロセシング機構、建築タンパク質、クロマチンのリモデリングおよび修飾に関与する酵素、クロマチンに関連するRNA分子など、他の多くの必須成分と相互作用します。転写、複製、修復に関与するこれらの重要な機構はすべて、これらのプロセスの天然基質として機能するクロマチンへのアクセスを必要とします。したがって、これらのDNAトランザクションの根底にある分子メカニズムを理解するには、これらの機構が収束し、生物学的反応を促進する特定のゲノム領域におけるクロマチン構造の集団的変化を正確に定義する必要があります。
遺伝学やタンパク質間相互作用の研究を通じて多数のクロマチン因子が同定されているにもかかわらず、特定のゲノム部位におけるクロマチン相互作用の直接的、偏りのない、包括的な分析を行うことは、依然として大きな障害となっています2,3。当初は、ゲノムの非常に豊富な領域(すなわち、反復遺伝子座)またはマルチコピープラスミドのみが、関連するタンパク質の質量分析同定に十分な量と純度で単離できました4,5,6,7。捕捉プローブのクロマチン化DNAへの直接ハイブリダイゼーション、CRISPR-dCas9システムを用いた近接ビオチン化、または配列特異的アダプタータンパク質の目的遺伝子座への結合に基づく一連の新しいアプローチにより、酵母および哺乳類のゲノムからのシングルコピー遺伝子座のプロテオームが解明され始めています8,9,10.しかし、これらすべての方法では、タンパク質とDNAの相互作用を安定化させるためのホルムアルデヒド架橋と、その後の精製のためにクロマチンを可溶化するための超音波処理が必要です。一緒に、両方の操作は、精製されたクロマチンのその後の構造的および機能的研究の可能性を排除する。
これらの限界を克服するために、我々は以前、酵母から標的染色体ドメインを抽出するために部位特異的組換えを採用する方法論を考案した11,12。要するに、関心のあるゲノム領域は、Zygosaccharomyces rouxi由来の部位特異的R-リコンビナーゼの認識部位(RS)に囲まれており、同時に原核生物の転写リプレッサーLexAタンパク質(LexA)の3つのDNA結合部位のグループを同じ領域内に組み込んでいます。酵母細胞には、R-リコンビナーゼとLexAタンパク質を同時に発現するための発現カセットが含まれており、タンデムアフィニティー精製(TAP)タグに融合しています。R-リコンビナーゼの誘導後、酵素は環状クロマチンドメインの形で染色体から標的領域を効率的に切除します。このドメインは、LexA DNA結合部位、およびアフィニティー担体に結合するLexA-TAPアダプタータンパク質を介して精製できます。この方法は、酵母染色体IIIの選択された複製起点を含む異なるクロマチンドメインを単離するために最近使用されています13。
この ex vivo アプローチの大きな利点の1つは、単離された材料の機能分析を可能にすることです。例えば、この方法で精製された複製起点ドメインを in vitro 複製アッセイに供して、天然の in vivo で組み立てられたクロマチンテンプレートから試験管内での起点焼成の効率を評価することができます。最終的に、単離された物質の生化学的および機能的特性評価により、精製されたタンパク質と天然クロマチンテンプレートを使用して核プロセスを再構成できる可能性があります。要約すると、この方法論は、特定の染色体トランザクションを受けている特定のゲノム領域の集合的な組成および構造クロマチンの変化を追跡することが可能になるため、クロマチン研究にエキサイティングな道を開きます。
プロトコル
このプロトコルで使用されるすべての材料と機器に関連する詳細については、 材料表 を参照してください。使用した溶液、バッファー、培地のリストについては、 表 1 を参照してください。
1. 組換え酵母株構築
- 組換え能力のある酵母株を構築するには、SbfI消化プラスミドK238を、目的の遺伝子座に統合されたLexA結合部位とRS組換え部位を有する酵母株に形質転換します13,14。
注:形質転換されたSbfI制限フラグメントには、LexA-TAP融合タンパク質とR-リコンビナーゼの構成的発現に必要な発現カセットと、相同組換えによる発現カセットのゲノム統合に必要な酵母染色体Iの相同配列が含まれています(図1)。 - コントロール株を構築するには、RSおよびLexA結合部位が統合されていないアイソジェニック酵母株を採取し、組換えに適した株に使用したのと同じ条件下で、SbfI消化K238プラスミドで形質転換します。
- SCD−LEU寒天プレート14上のLEU2選択マーカーに基づいてコンピテント酵母細胞を選択する。
2. IgG抗体とエポキシ活性化磁気ビーズのカップリング
注:IgG抗体をエポキシ活性化磁気ビーズに結合させるには、以下の公開プロトコル11に従ってください。
- 50 mLのコニカルチューブに、10 mLの50%アセトン(300 mgは~5.1 ×10 10 ビーズに相当)に300 mgのエポキシ活性化ビーズを懸濁します。ボルテックスミキサーで激しく振る。
- ビーズの入ったチューブを820 × g 、4°Cで2分間遠心分離します。上澄みを取り除きます。
- ビーズを20 mLの0.1 Mリン酸ナトリウム緩衝液(pH 7.4)で3回洗浄します。各洗浄ステップの後に、ステップ2.2で説明したように遠心分離により上清を除去します。
- ビーズを16 mLの0.1 Mリン酸ナトリウム緩衝液(pH 7.4)に懸濁し、ハイブリダイゼーションオーブン内で室温で5分間静かに回転させます。
- ウサギIgG(100mg)を7mLのdH2O(最終濃度:14mg/mL)に溶解します。
- IgG懸濁液を13,000 × g 、4°Cで10分間遠心分離し、懸濁液を清澄化します。
- 上清 3.5 mL(ウサギ IgG 50 mg に相当)を新しい 50 mL コニカルチューブに移します。
- IgG溶液を9.85 mLの0.1 Mリン酸ナトリウム緩衝液(pH 7.4)で希釈し、続いて6.65 mLの3 M硫酸アンモニウムを0.1 Mリン酸ナトリウム(pH 7.4)に滴下し、穏やかに混合します。
注:硫酸アンモニウムを溶液にすばやく添加すると、局所濃度の高い塩がウサギIgGの沈殿を引き起こすため、避けてください。 - IgG溶液を820 × g 、4°Cで3分間遠心分離し、得られた上清を磁気ビーズ懸濁液に加えます。
- チューブを一晩、または少なくとも30°Cで18時間、ハイブリダイゼーションオーブンで穏やかに回転させてインキュベートします。
- ステップ2.2の説明に従って上清を取り除きます。
- ビーズを20 mLの100 mMグリシン-HCl(pH 2.5)で洗浄します。IgGポリペプチドの変性を避けるために、ステップ2.2で説明したように溶液を速やかに除去します。
- ビーズを20 mLの10 mM Tris-HCl(pH 8.8)で1回洗浄します。ステップ2.2の説明に従って上清を吸引します。
- 20 mLの0.1Mトリエチルアミン溶液を穏やかな回転で5〜10分間加え、残留反応性エポキシ基を不活性化します。ステップ2.2の説明に従って上清を取り除きます。
- ビーズを20 mLのPBS(pH 7.4)で5分間、穏やかに回転させて4回洗浄します。各洗浄ステップの後、ステップ2.2の説明に従って上清を取り除きます。
- ビーズを20 mLのPBS(pH 7.4)と0.5% Triton X-100(w/v)でそれぞれ5分間および15分間、ハイブリダイゼーションオーブンで穏やかに回転させて2回洗浄します。ステップ2.2の説明に従って上清を取り除きます。
- 最終容量16 mLのPBS(pH 7.4)に0.02%アジ化ナトリウム(w/v)を含むビーズを懸濁します。使用するまで、1 mLのアリコートとして4°Cで保管してください。
3. 酵母細胞の培養と採取
- YPDプレートから5 mLのYPR培地にコントロールおよび組換え可能な酵母株を接種し、30°Cおよび200rpmで一晩インキュベートします。
- この培養液2 mLを100 mLのYPR培地に接種し、30°C、200rpmで一晩インキュベートします。
- 各菌株について、1,800 mLのオートクレーブ滅菌したYP培地と200 mLのオートクレーブ処理したラフィノース溶液(20%w/v)を、2つの5 L三角フラスコ(各菌株に合計4 Lの培養液、2つのフラスコに分割)のそれぞれに分注します。
- 増殖中の酵母細胞をそれぞれの培地でOD600 0.2で接種し、ステップ3.1に記載されているように約6時間、または細胞が所望のOD600 1.0に達するまでインキュベートします。細胞の正常な増殖を確保し、汚染がないように、2時間間隔でODを確認します。
- 200 mLのガラクトース(20%w/v)を添加して、部位特異的な組換えを誘導します。
- 110 μL(50 ng/mL)のYMFAを添加し(ガラクトースと同時にステップ3.5)、G1期の細胞を停止させ、2時間インキュベートします。
注:細胞へのYMFAの添加は、実験条件と対処すべき生物学的問題によって異なります。正確には、この実験では、細胞をG1期で停止させて、認可された複製起点を持つ均質な細胞集団を取得します。このプロセスでは、S期でDNA複製が始まる前に、前複製複合体がG1期の起点に結合します。 - 細胞懸濁液を1L遠心分離バケツに移し、6,000 × g 、4°Cで10分間遠心分離します。上清を廃棄し、細胞ペレットを総容量10〜15mLのdH2Oに再懸濁する。
- 25 mLシリンジをルアープラグで密封し、水で満たされた50 mLのコニカルチューブに入れます。細胞懸濁液をシリンジアセンブリに移し、室温で2,397 × g で10分間遠心分離します。上澄みを捨てます。
- シリンジからルアープラグを取り外し、細胞を液体窒素に押し出して細胞「スパゲッティ」を形成します。
注:4 Lの培地を使用すると、7〜10 gの最終細胞ペレットの湿潤重量が得られます。 - 凍結した細胞スパゲッティを50 mLのコニカルチューブに移し、さらに使用するまで-80°Cで保存します。
4. クロマチン遺伝子座の精製
注:この遺伝子座特異的クロマチン精製プロトコルに関与するステップの概略図については、 図 2 を参照してください。
- 市販のコーヒーグラインダーを30〜50gのドライアイスを粉砕して、毎回2回30秒間激しく振って冷却します。冷めたら、ドライアイスパウダーを捨てます。
- 予冷したコーヒーグラインダーで、3gの冷凍酵母細胞スパゲッティを3~30-50gのドライアイスと混ぜます。
- キャップとグラインダーの間の接合部をパラフィルムで密閉して、粉砕中の酵母細胞粉末の損失を防ぎます。
- 酵母細胞とドライアイスの混合物を毎回30秒間、各ラウンドの間に30秒の間隔を空けて10回粉砕します(合計時間の見積もり:~10分)。ドライアイスやセルパウダーがコーヒーグラインダーの壁に付着しないように、製粉中はコーヒーグラインダーの側面を連続して叩きます。
- 得られた酵母細胞ドライアイス粉末を、清潔で乾燥したスパチュラを使用してプラスチックビーカーに移します。
- ビーカーを室温に保ち、ドライアイスを蒸発させます。
- ドライアイスが蒸発したら、1xプロテアーゼおよびホスファターゼ阻害剤(酵母細胞750 μL/g)を含む2.25 mLのMBバッファーを酵母細胞粉末に加えます。
- 細胞と緩衝液の混合物を強力にピペットで固定し、細胞と緩衝液が完全に懸濁するようにし、15 mLのコニカルチューブに移します。
- 得られた細胞懸濁液(粗細胞抽出物[CCE])からDNA(0.1%)およびタンパク質(0.05%)分析用のサンプルを採取します。さらに処理するまで-20°Cで保存してください(セクション7で説明)。
- 細胞懸濁液を低結合性の2 mL反応チューブに移し、21,130 × g で4°Cで30分間遠心分離して、粗細胞ライセートから細胞破片を分離します。
- すべてのチューブから上清を1本の15 mLコニカルチューブにプールします。
- 上清(インプット[IN])からサンプルを採取し、DNA(0.1%)およびタンパク質分析(0.05%)を行います。さらに処理するまで-20°Cで保存してください(セクション7で説明)。
- 500 μL の IgG 共役磁気ビーズスラリー(酵母株ごとに)を、1 個のプロテアーゼおよびホスファターゼ阻害剤を含む 500 μL のコールド MB バッファーで 2 回、4 °C で 20 rpm 回転しながらそれぞれ 5 分間洗浄して平衡化します。各洗浄ステップの後、磁気ラックを使用してビーズから上清を廃棄します。
- IgG共役磁気ビーズを、1xプロテアーゼおよびホスファターゼ阻害剤を含む500 μLの低温MBバッファー中で、4°C、20rpmで1時間インキュベートします。磁気ラックを使用してビーズから上清を廃棄します。
- 平衡化した磁気ビーズスラリーを細胞ライセートと混合し、20 rpm、4°Cで2時間回転しながらインキュベートします。
- 完全な磁気ビーズ-細胞溶解液懸濁液を低結合反応チューブに移します。
- 磁気ラックを使用して、目的のクロマチン環を担持した磁気ビーズを細胞ライセートから分離します。
- 残りのフロースルー(FT)を各チューブから新しい 15 mL コニカルチューブに移し、DNA(0.1%)およびタンパク質(0.05%)分析用のサンプルを採取します。さらに処理するまで-20°Cで保存してください(セクション7で説明)。
- 各チューブの磁気ビーズを 300 μL のコールド MB バッファーに懸濁し、ビーズを 1 本の反応チューブにプールします。プロテアーゼおよびホスファターゼ阻害剤1個を含む750 μLのコールドMBバッファーで、それぞれ5回10分間、4°C、20rpmで回転させます。プロテアーゼおよびホスファターゼ阻害剤を含まない750 μLのコールドMBバッファーで最終洗浄を行います。
- プロテアーゼおよびホスファターゼ阻害剤を含まない40 μLのコールドMBバッファーにビーズを懸濁します。
注:溶出液の最終量は、予想される下流の用途に応じて調整できます。TEV溶出は通常、100〜300μLの範囲で効率的に機能します。
5. TEVプロテアーゼによる溶出
- ビーズからLexA-CBPクロマチン環複合体を遊離させるには、ビーズを2 μLの6x Hisタグ付き組換えTEVプロテアーゼとサーモミキサーで4°C、450rpmで一晩インキュベートします。
- 磁気ラックを使用して、最終溶出液からビーズを分離します。クロマチン環が切断された溶出液を新しい1.5 mL反応チューブに移します。
- チューブを再び磁気ラックに保管し、残留ビーズを最終溶出液から分離します。
- ビーズ(TB)を 750 μL の低温 AC バッファーに再懸濁し、DNA(0.1%)およびタンパク質(0.05%)分析用のサンプルを採取します。さらに処理するまで-20°Cで保存してください(セクション7で説明)。
- 最終溶出液(TE)から、DNA(0.5%)およびタンパク質(0.25%)分析用のサンプルを採取します。さらに処理するまで-20°Cで保存してください(セクション7で説明)。
注:最終溶出液の量が少ないため、分析中にタンパク質とDNAの含有量をより適切に表現するために、DNAおよびタンパク質分析用に収集されるサンプルの割合が増加します。
6. 変性溶出
- ビーズを750 μLの低温ACバッファーで2回、4°C、20rpmで回転させながら20分間毎回洗浄します。
- 残りの結合したLexA-クロマチン錯体を抽出するには、500 μLの0.5M NH4OHをビーズに添加して変性溶出を行い、室温で30分間インキュベートします。
- 磁気ラックを使用して懸濁液からビーズを分離し、溶出液を低結合反応チューブに移します。
- ステップ6.2と同様にビーズを再度インキュベートし、溶出液中の最大クロマチン遺伝子座を回収します。
- 磁気ラックを使用して懸濁液からビーズを分離し、得られた溶出液をステップ6.3の溶出液を含む同じチューブにプールします。
- ビーズ(DB)を750 μLの精製水(dH2O)に再懸濁し、DNA(0.1%)およびタンパク質(0.05%)分析用のサンプルを採取します。
- 最終溶出液(DE)から、DNA(0.5%)およびタンパク質(0.25%)分析用のサンプルを採取します。
7. DNAおよびタンパク質分析
- DNA分析
- サンプル調製
- DNAサンプルに、100μLのIRNバッファーを添加し、dH2Oで容量を増やして最終容量200 μLにします。
- 1 ng の K071 スパイクインプラスミド DNA を添加します。
- RNAse A(10 mg/mL)1 μLを添加し、37°Cで1時間インキュベートします。
- 5 μLのプロテイナーゼK(10 mg/mL)と10 μLのSDS(20%)を加え、56°Cで1時間インキュベートします。
- 200 μLのフェノール/クロロホルム/イソプロピルアルコール(25:24:1)を加え、毎回10秒間2回十分にボルテックスします。
- サンプルを 21,130 × g で 7 分間遠心分離し、有機相と水相を分離します。
- 上清を、1.5 μLのグリコーゲン(5 mg/mL)と2.5 x 100%エタノールを含む新しい1.5 mLチューブに移します。
- チューブを−20°Cで最低2時間、最長で一晩インキュベートして、DNAを沈殿させます。
- 21,130 × g、4°Cで45分間遠心分離します。上澄みを捨てます。
- DNAペレットを再懸濁せずに70%エタノール150μLを加え、21,130 × g 、4°C、10分間遠心分離します。
- DNAペレットを室温で10〜15分間乾燥させ、40μLのdH2Oに再懸濁します。
- ステップ7.1.1.11で単離したDNAをHpaI制限エンドヌクレアーゼで直鎖化するために、制限酵素消化を行います。50 μLの反応ミックスの場合、単離DNA 40 μL+HpaI酵素2 μL+制限酵素バッファー5 μL+精製水(dH2O)3 μLを37°Cで一晩インキュベートします。
- qPCR解析
- 制限酵素消化DNAを1:5の比率で希釈します(ステップ7.1.1.12で得られた制限酵素消化DNA10 μLを40 μLの精製水(dH2O)中)。
- ARS316領域、PDC1、およびスパイクインプラスミドDNA用に設計されたプライマーペアを使用してください。
- 表2に示すプログラムを使用してqPCRを実行します。
- ARS316 領域およびスパイクインプラスミド DNA をターゲットとし、PDC1(またはその他の遺伝子またはゲノム領域)を参照遺伝子座として使用し、相対定量により qPCR 結果を解析します。
- ARS316 および PDC1 プライマーの相対定量値を、各サンプルで採取した画分体積の割合で正規化することにより、PDC1 に対する ARS316 遺伝子座の回収率を評価します。たとえば、フロースルーの 0.1% に 1,000 倍、TEV 溶出液の 0.5% に 200 倍を掛けます。
- ARS316 および PDC1 の回収率を、スパイクインプラスミド DNA の相対定量値で正規化します。
- 式(1)を用いて得られた相対定量ターゲット/参照値を評価することにより、全クロマチンに対するARS316遺伝子座の濃縮度を評価します。
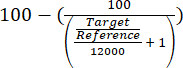 (1)
(1)
- サザンブロット解析
- 制限酵素消化DNAサンプル20 μLに、ゲルローディング色素5 μLを添加します。
- サンプルを 1% アガロースゲル中で 110 V で ~3 時間泳動します。
- ゲルをトレイに移し、20分間穏やかに振とうしながら脱液に浸します。
- ゲルをdH2Oですすぎ、振とうしながら変性溶液に15分間浸します。変性溶液を廃棄します。
- ゲルを変性溶液に15分間浸し、穏やかに振とうします。
- ゲルをdH2Oですすぎ、転写バッファーで毎回15分間2回、穏やかに振とうして洗浄します。
- トレイに1〜1.5Lの転写バッファーを充填し、安定したプラットフォームに置きます。
- ワットマン紙の長い部分を切り取り、紙の両端が転写バッファーに浸されるようにプラットフォームに置きます。
- 肯定的なナイロン膜の1つのストリップおよびゲルのサイズに等しいWhatmanのペーパーの4つのストリップを切ります。
- 転写バッファーに浸したワットマン紙を2枚プラットフォームに置きます。
- ゲルを下向きにして、ワットマン紙の上に置きます。
- ゲルの上に、ポジティブナイロンメンブレンを置き、続いて転写バッファーに浸した残りの2枚のWhatman紙を置きます。スタックは転写バッファーで濡らさないでください。
- 閉じ込められた気泡は、ガラス棒を使って転がして取り除きます。
- 組み立てたスタックの上にペーパータオルのスタックを置き、その後に0.5 kgのオブジェクト(ガラス瓶など)を置きます。
- アセンブリを室温で一晩移しておきます。
- 転写後、メンブレンをUV架橋し、総エネルギー出力は1,200 J/cm2です。
- ARS316遺伝子座の検出には、参照DNA標識システムを用いて合成した放射性プローブを用いてサザンブロットハイブリダイゼーションを行います。
注意: 特に明記されていない限り、以下のすべての手順を氷上で実行してください。 - 低結合反応チューブ内で、25〜40 ngのPCRフラグメント(プローブ)を19 μLの精製水(dH2O)で希釈し、95°Cで5分間インキュベートします。氷の上ですぐに冷まします。
- 500 μM dCTP、500 μM dGTP、500 μM dTTP をそれぞれ 1 μL チューブに加えます。
- キットに付属のランダムヌクレオチド六量体を含むバッファーを20 μL添加します。
- 放射性標識ヌクレオチド [α-32P] dATP 5 μL をチューブに加えます。放射能が承認された保護環境下で、放射性ラベル付けされた材料を含むすべての手順を実行します。
- 1 μL の Klenow フラグメントを加え、サーモミキサーで 37 °C で 15 分間インキュベートし、一本鎖 DNA 合成を行います。
- 5 μLの停止バッファーを添加して反応を停止します。
- サイズ排除カラムを 1,500 × g で 2 分間遠心分離し、保存バッファーを除去します。フロースルーを廃棄し、カラムを新しいチューブに入れます。
- プローブ混合物をカラムに通し、取り込まれていない放射性ヌクレオチドを除去します。1,500 × g で30秒間遠心分離し、プローブを回収します。
- 150 μLのサケ精子DNA(1:100)を添加して、プローブの膜への非特異的結合をブロックします。
- プローブ混合物を95°Cで5分間インキュベートし、二本鎖DNAを変性させます。
- 氷上で数秒間急速凍結し、500 × g で数秒間遠心分離して、蓋に凝縮した水滴を落とします。
- サザンブロットメンブレンをハイブリダイゼーションバッファーで5〜10分間、回転しながら簡単に洗浄します。
- ハイブリダイゼーションバッファーを用いて、55°Cで1時間、回転しながらメンブレンをプレハイブリダイズします。ハイブリダイゼーションバッファーを廃棄する。
- 調製したプローブとともに、15 mLの新鮮なハイブリダイゼーションバッファー(55°Cで予熱)をメンブレンに加えます。メンブレンを55°Cで一晩回転しながらインキュベートします。
- 0.3x SSC、0.1% SDS、55°Cで回転しながら、それぞれ15分間2回ハイブリダイゼーション後の洗浄を行います。
- 0.1x SSC、0.1% SDS、55°Cで回転しながら、それぞれ15分間、ハイブリダイゼーション後の洗浄を2回実施します。
- 0.1x SSC、1.5% SDS、55°Cで回転しながら、それぞれ15分間、2回ハイブリダイゼーション後の洗浄を行います。
- ハイブリダイゼーションチューブからメンブレンを取り出し、メンブレンを蛍光体スクリーンに最大3日間曝露して、フィルム上の放射性インプリントを取得します。
- 蛍光体イメージングレーザースキャニングシステムを使用してフィルムの画像を取得します。
- サンプル調製
- タンパク質分析
- サンプル調製
- 1 μL の β-メルカプトエタノール、PAGE LDS サンプルバッファー(1x)、および精製水2O を添加して、すべてのタンパク質サンプルを最終容量(粗細胞抽出物、インプット、フロースルー、ビーズ、溶出液サンプル用にそれぞれ 200 μL、100 μL、20 μL、20 μL)に調整します。
- サンプルを95°Cで5分間変性させます。
- ウェスタンブロット解析
注:SDS-PAGEおよびウェスタンブロッティングは、標準プロトコル15、16を使用して実行してください。- 各サンプル15 μLを1.5 mm SDS-PAGEゲルの各ウェルにロードします。
- PAP(1:2,000)およびLexA(1:1,000)抗体を用いて、4°Cで一晩インキュベートし、ブロットの免疫染色を行います。 5%粉乳/PBST溶液で希釈します。
注:PAP分析後、2番目のLexA抗体で免疫染色する前に、穏やかなストリッピングプロトコル17 を使用してブロットをストリッピングできます。
- サンプル調製
結果
~1.4 kb の ARS316 クロマチンドメインの精製は、恒常的に発現した LexA-TAP アダプタータンパク質によって媒介されました。ネガティブコントロールとして、LexA-TAPを発現するが、RSおよびLexA結合部位が統合されていない同種株を用いて精製を実施しました。 図3 は、ARS316遺伝子座を標的とする対照株と組換え能力株の両方に対して実施された標準精製実験のDNA分析結果を示...
ディスカッション
特定の標的ゲノム領域の因子とクロマチンランドスケープの同定は、クロマチン研究において大きな課題を提起し続けています18。このプロトコルはとりわけイースト染色体からの明瞭なchromatinの範囲を切除し、浄化する有効なシステムを記述する。私たちの知る限り、このシングルステップ精製の純度と収率は、遺伝子座特異的なクロマチン精製法の多くの制限を克服し?...
開示事項
著者には開示すべき利益相反はありません。
謝辞
S.H.研究所での作業は、SFB1064(プロジェクトID 213249687)、欧州研究会議(ERC Starting Grant 852798 ConflictResolution)、およびHelmholtz Gesellschaftを通じてDFGの支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Yeast strains | |||
| Control Strain: MATa; ura3Δ0; leu2Δ0; his3Δ1; met15Δ0; bar1::kanMX4; Chr I 212kb::LEU2 pTEF2-LEXA-TAP pGAL1-10 RecR | Section 1, see references 13 and 14 | ||
| Recombination Strain: MATa; ura3Δ0; leu2Δ0; his3Δ1; met15Δ0; bar1::kanMX4; RS_LEXA_NS-3_ARS316_NS+3_RS; Chr I 212kb::LEU2 pTEF2-LEXA-TAP pGAL1-10 RecR | Section 1, see reference 13 and 14 | ||
| Plasmid | |||
| K238 plasmid | Section 1, see reference 13 Storage: Store at -20 °C | ||
| K071 Spike-in plasmid DNA | Section 7.1, see reference 13 Storage: Store at -20 °C | ||
| Reagents | |||
| Acetone | Carl Roth | 5025.1 | Section 2 Storage: Store at room temperature |
| Ammonium acetate (NH4Ac) | Sigma Aldrich | A7262 | Section 6 and 7.1 Storage: Store at room temperature |
| Ammonium solution (NH4OH) 25% | Merck Millipore | 533003 | Section 6 Storage: Store at room temperature |
| Ammonium sulfate | Santa Cruz | Sc-29085 | Section 2 Storage: Store at room temperature |
| Bacto agar | BD (VWR) | 90000-760 | Section 3 Storage: Store at room temperature |
| Bacto peptone | BD (VWR) | 211820 | Section 3 Storage: Store at room temperature |
| β-Mercaptoethanol | Sigma Aldrich | 07604 | Section 7.2 Storage: Store at 4 °C |
| Chemiluminescent substrate kit | ThermoFisher | 34580 | Section 7.2 Storage: Store at 4 °C |
| Di-Sodium Hydrogen phosphate dodecahydrate | Merck | 1.06579.1000 | Section 2 and 7.1 Storage: Store at room temperature |
| Dithiothreitol (DTT) | ThermoFisher | 15508013 | Section 4 Storage: Store at 4 °C |
| Ethanol | Merck | 100983 | Section 7.1 Storage: Store at room temperature |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma Aldrich | ED | Section 7.1 Storage: Store at room temperature |
| Galactose (20% (w/v) stock) | Sigma Aldrich | G0625-1KG / 5KG | Section 3 Storage: Store at room temperature |
| Gel loading dye (6x) | BioLabs | B7024A | Section 7.1 Storage: Store at -20 °C |
| Glusose | Sigma-Aldrich | G8270 | Section Storage: Store at room temperature |
| Glycine | Carl Roth | .0079.4 | Section 2 Storage: Store at room temperature |
| Glycogen (5 mg/mL) | Invitrogen | AM9510 | Section 7.1 Storage: Store at -20 °C |
| Hydrochloric acid (HCl) | PanReac AppliChem | 182109.1211 | Section 2, 4 and 7.1 Storage: Store at room temperature |
| Magnesium Acetate (MgAc) | Bernd Kraft | 15274.2600/C035 | Section 4 Storage: Store at room temperature |
| Magnesium chloride (MgCl2) | Sigma Aldrich | M8266 | Section 6 Storage: Store at room temperature |
| Nu PAGE LDS sample buffer (4x) | Invitrogen | 2399549 | Section 7.2 Storage: Store at room temperature |
| Phenol/Chloroform/Isoamyl alcohol (25:24:1 v/v) | Invitrogen | 15593-031 | Section 7.1 Storage: Store at 4 °C |
| Potassium chloride (KCl) | Sigma | P9541 | Section 4 Storage: Store at room temperature |
| Radioactively labeled α-32P dATP (3,000 Ci/mmol, 10 mCi/mL) | Hartmann Analytic | SRP-203 | Section 7.1 Storage: Store at 4 °C |
| RadPrime labeling system | ThermoFisher | 18428-011 | Section 7.1 Storage: Store at -20 °C |
| Raffinose (20% (w/v) stock) | SERVA | 34140.03 | Section 3 Storage: Store at room temperature |
| Sodium chloride (NaCl) | Merck | K53710504142 | Section 7.1 Storage: Store at room temperature |
| Sodium citrate (Na3C6H5O7) | Sigma-Aldrich | 71402 | Section 7.1 Storage: Store at room temperature |
| Sodium hydroxide (NaOH) | Sigma Aldrich | S5881 | Section 7.1 Storage: Store at room temperature |
| Sodium n-dodecyl sulfate (SDS) (5% stock (w/v) ) | Alfa Aesar | A11183 | Section 7.1 Storage: Store at room temperature |
| Sodium phosphate monobasic | Sigma-Aldrich | 71496 | Section 2 and 7.1 Storage: Store at room temperature |
| Sodium azide | Santa Cruz Biotechnology | sc-208393 | Section 2 Storage: Store at -20 °C |
| Triethylamine | Sigma Aldrich | 90340 | Section 2 Storage: Store at room temperature |
| Tris base | Chem Cruz | SC-3715B | Section 2 and 4 Storage: Store at room temperature |
| Triton X-100 | Sigma Aldrich | X100 | Section 2 and 4 Storage: Store at room temperature |
| Tween-20 | Bernd Kraft | 18014332 | Section 4 Storage: Store at room temperature |
| Yeast extract | BD (VWR) | 212720 | Section 3 Storage: Store at room temperature |
| Yeast mating factor alpha (1 µg/mL stock ) | Biomol | Y2016.5 | Section 3 Storage: Store at -20 °C |
| Yeast Synthetic Drop-out medium Supplements without LEUCINE | Sigma Aldrich | Y1376 | Section 1, see reference 14 |
| Enzymes | |||
| HpaI restriction enzyme (5,000 U/mL) | NEB | R0105S | Section 7.1 Storage: Store at -20 °C |
| Protease and Phosphatase Inhibitor Cocktail (100x) | ThermoFisher Scientific | 78446 | Section 4 Storage: Store at4 °C |
| Proteinase K (10 mg/mL) | SERVA | 33756 | Section 7.1 Storage: Store at -20 °C |
| RNase A (10 mg/mL) | ThermoFisher | EN0531 | Section 7.1 Storage: Store at -20 °C |
| TEV protease (10000 U/µL) | NEB | P8112S | Section 5 Storage: Store at -20 °C |
| Materials | |||
| BcMag Epoxy-Activated Magnetic Beads | Bioclone Inc. | FC-102 | Section 2 Storage: Store at 4 °C |
| Dry ice | Section 4 | ||
| Low-binding centrifuge tubes 2.0 mL | Eppendorf | 22431102 | Section 4 |
| Microspin G-25 Columns | Cytiva | 27-5325-01 | Section 7.1 Storage: Store at room temperature |
| Parafilm | Merck | P7793 | Section 4 |
| Positive nylon membrane | Biozol | 11MEMP0001 | Section 7.1 Storage: Store at room temperature |
| PVDF transfer membrane | Immobilon-Merck Millipore | IPVH00010 | Section 7.2 Storage: Store at room temperature |
| SDS-PAGE gel 4-12% bis-tris (15 well, 1.5 mm) | Invitrogen | NP0336BOX | Section 7.2 Storage: Store at 4 °C |
| Syringe (25 mL) with luer fitting | Henke Sass Wolf | 4200-000V0 | Section 3 |
| Whatman paper (Grade 3MM CHR Cellulose Western Blotting Paper Sheet) | Cytiva | 3030-917 | Section 7.1 Storage: Store at room temperature |
| Antibodies | |||
| Anti-LexA, rabbit polyclonal IgG, DNA binding region antibody | Merck Millipore | 06-719 | Section 7.2 Storage: Store at -20 °C |
| Goat Anti-Rabbit IgG (H+L), Horseradish peroxidase conjugate | Invitrogen | G21234 | Section 7.2 Storage: Store at -20 °C |
| Peroxidase Anti-Peroxidase (PAP) antibody produced in rabbit for the detection of TAP-tagged proteins | Sigma Aldrich | P1291-500UL | Section 7.2 Storage: Store at -20 °C |
| Rabbit IgG antibodies | Sigma | I5006-100MG | Section 2 Storage: Store at 4 °C |
| Primers (10 µM) | |||
| ARS316: fwd 5'- CGGCATTATCGTACACAACCT, rev 5'- GTTCTTCGTTGCCTACATTTTCT | Section 7.1 | ||
| K071 Spike-in plasmid DNA: fwd: 5'-TTTTCGCTGCTTGTCCTTTT, rev 5'- CATTTTCGTCCTCCCAACAT | Section 7.1 | ||
| PCR fragment from yeast genomic DNA as a template for ARS316 amplification (for southern blot): fwd 5’- AAATTCTGCCCTTGATTCGT rev 5’- TTTGTTTATCTCATCACTAAT | Section 7.1 | ||
| PDC1: fwd 5'- CATGATCAGATGGGGCTTCA, rev 5'-ACCGGTGGTAGCGACTCTGT | Section 7.1 | ||
| Equipment | |||
| Coffee grinder | Gastroback | 42601 | Section 4 |
| Dewar flask | NAL GENE | 4150-2000 | Section 3 |
| DynaMag TM-2 magnetic rack | Invitrogen | 12321D | Section 4, 5 and 6 |
| Hybridization oven | Hybaid Mini10 | Ri418 | Section 2 |
| Microcentrifuge | Eppendorf | 5424R | Section 4 and 7.1 |
| UV-crosslinker | Analytikjena | 95-0174-02 | Section 7.1 |
参考文献
- Kornberg, R. D., Lorch, Y. Twenty-five years of the nucleosome, fundamental particle of the eukaryote chromosome. Cell. 98 (3), 285-294 (1999).
- Gauchier, M., van Mierlo, G., Vermeulen, M., Déjardin, J. Purification and enrichment of specific chromatin loci. Nature Methods. 17 (4), 380-389 (2020).
- Korthout, T., et al. Decoding the chromatin proteome of a single genomic locus by DNA sequencing. PLoS Biology. 16 (7), e2005542 (2018).
- Antão, J. M., Mason, J. M., Déjardin, J., Kingston, R. E. Protein landscape at Drosophila melanogaster telomere-associated sequence repeats. Molecular and Cellular Biology. 32 (12), 2170-2182 (2012).
- Déjardin, J., Kingston, R. E. Purification of proteins associated with specific genomic loci. Cell. 136 (1), 175-186 (2009).
- Ide, S., Dejardin, J. End-targeting proteomics of isolated chromatin segments of a mammalian ribosomal RNA gene promoter. Nature Communications. 6, 6674 (2015).
- Unnikrishnan, A., Gafken, P. R., Tsukiyama, T. Dynamic changes in histone acetylation regulate origins of DNA replication. Nature Structural & Molecular Biology. 17 (4), 430 (2010).
- Buxton, K. E., et al. Elucidating protein-DNA interactions in human alphoid chromatin via hybridization capture and mass spectrometry. Journal of Proteome Research. 16 (9), 3433-3442 (2017).
- Kennedy-Darling, J., et al. Discovery of chromatin-associated proteins via sequence-specific capture and mass spectrometric protein identification in Saccharomyces cerevisiae. Journal of Proteome Research. 13 (8), 3810-3825 (2014).
- Liu, S. J., et al. CRISPRi-based genome-scale identification of functional long noncoding RNA loci in human cells. Science. 355, 7111 (2017).
- Hamperl, S., et al. Purification of specific chromatin domains from single-copy gene loci in Saccharomyces cerevisiae. Functional Analysis of DNA and Chromatin. 1094, 329-341 (2014).
- Hamperl, S., et al. Compositional and structural analysis of selected chromosomal domains from Saccharomyces cerevisiae. Nucleic Acids Research. 42 (1), 2 (2014).
- Weiβ, M. Single-copy locus proteomics of early- and late-firing DNA replication origins identifies a role of Ask1/DASH complex in replication timing control. Cell Reports. 42 (2), 112045 (2023).
- Gietz, R. D., Schiestl, R. H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method. Nature Protocols. 2 (1), 31-34 (2007).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of America. 76 (9), 4350-4354 (1979).
- Western blot membrane stripping for restaining protocol. Abcam Available from: https://www.abcam.com/protocols/western-blot-membrane-stripping-for-restaining-protocol (2023)
- Vermeulen, M., Déjardin, J. Locus-specific chromatin isolation. Nature Reviews. Molecular Cell Biology. 21 (5), 249-250 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved