A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
RGBradford: كمية البروتين مع كاميرا الهاتف الذكي
In This Article
Summary
توفر هذه الورقة بروتوكولا لقياس كمية البروتين باستخدام مقايسة برادفورد والهاتف الذكي كجهاز تحليلي. يمكن قياس مستويات البروتين في العينات باستخدام بيانات الألوان المستخرجة من صورة صفيحة دقيقة تم التقاطها باستخدام هاتف ذكي.
Abstract
كمية البروتين هو إجراء أساسي في أبحاث علوم الحياة. من بين العديد من الطرق الأخرى ، يعد اختبار برادفورد أحد أكثر الطرق استخداما. بسبب انتشاره على نطاق واسع ، تم الإبلاغ عن قيود ومزايا اختبار برادفورد بشكل شامل ، بما في ذلك العديد من التعديلات على الطريقة الأصلية لتحسين أدائها. أحد تعديلات الطريقة الأصلية هو استخدام كاميرا الهاتف الذكي كأداة تحليلية. بالاستفادة من الأشكال الثلاثة لصبغة Coomassie Brilliant Blue الموجودة في ظروف فحص برادفورد ، تصف هذه الورقة كيفية تحديد كمية البروتين بدقة في العينات باستخدام بيانات الألوان المستخرجة من صورة واحدة للصفيحة الدقيقة. بعد إجراء الفحص في لوحة دقيقة ، يتم التقاط صورة باستخدام كاميرا الهاتف الذكي ، ويتم استخراج بيانات ألوان RGB من الصورة باستخدام تطبيق برمجي مجاني ومفتوح المصدر لتحليل الصور. بعد ذلك ، يتم استخدام نسبة الكثافة الزرقاء إلى الخضراء (في مقياس RGB) للعينات ذات التركيزات غير المعروفة من البروتين لحساب محتوى البروتين بناء على منحنى قياسي. لم يلاحظ فرق كبير بين القيم المحسوبة باستخدام بيانات ألوان RGB وتلك المحسوبة باستخدام بيانات الامتصاص التقليدية.
Introduction
بغض النظر عن الاستخدام النهائي (على سبيل المثال ، ELISA ، حركية الإنزيم ، النشاف الغربي ، تنقية البروتين ، وقياس الطيف الكتلي) ، فإن القياس الكمي للبروتين أمر بالغ الأهمية للتحليل الدقيق في مختبرات علوم الحياة. بالإضافة إلى استخدامها كقراءات ثانوية (أي لحساب المستويات النسبية للتحليلات لكل كتلة من البروتين) ، يمكن أن تكون مستويات البروتين في العينة هي المخرجات المطلوبة نفسها. على سبيل المثال ، يمكن للمرء أن يهتم بمستويات البروتين في الموارد الغذائية1 أو في البول2. هناك العديد من الطرق المتاحة لقياس تركيز البروتين في العينات3 ، بما في ذلك قراءات امتصاص الأشعة فوق البنفسجية المباشرة4 ، واستخلاب البروتين والنحاس 5,6 ، والمقايسات اللونية لربط صبغة البروتين7 ، ومقايسات الفلورسنت المرتبطة بصبغة البروتين8. تتجلى أهمية كمية البروتين من خلال وجود ورقتين تصفان طرق قياس البروتين 5,7 في أعلى 3 من الأدبيات الأكثر استشهادا 9,10. على الرغم من حقيقة أن العديد من المؤلفين يهملون استشهادهم الفعلي من خلال الاستشهاد بمراجع غير أساسية أو عدم الاستشهاد بأي شيء على الإطلاق ، فإن الأوراق الأصلية التي تصف مقايسة بروتين لوري ومقايسة بروتين برادفورد تبلغ 200000 >اقتباس لكلمنها 10.
تنبع شعبية اختبار برادفورد من قدرته على تحمل التكاليف وبساطته وسرعته وحساسيته. يعتمد الفحص على التفاعل بين البروتينات وصبغة Coomassie Brilliant Blue G في ظل الظروف الحمضية. في ظل ظروف الفحص (أي انخفاض درجة الحموضة) ، توجد الصبغة في ثلاثة أشكال: شكل كاتيوني أحمر مع λmax عند 470 نانومتر. شكل محايد أخضر مع λmax عند 650 نانومتر ؛ وشكل أنيوني أزرق مع λmax عند 590 نانومتر11,12 (الشكل 1). يسود الشكل الكاتيوني في غياب البروتينات. عندما تتفاعل البروتينات مع الصبغة ، فإنها تعمل على استقرار الشكل الأنيوني الأزرق ، مما يتسبب في تغيير ملحوظ في لون المحلول ، من البني إلى الأزرق. عادة ، يتم قياس التغير في تركيز الشكل الأزرق للصبغة طيفيا ، حيث يتناسب امتصاصه عند 590-595 نانومتر مع كمية البروتين في الفحص.
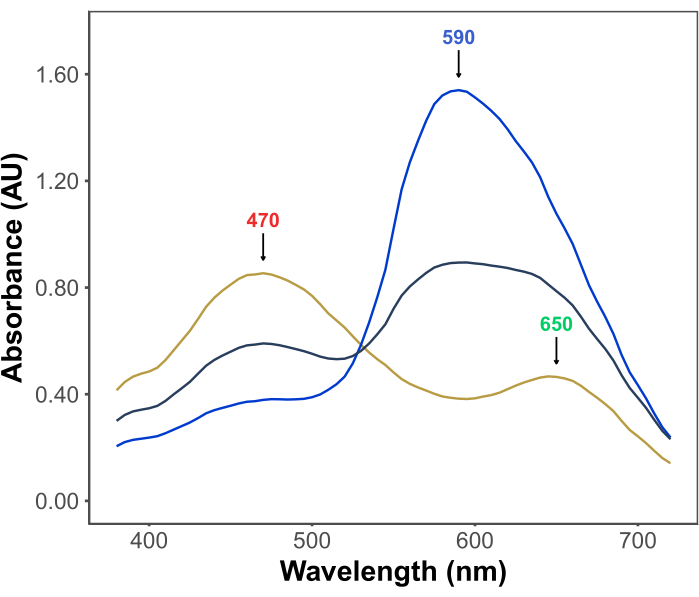
الشكل 1: أطياف امتصاص G الزرقاء الرائعة في كوماسي تحت ظروف فحص برادفورد. تم تمييز القمم الرئيسية الثلاث بأسهم تشير إلى λmax لأشكال الصبغة الحمراء (470 نانومتر) والأخضر (650 نانومتر) والأزرق (590 نانومتر). تم تسجيل الأطياف في غياب البروتين (الخط الأصفر) وفي وجود 3 ميكروغرام (الخط الرمادي) و 10 ميكروغرام (الخط الأزرق) من ألبومين مصل الأبقار. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
أدى الاستخدام الواسع النطاق لمقايسة برادفورد إلى تحديد العديد من القيود (على سبيل المثال ، الاستجابات المتغيرة للبروتينات المختلفة11 ، والتداخل بواسطة الدهون13 والمنظفات7) وتطوير تعديلات لتحسين أدائها (على سبيل المثال ، إضافة المنظفات14،15 ، القلوية14،16 واستخدام نسبة الامتصاص17). بالإضافة إلى التعديلات في الفحص نفسه ، تم أيضا وصف استخدام الأجهزة البديلة ، مثل الهواتف الذكية أو الكاميرات ، لالتقاط الإشارات التحليلية18،19،20. في الواقع ، كان تطوير الأساليب التي تستخدم الهواتف الذكية كأجهزة تحليل كيميائية محمولة مجالا نشطا للبحث. ينبع الدافع لاستخدام الهواتف الذكية من القدرة على تحمل التكاليف وقابلية النقل وسهولة الاستخدام والتوافر الواسع لهذه الأجهزة.
توفر هذه الورقة بروتوكولا لقياس كمية البروتين باستخدام اختبار RGBradford20 ، والذي يستخدم الهاتف الذكي كجهاز تحليلي. على عكس منشور RGBradford الأصلي20 ، هنا ، تم تقديم إجراء يبسط عملية استخراج الألوان. إنه ينطوي على استخدام تطبيق برمجي متاح مجانا لاستخراج معلومات الألوان من كل بئر من صورة الصفيحة الدقيقة تلقائيا ، مما يوفر وقتا وجهدا كبيرين. هذا بديل للطريقة السابقة للحصول يدويا على بيانات الألوان من كل بئر واحدا تلو الآخر باستخدام تطبيق برنامج محرر الرسومات20. في النهاية ، يمكن قياس مستويات البروتين في العينات باستخدام بيانات الألوان المستخرجة من صورة صفيحة دقيقة تم التقاطها بهاتف ذكي.
Protocol
1. إعداد كاشف فحص بروتين برادفورد
- قم بإذابة 100 مجم من Coomassie Brilliant Blue G في 50 مل 95٪ (وزن / حجم) من الإيثانول. اخلطي حتى يذوب كوماسي بريليانت بلو جي تماما.
تنبيه: الإيثانول قابل للاشتعال ويسبب تهيج العين. تجنب اللهب واستخدم النظارات الواقية. - إلى المحلول السابق ، أضف 100 مل من 85٪ (وزن / حجم) حمض الفوسفوريك بعناية.
تنبيه: حمض الفوسفوريك يسبب تآكل المعادن ويسبب تآكل الجلد وتلف العين الخطير والسمية الفموية الحادة. ارتداء القفازات والنظارات الواقية. - أضف المحلول الذي يحتوي على Coomassie Brilliant Blue G والإيثانول وحمض الفوسفوريك ببطء إلى 600 مل من الماء منزوع الأيونات.
- خفف المحلول إلى حجم نهائي قدره 1000 مل. قم بالتوسع لأعلى أو لأسفل وفقا لعدد العينات المراد تحليلها. كما هو موضح في الطريقة الأصلية7 ، يجب أن تكون التركيزات النهائية في كاشف برادفورد العامل 0.01٪ (وزن / حجم) Coomassie Brilliant Blue G ، 4.7٪ (وزن / حجم) إيثانول ، و 8.5٪ (وزن / حجم) حمض الفوسفوريك.
- قم بإزالة أي ترشيح للمواد غير القابلة للذوبان من خلال ورق الترشيح (ورق Whatman # 1 أو ما يعادله).
- الكاشف مستقر لعدة أسابيع عند تخزينه في درجة حرارة الغرفة (RT) ومحمي من الضوء. قم بالتصفية حسب الضرورة لأن الرواسب قد تتشكل بمرور الوقت.
ملاحظة: بدلا من ذلك ، تتوفر كواشف برادفورد الجاهزة للتخفيف والاستخدام تجاريا. اتبع تعليمات الشركة المصنعة لإعداد الكاشف وانتقل إلى الخطوة التالية.
2. إعداد حلول البروتين القياسية
- قم بإعداد محلول مخزون (راجع الخطوة 2.4) من بروتين معزول لاستخدامه كمعيار. بروتين ميسور التكلفة وشائع الاستخدام هو ألبومين مصل الأبقار (BSA). الخيارات الأخرى هي البولينالين البيضاوي وجلوبيولين جاما البقري.
- إذا كانت الامتصاصية المولية للبروتين المستخدم كمعيار معروفة ، فتحقق من تركيز محلول المخزون في مقياس الطيف.
- بالنسبة ل BSA ، الصيغة شائعة الاستخدام هي BSA (mg / mL) = (A280 / 6.6) × 10 ، حيث A280 هو الامتصاص عند 280 نانومتر بطول مسار 1 سم مقروء مقابل فراغ مناسب (أيε 2801٪ = 6.6)7. على سبيل المثال ، 0.8 مجم / مل BSA لديه امتصاص 0.528 عند 280 نانومتر.
- لتوليد المنحنى القياسي ، قم بإعداد العديد من التخفيفات من BSA في حدود 0.025 مجم / مل و 1.0 مجم / مل. سيؤدي ذلك إلى 0.25-10 ميكروغرام من BSA لكل بئر بعد إضافة حجم عينة يبلغ 10 ميكرولتر لكل بئر.
ملاحظة: يجب تحضير المحاليل القياسية للبروتين في وسط بنفس التركيب (التركيز النهائي) للوسط المستخدم في تحضير العينات.
3. الفحص
- قم بتخفيف العينات لتحقيق تركيز البروتين ضمن نطاق المنحنى القياسي من 0.025-1.0 مجم / مل. لديك العديد من التخفيفات (3 على الأقل) عينة داخل النطاق.
ملاحظة: يمكن تخفيف العينات باستخدام محلول ملحي مخزن بالفوسفات (PBS) أو أي تركيبة وسيطة / عازلة أخرى متوافقة مع كاشف برادفورد. يجب ألا يختلف التركيز النهائي للمكونات المتوسطة بين المعيار والعينات. - أضف 10 ميكرولتر من كل محلول قياسي للبروتين إلى ثلاثة آبار (أي في ثلاث نسخ) من صفيحة دقيقة 96 بئرا. بالنسبة لنقطة البروتين 0 (صفر) ، أضف 10 ميكرولتر من المخزن المؤقت / الوسيط المستخدم لإعداد المحاليل القياسية وتخفيفات العينة.
- إلى مجموعة أخرى من الآبار ، أضف 10 ميكرولتر من كل تخفيف عينة إلى ثلاثة آبار (أي في ثلاث نسخ) من نفس الصفيحة الدقيقة المكونة من 96 بئرا. تتمثل إحدى الطرق في إضافة أحجام مختلفة من العينة وإكمالها بوسط يصل إلى 10 ميكرولتر لكل بئر (على سبيل المثال ، 0.5 ميكرولتر ، 1 ميكرولتر ، 2 ميكرولتر ، 4 ميكرولتر ، و 8 ميكرولتر من العينة بالإضافة إلى 9.5 ميكرولتر و 9 ميكرولتر و 8 ميكرولتر و 6 ميكرولتر و 2 ميكرولتر من الوسط).
- أضف 250 ميكرولتر من كاشف فحص بروتين برادفورد إلى جميع الآبار. يظهر إعداد صفيحة مجهرية نموذجي في الشكل 2. في هذا المثال ، تم تضمين مجموعة من الآبار الفارغة التي تحتوي على 260 ميكرولتر (الحجم النهائي لكل بئر) من الماء لتكون فارغة في قارئ الصفائح الدقيقة (الخطوة 4.5). هذا مطلوب فقط إذا تم جمع بيانات الامتصاص أيضا.
ملاحظة: قم بإعداد منحنى قياسي في نفس الصفيحة الدقيقة للعينات في كل مرة يتم فيها إجراء الفحص. بمعنى آخر ، إذا كان عدد العينات يتطلب لوحة أخرى ، فقم بإعداد منحنى قياسي آخر في اللوحة الثانية ، وهكذا. - سجل النتائج (القسم 4) في غضون 5-15 دقيقة.
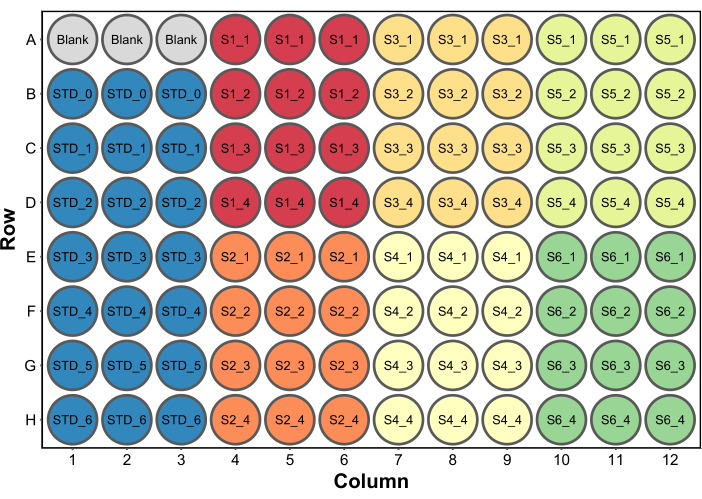
الشكل 2: تخطيط لوحة نموذجي لمقايسة بروتين برادفورد. يشير الفراغ إلى ثلاثة آبار تحتوي على 260 ميكرولتر من الماء لاستخدامها فارغة في قارئ الصفائح الدقيقة. الأمراض المنقولة جنسيا يشير إلى معايير البروتين. S1-S6 هي ست عينات مختلفة. SX_1-SX_4 أربعة تخفيفات مختلفة للعينة لكل عينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تسجيل النتائج
- في غرفة مضاءة جيدا ، أمسك الصفيحة الدقيقة الموازية للمقعد على خلفية بيضاء موحدة (على سبيل المثال ، ورقة ورقية) بيد واحدة. تأكد من المحاذاة الدقيقة عن طريق وضع مستوى الفقاعة على اللوحة.
- من ناحية أخرى ، أمسك الهاتف الذكي بالتوازي (تشير بعض تطبيقات الكاميرا بشكل مفيد إلى ميل الجهاز) إلى المقعد والصفيحة الدقيقة والتقط صورة واحدة أو عدة صور للصفيحة الدقيقة بأكملها (الشكل 3). في أجهزة iOS ، قم بتشغيل مؤشر مستوى الكاميرا في إعدادات الكاميرا عن طريق تمكين خيار الشبكة. في أجهزة Android ، قم بتشغيل مؤشر مستوى الكاميرا في إعدادات الكاميرا من خلال تمكين تلميحات الإطار.
- لا يلزم وجود جهاز إضاءة خاص ، ولكن احرص على تجنب الظلال والانعكاسات. على سبيل المثال ، تجنب تظليل اللوحة أو الخلفية بالهاتف الذكي وتجنب تظليل الخلفية باستخدام الصفيحة الدقيقة. الانعكاسات الصغيرة في حواف منطقة البئر ليست مشكلة ؛ يمكن استخراج بيانات اللون من منطقة صغيرة جدا في وسط كل بئر.
- تحقق لفترة وجيزة من الصورة لمعرفة تناسق الخلفية والظلال والانعكاسات. أيضا ، ألق نظرة على زاوية الآبار ؛ يجب أن يكون مركز كل بئر مرئيا مباشرة (أي ليس خلف جدران البئر).
- إذا كانت المقارنة بين قراءات امتصاص الصفيحة الدقيقة وبيانات لون الصورة مطلوبة ، فاقرأ الصفيحة الدقيقة عند 590 نانومتر و 450 نانومتر في قارئ الصفيحة الدقيقة21.

الشكل 3: التقاط نتائج فحص بروتين برادفورد. في غرفة مضاءة جيدا ، يتم وضع الصفيحة الدقيقة بالتوازي مع المقعد على خلفية موحدة بيد واحدة. من ناحية أخرى ، يتم تثبيت الهاتف الذكي بالتوازي مع المقعد والصفيحة الدقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. استخراج بيانات اللون تلقائيا
- قم بتنزيل ImageJ و ReadPlate22 ، يتوفر مكون إضافي ImageJ في https://imagej.nih.gov/ij/plugins/readplate/index.html (هذا ملف .txt).
- افتح ImageJ ، وانقر فوق المكونات الإضافية > التثبيت وحدد الملف الذي تم تنزيله في الخطوة 6.1.
- اضبط معلمات القياس بالنقر فوق تحليل > تعيين القياسات وتحقق من الخيارات التالية: منطقة؛ الانحراف المعياري الحد الأدنى والحد الأقصى للقيمة الرمادية ؛ يعني القيمة الرمادية ؛ قيمة رمادية مشروطة. في أسفل النافذة، اضبط إعادة التوجيه إلى: بلا والمنازل العشرية (0-9): 3.
- انتقل إلى ملف > فتح وحدد صورة الصفيحة الدقيقة التي تم التقاطها في الخطوة 4.
- انتقل إلى المكونات الإضافية > ReadPlate. اقرأ الإرشادات ثم انقر فوق موافق.
- حدد عدد الآبار: 96.
- باستخدام أداة التحديد المستطيل التي يتم تحميلها تلقائيا بواسطة المكون الإضافي ، قم بعمل مستطيل يبدأ في وسط البئر A1 وينتهي في وسط البئر H12. ثم انقر فوق موافق.
- حدد القناة الزرقاء وانقر فوق موافق.
- قم بتأكيد المعلمات الافتراضية بالنقر فوق موافق.
- تحقق مما إذا كان البرنامج قد حدد منطقة داخل كل بئر وما إذا كانت المناطق المحددة لا تغطي مناطق ذات ظلال أو انعكاس غير طبيعي. انقر فوق موافق.
- احفظ النتائج وكرر الخطوات من 5.8 إلى 5.10 للقناة الخضراء.
- احسب نسبة الأزرق إلى الأخضر باستخدام الوضع لكل لون.
ملاحظة: يمكن إجراء الحساب يدويا أو باستخدام برنامج تفضيلات القارئ ، مثل R أو Microsoft Excel أو GraphPad Prism.
6. استخراج بيانات اللون يدويا
- قم بتنزيل Inkscape ، محرر رسومات مجاني ومفتوح المصدر.
ملاحظة: يمكن استخدام أي برنامج مزود بأداة منتقي الألوان (عادة ما يتم تصويره على أنه قطارة عين) لتحديد اللون واستخراج بيانات RGB. - افتح Inkscape ، انتقل إلى ملف > فتح. حدد صورة الصفيحة الدقيقة التي تم التقاطها في الخطوة 4.
- اختر أداة تحديد وتحويل الكائنات (S) ، والتي يتم تصويرها كسهم في أعلى الجانب الأيسر ، وانقر فوق الصورة. سيشير حد الخط المتقطع إلى التحديد.
- حدد أداة انتقاء الألوان من الصورة (D)، والتي يتم تصويرها على هيئة شافطة عين على الجانب الأيسر.
- انقر في وسط البئر. سيتغير اللون الموجود على اللوحة السفلية ("تعبئة:") وفقا لذلك. انقر فوق اللون وستظهر علامة التبويب Fill and Stroke على الجانب الأيمن.
- قم بتغيير القائمة المنسدلة Flat Color إلى RGB. سجل القيم المعروضة للقنوات الزرقاء والخضراء لكل بئر.
- احسب نسبة الأزرق إلى الأخضر باستخدام القيم المسجلة.
ملاحظة: يمكن إجراء الحساب يدويا أو باستخدام برنامج تفضيلات القارئ ، مثل R أو Microsoft Excel أو GraphPad Prism.
7. بناء منحنيات قياسية واستقراء المجهول
- ارسم متوسط نسبة الكثافة الخضراء إلى الزرقاء كدالة للتركيز القياسي للبروتين.
ملاحظة: ارسم البيانات يدويا أو باستخدام برنامج تفضيلات القارئ ، مثل R أو Microsoft Excel أو GraphPad Prism. - احسب متوسط نسبة الشدة من الأخضر إلى الأزرق لكل عينة والتخفيف.
- تحقق مما إذا كانت الإشارة التي تم الحصول عليها للعينة تقع ضمن النطاق الخطي لمعيار البروتين.
- تجاهل أي قيمة أقل أو أعلى من القيم الدنيا أو القصوى للمنحنى القياسي.
- استخدم المعادلة الخطية التي تصف المنحنى القياسي لاستقراء كمية البروتين في العينة. اضرب القيم المحسوبة في عامل التخفيف وفقا لذلك.
النتائج
الشكل 4 عبارة عن صورة لصفيحة دقيقة تم استخراج بيانات اللون منها ، وتم تسجيل الامتصاص عند 450 نانومتر و 590 نانومتر. تم الحصول على بيانات ألوان RGB المبلغ عنها هنا كممثل تلقائيا كما هو موضح في القسم 5. النمط النموذجي لبيانات الألوان هو زيادة في القيم الزرقاء وانخفاض في القيم الحمر...
Discussion
تصف هذه الورقة RGBradford ، وهي طريقة تستخدم كاميرا الهاتف الذكي لتسجيل البيانات من فحص بروتين برادفورد ، واستخراج بيانات الألوان ، وتحديد مستويات البروتين بدقة في العينات البيولوجية كما هو موضح في الأصلمؤخرا 20. أحد الاختلافات عن طريقة RGBradford الأصلية هو أنه تم استخدام إجراء للحصو?...
Disclosures
ليس لدى صاحب البلاغ أي تضارب في المصالح للإعلان.
Acknowledgements
تم تمويل هذا العمل من قبل المجلس الوطني للتنمية العلمية والتكنولوجية (CNPq ، البرازيل) [أرقام المنح 428048 / 2018-8 و 402556 / 2022-4] وجامعة برازيليا (البرازيل). يشكر المؤلف الدكتور دوارتي نونو كارفالهو والدكتورة إيفلين سانتوس (i3s ، بورتو ، البرتغال) على توفير الوصول إلى هواتفهم الذكية المستخدمة في هذا البحث.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
References
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved