Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
RGBradford: Akıllı Telefon Kamerası ile Protein Kantitasyonu
Bu Makalede
Özet
Bu makale, Bradford tahlili ve analitik bir cihaz olarak bir akıllı telefon kullanarak protein miktar tayini için bir protokol sağlar. Numunelerdeki protein seviyeleri, bir akıllı telefonla çekilen bir mikroplaka resminden çıkarılan renk verileri kullanılarak ölçülebilir.
Özet
Protein miktarı, yaşam bilimleri araştırmalarında önemli bir prosedürdür. Diğer birçok yöntem arasında, Bradford testi en çok kullanılanlardan biridir. Yaygın olması nedeniyle, Bradford testinin sınırlamaları ve avantajları, performansını artırmak için orijinal yöntemin çeşitli modifikasyonları da dahil olmak üzere kapsamlı bir şekilde rapor edilmiştir. Orijinal yöntemin değişikliklerinden biri, analitik bir araç olarak bir akıllı telefon kamerasının kullanılmasıdır. Bradford tahlili koşullarında var olan Coomassie Brilliant Blue boyasının üç formundan yararlanan bu makale, bir mikroplakanın tek bir resminden çıkarılan renk verilerini kullanarak numunelerdeki proteinin nasıl doğru bir şekilde ölçüleceğini açıklamaktadır. Testi bir mikroplakada gerçekleştirdikten sonra, bir akıllı telefon kamerası kullanılarak bir resim çekilir ve ücretsiz ve açık kaynaklı bir görüntü analiz yazılımı uygulaması kullanılarak resimden RGB renk verileri çıkarılır. Daha sonra, standart bir eğriye dayalı olarak protein içeriğini hesaplamak için bilinmeyen protein konsantrasyonlarına sahip numunelerin mavinin yeşile oranı (RGB ölçeğinde) kullanılır. RGB renk verileri kullanılarak hesaplanan değerler ile geleneksel absorbans verileri kullanılarak hesaplanan değerler arasında anlamlı bir fark gözlenmemiştir.
Giriş
Aşağı akış kullanımından bağımsız olarak (örneğin, ELISA, enzim kinetiği, western blotlama, protein saflaştırma ve kütle spektrometresi), yaşam bilimleri laboratuvarlarında doğru analiz için protein miktar tayini çok önemlidir. İkincil okumalar olarak kullanımlarına ek olarak (yani, protein kütlesi başına analitlerin nispi seviyelerini hesaplamak için), bir numunedeki protein seviyeleri de istenen çıktının kendisi olabilir. Örneğin, gıda kaynakları1 veya idrar2'deki protein seviyeleri ile ilgilenilebilir. Doğrudan UV absorbans okumaları 4, protein-bakır şelasyonu 5,6, protein boyası bağlayıcı kolorimetrik deneyler 7 ve protein boyası bağlayıcı floresan deneyleri 8 dahil olmak üzere numunelerde3 protein konsantrasyonunu ölçmek için birçok yöntem mevcuttur. Protein kantitasyonunun önemi, en çok alıntı yapılan literatürün 5,7'ünde protein ölçüm yöntemlerini5,7 açıklayan iki makaleninvarlığıyla kanıtlanmıştır 9,10. Birçok yazarın birincil olmayan referanslara atıfta bulunarak veya hiçbir şeyden alıntı yapmayarak gerçek alıntılarını ihmal etmesine rağmen, Lowry protein tahlilini ve Bradford protein tahlilini açıklayan orijinal makalelerin herbiri 10 >200.000 alıntıdır.
Bradford testinin popülaritesi, satın alınabilirliğinden, basitliğinden, hızından ve hassasiyetinden kaynaklanmaktadır. Test, asidik koşullar altında proteinler ve Coomassie Brilliant Blue G boyası arasındaki etkileşime dayanmaktadır. Tahlil koşulları altında (yani, düşük pH), boya üç şekilde bulunur: λ ile kırmızı katyonik formmaks 470 nm'de; λmax 650 nm'de yeşil nötr bir form; ve λ ile mavi anyonik formmaks 590 nm 11,12'de (Şekil 1). Katyonik form, proteinlerin yokluğunda baskındır. Proteinler boya ile etkileşime girdiğinde, mavi anyonik formu stabilize ederek çözeltinin renginde kahverengimsiden maviye gözle görülür bir değişikliğe neden olurlar. Genellikle, boyanın mavi formunun konsantrasyonundaki değişiklik, 590-595 nm'deki absorbansı tahlildeki protein miktarı ile orantılı olan spektrofotometrik olarak ölçülür.
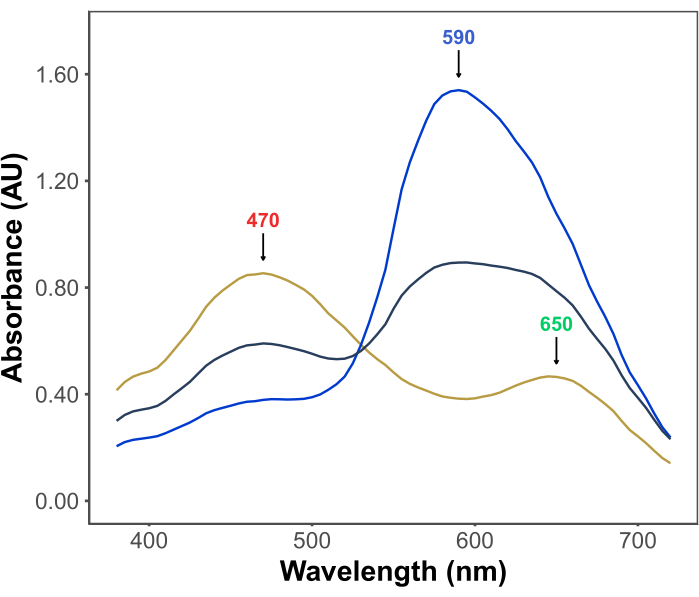
Şekil 1: Bradford testi koşulları altında Coomassie parlak mavi G absorpsiyon spektrumları. Üç ana tepe noktası, boyanın kırmızı (470 nm), yeşil (650 nm) ve mavi (590 nm) formlarının λmax'ını gösteren oklarla işaretlenmiştir. Spektrumlar, protein yokluğunda (sarı çizgi) ve 3 μg (gri çizgi) ve 10 μg (mavi çizgi) sığır serum albümini varlığında kaydedildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bradford testinin yaygın kullanımı, çeşitli sınırlamaların tanımlanmasına (örneğin, farklı proteinlere11 değişken tepkiler ve lipitler13 ve deterjanlar7 tarafından girişim) ve performansını iyileştirmek için modifikasyonların geliştirilmesine yol açmıştır (örneğin, deterjanlarıneklenmesi 14,15, alkalinizasyon14,16 ve absorbans oranının kullanılması17). Testin kendisindeki değişikliklere ek olarak, analitik sinyalleri yakalamak için akıllı telefonlar veya kameralar gibi alternatif cihazların kullanımı da tanımlanmıştır 18,19,20. Gerçekten de, akıllı telefonları taşınabilir kimyasal analizörler olarak kullanan yöntemlerin geliştirilmesi aktif bir araştırma alanı olmuştur. Akıllı telefonların kullanım motivasyonu, bu cihazların satın alınabilirliğinden, taşınabilirliğinden, kullanım kolaylığından ve yaygın olarak bulunmasından kaynaklanmaktadır.
Bu makale, analitik bir cihaz olarak bir akıllı telefon kullanan RGBradford testi20'yi kullanarak protein ölçümü için bir protokol sağlar. Orijinal RGBradford yayını20'nin aksine, burada renk çıkarma işlemini kolaylaştıran bir prosedür tanıtıldı. Bir mikroplaka resminin her bir kuyucuğundan renk bilgilerini otomatik olarak çıkarmak için ücretsiz olarak kullanılabilen bir yazılım uygulamasının kullanılmasını içerir, bu da önemli ölçüde zaman ve emek tasarrufu sağlar. Bu, bir grafik düzenleme yazılımı uygulaması20 kullanarak her bir kuyudan renk verilerini tek tek manuel olarak elde etmenin önceki yöntemine bir alternatiftir. Sonuç olarak, numunelerdeki protein seviyeleri, bir akıllı telefonla çekilen bir mikroplaka resminden çıkarılan renk verileri kullanılarak ölçülebilir.
Protokol
1. Bradford protein tahlil reaktifinin hazırlanması
- 100 mg Coomassie Brilliant Blue G'yi 50 mL% 95 (a / h) etanol içinde çözün. Coomassie Brilliant Blue G tamamen eriyene kadar karıştırın.
DİKKAT: Etanol yanıcıdır ve göz tahrişine neden olur. Alevlerden kaçının ve gözlük kullanın. - Önceki çözeltiye dikkatlice 100 mL %85 (a/h) fosforik asit ekleyin.
DİKKAT: Fosforik asit metaller için aşındırıcıdır ve cilt korozyonuna, ciddi göz hasarına ve akut ağız toksisitesine neden olur. Eldiven ve gözlük takın. - Coomassie Brilliant Blue G, etanol ve fosforik asit içeren çözeltiyi 600 mL deiyonize suya yavaşça ekleyin.
- Çözeltiyi 1.000 mL'lik bir nihai hacme seyreltin. Analiz edilecek numune sayısına göre ölçeği büyütün veya küçültün. Orijinal yöntem7'de açıklandığı gibi, çalışan Bradford reaktifindeki nihai konsantrasyonlar %0.01 (a/h) Coomassie Brilliant Blue G, %4.7 (a/h) etanol ve %8.5 (a/h) fosforik asit olmalıdır.
- Filtre kağıdından (Whatman #1 kağıdı veya eşdeğeri) süzülen çözünmeyen malzemeleri çıkarın.
- Reaktif, oda sıcaklığında (RT) saklandığında ve ışıktan korunduğunda birkaç hafta stabildir. Zamanla çökeltiler oluşabileceğinden gerektiği gibi filtreleyin.
NOT: Alternatif olarak, seyreltmeye ve kullanıma hazır Bradford reaktifleri ticari olarak temin edilebilir. Reaktifi hazırlamak için üreticinin talimatlarını izleyin ve bir sonraki adıma geçin.
2. Protein standart çözeltilerinin hazırlanması
- Standart olarak kullanılacak izole edilmiş bir proteinin stok çözeltisini hazırlayın (bkz. adım 2.4). Uygun fiyatlı ve yaygın olarak kullanılan bir protein, sığır serum albüminidir (BSA). Diğer seçenekler ovalbümin ve sığır gama globulinidir.
- Standart olarak kullanılan proteinin molar absorptivesi biliniyorsa, stok çözeltisinin konsantrasyonunu bir spektrofotometrede kontrol edin.
- BSA için yaygın olarak kullanılan bir formül BSA (mg/mL) = (A280/6.6) × 10'dur, burada A280, uygun bir boşluğa karşı okunan 1 cm'lik bir yol uzunluğuna sahip 280 nm'de absorbanstır (yani, ε280%1 = 6.6)7. Örneğin, 0.8 mg / mL BSA, 280 nm'de 0.528'lik bir absorbansa sahiptir.
- Standart eğriyi oluşturmak için, 0.025 mg / mL ve 1.0 mg / mL içinde birkaç BSA dilüsyonu hazırlayın. Bunlar, kuyucuk başına 10 μL'lik bir numune hacmi eklendikten sonra kuyu başına 0.25-10 μg BSA ile sonuçlanacaktır.
NOT: Protein standart çözeltileri, numuneleri hazırlamak için kullanılan ortamla aynı bileşime (nihai konsantrasyon) sahip bir ortamda hazırlanmalıdır.
3. Tahlil
- 0.025-1.0 mg/mL'lik standart eğri aralığında bir protein konsantrasyonu elde etmek için numuneleri seyreltin. Aralık içinde birkaç (en az 3) numune seyreltmesine sahip olun.
NOT: Numuneler, fosfat tamponlu salin (PBS) veya Bradford reaktifi ile uyumlu başka herhangi bir ortam/tampon bileşimi ile seyreltilebilir. Orta bileşenlerin nihai konsantrasyonu, standart ve numuneler arasında farklılık göstermemelidir. - Her protein standart çözeltisinden 10 μL'yi 96 oyuklu bir mikroplakanın üç oyuğuna (yani üç kopya halinde) ekleyin. 0 (sıfır) protein noktası için, standart çözeltileri ve numune seyreltmelerini hazırlamak için kullanılan 10 μL tampon/ortam ekleyin.
- Başka bir kuyucuk grubuna, aynı 96 oyuklu mikroplakanın üç oyuğuna (yani üç kopya halinde) her bir numune seyreltmesinden 10 μL ekleyin. Bir yaklaşım, bir numunenin farklı hacimlerini eklemek ve kuyu başına 10 μL'ye kadar bir ortamla tamamlamaktır (örneğin, 0.5 μL, 1 μL, 2 μL, 4 μL ve 8 μL numune artı 9.5 μL, 9 μL, 8 μL, 6 μL ve 2 μL ortam).
- Tüm kuyucuklara 250 μL Bradford protein tahlil reaktifi ekleyin. Tipik bir mikroplaka kurulumu Şekil 2'de gösterilmektedir. Bu örnekte, bir mikroplaka okuyucusunda boş olarak hizmet etmek üzere 260 μL (kuyu başına son hacim) su içeren bir dizi boş kuyu dahil edilmiştir (adım 4.5). Bu, yalnızca absorbans verileri de toplanacaksa gereklidir.
NOT: Tahlil her gerçekleştirildiğinde aynı mikroplaka numunesinde standart bir eğri hazırlayın. Başka bir deyişle, numune sayısı başka bir plaka gerektiriyorsa, ikinci plakada başka bir standart eğri hazırlayın ve bu şekilde devam edin. - Sonuçları (bölüm 4) 5-15 dakika içinde kaydedin.
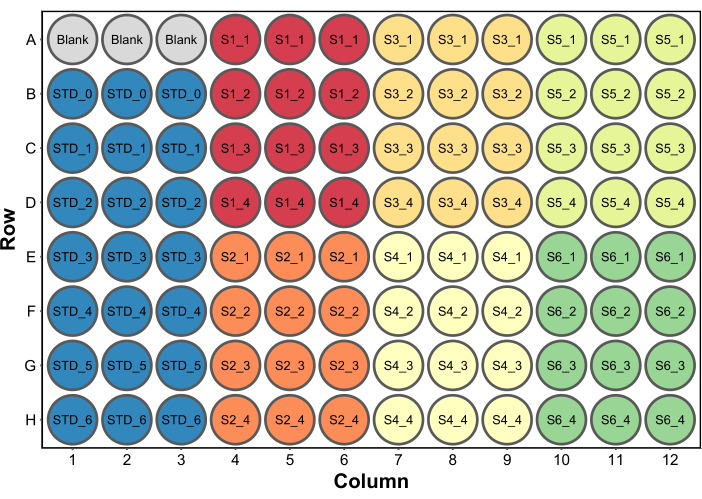
Şekil 2: Bradford protein testi için tipik bir plaka düzeni. Boş, bir mikroplaka okuyucusunda boş olarak kullanılacak 260 μL su içeren üç kuyuyu ifade eder. STD, protein standartlarını ifade eder. S1-S6 altı farklı örnektir. SX_1-SX_4, her numune için dört farklı numune seyreltmesidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Sonuçların kaydedilmesi
- İyi aydınlatılmış bir odada, mikroplakayı bir elinizle tek tip beyaz bir arka plana (örneğin bir kağıt yaprağı) karşı tezgaha paralel tutun. Plakaya bir kabarcık seviyesi yerleştirerek doğru hizalamayı sağlayın.
- Öte yandan, akıllı telefonu tezgaha ve mikroplakaya paralel tutun (bazı kamera uygulamaları cihazın eğimini faydalı bir şekilde gösterir) ve tüm mikroplakanın bir veya birkaç fotoğrafını çekin (Şekil 3). iOS cihazlarda, Izgara seçeneğini etkinleştirerek kamera ayarlarında kamera seviyesi göstergesini açın. Android cihazlarda, Çerçeveleme İpuçları'nı etkinleştirerek kamera ayarlarında kamera seviyesi göstergesini açın.
- Özel bir aydınlatma aparatı gerekmez, ancak gölge ve yansımalardan kaçınmaya özen gösterin. Örneğin, plakayı veya arka planı akıllı telefonla gölgelendirmekten kaçının ve arka planı mikroplaka ile gölgelendirmekten kaçının. Kuyu alanının kenarlarındaki küçük yansımalar sorun değildir; Renk verileri, her kuyunun ortasındaki çok küçük bir alandan çıkarılabilir.
- Arka plan tekdüzeliği, gölgeler ve yansımalar için resmi kısaca kontrol edin. Ayrıca, kuyuların açısına bir göz atın; Her kuyunun merkezi doğrudan görünür olmalıdır (yani, kuyu duvarlarının arkasında değil).
- Mikroplaka absorbans okumaları ile resim renk verileri arasında karşılaştırma yapılmak isteniyorsa, mikroplakayı bir mikroplaka okuyucusunda 590 nm ve 450 nm'de okuyun21.

Şekil 3: Bradford protein testinin sonuçlarının yakalanması. İyi aydınlatılmış bir odada, mikroplaka tek elle tek tip bir arka plana karşı tezgaha paralel olarak konumlandırılır. Öte yandan, akıllı telefon tezgaha ve mikroplakaya paralel olarak tutulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Renk verilerini otomatik olarak çıkarma
- ImageJ ve ReadPlate22'yi indirin, bir ImageJ eklentisi https://imagej.nih.gov/ij/plugins/readplate/index.html adresinde mevcuttur (bu bir .txt dosyasıdır).
- ImageJ'yi açın, Eklentiler > Yükle'ye tıklayın ve adım 6.1'de indirilen dosyayı seçin.
- Analiz Et > Ölçümleri Ayarla'ya tıklayarak ölçüm parametrelerini ayarlayın ve aşağıdaki seçenekleri kontrol edin: Alan; Standart sapma; Min ve maks gri değeri; Ortalama gri değer; Modal gri değer. Pencerenin alt kısmında, Yeniden Yönlendir'i şu şekilde ayarlayın: Yok ve Ondalık basamaklar (0-9): 3.
- Dosya > Aç'a gidin ve 4. adımda çekilen mikroplaka resmini seçin.
- Eklentiler > ReadPlate'e gidin. Yönergeleri okuyun ve ardından Tamam'ı tıklatın.
- Kuyu sayısını seçin: 96.
- Eklenti tarafından otomatik olarak yüklenen Dikdörtgen seçim aracını kullanarak, A1 kuyusunun ortasından başlayıp H12 kuyusunun ortasında biten bir dikdörtgen yapın. Ardından, Tamam'ı tıklatın.
- Mavi kanalı seçin ve Tamam'a tıklayın.
- Tamam'a tıklayarak varsayılan parametreleri onaylayın.
- Yazılımın her bir kuyucuğun içindeki bir alanı tanımlayıp tanımlamadığını ve seçilen alanların anormal gölgeler veya yansıma olan alanları kapsayıp kapsamadığını kontrol edin. Tamam'a tıklayın.
- Sonuçları kaydedin ve yeşil kanal için 5.8-5.10 arasındaki adımları tekrarlayın.
- Her renk için modu kullanarak mavi-yeşil oranını hesaplayın.
NOT: Hesaplama manuel olarak veya R, Microsoft Excel veya GraphPad Prism gibi okuyucu tercihlerinin yazılımı kullanılarak yapılabilir.
6. Renk verilerinin çıkarılması-Manuel olarak
- Ücretsiz ve açık kaynaklı bir grafik düzenleyici olan Inkscape'i indirin.
NOT: Rengi tanımlamak ve RGB verilerini ayıklamak için renk seçici aracına sahip herhangi bir yazılım (genellikle göz damlalığı olarak gösterilir) kullanılabilir. - Inkscape'i açın, Dosya > Aç'a gidin. Adım 4'te çekilen mikroplaka resmini seçin.
- Sol üst tarafta ok olarak gösterilen Nesneleri Seç ve Dönüştür (S) aracını seçin ve resme tıklayın. Kesikli çizgi kenarlığı seçimi gösterir.
- Sol tarafta göz damlalığı olarak gösterilen Görüntüden Renk Seç (D) aracını seçin.
- Bir kuyunun ortasına tıklayın. Alt paneldeki renk ("Dolgu:") buna göre değişecektir. Renge tıklayın ve sağ tarafta bir Dolgu ve Kontur sekmesi açılacaktır.
- Düz Renk açılır menüsünü RGB olarak değiştirin. Her kuyu için mavi ve yeşil kanallar için gösterilen değerleri kaydedin.
- Kaydedilen değerleri kullanarak mavi-yeşil oranını hesaplayın.
NOT: Hesaplama manuel olarak veya R, Microsoft Excel veya GraphPad Prism gibi okuyucu tercihlerinin yazılımı kullanılarak yapılabilir.
7. Standart eğriler oluşturma ve bilinmeyenleri tahmin etme
- Ortalama yeşil-mavi yoğunluk oranını, protein standart konsantrasyonunun bir fonksiyonu olarak çizin.
NOT: Verileri manuel olarak veya R, Microsoft Excel veya GraphPad Prism gibi okuyucu tercihlerinin yazılımını kullanarak çizin. - Her numune ve seyreltme için ortalama yeşil-mavi yoğunluk oranını hesaplayın.
- Numune için elde edilen sinyalin protein standardının doğrusal aralığında olup olmadığını kontrol edin.
- Standart eğrinin minimum veya maksimum değerlerinin altındaki veya üstündeki herhangi bir değeri yok sayın.
- Numunedeki protein miktarını tahmin etmek için standart eğriyi tanımlayan doğrusal denklemi kullanın. Hesaplanan değerleri buna göre seyreltme faktörü ile çarpın.
Sonuçlar
Şekil 4, renk verilerinin çıkarıldığı ve 450 nm ve 590 nm'de absorbansın kaydedildiği bir mikroplakanın resmidir. Burada temsili olarak bildirilen RGB renk verileri, bölüm 5'te açıklandığı gibi otomatik olarak elde edilmiştir. Tipik bir renk verisi modeli, mavi değerlerde bir artış ve kırmızı ve yeşil değerlerde bir azalmadır (Şekil 5). Tüm kuyucuklardaki belirgin yansımaya ve mükemmel hizalanmamış bir mikroplakaya (
Tartışmalar
Bu makale, bir Bradford protein tahlilinden veri kaydetmek, renk verilerini çıkarmak ve yakın zamanda açıklandığı gibi biyolojik örneklerdeki protein seviyelerini doğru bir şekilde ölçmek için bir akıllı telefon kamerası kullanan bir yöntem olan RGBradford'u açıklamaktadır20. Orijinal RGBradford yönteminden bir fark, burada bir ImageJ eklentisi22 ile renk verilerini otomatik olarak elde etmek için bir prosedürün kullanılmış olmasıdır. RGBradfor...
Açıklamalar
Yazarın beyan etmesi gereken herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Ulusal Bilimsel ve Teknolojik Kalkınma Konseyi (CNPq, Brezilya) [hibe numaraları 428048/2018-8 ve 402556/2022-4] ve Brasilia Üniversitesi (Brezilya) tarafından finanse edilmiştir. Yazar, bu araştırmada kullanılan akıllı telefonlarına erişim sağladıkları için Dr. Duarte Nuno Carvalho ve Dr. Evelyn Santos'a (i3s, Porto, Portekiz) teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
Referanslar
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır