需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
RGBradford:使用智能手机相机进行蛋白质定量
摘要
本文提供了一种使用 Bradford 测定法和智能手机作为分析设备进行蛋白质定量的方案。样品中的蛋白质水平可以使用从智能手机拍摄的微孔板图片中提取的颜色数据进行量化。
摘要
蛋白质定量是生命科学研究中必不可少的程序。在其他几种方法中,布拉德福德测定法是最常用的方法之一。由于其广泛应用,Bradford测定法的局限性和优点已被详尽报道,包括对原始方法的多次修改以提高其性能。原始方法的改变之一是使用智能手机相机作为分析仪器。利用Bradford测定条件下存在的三种形式的考马斯亮蓝染料,本文描述了如何使用从单张微孔板图片中提取的颜色数据准确定量样品中的蛋白质。在微孔板中进行测定后,使用智能手机相机拍摄照片,并使用免费的开源图像分析软件应用程序从图片中提取RGB颜色数据。然后,使用未知蛋白质浓度样品的蓝色与绿色强度之比(在RGB标度中)基于标准曲线计算蛋白质含量。使用RGB颜色数据计算的值与使用常规吸光度数据计算的值之间没有显著差异。
引言
无论下游用途如何(例如 ELISA、酶动力学、蛋白质印迹、蛋白质纯化和质谱),蛋白质定量对于生命科学实验室的准确分析都至关重要。除了用作辅助读数(即计算每质量蛋白质的分析物的相对水平)外,样品中的蛋白质水平本身也可以是所需的输出。例如,人们可能对食物资源1 或尿液2 中的蛋白质水平感兴趣。有许多方法可用于测量样品3中的蛋白质浓度,包括直接紫外吸光度读数4、蛋白质-铜螯合5,6、蛋白质-染料结合比色法7和蛋白质-染料结合荧光试验8。在引用次数最多的文献9,10的前三名中,有两篇描述蛋白质测量方法的论文5,7证明了蛋白质定量的相关性。尽管许多作者通过引用非主要参考文献或根本没有引用任何内容而忽略了他们的实际引用,但描述Lowry蛋白测定和Bradford蛋白测定的原始论文各有>200,000次引用10次。
Bradford 检测的受欢迎程度源于其经济性、简单性、速度和灵敏度。该测定基于蛋白质与染料考马斯亮蓝G在酸性条件下的相互作用。在测定条件下(即低pH值),染料以三种形式存在:红色阳离子形式,λmax为470nm;在650 nm处具有λmax的绿色中性形式;以及在590nm处λmax为11,12的蓝色阴离子形式(图1)。阳离子形式在没有蛋白质的情况下占主导地位。当蛋白质与染料相互作用时,它们会稳定蓝色阴离子形式,导致溶液颜色发生明显变化,从棕色变为蓝色。通常,通过分光光度法定量染料蓝色形式浓度的变化,其在590-595nm处的吸光度与测定中的蛋白质量成正比。
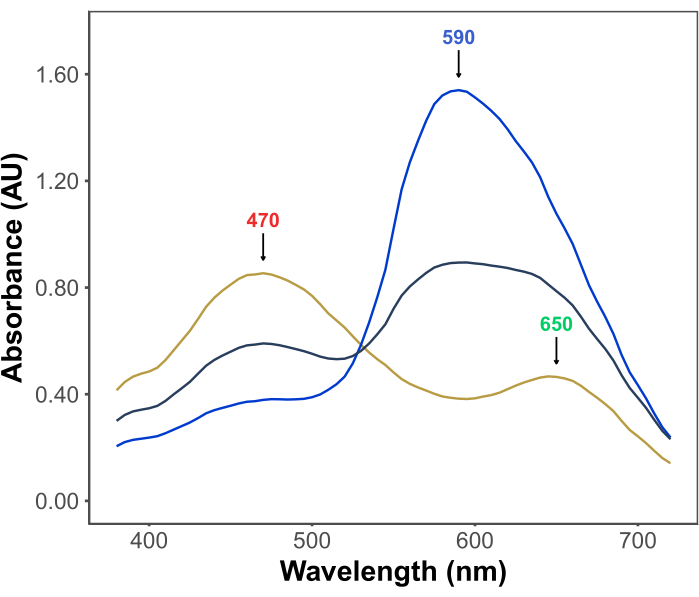
图 1:Bradford 测定条件下的考马斯亮蓝 G 吸收光谱。 三个主峰用箭头标记,表示染料的红色(470 nm)、绿色(650 nm)和蓝色(590 nm)形式的λmax。在没有蛋白质(黄线)和存在 3 μg(灰线)和 10 μg(蓝线)牛血清白蛋白的情况下记录光谱。 请点击这里查看此图的较大版本.
Bradford测定法的广泛使用导致了几个局限性的识别(例如,对不同蛋白质11的可变反应,以及脂质13和洗涤剂7的干扰)以及改进其性能的修饰(例如,添加洗涤剂14,15,碱化14,16和使用吸光度比率17).除了对测定本身的修改外,还描述了使用替代设备(例如智能手机或相机)来捕获分析信号18,19,20。事实上,利用智能手机作为便携式化学分析仪的方法的开发一直是一个活跃的研究领域。使用智能手机的动机源于这些设备的可负担性、便携性、易用性和广泛可用性。
本文提供了一种使用 RGBradford assay20 进行蛋白质定量的方案,该检测使用智能手机作为分析设备。与最初的 RGBradford 出版物20 相比,这里引入了简化颜色提取过程的程序。它涉及使用免费提供的软件应用程序从微孔板图片的每个孔中自动提取颜色信息,从而节省大量时间和精力。这是使用图形编辑器软件应用程序20从每个孔逐个手动获取颜色数据的先前方法的替代方法。最终,可以使用从智能手机拍摄的微孔板图片中提取的颜色数据来量化样品中的蛋白质水平。
研究方案
1. Bradford蛋白测定试剂的制备
- 将 100 mg 考马斯亮蓝 G 溶解在 50 mL 95% (w/v) 乙醇中。混合至考马斯亮蓝G完全溶解。
注意:乙醇易燃,会引起眼睛刺激。避免火焰并使用护目镜。 - 在前面的溶液中,小心地加入 100 mL 85% (w/v) 磷酸。
注意: 磷酸对金属有腐蚀性,会导致皮肤腐蚀、严重的眼睛损伤和急性口腔毒性。戴上手套和护目镜。 - 将含有考马斯亮蓝 G、乙醇和磷酸的溶液缓慢加入 600 mL 去离子水中。
- 将溶液稀释至最终体积为 1,000 mL。根据要分析的样品数量扩大或缩小规模。如原始方法7所述,工作Bradford试剂中的终浓度应为0.01%(w/v)考马斯亮蓝G、4.7%(w/v)乙醇和8.5%(w/v)磷酸。
- 通过滤纸(Whatman #1 纸或同等纸)去除任何不溶性物质过滤。
- 该试剂在室温 (RT) 下储存并避光时可稳定数周。必要时过滤,因为沉淀物可能会随着时间的推移而形成。
注意:或者,市售的即用型 Bradford 试剂也可随手使用。按照制造商的说明制备试剂,然后继续下一步。
2.蛋白质标准溶液的制备
- 制备分离蛋白质的储备溶液(参见步骤2.4)作为标准品使用。牛血清白蛋白 (BSA) 是一种经济实惠且常用的蛋白质。其他选择是卵清蛋白和牛丙种球蛋白。
- 如果已知用作标准品的蛋白质的摩尔吸收率,请在分光光度计中检查储备溶液的浓度。
- 对于 BSA,常用的公式是 BSA (mg/mL) = (A280/6.6) × 10,其中 A280 是相对于适当空白(即ε 2801% = 6.6)7 处的吸光度,光程长度为 1 cm。例如,0.8 mg/mL BSA 在 280 nm 处的吸光度为 0.528。
- 为了生成标准曲线,在0.025 mg / mL和1.0 mg / mL内制备几种稀释的BSA。在每孔添加 10 μL 的样品体积后,每孔将获得 0.25-10 μg BSA。
注意:蛋白质标准溶液应在与用于制备样品的培养基具有相同成分(终浓度)的培养基中制备。
3. 测定
- 稀释样品,使蛋白质浓度达到0.025-1.0mg/mL的标准曲线范围内。在该范围内进行多次(至少 3 次)样品稀释。
注意:样品可以用磷酸盐缓冲盐水 (PBS) 或任何其他与 Bradford 试剂兼容的培养基/缓冲液组合物稀释。标准品和样品之间培养基组分的最终浓度不应有差异。 - 将 10 μL 每种蛋白质标准溶液加入 96 孔微孔板的三个孔(即一式三份)中。对于 0(零)蛋白点,加入 10 μL 用于制备标准溶液和样品稀释液的缓冲液/培养基。
- 在另一组孔中,将每个样品稀释度的 10 μL 加入到相同 96 孔微孔板的三个孔(即一式三份)中。一种方法是添加不同体积的样品,并完成每孔最多 10 μL 的培养基(例如,0.5 μL、1 μL、2 μL、4 μL 和 8 μL 样品加上 9.5 μL、9 μL、8 μL、6 μL 和 2 μL 培养基)。
- 向所有孔中加入 250 μL Bradford 蛋白测定试剂。典型的微孔板设置如 图2所示。在本例中,包括一组含有 260 μL(每孔最终体积)水的空白孔,作为酶标仪中的空白孔(步骤 4.5)。仅当还将收集吸光度数据时,才需要这样做。
注意:每次进行测定时,在同一样品微孔板中制备标准曲线。换言之,如果样品数量需要另一块板,则在第二块板中准备另一条标准曲线,依此类推。 - 在 5-15 分钟内记录结果(第 4 节)。
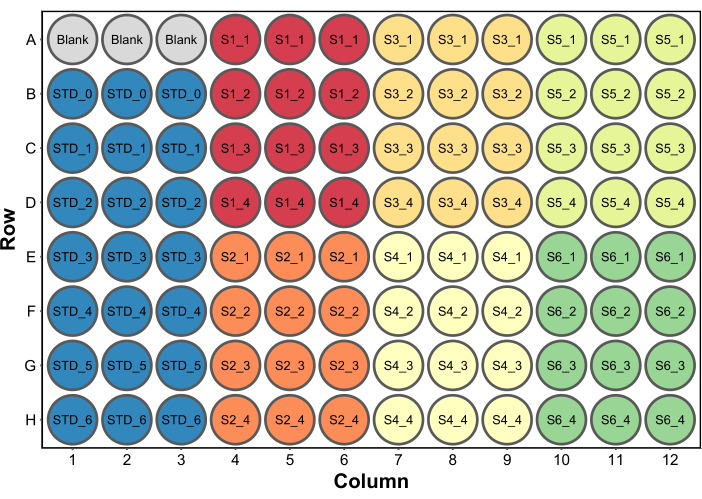
图 2:Bradford 蛋白检测的典型板布局。 空白是指在酶标仪中用作空白的三孔,其中含有 260 μL 水。STD是指蛋白质标准品。S1-S6 是六个不同的样品。SX_1-SX_4是每个样品的四种不同的样品稀释度。 请点击这里查看此图的较大版本.
4. 记录结果
- 在光线充足的房间内,用一只手将微孔板平行于工作台,放在均匀的白色背景(例如,纸张)上。通过在板上放置气泡水平仪来确保准确对齐。
- 另一方面,将智能手机平行握住(某些相机应用程序可以有效地指示设备的倾斜度)到工作台和微孔板上,并拍摄整个微孔板的一张或几张照片(图 3)。在 iOS 设备中,通过启用 网格 选项在相机设置中打开相机电平指示器。在 Android 设备中,通过启用 取景提示来打开相机设置中的相机电平指示器。
- 不需要特殊的照明设备,但要注意避免阴影和反射。例如,避免使用智能手机对印版或背景进行着色,并避免使用微孔板对背景进行着色。井区边缘的小反射不是问题;颜色数据可以从每个孔中心的一个非常小的区域中提取。
- 简要检查图片的背景均匀性、阴影和反射。另外,看看井的角度;每个井的中心应该是直接可见的(即,而不是在井壁后面)。
- 如果需要比较微孔板吸光度读数和图片颜色数据,请在酶标仪21中读取590nm和450nm处的微孔板。

图 3:捕获 Bradford 蛋白检测的结果。 在光线充足的房间中,用一只手将微孔板平行放置在均匀的背景下。另一方面,智能手机平行于工作台和微孔板。 请点击这里查看此图的较大版本.
5.自动提取颜色数据
- 下载 ImageJ 和 ReadPlate22,ImageJ 插件可在 https://imagej.nih.gov/ij/plugins/readplate/index.html 获得(这是一个.txt文件)。
- 打开 ImageJ,单击 Plugins > Install ,然后选择在步骤 6.1 中下载的文件。
- 通过单击 "分析">"设置测量 值"来设置测量参数,然后选中以下选项: 面积;标准差;最小和最大灰度值;平均灰度值;模态灰度值。在窗口底部,将 "重定向为:无 "和 "小数位 (0-9):3"设置为"重定向"。
- 转到 "文件>"打开 ",然后选择步骤4中拍摄的微孔板的图片。
- 转到 ReadPlate >插件。阅读说明,然后单击 "确定"。
- 选择孔数: 96。
- 使用插件自动加载的 矩形选择 工具,制作一个从 A1 孔中心开始到 H12 孔中心结束的矩形。然后,单击 "确定"。
- 选择 "蓝色 "通道,然后单击 "确定"。
- 单击 "确定"确认默认参数。
- 检查软件是否在每个孔内划定了一个区域,以及所选区域是否没有覆盖具有异常阴影或反射的区域。单击 "确定"。
- 保存结果,然后对绿色通道重复步骤 5.8-5.10。
- 使用每种颜色的模式计算蓝绿比。
注意:计算可以手动完成,也可以使用读者首选项的软件完成,例如 R、Microsoft Excel 或 GraphPad Prism。
6. 手动提取颜色数据
- 下载 Inkscape,一个免费的开源图形编辑器。
注意:任何带有颜色选择器工具(通常描述为滴管)的软件都可用于识别颜色并提取 RGB 数据。 - 打开 Inkscape,转到 "文件">"打开"。 选择 在步骤4中拍摄的微孔板的图片。
- 选择 选择和变换对象 (S) 工具,该工具在左上角显示为箭头,然后单击图片。虚线边框将指示选择。
- 选择 从图像中选取颜色 (D) 工具,该工具在左侧显示为吸管。
- 点击一口井的中心。底部面板上的颜色("填充:")将相应更改。单击颜色,右侧将弹出" 填充和描边 "选项卡。
- 将 "纯色 "下拉菜单更改为 "RGB"。记录每个孔的蓝色和绿色通道显示的值。
- 使用记录的值计算蓝绿比。
注意:计算可以手动完成,也可以使用读者首选项的软件完成,例如 R、Microsoft Excel 或 GraphPad Prism。
7. 构建标准曲线并推断未知数
- 绘制平均绿色与蓝色强度比作为蛋白质标准浓度的函数。
注意:手动绘制数据或使用阅读器首选项的软件,例如 R、Microsoft Excel 或 GraphPad Prism。 - 计算每个样品的平均绿蓝强度比和稀释度。
- 检查样品获得的信号是否在蛋白质标准品的线性范围内。
- 忽略低于或高于标准曲线的最小值或最大值的任何值。
- 使用描述标准曲线的线性方程来推断样品中的蛋白质量。相应地将计算值乘以稀释系数。
结果
图4是微孔板的图片,从中提取颜色数据,并记录了450nm和590nm处的吸光度。此处报告的代表性 RGB 颜色数据是自动获取的,如第 5 节所述。颜色数据的典型模式是蓝色值的增加和红色和绿色值的减少(图 5)。请注意,尽管所有孔中都有明显的反射,并且微孔板未完全对齐(图4),但从图片中提取的颜色数据准确地反映了吸光度读...
讨论
本文描述了RGBradford,这是一种使用智能手机摄像头记录来自Bradford蛋白质测定的数据,提取颜色数据并准确定量生物样品中的蛋白质水平的方法,如最近最初描述的那样20。与原始RGBradford方法的一个区别是,这里使用了使用ImageJ插件22 自动获取颜色数据的过程。RGBradford方法的主要新颖之处在于使用RGB数据作为分析信号;因此,人们可以使用实验室中使用的任何?...
披露声明
作者没有利益冲突需要声明。
致谢
这项工作由国家科学技术发展委员会(CNPq,巴西)[资助号428048/2018-8和402556/2022-4]和巴西利亚大学(巴西)资助。作者感谢 Duarte Nuno Carvalho 博士和 Evelyn Santos 博士(i3s,葡萄牙波尔图)提供对他们在本研究中使用的智能手机的访问。
材料
| Name | Company | Catalog Number | Comments |
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
参考文献
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。