È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
RGBradford: quantificazione delle proteine con la fotocamera di uno smartphone
In questo articolo
Riepilogo
Questo documento fornisce un protocollo per la quantificazione delle proteine utilizzando il saggio di Bradford e uno smartphone come dispositivo analitico. I livelli di proteine nei campioni possono essere quantificati utilizzando i dati a colori estratti da un'immagine di una micropiastra scattata con uno smartphone.
Abstract
La quantificazione delle proteine è una procedura essenziale nella ricerca nel campo delle scienze della vita. Tra i molti altri metodi, il test di Bradford è uno dei più utilizzati. A causa della sua diffusione, i limiti e i vantaggi del test di Bradford sono stati riportati in modo esaustivo, comprese diverse modifiche al metodo originale per migliorarne le prestazioni. Una delle modifiche del metodo originale è l'uso della fotocamera di uno smartphone come strumento analitico. Sfruttando le tre forme del colorante Coomassie Brilliant Blue che esistono nelle condizioni del saggio di Bradford, questo documento descrive come quantificare con precisione le proteine nei campioni utilizzando i dati cromatici estratti da una singola immagine di una micropiastra. Dopo aver eseguito il test in una micropiastra, viene scattata un'immagine utilizzando la fotocamera di uno smartphone e i dati di colore RGB vengono estratti dall'immagine utilizzando un'applicazione software di analisi delle immagini gratuita e open-source. Quindi, il rapporto tra l'intensità blu e verde (nella scala RGB) di campioni con concentrazioni sconosciute di proteine viene utilizzato per calcolare il contenuto proteico in base a una curva standard. Non si osserva alcuna differenza significativa tra i valori calcolati utilizzando i dati di colore RGB e quelli calcolati utilizzando i dati di assorbanza convenzionali.
Introduzione
Indipendentemente dall'uso a valle (ad esempio, ELISA, cinetica enzimatica, western blotting, purificazione delle proteine e spettrometria di massa), la quantificazione delle proteine è fondamentale per un'analisi accurata nei laboratori di scienze biologiche. Oltre al loro utilizzo come letture secondarie (ad esempio, per calcolare i livelli relativi di analiti per massa di proteine), i livelli di proteine in un campione possono anche essere l'output desiderato. Ad esempio, si può essere interessati ai livelli di proteine nelle risorse alimentari1 o nelle urine2. Sono disponibili molti metodi per misurare la concentrazione di proteine nei campioni3, tra cui le letture dirette dell'assorbanza UV4, la chelazione proteina-rame 5,6, i saggi colorimetrici di legame proteina-colorante7 e i saggi fluorescenti di legame proteina-colorante8. L'importanza della quantificazione delle proteine è evidenziata dalla presenza di due articoli che descrivono i metodi di misurazione delle proteine 5,7 nella top-3 della letteratura più citata 9,10. Nonostante il fatto che molti autori trascurino la loro citazione effettiva citando riferimenti non primari o non citando nulla, gli articoli originali che descrivono il saggio della proteina di Lowry e il saggio della proteina di Bradford ammontano > 200.000 citazioni ciascuno10.
La popolarità del test di Bradford deriva dalla sua convenienza, semplicità, velocità e sensibilità. Il test si basa sull'interazione tra le proteine e il colorante Coomassie Brilliant Blue G in condizioni acide. Nelle condizioni del saggio (cioè pH basso), il colorante esiste in tre forme: una forma cationica rossa con λmax a 470 nm; una forma neutra verde con λmax a 650 nm; e una forma anionica blu con λmax a 590 nm11,12 (Figura 1). La forma cationica predomina in assenza di proteine. Quando le proteine interagiscono con il colorante, stabilizzano la forma anionica blu, causando un notevole cambiamento nel colore della soluzione, da brunastro a blu. Di solito, la variazione della concentrazione della forma blu del colorante viene quantificata spettrofotometricamente, la cui assorbanza a 590-595 nm è proporzionale alla quantità di proteina nel saggio.
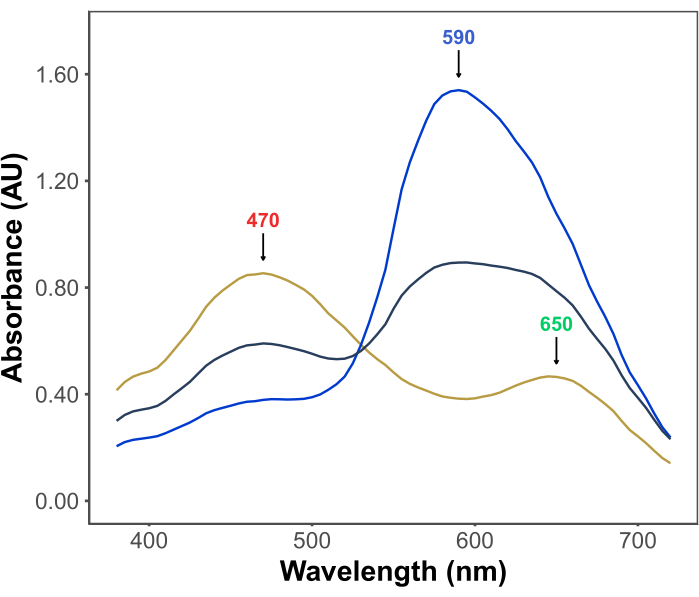
Figura 1: Spettri di assorbimento G blu brillante di Coomassie nelle condizioni del saggio di Bradford. I tre picchi principali sono contrassegnati da frecce che indicano il λmax delle forme rossa (470 nm), verde (650 nm) e blu (590 nm) del colorante. Gli spettri sono stati registrati in assenza di proteine (linea gialla) e in presenza di 3 μg (linea grigia) e 10 μg (linea blu) di albumina sierica bovina. Fare clic qui per visualizzare una versione più grande di questa figura.
L'uso diffuso del saggio di Bradford ha portato all'identificazione di diverse limitazioni (ad esempio, risposte variabili a diverse proteine11 e interferenza da parte di lipidi13 e detergenti7) e allo sviluppo di modifiche per migliorarne le prestazioni (ad esempio, l'aggiunta di detergenti14,15, l'alcalinizzazione14,16 e l'uso del rapporto di assorbanza17). Oltre alle modifiche nel saggio stesso, è stato descritto anche l'uso di dispositivi alternativi, come smartphone o fotocamere, per catturare i segnali analitici 18,19,20. In effetti, lo sviluppo di metodi che utilizzano gli smartphone come analizzatori chimici portatili è stata un'area di ricerca attiva. La motivazione per l'uso degli smartphone deriva dall'accessibilità, dalla portabilità, dalla facilità d'uso e dall'ampia disponibilità di questi dispositivi.
Questo documento fornisce un protocollo per la quantificazione delle proteine utilizzando il saggio RGBradford20, che utilizza uno smartphone come dispositivo analitico. A differenza della pubblicazione originaleRGBradford 20, qui è stata introdotta una procedura che semplifica il processo di estrazione del colore. Comporta l'utilizzo di un'applicazione software disponibile gratuitamente per estrarre automaticamente le informazioni sul colore da ciascun pozzetto di un'immagine per micropiastre, risparmiando tempo e fatica significativi. Si tratta di un'alternativa al metodo precedente di acquisizione manuale dei dati di colore da ciascun pozzetto uno per uno utilizzando un'applicazione software di editor grafico20. In definitiva, i livelli di proteine nei campioni possono essere quantificati utilizzando i dati a colori estratti da un'immagine di una micropiastra scattata con uno smartphone.
Protocollo
1. Preparazione del reagente del saggio della proteina Bradford
- Sciogliere 100 mg di Coomassie Brilliant Blue G in 50 mL di etanolo al 95% (p/v). Mescolare fino a quando Coomassie Brilliant Blue G non si è completamente sciolto.
ATTENZIONE: L'etanolo è infiammabile e provoca irritazione agli occhi. Evitare le fiamme e utilizzare gli occhiali. - Alla soluzione precedente, aggiungere con cautela 100 mL di acido fosforico all'85% (p/v).
ATTENZIONE: L'acido fosforico è corrosivo per i metalli e provoca corrosione cutanea, gravi danni agli occhi e tossicità orale acuta. Indossare guanti e occhiali. - Aggiungere lentamente la soluzione contenente Coomassie Brilliant Blue G, etanolo e acido fosforico a 600 ml di acqua deionizzata.
- Diluire la soluzione fino a ottenere un volume finale di 1.000 ml. Scalare verso l'alto o verso il basso in base al numero di campioni da analizzare. Come descritto nel metodo originale7, le concentrazioni finali nel reagente Bradford di lavoro devono essere dello 0,01% (p/v) di Coomassie Brilliant Blue G, del 4,7% (p/v) di etanolo e dell'8,5% (p/v) di acido fosforico.
- Rimuovere qualsiasi materiale insolubile filtrante attraverso la carta da filtro (carta Whatman #1 o equivalente).
- Il reagente è stabile per diverse settimane se conservato a temperatura ambiente (RT) e protetto dalla luce. Filtrare se necessario poiché i precipitati possono formarsi nel tempo.
NOTA: In alternativa, sono disponibili in commercio reagenti Bradford pronti per la diluizione e l'uso. Seguire le istruzioni del produttore per la preparazione del reagente e procedere al passaggio successivo.
2. Preparazione di soluzioni proteiche standard
- Preparare una soluzione madre (fare riferimento al punto 2.4) di una proteina isolata da utilizzare come standard. Una proteina economica e comunemente usata è l'albumina sierica bovina (BSA). Altre opzioni sono l'ovoalbumina e le gammaglobuline bovine.
- Se l'assorbimento molare della proteina utilizzata come standard è noto, controllare la concentrazione della soluzione madre in uno spettrofotometro.
- Per la BSA, una formula comunemente usata è BSA (mg/mL) = (A280/6,6) × 10, dove A280 è l'assorbanza a 280 nm con una lunghezza del cammino di 1 cm letta su un bianco appropriato (cioè ε2801% = 6,6)7. Ad esempio, 0,8 mg/mL di BSA ha un'assorbanza di 0,528 a 280 nm.
- Per generare la curva standard, preparare diverse diluizioni di BSA entro 0,025 mg/mL e 1,0 mg/mL. Questi si tradurranno in 0,25-10 μg di BSA per pozzetto dopo l'aggiunta di un volume di campione di 10 μL per pozzetto.
NOTA: Le soluzioni proteiche standard devono essere preparate in un terreno con la stessa composizione (concentrazione finale) del terreno utilizzato per preparare i campioni.
3. Saggio
- Diluire i campioni per ottenere una concentrazione proteica all'interno dell'intervallo della curva standard di 0,025-1,0 mg/mL. Avere diverse (almeno 3) diluizioni del campione all'interno dell'intervallo.
NOTA: I campioni possono essere diluiti con soluzione salina tamponata con fosfato (PBS) o qualsiasi altra composizione di terreno/tampone compatibile con il reagente Bradford. La concentrazione finale dei componenti del mezzo non deve differire tra lo standard e i campioni. - Aggiungere 10 μL di ciascuna soluzione proteica standard a tre pozzetti (cioè in triplice copia) di una micropiastra a 96 pozzetti. Per il punto 0 (zero) della proteina, aggiungere 10 μL del tampone/terreno utilizzato per preparare le soluzioni standard e le diluizioni del campione.
- A un'altra serie di pozzetti, aggiungere 10 μL di ciascuna diluizione del campione a tre pozzetti (cioè in triplice copia) della stessa micropiastra a 96 pozzetti. Un approccio consiste nell'aggiungere diversi volumi di un campione e completarlo con un terreno fino a 10 μL per pozzetto (ad esempio, 0,5 μL, 1 μL, 2 μL, 4 μL e 8 μL del campione più 9,5 μL, 9 μL, 8 μL, 6 μL e 2 μL di terreno).
- Aggiungere 250 μL di reagente per il test delle proteine di Bradford a tutti i pozzetti. Una tipica configurazione della micropiastra è mostrata nella Figura 2. In questo esempio, è stato incluso un set di pozzetti vuoti contenenti 260 μL (il volume finale per pozzetto) di acqua da utilizzare come bianco in un lettore di micropiastre (passaggio 4.5). Questo è necessario solo se verranno raccolti anche dati sull'assorbanza.
NOTA: Preparare una curva standard nella stessa micropiastra di campioni ogni volta che viene eseguito il test. In altre parole, se il numero di campioni richiede un'altra piastra, preparare un'altra curva standard nella seconda piastra e così via. - Registrare i risultati (sezione 4) entro 5-15 minuti.
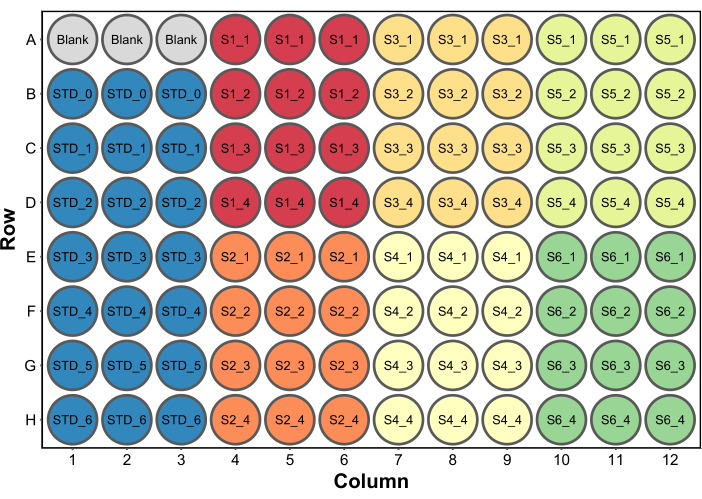
Figura 2: Un tipico layout di piastra per il saggio delle proteine di Bradford. Il bianco si riferisce a tre pozzetti contenenti 260 μL di acqua da utilizzare come bianco in un lettore di micropiastre. STD si riferisce agli standard proteici. S1-S6 sono sei campioni diversi. SX_1-SX_4 sono quattro diverse diluizioni del campione per ogni campione. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Registrazione dei risultati
- In una stanza ben illuminata, tenere la micropiastra parallela al banco su uno sfondo bianco uniforme (ad es. un foglio di carta) con una mano. Garantire un allineamento accurato posizionando una livella a bolla sulla piastra.
- Con l'altra mano, tenere lo smartphone parallelamente (alcune applicazioni della fotocamera indicano utilmente l'inclinazione del dispositivo) al banco e alla micropiastra e scattare una o più foto dell'intera micropiastra (Figura 3). Nei dispositivi iOS, attiva l'indicatore del livello della fotocamera nelle impostazioni della fotocamera abilitando l'opzione Griglia . Nei dispositivi Android, attiva l'indicatore del livello della fotocamera nelle impostazioni della fotocamera abilitando i suggerimenti per l'inquadratura.
- Non è necessario alcun apparecchio di illuminazione speciale, ma fare attenzione ad evitare ombre e riflessi. Ad esempio, evitare di ombreggiare la piastra o lo sfondo con lo smartphone ed evitare di ombreggiare lo sfondo con la micropiastra. Piccoli riflessi nei bordi dell'area del pozzo non sono un problema; I dati cromatici possono essere estratti da un'area molto piccola al centro di ciascun pozzetto.
- Controlla brevemente l'immagine per l'uniformità dello sfondo, le ombre e i riflessi. Inoltre, dai un'occhiata all'angolo dei pozzi; Il centro di ogni pozzo dovrebbe essere direttamente visibile (cioè non dietro le pareti del pozzo).
- Se si desidera confrontare le letture dell'assorbanza delle micropiastre e i dati sui colori dell'immagine, leggere la micropiastra a 590 nm e 450 nm in un lettore per micropiastre21.

Figura 3: Acquisizione dei risultati del saggio della proteina di Bradford. In una stanza ben illuminata, la micropiastra viene posizionata parallelamente al banco su uno sfondo uniforme con una mano. Con l'altra mano, lo smartphone viene tenuto parallelamente al banco e alla micropiastra. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Estrazione automatica dei dati di colore
- Scarica ImageJ e ReadPlate22, un plugin per ImageJ è disponibile su https://imagej.nih.gov/ij/plugins/readplate/index.html (questo è un file .txt).
- Aprire ImageJ, fare clic su Plugins > Install e selezionare il file scaricato al punto 6.1.
- Impostare i parametri di misurazione facendo clic su Analizza > Imposta misurazioni e selezionare le seguenti opzioni: Area; Deviazione standard; Valore minimo e massimo del grigio; Valore medio del grigio; Valore del grigio modale. Nella parte inferiore della finestra, imposta Reindirizza su: Nessuno e Posizioni decimali (0-9): 3.
- Andare su File > Open e selezionare l'immagine della micropiastra scattata al punto 4.
- Vai su Plugin > ReadPlate. Leggere le istruzioni e fare clic su OK.
- Selezionare il numero di pozzetti: 96.
- Utilizzando lo strumento di selezione rettangolare caricato automaticamente dal plugin, crea un rettangolo che inizia al centro del pozzetto A1 e termina al centro del pozzetto H12. Quindi, fare clic su OK.
- Selezionare il canale blu e fare clic su OK.
- Confermare i parametri predefiniti facendo clic su OK.
- Controlla se il software ha delineato un'area all'interno di ciascun pozzetto e se le aree selezionate non coprono aree con ombre o riflessi anomali. Fare clic su OK.
- Salvare i risultati e ripetere i passaggi 5.8-5.10 per il canale verde.
- Calcola il rapporto blu-verde utilizzando la modalità per ciascun colore.
NOTA: Il calcolo può essere eseguito manualmente o utilizzando il software delle preferenze del lettore, come R, Microsoft Excel o GraphPad Prism.
6. Estrazione manuale dei dati di colore
- Scarica Inkscape, un editor grafico gratuito e open-source.
NOTA: Qualsiasi software con lo strumento di selezione del colore (di solito raffigurato come un contagocce) può essere utilizzato per identificare il colore ed estrarre i dati RGB. - Apri Inkscape, vai su File > Apri. Selezionare l'immagine della micropiastra scattata al punto 4.
- Scegliete lo strumento Seleziona e Trasforma Oggetti (S), raffigurato come una freccia in alto a sinistra, e fate clic sull'immagine. Un bordo tratteggiato indicherà la selezione.
- Selezionate lo strumento Scegli colori dall'immagine (D), raffigurato come un contagocce sul lato sinistro.
- Fare clic al centro di un pozzo. Il colore sul pannello inferiore ("Riempimento:") cambierà di conseguenza. Fai clic sul colore e sul lato destro verrà visualizzata una scheda Riempimento e traccia .
- Cambia il menu a discesa Colore piatto in RGB. Registrare i valori mostrati per i canali blu e verde per ciascun pozzetto.
- Calcolare il rapporto blu-verde utilizzando i valori registrati.
NOTA: Il calcolo può essere eseguito manualmente o utilizzando il software delle preferenze del lettore, come R, Microsoft Excel o GraphPad Prism.
7. Costruire curve standard ed estrapolare incognite
- Tracciare il rapporto medio di intensità verde-blu in funzione della concentrazione standard della proteina.
NOTA: Tracciare i dati manualmente o utilizzando il software delle preferenze del lettore, ad esempio R, Microsoft Excel o GraphPad Prism. - Calcolare il rapporto medio di intensità verde-blu per ciascun campione e diluizione.
- Verificare se il segnale ottenuto per il campione si trova all'interno dell'intervallo lineare dello standard proteico.
- Ignorate qualsiasi valore al di sotto o al di sopra dei valori minimo o massimo della curva standard.
- Utilizzare l'equazione lineare che descrive la curva standard per estrapolare la quantità di proteine nel campione. Moltiplicare di conseguenza i valori calcolati per il fattore di diluizione.
Risultati
La Figura 4 è un'immagine di una micropiastra da cui sono stati estratti i dati cromatici ed è stata registrata l'assorbanza a 450 nm e 590 nm. I dati di colore RGB qui riportati come rappresentativi sono stati ottenuti automaticamente come descritto nella sezione 5. Un modello tipico dei dati di colore è un aumento dei valori del blu e una diminuzione dei valori del rosso e del verde (Figura 5). Si noti che, nonostante l'evidente riflesso in tutti i pozzetti...
Discussione
Questo documento descrive RGBradford, un metodo che utilizza la fotocamera di uno smartphone per registrare i dati di un test proteico Bradford, estrarre i dati cromatici e quantificare con precisione i livelli di proteine nei campioni biologici, come originariamente descritto di recente20. Una differenza rispetto al metodo originale RGBradford è che in questo caso è stata utilizzata una procedura per ottenere automaticamente i dati di colore con un plug-in ImageJ22 . La ...
Divulgazioni
L'autore non ha conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato finanziato dal Consiglio Nazionale per lo Sviluppo Scientifico e Tecnologico (CNPq, Brasile) [numeri di sovvenzione 428048/2018-8 e 402556/2022-4] e dall'Università di Brasilia (Brasile). L'autore ringrazia il Dr. Duarte Nuno Carvalho e la Dr.ssa Evelyn Santos (i3s, Porto, Portogallo) per aver fornito l'accesso ai loro smartphone utilizzati in questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
Riferimenti
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon