É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
RGBradford: Quantificação de proteínas com uma câmera de smartphone
Neste Artigo
Resumo
Este trabalho fornece um protocolo para quantificação de proteínas usando o ensaio de Bradford e um smartphone como dispositivo analítico. Os níveis de proteína nas amostras podem ser quantificados usando dados de cor extraídos de uma foto de uma microplaca tirada com um smartphone.
Resumo
A quantificação de proteínas é um procedimento essencial na pesquisa em ciências da vida. Dentre vários outros métodos, o ensaio de Bradford é um dos mais utilizados. Devido à sua difusão, as limitações e vantagens do ensaio de Bradford foram exaustivamente relatadas, incluindo várias modificações do método original para melhorar seu desempenho. Uma das alterações do método original é o uso de uma câmera de smartphone como instrumento analítico. Aproveitando as três formas do corante Coomassie Brilliant Blue que existem nas condições do ensaio de Bradford, este artigo descreve como quantificar com precisão a proteína em amostras usando dados de cor extraídos de uma única imagem de uma microplaca. Depois de realizar o ensaio em uma microplaca, uma foto é tirada usando uma câmera de smartphone, e os dados de cor RGB são extraídos da imagem usando um aplicativo de software de análise de imagem gratuito e de código aberto. Em seguida, a razão entre a intensidade azul e verde (na escala RGB) de amostras com concentrações desconhecidas de proteína é usada para calcular o conteúdo proteico com base em uma curva padrão. Não há diferença significativa entre os valores calculados com dados de cor RGB e aqueles calculados com dados convencionais de absorbância.
Introdução
Independentemente do uso a jusante (por exemplo, ELISA, cinética enzimática, western blotting, purificação de proteínas e espectrometria de massa), a quantificação de proteínas é crucial para análises precisas em laboratórios de ciências da vida. Além de seu uso como leituras secundárias (ou seja, para calcular níveis relativos de analitos por massa de proteína), os níveis de proteína em uma amostra também podem ser a saída desejada em si. Por exemplo, pode-se estar interessado nos níveis de proteína nos recursos alimentares1 ou na urina2. Existem muitos métodos disponíveis para medir a concentração de proteínas em amostras3, incluindo leituras diretas de absorbância UV4, quelação proteína-cobre 5,6, ensaios colorimétricos de ligação proteína-corante7 e ensaios fluorescentes de ligação proteína-corante8. A relevância da quantificação de proteínas é evidenciada pela presença de dois trabalhos descrevendo métodos de dosagem deproteínas5,7 no top-3 da literatura maiscitada9,10. Apesar do fato de que muitos autores negligenciam sua citação real citando referências não primárias ou não citando nada, os artigos originais descrevendo o ensaio de proteína de Lowry e o ensaio de proteína de Bradford totalizam > 200.000 citações a cada10.
A popularidade do ensaio de Bradford deriva de sua acessibilidade, simplicidade, velocidade e sensibilidade. O ensaio é baseado na interação entre proteínas e o corante Coomassie Brilliant Blue G sob condições ácidas. Sob as condições do ensaio (isto é, pH baixo), o corante existe em três formas: uma forma catiônica vermelha com λmax a 470 nm; uma forma neutra verde com λmax a 650 nm; e uma forma aniônica azul com λmax a 590 nm11,12 (Figura 1). A forma catiônica predomina na ausência de proteínas. À medida que as proteínas interagem com o corante, elas estabilizam a forma aniônica azul, causando uma mudança perceptível na cor da solução, de acastanhada para azul. Normalmente, a mudança na concentração da forma azul do corante é quantificada espectrofotometricamente, cuja absorbância a 590-595 nm é proporcional à quantidade de proteína no ensaio.
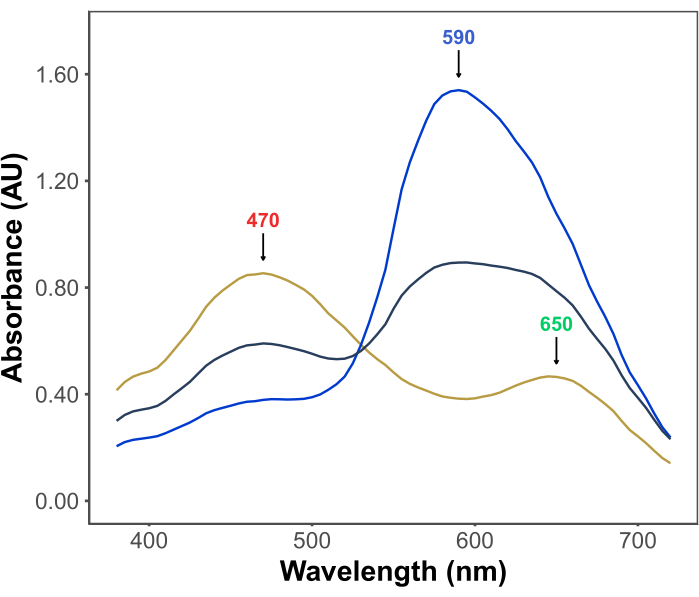
Figura 1: Espectros de absorção de Coomassie azul brilhante G nas condições do ensaio de Bradford. Os três picos principais são marcados com setas indicando o λmax das formas vermelha (470 nm), verde (650 nm) e azul (590 nm) do corante. Os espectros foram registrados na ausência de proteína (linha amarela) e na presença de 3 μg (linha cinza) e 10 μg (linha azul) de albumina de soro bovino. Clique aqui para ver uma versão maior desta figura.
O amplo uso do ensaio de Bradford levou à identificação de várias limitações (por exemplo, respostas variáveis a diferentes proteínas11 e interferência de lipídios13 e detergentes7) e ao desenvolvimento de modificações para melhorar seu desempenho (por exemplo, adição de detergentes14,15, alcalinização14,16 e uso da razão de absorbâncias17). Além das modificações no próprio ensaio, também tem sido descrito o uso de dispositivos alternativos, como smartphones ou câmeras, para captação de sinais analíticos 18,19,20. De fato, o desenvolvimento de métodos que fazem uso de smartphones como analisadores químicos portáteis tem sido uma área ativa de pesquisa. A motivação para o uso de smartphones decorre da acessibilidade, portabilidade, facilidade de uso e ampla disponibilidade desses dispositivos.
Este trabalho fornece um protocolo para quantificação de proteínas usando o ensaio RGBradford20, que usa um smartphone como dispositivo analítico. Em contraste com a publicação RGBradford original20, aqui, um procedimento que agiliza o processo de extração de cores foi introduzido. Envolve a utilização de um aplicativo de software disponível gratuitamente para extrair informações de cor de cada poço de uma imagem de microplaca automaticamente, economizando tempo e esforço significativos. Esta é uma alternativa ao método anterior de aquisição manual de dados de cores de cada poço, um a um, usando um aplicativo de software editor gráfico20. Em última análise, os níveis de proteína em amostras podem ser quantificados usando dados de cor extraídos de uma foto de uma microplaca tirada com um smartphone.
Protocolo
1. Preparação do reagente para ensaio de proteína de Bradford
- Dissolver 100 mg de Coomassie Brilliant Blue G em 50 mL de etanol 95% (p/v). Misture até que o Coomassie Brilliant Blue G esteja completamente dissolvido.
CUIDADO: O etanol é inflamável e causa irritação ocular. Evite chamas e use óculos. - À solução anterior, adicionar cuidadosamente 100 ml de ácido fosfórico a 85% (p/v).
CUIDADO: O ácido fosfórico é corrosivo para metais e causa corrosão cutânea, danos oculares graves e toxicidade oral aguda. Use luvas e óculos. - Adicionar lentamente a solução contendo Coomassie Brilliant Blue G, etanol e ácido fosfórico a 600 mL de água deionizada.
- Diluir a solução para um volume final de 1.000 mL. Aumente ou diminua de acordo com o número de amostras a serem analisadas. Conforme descrito no método original7, as concentrações finais no reagente de Bradford de trabalho devem ser 0,01% (p/v) de Coomassie Brilliant Blue G, 4,7% (p/v) de etanol e 8,5% (p/v) de ácido fosfórico.
- Remova qualquer material insolúvel filtrando através de papel de filtro (papel Whatman #1 ou equivalente).
- O reagente é estável por várias semanas quando armazenado à temperatura ambiente (TR) e protegido da luz. Filtre conforme necessário, pois precipitados podem se formar ao longo do tempo.
NOTA: Alternativamente, reagentes Bradford prontos para diluir e usar estão comercialmente disponíveis. Siga as instruções do fabricante para preparar o reagente e prossiga para a próxima etapa.
2. Preparação de soluções-padrão proteicas
- Preparar uma solução-mãe (ver passo 2.4) de uma proteína isolada a utilizar como padrão. Uma proteína acessível e comumente usada é a albumina de soro bovino (BSA). Outras opções são a ovalbumina e a gamaglobulina bovina.
- Se a absortividade molar da proteína utilizada como padrão for conhecida, verifique a concentração da solução-mãe em espectrofotômetro.
- Para a SCQ, uma fórmula comumente usada é a BSA (mg/mL) = (A280/6,6) × 10, onde A280 é a absorbância a 280 nm com um comprimento de trajetória de 1 cm lido contra um branco apropriado (ou seja,ε 2801% = 6,6)7. Por exemplo, 0,8 mg/mL de BSA tem uma absorbância de 0,528 a 280 nm.
- Para gerar a curva padrão, preparar várias diluições de BSA dentro de 0,025 mg/mL e 1,0 mg/mL. Isso resultará em 0,25-10 μg de BSA por poço após a adição de um volume de amostra de 10 μL por poço.
NOTA: As soluções-padrão proteicas devem ser preparadas num meio com a mesma composição (concentração final) do meio utilizado para preparar as amostras.
3. Ensaio
- Diluir as amostras para obter uma concentração de proteína dentro do intervalo de curva padrão de 0,025-1,0 mg/mL. Ter várias (pelo menos 3) diluições de amostra dentro do intervalo.
NOTA: As amostras podem ser diluídas com solução salina tamponada com fosfato (PBS) ou qualquer outra composição de meio/tampão compatível com o reagente de Bradford. A concentração final dos componentes do meio não deve diferir entre as amostras padrão e as amostras. - Adicionar 10 μL de cada solução padrão proteica a três poços (isto é, em triplicata) de uma microplaca de 96 poços. Para o ponto de proteína 0 (zero), adicionar 10 μL do tampão/meio utilizado para preparar as soluções-padrão e as diluições das amostras.
- A outro conjunto de poços, adicionar 10 μL de cada diluição da amostra a três poços (isto é, em triplicata) da mesma microplaca de 96 poços. Uma abordagem é adicionar diferentes volumes de uma amostra e completar com um meio de até 10 μL por poço (por exemplo, 0,5 μL, 1 μL, 2 μL, 4 μL e 8 μL da amostra mais 9,5 μL, 9 μL, 8 μL, 6 μL e 2 μL de meio).
- Adicionar 250 μL de reagente de ensaio de proteína de Bradford a todos os poços. Uma configuração típica de microplaca é mostrada na Figura 2. Neste exemplo, um conjunto de poços em branco contendo 260 μL (o volume final por poço) de água foi incluído para servir como branco em um leitor de microplacas (passo 4.5). Isso é necessário apenas se os dados de absorbância também forem coletados.
NOTA: Preparar uma curva padrão na mesma microplaca de amostras cada vez que o ensaio for realizado. Em outras palavras, se o número de amostras exigir outra placa, prepare outra curva padrão na segunda placa, e assim por diante. - Registre os resultados (seção 4) dentro de 5-15 min.
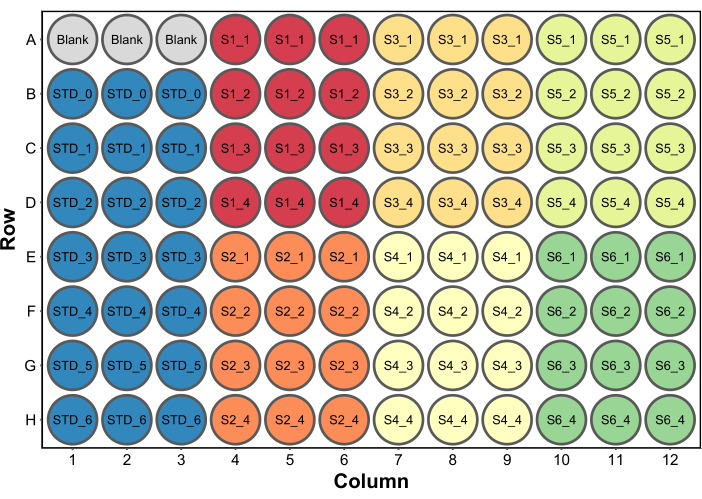
Figura 2: Layout típico da placa para o ensaio de proteína de Bradford. Blank refere-se a três poços contendo 260 μL de água para ser usado como branco em um leitor de microplacas. DST refere-se a padrões proteicos. S1-S6 são seis amostras diferentes. SX_1-SX_4 são quatro diluições de amostra diferentes para cada amostra. Clique aqui para ver uma versão maior desta figura.
4. Registro dos resultados
- Em uma sala bem iluminada, segure a microplaca paralela ao banco contra um fundo branco uniforme (por exemplo, uma folha de papel) com uma mão. Garanta um alinhamento preciso colocando um nível de bolha na placa.
- Com a outra mão, segure o smartphone paralelamente (alguns aplicativos de câmera indicam utilmente a inclinação do dispositivo) à bancada e à microplaca e tire uma ou várias fotos de toda a microplaca (Figura 3). Em dispositivos iOS, ative o indicador de nível da câmera nas configurações da câmera ativando a opção Grade . Em dispositivos Android, ative o indicador de nível da câmera nas configurações da câmera ativando as Dicas de enquadramento.
- Nenhum aparato de iluminação especial é necessário, mas tome cuidado para evitar sombras e reflexos. Por exemplo, evite sombrear a placa ou o fundo com o smartphone e evite sombrear o fundo com a microplaca. Pequenos reflexos nas bordas da área do poço não são um problema; Os dados de cor podem ser extraídos de uma área muito pequena no centro de cada poço.
- Verifique brevemente a uniformidade do plano de fundo, sombras e reflexos. Além disso, dê uma olhada no ângulo dos poços; O centro de cada poço deve ser diretamente visível (ou seja, não atrás das paredes do poço).
- Se a comparação entre as leituras de absorbância da microplaca e os dados de cor da imagem for desejada, leia a microplaca a 590 nm e 450 nm em um leitor de microplacas21.

Figura 3: Captura dos resultados do ensaio da proteína de Bradford. Em uma sala bem iluminada, a microplaca é posicionada paralelamente ao banco contra um fundo uniforme com uma mão. Com a outra mão, o smartphone é mantido em paralelo à bancada e à microplaca. Clique aqui para ver uma versão maior desta figura.
5. Extraindo dados de cor - Automaticamente
- Download ImageJ e ReadPlate22, um plugin ImageJ está disponível em https://imagej.nih.gov/ij/plugins/readplate/index.html (este é um arquivo .txt).
- Abra o ImageJ, clique em Plugins > Install e selecione o arquivo baixado na etapa 6.1.
- Defina os parâmetros de medição clicando em Analisar > Definir Medidas e marque as seguintes opções: Área; Desvio padrão; Valor mínimo de cinza & máximo; Valor médio de cinza; Valor de cinza modal. Na parte inferior da janela, defina Redirecionar para: Nenhum e Casas decimais (0-9): 3.
- Vá para Arquivo > Abrir e selecione a foto da microplaca tirada na etapa 4.
- Vá para Plugins > ReadPlate. Leia as instruções e clique em OK.
- Selecione o número de poços: 96.
- Usando a ferramenta de seleção retangular carregada automaticamente pelo plugin, faça um retângulo começando no centro do poço A1 e terminando no centro do poço H12. Em seguida, clique em OK.
- Selecione o canal Azul e clique em OK.
- Confirme os parâmetros padrão clicando em OK.
- Verifique se o software delineou uma área dentro de cada poço e se as áreas selecionadas não estão cobrindo áreas com sombras ou reflexos anormais. Clique em OK.
- Salve os resultados e repita as etapas 5.8-5.10 para o canal verde.
- Calcule a proporção azul-verde usando o modo para cada cor.
NOTA: O cálculo pode ser feito manualmente ou usando o software das preferências do leitor, como R, Microsoft Excel ou GraphPad Prism.
6. Extraindo dados de cor manualmente
- Baixe o Inkscape, um editor gráfico gratuito e de código aberto.
NOTA: Qualquer software com a ferramenta de seleção de cores (geralmente representada como um conta-gotas) pode ser usado para identificar a cor e extrair dados RGB. - Abra o Inkscape, vá para Arquivo > Abrir. Selecione a foto da microplaca tirada na Etapa 4.
- Escolha a ferramenta Selecionar e Transformar Objetos (S), que é representada como uma seta no lado superior esquerdo, e clique na imagem. Uma borda de linha tracejada indicará a seleção.
- Selecione a ferramenta Escolher cores da imagem (D), que é representada como um conta-gotas no lado esquerdo.
- Clique no centro de um poço. A cor no painel inferior ("Preenchimento:") mudará de acordo. Clique na cor e uma guia Preenchimento e traçado aparecerá no lado direito.
- Altere o menu suspenso Cor plana para RGB. Registre os valores mostrados para os canais azul e verde para cada poço.
- Calcule a proporção azul-verde usando os valores registrados.
NOTA: O cálculo pode ser feito manualmente ou usando o software das preferências do leitor, como R, Microsoft Excel ou GraphPad Prism.
7. Construindo curvas padrão e extrapolando incógnitas
- Plotar a razão média de intensidade verde-azul em função da concentração padrão de proteína.
Observação : plotar os dados manualmente ou usando o software das preferências do leitor, como R, Microsoft Excel ou GraphPad Prism. - Calcular a relação média entre a intensidade verde/azul para cada amostra e diluição.
- Verificar se o sinal obtido para a amostra está dentro da faixa linear do padrão proteico.
- Ignore qualquer valor abaixo ou acima dos valores mínimo ou máximo da curva padrão.
- Use a equação linear que descreve a curva padrão para extrapolar a quantidade de proteína na amostra. Multiplique os valores calculados pelo factor de diluição em conformidade.
Resultados
A Figura 4 é a figura de uma microplaca da qual foram extraídos dados de cor, e a absorbância a 450 nm e 590 nm foi registrada. Os dados de cor RGB aqui relatados como representativos foram obtidos automaticamente conforme descrito na seção 5. Um padrão típico de dados de cores é um aumento nos valores de azul e uma diminuição nos valores de vermelho e verde (Figura 5). Observe que, apesar da reflexão evidente em todos os poços e de uma microplaca n?...
Discussão
Este artigo descreve o RGBradford, um método que usa uma câmera de smartphone para gravar dados de um ensaio de proteína de Bradford, extrair dados de cor e quantificar com precisão os níveis de proteína em amostras biológicas, como originalmente descrito recentemente20. Uma diferença em relação ao método RGBradford original é que aqui foi usado um procedimento para obter dados de cores automaticamente com um plugin ImageJ22 . A principal novidade do método RGB...
Divulgações
O autor declara não haver conflitos de interesse.
Agradecimentos
Este trabalho foi financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasil) [processos 428048/2018-8 e 402556/2022-4] e pela Universidade de Brasília (Brasil). O autor agradece ao Dr. Duarte Nuno Carvalho e à Dra. Evelyn Santos (i3s, Porto, Portugal) pelo acesso aos seus smartphones utilizados nesta investigação.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
Referências
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados