A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أغماد الذرة المنفصلة لتصوير الخلايا الحية للعدوى بمسببات أمراض الذرة الورقية الفطرية
In This Article
Summary
تفصل هذه المخطوطة بروتوكول التلقيح الأمثل الذي يستخدم أغماد أوراق الذرة المنفصلة للدراسات الخلوية والفسيولوجية والجزيئية القابلة للتكرار لتفاعلات الذرة مع مسببات الأمراض النباتية الفطرية. تسهل أغماد الأوراق المراقبة في الوقت الفعلي للتفاعلات الخلوية بين النبات الحي والفطريات في الأنسجة غير الثابتة.
Abstract
لقد قمنا بتحسين بروتوكول لتلقيح أغماد أوراق الذرة بالفطريات المسببة للأمراض الورقية ذاتية التغذية والميتة. تم تعديل الطريقة من طريقة تم تطبيقها في الأصل على أغلفة أوراق الأرز وتسمح بالمراقبة المجهرية المباشرة لنمو الفطريات وتطورها في الخلايا النباتية الحية. يتم تلقيح أغماد الأوراق التي يتم جمعها من شتلات الذرة مع اثنين من أطواق الأوراق الناشئة بالكامل بقطرات 20 ميكرولتر من 5 × 105 جراثيم / مل معلقات جراثيم فطرية وحضنها في غرف الرطوبة عند 23 درجة مئوية تحت ضوء الفلورسنت المستمر. بعد 24-72 ساعة ، تتم إزالة الأنسجة الزائدة بشفرة حلاقة لترك طبقة واحدة من خلايا البشرة ، وهي عينة واضحة بصريا يمكن تصويرها مباشرة دون الحاجة إلى التثبيت الكيميائي أو التطهير. تبقى الخلايا النباتية والفطرية على قيد الحياة طوال مدة التجربة ويمكن تصور التفاعلات في الوقت الفعلي. يمكن تلطيخ الأغماد أو تعريضها لانحلال البلازما لدراسة علم الخلايا النمائي وصلاحية الخلايا المضيفة والممرضة أثناء العدوى والاستعمار. يمكن تلقيح السلالات الفطرية التي تم تحويلها للتعبير عن البروتينات الفلورية أو تلقيحها بشكل مشترك على الأغماد لزيادة الدقة ولتسهيل تقييم التفاعلات التنافسية أو التآزرية. يمكن استخدام السلالات الفطرية التي تعبر عن بروتينات الاندماج الفلورية لتتبع وقياس إنتاج واستهداف هذه البروتينات الفردية في لسان النبات. يمكن استخلاص أنسجة الغلاف الملقحة لتوصيف الأحماض النووية أو البروتينات أو الأيضات. أدى استخدام مقايسات الغمد هذه إلى تقدم كبير في الدراسات التفصيلية لآليات الإمراضية الفطرية في الذرة وكذلك مستجيبات البروتين الفطري والمستقلبات الثانوية التي تساهم في الإمراضية.
Introduction
تعتبر التحليلات المكانية والزمانية على المستوى الخلوي ضرورية لفهم فسيولوجيا وعلم الخلايا للتفاعلات الفطرية النباتية. تم استخدام الأنسجة الورقية التي تم تثبيتها كيميائيا1،2،3أو تطهيرها وتلوينها4 ، وكذلك الأغشية الاصطناعية5 ، في الماضي للتحقيق في علم الخلايا لتطور مسببات الأمراض الورقية والتفاعلات الفطرية النباتية. ومع ذلك ، فإن التحقيق في أحداث العدوى في أنسجة المضيف الحي في الوقت الفعلي دون تثبيت أو إزالة يمثل تحديا بسبب المشكلات الفنية المتعلقة بإعداد عينات شفافة بصريا للتصوير.
تم تطوير بروتوكول تلقيح غمد الأوراق المنفصل في أواخر أربعينيات القرن العشرين للتحقيق المجهري الميداني الساطع لمقاومة خلايا بشرة الأرز الحية لفطر انفجار الأرز Magnaporthe oryza6. في الآونة الأخيرة ، تم تسهيل الملاحظات الجزيئية والفسيولوجية والخلوية التفصيلية لاستعمار المضيف بواسطة أنواع Colletotrichum و Magnaporthe بشكل كبير من خلال الجمع بين الإصدارات المعدلة من طريقة غمد الأوراق هذه مع المحولات الفطرية التي تعبر عن البروتينات الفلورية ، وبروتوكولات تصوير الخلايا الحية عالية الأداء ، بما في ذلك التألق والمجهر متحد البؤر7،8،9،10 ،11,12,13.
يفصل هذا البحث بروتوكول التلقيح الأمثل باستخدام أغلفة أوراق الذرة المنفصلة لمراقبة عمليات العدوى بواسطة مسببات الأمراض الفطرية الورقية والميتة. لقد استخدمناه على وجه التحديد لدراسة Colletotrichum graminicola (C. graminicola) ، العامل المسبب لآفة أوراق أنثراكنوز وتعفن الساق ، و Stenocarpella maydis ، الذي يسبب لفحة أوراق الديبلوديا وتعفن الساق. ومع ذلك ، يجب أن تكون الطريقة قابلة للتطبيق على مسببات الأمراض الفطرية الورقية الأخرى والنخرية. تتشابه الاستجابات الخلوية والفسيولوجية أثناء أحداث العدوى والاستعمار في أغماد الأوراق المستأصلة هذه مع تلك الموجودة في شفرات الأوراق بأكملها12،14،15. علاوة على ذلك ، فإن الاستعمار النصفي لخلايا البشرة الغمد بواسطة C. graminicola يشبه استعمار خلايا لب الساق16,17. تظهر الأغماد المنفصلة تزامنا أكبر واستنساخا تجريبيا لاختراق الفطريات واستعمارها مقارنة بشفرات الأوراق أو أنسجة لب الساق14،16،17،18. يمكن استخدام معظم أصناف الذرة لهذا البروتوكول. ومع ذلك ، فإن السلالات الداخلية أو الهجينة ذات الأصباغ الأرجوانية المفرطة في الأغماد أقل ملاءمة لأن الأصباغ تتداخل مع التصوير. كانت الذرة الحلوة في اليوبيل الذهبي مفيدة بشكل خاص لدراساتنا لأن البذور غير المعالجة متوفرة تجاريا ، والنباتات معرضة بشدة للعديد من الأمراض الورقية ، وتنمو جيدا في الدفيئة. أدت الأوبئة الأولى لتعفن ساق أنثراكنوز في الولايات المتحدة إلى فقدان إجمالي لمحاصيل الذرة الحلوة في ولاية إنديانا في سبعينيات القرن العشرين19,20. يمكن تطبيق طريقة تلقيح غمد الأوراق هذه لمراقبة نمو الفطريات وتطورها بشكل مباشر وقياسها في الخلايا النباتية الحية مقابل الخلايا النباتية المقتولة محليا ، لإظهار تفاعلات المقاومة في الاستجابات المتوافقة / غير المتوافقة للعدوى الفطرية ، واختبار التفاعلات بين السلالات الفطرية على نفس الغمد في الوقت الفعلي.
Protocol
ملاحظة: يظهر سير العمل الخاص بالأسلوب في الشكل 1.
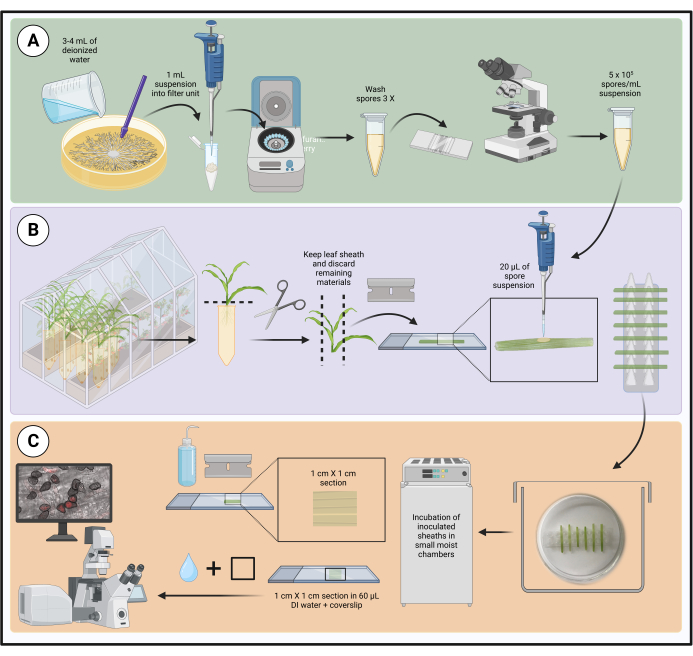
الشكل 1: خطوات بروتوكول التلقيح الأمثل باستخدام أغلفة أوراق الذرة المنفصلة. يتم تمييز تحضير تعليق البوغ ، وتلقيح غمد الأوراق ، وإعداد العينة للفحص المجهري للخلايا الحية في مربعات خضراء (A) وأرجوانية (B) وبرتقالية (C) ، على التوالي. تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. المواد النباتية والفطرية
- نمو النبات
- زراعة شتلات الذرة (انظر جدول المواد) في الدفيئة (14 ساعة ضوء / 27 درجة مئوية و 10 ساعات مظلمة / 22 درجة مئوية) في حاويات SC10 (انظر جدول المواد). استخدم وسط نمو يتكون من ثلاثة أجزاء من تربة تأصيص تجارية (انظر جدول المواد) وجزئين من التربة السطحية المعقمة بالبخار.
- شتلات المياه لمدة 2 دقيقة مع نظام الري العلوي مرة واحدة كل يوم ، في الصباح.
- حصاد الشتلات في مرحلة V2 عن طريق قطعها على مستوى التربة. يتم الوصول إلى مرحلة نمو V2 عندما يبلغ طول الشتلات من 5 إلى 10 سم ولها ورقتان مرئيتان من الياقات21.
- لف النباتات بمنشفة ورقية مبللة وضعها في كيس بلاستيكي لنقلها إلى المختبر لمزيد من المعالجة.
- الثقافات الفطرية
- إعادة تنشيط مزارع مخزون السيليكا الفطرية المخزنة في ظل ظروف معقمة22عن طريق رش ما يقرب من 50 حبيبة من السيليكا المصابة على وسط أجار مناسب. لتجنب التغيرات المورفولوجية وفقدان الإمراضية ، لا تزيد سلالات الثقافة الفرعية عن 3x بعد إعادة التنشيط. يستخدم أجار سكر العنب في البطاطس (PDA ؛ انظر جدول المواد) بشكل روتيني لاستزراع C. graminicola بينما يستخدم أجار الشوفان (OA ؛ انظر جدول المواد) ل S. maydis.
- لتحضير المساعد الرقمي الشخصي لزراعة المخزونات الفطرية ، قم بتعليق 19.5 جم من المساعد الرقمي الشخصي المجفف المحضر تجاريا في 500 مل من الماء منزوع الأيونات (DI). لعمل الزراعة العضوية ، قم بغلي 36 جم من الزراعة العضوية المجففة المحضرة تجاريا في ماء DI لمدة 15-30 دقيقة ، وقم بالتصفية من خلال ثلاث طبقات من القماش القطني ، وجلب الترشيح إلى 500 مل بماء DI. وسائط الأوتوكلاف للتعقيم.
- زيادة الوسائط المنصهرة والمبردة بمضاد حيوي مناسب (على سبيل المثال ، hygromycin B ، geneticin) عند العمل مع سلالات محولة. التركيزات النهائية للهيجروميسين أو الجينيتين في 500 مل من الوسائط هي 250 ميكروغرام / مل و 100 ميكروغرام / مل ، على التوالي.
- احتضان الثقافات في ظل الظروف المثلى حتى تتطور أفطورة sporulating. تنمو Colletotrichum graminicola و S. maydis بشكل جيد عند 23 درجة مئوية مع ضوء الفلورسنت المستمر ومستويات الرطوبة المحيطة. يحدث التبويض لمدة 7 أيام بعد التلقيح (داي) ل S. maydis أو 14 داي ل C. graminicola.
2. تلقيح غمد الأوراق
- تجميع وحدة مرشح الصوف الزجاجي
- استخدم مقصا أو مقصات شديدة التحمل لقطع الغطاء وحوالي 0.5 مم من القاع المخروطي لأنبوب طرد مركزي دقيق سعة 1.5 مل (انظر جدول المواد).
- ضع قطعة من الصوف الزجاجي (حوالي 0.5 سم × 0.5 سم ؛ انظر جدول المواد) داخل الأنبوب المقطوع لتغطية الفتحة المركزية ، كما هو موضح في الشكل 2.
- ارتد قفازات أثناء قطع الصوف الزجاجي ، لأن زجاج البورسليكات يمكن أن يسبب تهيجا.
- إعداد رفوف دعم غمد الأوراق
- قم بقطع لوحة PCR غير ذات 96 بئرا (انظر جدول المواد) إلى ستة رفوف دعم ذات عمودين (8 × 2 آبار) كما هو موضح في الشكل 3 أ.
- اقلب الرفوف ذات العمودين بحيث تكون القيعان المخروطية للآبار متجهة لأعلى وتواجه القمم المسطحة لأسفل (الشكل 3 ب).
- ضع كل دعامة في صفيحة بتري زجاجية تحتوي على ورق ترشيح مبلل وقم بتغطيتها بالغطاء (انظر جدول المواد). تعمل هذه الوحدة كغرفة رطوبة صغيرة للأغماد.
- إعداد اللقاح
- لكل سلالة فطرية ، ضع وحدة مرشح واحدة مجمعة من الصوف الزجاجي في أنبوب طرد مركزي معقم سليم سعة 1.5 مل كما هو موضح في الشكل 2. هذا الأخير يعمل كأنبوب جمع.
- قم بتسمية الأنابيب.
- احصد الكونيديا من الثقافات المبوضة عن طريق إغراق كل طبق أولا ب 3-4 مل من ماء DI المعقم. قد يكون من الضروري المزيد من الماء في بعض الحالات لإنتاج طبقة من السائل على سطح المستعمرة. عوامل الترطيب ليست ضرورية في هذا النظام.
- قم بفك الجراثيم من الآجار باستخدام مدقة معقمة مخروطية الطرف (انظر جدول المواد) لكشطها بالتساوي عبر اللوحة بأكملها.
- ضع 1 مل من معلق البوغ على وحدة مرشح من الصوف الزجاجي بشكل معقم واترك الجراثيم تتدفق إلى أنبوب التجميع عن طريق الجاذبية.
- أجهزة الطرد المركزي أنابيب التجميع التي تحتوي على معلقات البوغ المفلترة عند 3500 × جم لمدة 5 دقائق. يجب تكوير الجراثيم في الجزء السفلي من أنبوب الطرد المركزي الدقيق.
ملاحظة: تؤدي جراثيم C. graminicola بالطرد المركزي بسرعات أعلى من الموصى بها هنا إلى فقدان كبير للحياة. - اسكب السائل في وعاء قابل للتعقيم ، وأضف 1 مل من ماء DI المعقم ، وحركه برفق لإعادة تعليق الجراثيم المحببة. أجهزة الطرد المركزي كما في الخطوة 2.3.6.
- اغسل الجراثيم 3x لإزالة أي مصفوفة مخروطية قد تحتوي على مثبطات ذاتية قد تقلل من الإنبات أو الاختراق.
- بعد الغسيل الثالث ، أضف 300-500 ميكرولتر من ماء DI المعقم لإعادة تعليق الجراثيم للقياس الكمي.
- استخدم مقياس الدم تحت المجهر المركب عند تكبير 100x لتحديد تركيز البوغ. بوغ تلطيخ ليست ضرورية قبل العد.
- قم بإعداد معلق 5 × 105 جراثيم / مل بماء DI معقم.
ملاحظة: يمكن الاحتفاظ بتعليق بوغ C. graminicola في درجة حرارة الغرفة لمدة لا تزيد عن 4 ساعات قبل الفقدان السريع للصلاحية. تبريد كونيديا لا يزيد من الجدوى.
- التطعيمات غمد
- تحقق من ممارسات وإجراءات السلامة الأحيائية ذات الصلة قبل تلقيح النباتات بالسلالات الفطرية.
- قم بإزالة الغمد من الورقة الحقيقية الأولى لشتلات V2 عن طريق تشغيل صورة مصغرة على طول الهامش المتداخل للغمد ، وقم بفكها برفق من اللقطة. قم بفك الغمد من جانبي اللقطة قبل محاولة إزالته.
- قطع أغلفة الأوراق المستردة إلى شرائح 3-5 سم. ليس من الضروري تطهير الأغماد قبل التلقيح.
- قم بفك كل جزء برفق شديد لكشف طبقة البشرة الداخلية (المحورية).
- أثناء تحضير الأغماد للتلقيح ، احتفظ بالأغماد المستأصلة المتبقية ملفوفة بمنشفة ورقية مبللة لتجنب الجفاف.
- ضع 20 ميكرولتر من معلق البوغ الفطري على السطح الداخلي في مركز قطعة الغمد، فوق الضلع الأوسط مباشرة، كما هو موضح في الشكل 4.
- ضع أغلفة الأوراق الملقحة أفقيا ، مع وضع الضلع الأوسط في الأسفل ، في الدعامة داخل صفيحة بتري زجاجية تحتوي على ورق ترشيح مبلل كما هو موضح في الشكل 5.
- كل رف يحمل ما يصل إلى سبعة أغماد. تلقيح ما لا يقل عن خمسة أغماد لكل سلالة للتعويض عن فقدان النسخ المتماثلة التي قد تحدث أثناء تحضير العينة أو الحضانة.
- ضع غرف الرطوبة الصغيرة في صندوق تخزين شفاف مبطن بورق إنبات مبلل (انظر جدول المواد).
- غطي الصندوق بالغطاء. احتضان الصندوق عند 23 درجة مئوية مع إضاءة مستمرة للدورة الزمنية المقصودة ، والتي تعتمد على الفطريات وعلى مراحل تطور الفطريات التي سيتم ملاحظتها. ويرد في الجدول 1 ملخص للدورة الزمنية لأغماد الذرة الملقحة ب C. graminicola.
- تحقق كل يوم من علامات / أعراض المرض على الأغماد وحافظ على رطوبة كل من أوراق الإنبات والترشيح. يمكن الاحتفاظ بأغلفة الأوراق لمدة تصل إلى 6 أيام دون موت واضح للخلايا النباتية أو تدهورها في حالة عدم وجود تلقيح.
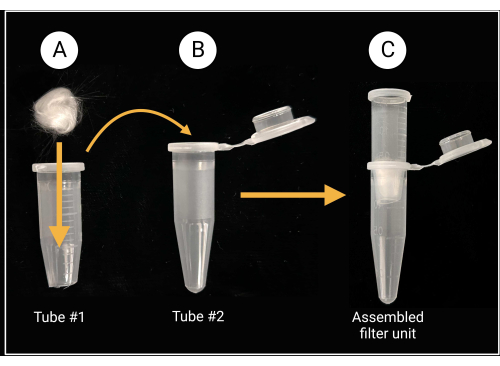
الشكل 2: تحضير وحدة مرشح الصوف الزجاجي. (أ) توضع كرة من الصوف الزجاجي مقاس 0.5 سم × 0.5 سم داخل أنبوب الطرد المركزي الدقيق 1 الذي تمت إزالة قاعه المخروطي. (ب-ج) ثم يتم وضع أنبوب المرشح في أنبوب الطرد المركزي الدقيق 2 لإنشاء وحدة مرشح مجمعة لإعداد تعليق البوغ. تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
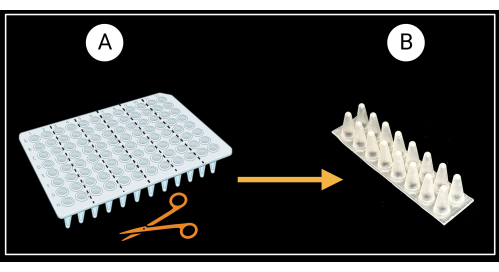
الشكل 3: طريقة قطع لوحة PCR غير ذات 96 بئرا. (أ) لوحة PCR مقطعة إلى ستة رفوف دعم ، 8 × 2 آبار. مثال على دعامة غمد واحدة موضح في (ب). يتم وضع أغماد الأوراق أفقيا على الدعم. تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: طريقة تلقيح الغمد. قطرة واحدة من اللقاح تطبق مباشرة على السطح المحوري لقسم الغمد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
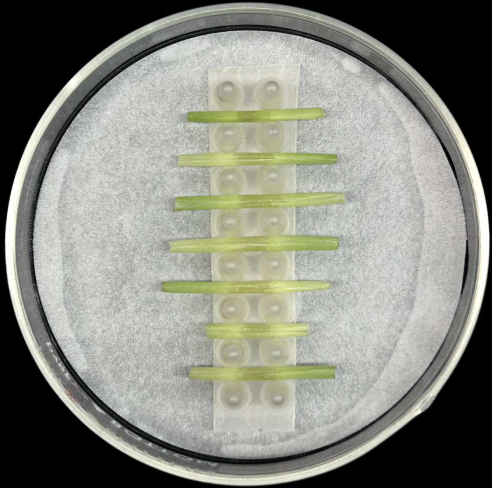
الشكل 5: طريقة حضانة الغمد. أغماد الأوراق الملقحة موضوعة أفقيا في رف دعم داخل صفيحة بتري زجاجية تحتوي على ورق ترشيح مبلل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. مجهر الخلية الحية
- تحضير العينة للفحص المجهري
- اشطف قطع الغمد برفق بماء DI المعقم لإزالة أي جراثيم غير ملتصقة أو نمو فطري سطحي.
- ضع الغمد على شريحة مجهر زجاجية نظيفة (انظر جدول المواد) بحيث يكون السطح المحوري (الداخلي) لقطعة الغمد متجها لأسفل والسطح المحوري (الخارجي) في الأعلى.
- استخدم شفرة حلاقة جديدة أحادية الحافة (انظر جدول المواد) لتقليم حوالي 1 سم من أطراف الغمد وإزالة معظم أنسجة الصفيحة على جانبي الضلع الأوسط.
- أمسك شفرة الحلاقة بزاوية 90 درجة بالنسبة للغمد لحلق الأنسجة من الضلع الأوسط المحوري وكشف طبقة البشرة على السطح المحوري فوق البقعة الملقحة. حاول الحفاظ على سمك موحد. بمجرد حلق أغلفة الأوراق ، لا ينصح بمزيد من التشذيب لأن ذلك قد يتلف العينة.
- تأكد من أن حجم المقاطع المحلوقة لا يزيد عن 1 سم × 1 سم. تجنب الضغط على مركز الغمد أثناء هذه العملية. عند العمل مع الأغماد الملقحة بمعلقات بوغ مختلفة ، قم بتطهير القفازات وتغيير شفرة الحلاقة بين العينات.
- حافظ على شريحة مجهر زجاجي نظيف جاهزة. ارفع قسم الغلاف من حافة واحدة وانقله بعناية إلى شريحة جديدة. يجب أن يكون السطح الملقح (المحوري) للغمد أعلى ، أقرب إلى العدسة الموضوعية. قم بتركيب المقاطع برفق لتجنب تلف الهياكل الفطرية.
- ضع 60 ميكرولتر من ماء DI المعقم على القسم وأضف غطاء زجاجي مقاس 24 مم × 60 مم (انظر جدول المواد). افعل ذلك ببطء لتجنب فقاعات الهواء.
- عندما تكون جاهزا للفحص المجهري ، أغلق الغطاء بطلاء أظافر شفاف (انظر جدول المواد) عن طريق وضع قطرة صغيرة على كل حافة ثم توصيل القطرات معا بفرشاة طلاء الأظافر لعمل ختم سلس.
ملاحظة: يمكن استخدام بروتوكول الغمد هذا مع البقع الخلوية ، على سبيل المثال ، 4 ′ ، 6-diamidino-2-phenylindole (DAPI) ، أو الأحمر المحايد ، أو التريبان الأزرق ، أو لمراقبة انحلال البلازما الخلوي لتقييم صلاحية الخلايا النباتية. لتلطيخ الغمد أو مقايسات انحلال البلازما الخلوي ، لا تغلق الغطاء. - بالنسبة لمقايسات انحلال البلازما ، أضف محلولا مفرط التوتر (0.75 M سكروز أو 1 M كلوريد الصوديوم) إلى حافة واحدة من غطاء الغطاء واستخدم مناديل ورقية مطوية خالية من النسالة لسحب المحلول عبر العينة إلى الحافة الأخرى من غطاء الغطاء. للتلطيخ ، استخدم طريقة مماثلة لتطبيق محلول البقع.
- الفحص المجهري واسع المجال
- بمجرد تركيب أغلفة الأوراق على شرائح المجهر ، افحصها بحثا عن الاستعمار الفطري باستخدام مجهر ضوئي واسع المجال بتكبير 400x.
- لمراقبة الهياكل الفطرية بالتفصيل ، استخدم هدف الغمر في الماء بدلا من الزيت للحصول على جودة صورة أفضل للعينات. قد يؤدي الانحراف الكروي الناتج عن عدم تطابق معامل الانكسار إلى تدهور الصورة. أهداف المياه متاحة للمجاهر الضوئية واسعة المجال وكذلك المجاهر متحدة البؤر.
- لتحديد الكمية النسبية للاستعمار لكل غمد ، احسب عدد خلايا الذرة التي تم غزوها من كل موقع اختراق فطري باستخدام مجهر ضوئي واسع المجال عند تكبير 100x. هذا القياس الكمي هو خطوة فحص مناسبة قبل أي تحليلات إحصائية تقارن السلالات والعلاجات و / أو مراحل النمو.
- مجهر المسح بالليزر متحد البؤر
- لمراقبة البروتينات الفلورية في أنسجة الذرة أثناء تطور السلالات الفطرية المعدلة وراثيا ، اضبط المعلمات الأساسية لاكتساب الصورة. حدد أفضل إعدادات الإثارة/الانبعاث بناء على علامة الفلورسنت المحددة.
ملاحظة: يفضل استخدام هدف مائي 60 ضعفا عند تحليل عمليات الاندماج الفلورية التي تم إنشاؤها باستخدام البروتينات المفرزة. تحتوي المجاهر الحديثة متحدة البؤر على أهداف غمر الماء المصححة للغاية لتجنب القطع الأثرية وانحرافات الشكل. - إذا كان تصوير الخلايا الحية للبروتينات الفلورية مقصودا ، فاستخدم السلالات الفطرية غير المحولة كعناصر تحكم للتألق الذاتي. استخدم معلمات الحصول على الصور التالية لالتقاط ديناميكيات المضيف الفطري على مجهر متحد البؤر مقلوب ولبروتين الفلورسنت mCherry . اضبط طاقة الليزر حتى 5٪ ، 450-600 جهد عالي (HV) اعتمادا على مستوى التعبير ، كسب 1.375 X ، إزاحة 3٪ ، عامل تكبير بصري 1 لتحليل ما يصل إلى خمس خلايا ذرة لكل قسم ، وعامل تكبير بصري من 2-5 للخيوط الفردية.
ملاحظة: توفر الصور البؤرية عالية الدقة Z-stack بيانات ثلاثية الأبعاد ورؤية أفضل للتفاعلات في الوقت الفعلي بين المضيف والممرض. - لتحديد شدة التألق المقابلة لبروتينات الاندماج المفرزة ، استخدم برنامج تحليل الصور من الشركة المصنعة متحدة البؤر أو برنامج معالجة الصور مثل ImageJ ، والذي يمكن تنزيله مجانا عبر الإنترنت. راجع دليلا للحصول على تفاصيل حول كيفية تحديد إشارات الفلورسنت وفقا لذلك.
- لمراقبة البروتينات الفلورية في أنسجة الذرة أثناء تطور السلالات الفطرية المعدلة وراثيا ، اضبط المعلمات الأساسية لاكتساب الصورة. حدد أفضل إعدادات الإثارة/الانبعاث بناء على علامة الفلورسنت المحددة.
النتائج
تصف الأمثلة أدناه النتائج التمثيلية بعد استخدام طريقة تلقيح غمد أوراق الذرة. توضح هذه الأمثلة السهولة والسرعة والدقة التي يمكن من خلالها تحقيق الملاحظة والمقارنة بين تفاعلات الذرة والفطريات في الوقت الفعلي باستخدام هذا الفحص الأمثل. يسمح تصوير الخلايا الحية أيضا باستخراج المعلومات الك?...
Discussion
تم تعديل طريقة تلقيح غمد الأوراق المحسنة الموصوفة هنا من بروتوكول أصلي تم تطويره وتم تطبيقه على أغلفة أوراق الأرز6،8،36. يسمح بملاحظات مباشرة ومفصلة لنمو الفطريات وتطورها في الخلايا النباتية الحية إما بالمجهر واسع المجال أو متحد البؤر. ال...
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية متنافسة وليس لديهما ما يفصحان عنه.
Acknowledgements
يشكر المؤلفون USDA-NIFA على دعمهم المالي (أرقام المنح 2018-67013-28489 و 2020-70410-32901). أي آراء أو نتائج أو استنتاجات أو توصيات معبر عنها في هذه المخطوطة هي آراء المؤلفين فقط ولا تعكس بالضرورة آراء وزارة الزراعة الأمريكية. نشكر الطالبة الزائرة من البرازيل ، ميارا دي سيلفا ، على الصور التي تظهر في الشكل 6A وفي الشكل 7D. كما نعترف بقسم أمراض النبات في جامعة كنتاكي لتوفير الوصول إلى مجاهر أوليمبوس متحدة البؤر.
Materials
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
References
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved