É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Bainhas de milho destacadas para imagens de células vivas da infecção por patógenos fúngicos foliares de milho
Neste Artigo
Resumo
Este manuscrito detalha um protocolo de inoculação otimizado que utiliza bainhas de folhas de milho destacadas para estudos citológicos, fisiológicos e moleculares reprodutíveis de interações do milho com fitopatógenos fúngicos. As bainhas foliares facilitam a observação em tempo real das interações celulares entre a planta viva e o fungo em tecidos não fixos.
Resumo
Otimizamos um protocolo para inocular bainhas foliares de milho com fungos hemibiotróficos e necrotróficos foliares patogênicos. O método é modificado a partir de um originalmente aplicado em bainhas de folhas de arroz e permite a observação microscópica direta do crescimento e desenvolvimento de fungos em células vivas de plantas. Bainhas foliares coletadas de plântulas de milho com dois colares de folhas completamente emergidos são inoculadas com gotas de 20 μL de suspensões de esporos fúngicos de 5 x 105 esporos/mL e incubadas em câmaras de umidade a 23 °C sob luz fluorescente contínua. Após 24-72 h, o excesso de tecido é removido com uma lâmina de barbear para deixar uma única camada de células epidérmicas, uma amostra opticamente clara que pode ser fotografada diretamente sem a necessidade de fixação química ou clareamento. Células de plantas e fungos permanecem vivas durante todo o experimento e as interações podem ser visualizadas em tempo real. As bainhas podem ser coradas ou submetidas à plasmólise para estudar a citologia do desenvolvimento e a viabilidade das células do hospedeiro e do patógeno durante a infecção e colonização. Cepas fúngicas transformadas para expressar proteínas fluorescentes podem ser inoculadas ou co-inoculadas nas bainhas para maior resolução e para facilitar a avaliação de interações competitivas ou sinérgicas. Cepas fúngicas expressando proteínas de fusão fluorescente podem ser usadas para rastrear e quantificar a produção e o direcionamento dessas proteínas individuais em planta. Tecidos da bainha inoculados podem ser extraídos para caracterizar ácidos nucléicos, proteínas ou metabólitos. O uso destes ensaios de bainha tem avançado muito os estudos detalhados dos mecanismos de patogenicidade fúngica em milho e também de efetores de proteínas fúngicas e metabólitos secundários que contribuem para a patogenicidade.
Introdução
Análises espaciais e temporais em nível celular são críticas para o entendimento da fisiologia e citologia das interações fúngico-planta. Tecidos foliares quimicamentefixados1,2,3 ou clareados4, bem como membranas artificiais5, têm sido utilizados no passado para investigar a citologia do desenvolvimento de patógenos foliares e interações planta-fungos. No entanto, a investigação de eventos infecciosos em tecidos vivos do hospedeiro em tempo real, sem fixação ou clareamento, é um desafio devido a questões técnicas relacionadas à preparação de amostras opticamente transparentes para obtenção de imagens.
Um protocolo de inoculação em bainha de folha destacada foi desenvolvido no final da década de 1940 para investigação microscópica de campo brilhante da resistência de células epidérmicas vivas de arroz ao fungo da brusone do arroz Magnaporthe oryza6. Mais recentemente, observações moleculares, fisiológicas e citológicas detalhadas da colonização do hospedeiro por espécies de Colletotrichum e Magnaporthe foram grandemente facilitadas pela combinação de versões modificadas desse método de bainha foliar com transformadores fúngicos expressando proteínas fluorescentes e protocolos de imagem de células vivas de alto desempenho, incluindo epifluorescência e microscopia confocal 7,8,9,10,11,12,13.
Este trabalho detalha um protocolo de inoculação otimizado utilizando bainhas foliares destacadas de milho para observação de processos de infecção por patógenos fúngicos foliares hemibiotróficos e necrotróficos. Nós o usamos especificamente para estudar Colletotrichum graminicola (C. graminicola), o agente causal da requeima das folhas da antracnose e da podridão do colmo, e Stenocarpella maydis, que causa a queima das folhas de Diplodia e a podridão do colmo. No entanto, o método deve ser aplicável a outros patógenos fúngicos foliares hemibiotróficos e necrotróficos. As respostas citológicas e fisiológicas durante eventos de infecção e colonização nessas bainhas excisadas são semelhantes àquelas em lâminas foliares inteiras12,14,15. Além disso, a colonização hemibiotrófica das células epidérmicas da bainha por C. graminicola é semelhante à colonização das células da medula do pedúnculo16,17. Bainhas destacadas apresentam maior sincronicidade e reprodutibilidade experimental da penetração e colonização de fungos do que lâminas foliares ou tecidos da medula do pedúnculo14,16,17,18. A maioria das variedades de milho pode ser utilizada para este protocolo. No entanto, endogâmicas ou híbridos com excesso de pigmentos roxos nas bainhas são menos adequados, uma vez que os pigmentos interferem na imagem. O milho doce Golden Jubilee tem sido particularmente útil para nossos estudos porque sementes não tratadas estão disponíveis comercialmente, as plantas são altamente suscetíveis a muitas doenças foliares e crescem bem em casa de vegetação. As primeiras epidemias de podridão do colmo da antracnose nos Estados Unidos resultaram na perda total das lavouras de milho doce em Indiana na década de1970 19,20. Este método de inoculação da bainha foliar pode ser aplicado para observar e quantificar diretamente o crescimento e desenvolvimento fúngico em células vegetais vivas versus mortas localmente, para demonstrar reações de resistência em respostas compatíveis/incompatíveis à infecção fúngica e para testar interações entre cepas fúngicas na mesma bainha em tempo real.
Protocolo
Observação : o fluxo de trabalho para o método é mostrado na Figura 1.
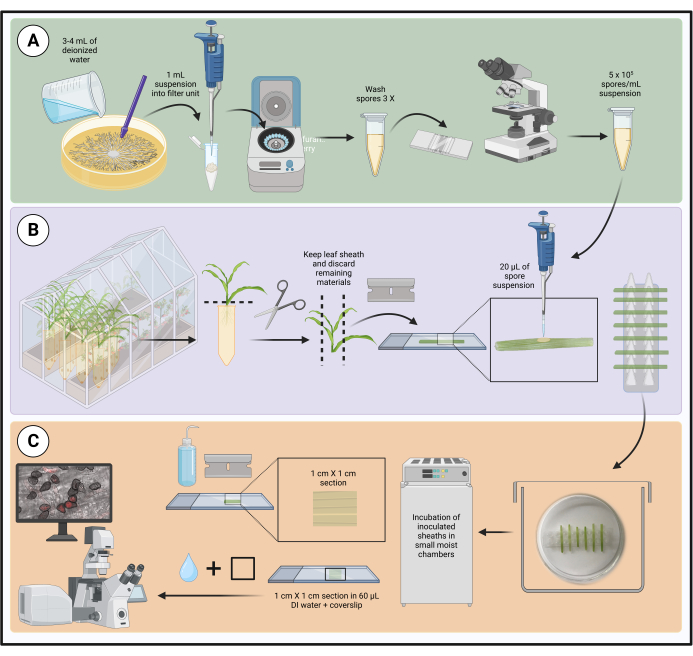
Figura 1: Etapas do protocolo de inoculação otimizado utilizando bainhas de folhas de milho destacadas. O preparo da suspensão de esporos, a inoculação da bainha foliar e o preparo da amostra para microscopia de células vivas são destacados nas caixas verde (A), roxa (B) e laranja (C), respectivamente. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
1. Material vegetal e fúngico
- Crescimento vegetal
- Cultivar mudas de milho (ver Tabela de Materiais) na estufa (14 h claro/27 °C e 10 h escuro/22 °C) em recipientes SC10 (ver Tabela de Materiais). Use um meio de crescimento composto por três partes de solo de vaso comercial (consulte a Tabela de Materiais) e duas partes de solo superficial esterilizado a vapor.
- Regue as mudas por 2 min com um sistema de irrigação aérea uma vez por dia, pela manhã.
- Colher mudas no estádio V2, cortando-as ao nível do solo. O estádio de crescimento V2 é atingido quando as plântulas têm de 5 a 10 cm de altura e duas folhas visíveis com colarinho21.
- Embrulhe as plantas com uma toalha de papel úmida e coloque-as em um saco plástico para transporte ao laboratório para processamento posterior.
- Culturas fúngicas
- Reativar culturas estoque de sílica fúngica armazenadas em condições assépticas22polvilhando aproximadamente 50 grânulos da sílica infestada em meio ágar apropriado. Para evitar alterações morfológicas e perda de patogenicidade, as cepas de subcultivo não mais do que 3x após a reativação. O ágar batata-dextrose (PDA; ver Tabela de Materiais) é rotineiramente usado para cultivar C. graminicola, enquanto o ágar aveia (OA; ver Tabela de Materiais) é usado para S. maydis.
- Para preparar o BDA para a cultura de estoques fúngicos, suspender 19,5 g de PDA desidratado preparado comercialmente em 500 mL de água deionizada (DI). Para fazer OA, ferva 36 g de OA desidratado preparado comercialmente em água DI por 15-30 min, filtre através de três camadas de pano de queijo e leve o filtrado a 500 mL com água DI. Meios de autoclave para esterilização.
- Aumente o meio fundido e resfriado com um antibiótico apropriado (por exemplo, higromicina B, geneticina) ao trabalhar com cepas transformantes. As concentrações finais de higromicina ou geneticina em 500 mL de meio são de 250 μg/mL e 100 μg/mL, respectivamente.
- Incubar culturas em condições ótimas até que um micélio esporulante tenha se desenvolvido. Colletotrichum graminicola e S. maydis crescem bem a 23 °C com luz fluorescente contínua e níveis de umidade ambiente. A esporulação ocorre 7 dias após a inoculação (dai) para S. maydis ou 14 dai para C. graminicola.
2. Inoculações da bainha foliar
- Montagem da unidade de filtro de lã de vidro
- Use tesouras ou tesouras para serviço pesado para cortar a tampa e aproximadamente 0,5 mm do fundo cônico de um tubo de microcentrífuga de 1,5 mL (consulte a Tabela de Materiais).
- Coloque um pedaço de lã de vidro (aproximadamente 0,5 cm x 0,5 cm; ver Tabela de Materiais) dentro do tubo cortado para cobrir o orifício central, conforme ilustrado na Figura 2.
- Use luvas ao cortar lã de vidro, pois o vidro borossilicato pode causar irritação.
- Preparação de cremalheiras de apoio de bainha foliar
- Corte uma placa de PCR de 96 poços não contornada (consulte a Tabela de Materiais) em seis racks de suporte de duas colunas (8 x 2 poços), conforme ilustrado na Figura 3A.
- Inverta os racks de duas colunas de modo que os fundos cônicos dos poços fiquem voltados para cima e os topos planos voltados para baixo (Figura 3B).
- Coloque cada suporte em uma placa de Petri de vidro contendo papel de filtro umedecido e cubra com a tampa (consulte Tabela de Materiais). Esta unidade funciona como uma pequena câmara de umidade para as bainhas.
- Preparação do inóculo
- Para cada cepa fúngica, coloque uma unidade de filtro de lã de vidro montada em um tubo de microcentrífuga estéril intacto de 1,5 mL, conforme ilustrado na Figura 2. Este último funciona como um tubo de coleta.
- Rotule os tubos.
- Colher conídios de culturas esporulantes inundando primeiro cada placa com 3-4 mL de água DI estéril. Mais água pode ser necessária em alguns casos para produzir uma camada de líquido na superfície da colônia. Agentes umectantes não são necessários neste sistema.
- Solte os esporos do ágar usando um pilão estéril de ponta cônica (ver Tabela de Materiais) para raspar uniformemente em toda a placa.
- Aplicar 1 ml da suspensão de esporos numa unidade filtrante de lã de vidro de forma asséptica e permitir que os esporos fluam para o tubo de recolha por gravidade.
- Centrifugar os tubos de coleta contendo as suspensões de esporos filtrados a 3.500 x g por 5 min. Os esporos devem ser peletizados no fundo do tubo da microcentrífuga.
NOTA: A centrifugação de esporos de C. graminicola em velocidades mais altas do que as recomendadas aqui resulta em uma perda significativa de viabilidade. - Despeje o líquido em um recipiente autoclavável, adicione 1 mL de água DI estéril e agite suavemente para ressuspender os esporos peletizados. Centrifugar como no passo 2.3.6.
- Lave os esporos 3x para remover qualquer matriz conidial que possa conter autoinibidores que possam reduzir a germinação ou penetração.
- Após a terceira lavagem, adicionar 300-500 μL de água DI estéril para ressuspender os esporos para quantificação.
- Use um hemocitômetro sob um microscópio composto em aumento de 100x para determinar a concentração de esporos. A coloração de esporos não é necessária antes da contagem.
- Preparar uma suspensão de 5 x 105 esporos/mL com água DI estéril.
NOTA: A suspensão de esporos de C. graminicola pode ser mantida à temperatura ambiente por não mais de 4 h antes da rápida perda de viabilidade. A refrigeração dos conídios não aumenta a viabilidade.
- Inoculações de bainha
- Verificar as práticas e procedimentos de biossegurança relevantes antes de inocular plantas com cepas fúngicas.
- Retire a bainha da primeira folha verdadeira de mudas V2 passando uma miniatura ao longo da margem sobreposta da bainha e solte-a suavemente da parte aérea. Solte a bainha de ambos os lados do rebento antes de tentar removê-la.
- Corte as bainhas foliares recuperadas em segmentos de 3-5 cm. Não é necessário desinfetar as bainhas antes da inoculação.
- Desenrolar cada segmento muito suavemente para expor a camada epidérmica interna (adaxial).
- Ao preparar bainhas para inoculação, mantenha as bainhas excisadas restantes embrulhadas com uma toalha de papel úmida para evitar a dessecação.
- Colocar 20 μL da suspensão de esporos fúngicos na superfície interna, no centro da bainha, diretamente acima da nervura central, como mostra a Figura 4.
- Coloque as bainhas foliares inoculadas horizontalmente, com a nervura central colocada na parte inferior, no suporte dentro de uma placa de Petri de vidro contendo um papel de filtro umedecido, conforme ilustrado na Figura 5.
- Cada rack comporta até sete bainhas. Inocular pelo menos cinco bainhas por cepa para compensar a perda de réplicas que possa ocorrer durante a preparação ou incubação da amostra.
- Coloque as pequenas câmaras de humidade numa caixa de armazenamento transparente forrada com papel de germinação humedecido (ver Tabela de Materiais).
- Cubra a caixa com a tampa. Incubar a caixa a 23 °C com iluminação contínua para o curso de tempo pretendido, que depende do fungo e dos estágios de desenvolvimento fúngico que serão observados. Um resumo do curso temporal para bainhas de milho inoculadas com C. graminicola é apresentado na Tabela 1.
- Verifique todos os dias se há sinais/sintomas de doença nas bainhas e mantenha os papéis de germinação e de filtro úmidos. As bainhas foliares podem ser retidas por até 6 dias sem morte ou degradação celular vegetal óbvia na ausência de inoculação.
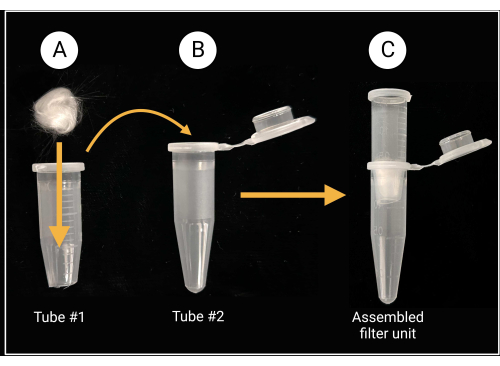
Figura 2: Preparação da unidade filtrante de lã de vidro. (A) Uma esfera de lã de vidro de 0,5 cm x 0,5 cm é colocada dentro do tubo de microcentrífuga 1 que tem seu fundo cônico removido. (B-C) O tubo do filtro é então colocado no tubo de microcentrífuga 2 para gerar uma unidade de filtro montada para a preparação da suspensão de esporos. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
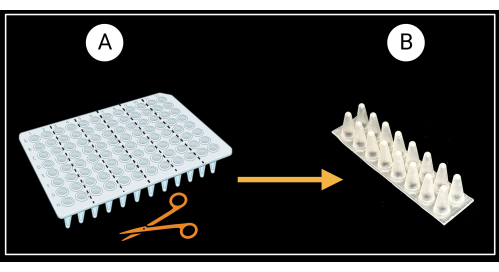
Figura 3: Método de corte de uma placa de PCR de 96 poços não contornada. (A) Placa de PCR cortada em seis racks de apoio, 8 x 2 poços. Um exemplo de um único suporte de bainha é descrito em (B). As bainhas foliares são colocadas horizontalmente sobre o suporte. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.

Figura 4: Método de inoculação da bainha. Uma gota de inóculo aplicada diretamente na superfície adaxial do corte da bainha. Clique aqui para ver uma versão maior desta figura.
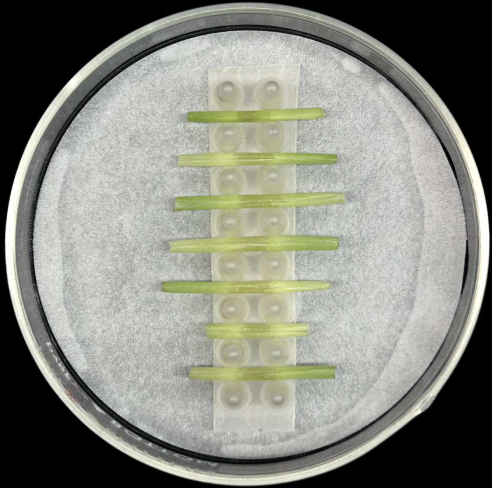
Figura 5: Método de incubação da bainha. Bainhas foliares inoculadas colocadas horizontalmente em uma prateleira de suporte dentro de uma placa de Petri de vidro contendo papel de filtro umedecido. Clique aqui para ver uma versão maior desta figura.
3. Microscopia de células vivas
- Preparação da amostra para microscopia
- Enxágue suavemente as peças da bainha com água DI estéril para remover quaisquer esporos não aderidos ou crescimento fúngico superficial.
- Coloque a bainha em uma lâmina limpa de microscópio de vidro (ver Tabela de Materiais) com a superfície adaxial (interna) da bainha voltada para baixo e a superfície abaxial (externa) mais superior.
- Use uma nova lâmina de barbear de borda única (consulte Tabela de Materiais) para cortar aproximadamente 1 cm das extremidades da bainha e remover a maior parte do tecido da lâmina em ambos os lados da nervura central.
- Segure a lâmina de barbear em um ângulo de 90° em relação à bainha para raspar o tecido da nervura central abaxial e expor a camada epidérmica na superfície adaxial acima do ponto inoculado. Procure manter uma espessura uniforme. Uma vez que as bainhas das folhas são raspadas, não é recomendado um corte adicional, pois isso pode danificar a amostra.
- Certifique-se de que as seções raspadas não tenham mais de 1 cm x 1 cm de tamanho. Evite pressionar o centro da bainha durante este processo. Ao trabalhar com bainhas inoculadas com diferentes suspensões de esporos, desinfete as luvas e troque a lâmina de barbear entre as amostras.
- Mantenha uma lâmina de microscópio de vidro limpa pronta. Levante a seção da bainha de uma borda e transfira-a cuidadosamente para uma nova corrediça. A superfície inoculada (adaxial) da bainha deve ser mais superior, mais próxima da lente objetiva. Monte seções suavemente para evitar danos às estruturas fúngicas.
- Aplicar 60 μL de água DI estéril na secção e adicionar uma lamínula de vidro de 24 mm x 60 mm (ver Tabela de Materiais). Faça isso lentamente para evitar bolhas de ar.
- Quando estiver pronto para a microscopia, sele a lamínula com esmalte transparente (consulte Tabela de Materiais) colocando uma pequena gota em cada borda e, em seguida, conectando as gotas com uma escova de esmalte para fazer uma vedação sem costura.
NOTA: Este protocolo de bainha pode ser usado com colorações citológicas, por exemplo, 4′,6-diamidino-2-fenilindol (DAPI), vermelho neutro ou azul de tripano, ou para observação de plasmólise celular para avaliar a viabilidade de células vegetais. Para ensaios de coloração de bainha ou plasmólise celular, não sele a lamínula. - Para ensaios de plasmólise, adicionar uma solução hipertônica (sacarose 0,75 M ou cloreto de sódio 1 M) a uma borda da lamínula e usar um papel higiênico dobrado sem fiapos para desenhar a solução através da amostra até a outra borda da lamínula. Para a coloração, use um método semelhante para aplicar a solução de mancha.
- Microscopia de campo largo
- Uma vez que as bainhas foliares estejam montadas em lâminas de microscópio, inspecione-as quanto à colonização fúngica usando um microscópio de luz de campo largo com aumento de 400x.
- Para observar as estruturas fúngicas em detalhes, use uma objetiva de imersão em água em vez de óleo para melhor qualidade de imagem das amostras. A aberração esférica devido a uma incompatibilidade de índice de refração pode causar degradação da imagem. As objetivas de água estão disponíveis para microscópios de luz de campo largo, bem como microscópios confocais.
- Para determinar a quantidade relativa de colonização por bainha, conte o número de células de milho invadidas de cada local de penetração fúngica usando um microscópio de luz de campo largo em aumento de 100x. Essa quantificação é uma etapa de triagem apropriada antes de qualquer análise estatística comparando cepas, tratamentos e/ou estágios de desenvolvimento.
- Microscopia confocal de varredura a laser
- Para observar proteínas fluorescentes em tecidos de milho durante o desenvolvimento de cepas fúngicas transgênicas, ajustar os parâmetros básicos de aquisição de imagens. Identifique as melhores configurações de excitação/emissão com base no marcador fluorescente selecionado.
NOTA: Uma objetiva de água de 60x é preferível ao analisar fusões fluorescentes construídas com proteínas secretadas. Os microscópios confocais modernos têm objetivas de imersão em água altamente corrigidas para evitar artefatos e aberrações de forma. - Se a imagem de células vivas de proteínas fluorescentes for pretendida, use cepas fúngicas não transformadas como controles para autofluorescência. Use os seguintes parâmetros de aquisição de imagem para capturar a dinâmica fúngico-hospedeiro em um microscópio confocal invertido e para a proteína fluorescente mCherry. Ajuste a potência do laser até 5%, 450-600 de alta tensão (HV) dependendo do nível de expressão, ganho de 1,375 X, deslocamento de 3%, fator de zoom óptico de 1 para a análise de até cinco células de milho por seção e fator de zoom óptico de 2-5 para hifas individuais.
NOTA: Imagens confocais Z-stack de alta resolução fornecem dados tridimensionais e uma melhor visualização das interações em tempo real entre o hospedeiro e o patógeno. - Para quantificar as intensidades de fluorescência correspondentes às proteínas de fusão secretadas, use um software de análise de imagem do fabricante confocal ou um programa de processamento de imagem como o ImageJ, que pode ser baixado gratuitamente on-line. Consulte um manual para obter detalhes sobre como quantificar sinais fluorescentes de acordo.
- Para observar proteínas fluorescentes em tecidos de milho durante o desenvolvimento de cepas fúngicas transgênicas, ajustar os parâmetros básicos de aquisição de imagens. Identifique as melhores configurações de excitação/emissão com base no marcador fluorescente selecionado.
Resultados
Os exemplos a seguir descrevem resultados representativos após o uso do método de inoculação em bainha de milho. Esses exemplos demonstram a facilidade, a velocidade e a precisão com que a observação e a comparação das interações milho-fungo podem ser realizadas em tempo real com este ensaio otimizado. A imagem de células vivas também permite a extração de informações quantitativas, fornecendo uma ferramenta útil para estudos moleculares, citológicos e fisiológicos comparativos. Mais detalhes podem se...
Discussão
O método otimizado de inoculação de bainha foliar aqui descrito é modificado de um protocolo original que foi desenvolvido e aplicado em bainhas foliares de arroz 6,8,36. Permite observações diretas e detalhadas do crescimento e desenvolvimento de fungos em células vegetais vivas com microscopia de campo amplo ou confocal. O protocolo é adequado para caracterização, comparação e quantificação de uma variedade de fe...
Divulgações
Os autores declaram não ter interesses financeiros concorrentes e nada a divulgar.
Agradecimentos
Os autores agradecem ao USDA-NIFA por seu apoio financeiro (números de concessão 2018-67013-28489 e 2020-70410-32901). Quaisquer opiniões, achados, conclusões ou recomendações expressas neste manuscrito são exclusivamente dos autores e não refletem necessariamente as opiniões do Departamento de Agricultura dos EUA. Agradecemos à aluna visitante do Ciência sem Fronteiras, Mayara da Silva, pelas imagens que aparecem na Figura 6A e na Figura 7D. Também agradecemos ao Departamento de Fitopatologia da Universidade de Kentucky por fornecer acesso aos microscópios confocais Olympus.
Materiais
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
Referências
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados