Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mantar yaprakları mısır patojenlerinin neden olduğu enfeksiyonun canlı hücre görüntülemesi için müstakil mısır kılıfları
Bu Makalede
Özet
Bu makale, mantar bitki patojenleri ile mısır etkileşimlerinin tekrarlanabilir sitolojik, fizyolojik ve moleküler çalışmaları için ayrılmış mısır yaprağı kılıflarını kullanan optimize edilmiş bir aşılama protokolünü detaylandırmaktadır. Yaprak kılıfları, sabitlenmemiş dokularda canlı bitki ve mantar arasındaki hücresel etkileşimlerin gerçek zamanlı gözlemini kolaylaştırır.
Özet
Mısır yaprağı kılıflarını hemibiotrofik ve nekrotrofik yaprak patojenik mantarlarla aşılamak için bir protokolü optimize ettik. Yöntem, orijinal olarak pirinç yaprağı kılıflarına uygulanandan modifiye edilmiştir ve canlı bitki hücrelerinde mantar büyümesi ve gelişiminin doğrudan mikroskobik gözlemine izin verir. İki adet tam yaprak boğazı ile mısır fidelerinden toplanan yaprak kılıfları, 20 μL damla 5 x 105 spor/mL mantar sporu süspansiyonu ile aşılanır ve sürekli floresan ışık altında 23 °C'de nem odalarında inkübe edilir. 24-72 saat sonra, kimyasal fiksasyon veya temizleme gerektirmeden doğrudan görüntülenebilen optik olarak berrak bir numune olan tek bir epidermal hücre tabakası bırakmak için fazla doku bir tıraş bıçağıyla çıkarılır. Bitki ve mantar hücreleri deney süresince canlı kalır ve etkileşimler gerçek zamanlı olarak görselleştirilebilir. Kılıflar, enfeksiyon ve kolonizasyon sırasında konakçı ve patojen hücrelerin gelişimsel sitolojisini ve canlılığını incelemek için boyanabilir veya plazmolize tabi tutulabilir. Floresan proteinleri eksprese etmek için dönüştürülen mantar suşları, daha fazla çözünürlük için ve rekabetçi veya sinerjik etkileşimlerin değerlendirilmesini kolaylaştırmak için kılıflar üzerine aşılanabilir veya birlikte aşılanabilir. Floresan füzyon proteinlerini eksprese eden mantar suşları, plantadaki bu bireysel proteinlerin üretimini ve hedeflenmesini izlemek ve ölçmek için kullanılabilir. Aşılanmış kılıf dokuları, nükleik asitleri, proteinleri veya metabolitleri karakterize etmek için ekstrakte edilebilir. Bu kılıf tahlillerinin kullanımı, mısırda mantar patojenitesi mekanizmalarının ve ayrıca patojeniteye katkıda bulunan mantar protein efektörlerinin ve ikincil metabolitlerin ayrıntılı çalışmalarını büyük ölçüde ilerletmiştir.
Giriş
Hücresel düzeyde mekansal ve zamansal analizler, mantar-bitki etkileşimlerinin fizyolojisini ve sitolojisini anlamak için kritik öneme sahiptir. Kimyasal olarak sabitlenmiş 1,2,3 veya temizlenmiş ve boyanmış4 yaprak dokuları ve yapay zarlar5, geçmişte yaprak patojen gelişiminin sitolojisini ve bitki-mantar etkileşimlerini araştırmak için kullanılmıştır. Bununla birlikte, canlı konakçı dokulardaki enfeksiyon olaylarının fiksasyon veya temizleme olmadan gerçek zamanlı olarak araştırılması, görüntüleme için optik olarak şeffaf örneklerin hazırlanmasıyla ilgili teknik sorunlar nedeniyle zordur.
1940'ların sonlarında, canlı pirinç epidermal hücrelerinin pirinç patlaması mantarı Magnaporthe oryza6'ya karşı direncinin parlak alan mikroskobik araştırması için müstakil bir yaprak kılıfı aşılama protokolü geliştirilmiştir. Daha yakın zamanlarda, Colletotrichum ve Magnaporthe türleri tarafından konak kolonizasyonunun ayrıntılı moleküler, fizyolojik ve sitolojik gözlemleri, bu yaprak kılıfı yönteminin modifiye edilmiş versiyonlarının floresan proteinleri eksprese eden mantar dönüştürücüleri ve epifloresan ve konfokal mikroskopi dahil olmak üzere yüksek performanslı canlı hücre görüntüleme protokolleri ile birleştirilmesiyle büyük ölçüde kolaylaştırılmıştır 7,8,9,10,11,12,13.
Bu makale, hemibiyotrofik ve nekrotrofik yaprak mantar patojenleri tarafından enfeksiyon süreçlerinin gözlemlenmesi için ayrılmış mısır yaprağı kılıfları kullanılarak optimize edilmiş bir aşılama protokolünü detaylandırmaktadır. Antraknoz yaprak yanıklığı ve sap çürüklüğünün etken maddesi olan Colletotrichum graminicola (C. graminicola) ve Diplodia yaprak yanıklığına ve sap çürümesine neden olan Stenocarpella maydis'i incelemek için özel olarak kullandık. Bununla birlikte, yöntem diğer hemibiotrofik ve nekrotrofik yaprak mantar patojenlerine uygulanabilir olmalıdır. Bu eksize edilen yaprak kılıflarında enfeksiyon ve kolonizasyon olayları sırasındaki sitolojik ve fizyolojik yanıtlar, tüm yaprak bıçaklarındakilerebenzerdir 12,14,15. Ayrıca, kılıf epidermal hücrelerinin C. graminicola tarafından hemibiyotrofik kolonizasyonu, sap öz hücrelerininkolonizasyonuna benzer 16,17. Müstakil kılıflar, mantar penetrasyonu ve kolonizasyonunun yaprak bıçaklarından veya sap özü dokularından daha fazla eşzamanlılık ve deneysel tekrarlanabilirlik gösterir14,16,17,18. Çoğu mısır çeşidi bu protokol için kullanılabilir. Bununla birlikte, kılıflarda aşırı mor pigmentlere sahip akrabalı veya melezler, pigmentler görüntülemeye müdahale ettiği için daha az uygundur. Golden Jubilee tatlı mısır, çalışmalarımız için özellikle yararlı olmuştur, çünkü işlenmemiş tohumlar ticari olarak temin edilebilir, bitkiler birçok yaprak hastalığına karşı oldukça hassastır ve serada iyi büyürler. Amerika Birleşik Devletleri'ndeki ilk antraknoz sap çürüklüğü salgınları, 1970'lerde Indiana'da tatlı mısır mahsullerinin toplam kaybına neden oldu19,20. Bu yaprak kılıfı aşılama yöntemi, canlı ve yerel olarak öldürülmüş bitki hücrelerinde mantar büyümesini ve gelişimini doğrudan gözlemlemek ve ölçmek, mantar enfeksiyonuna uyumlu/uyumsuz yanıtlarda direnç reaksiyonlarını göstermek ve aynı kılıf üzerindeki mantar suşları arasındaki etkileşimleri gerçek zamanlı olarak test etmek için uygulanabilir.
Protokol
NOT: Yöntemin iş akışı Şekil 1'de gösterilmiştir.
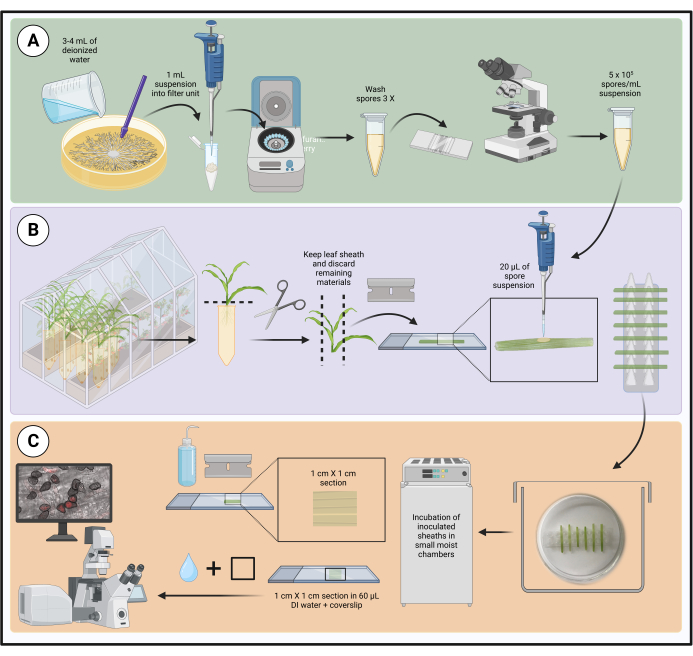
Şekil 1: Ayrılmış mısır yaprağı kılıfları kullanılarak optimize edilmiş aşılama protokolündeki adımlar. Spor süspansiyon hazırlama, yaprak kılıfı aşılama ve canlı hücre mikroskobu için numune hazırlama sırasıyla yeşil (A), mor (B) ve turuncu (C) kutularda vurgulanmıştır. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Bitki ve mantar materyali
- Bitki büyümesi
- Serada (14 saat açık/27 °C ve 10 saat karanlık/22 °C) SC10 kaplarda mısır fideleri (Malzeme Tablosuna bakınız) yetiştirin (bkz. Malzeme Tablosu). Üç kısım ticari saksı toprağından (Malzeme Tablosuna bakınız) ve iki kısım buharla sterilize edilmiş üst topraktan oluşan bir büyüme ortamı kullanın.
- Fideleri sabahları her gün bir kez üstten sulama sistemi ile 2 dakika sulayın.
- Fideleri toprak seviyesinde keserek V2 aşamasında hasat edin. V2 büyüme aşamasına, fideler 5 ila 10 cm boyunda olduğunda ve iki görünür yakalı yaprağasahip olduğunda ulaşılır 21.
- Bitkileri nemli bir kağıt havluyla sarın ve daha sonraki işlemler için laboratuvara taşınmak üzere plastik bir torbaya koyun.
- Mantar kültürleri
- Depolanmış mantar silika stok kültürleriniaseptik koşullar altında yeniden etkinleştirin 22istila edilmiş silikanın yaklaşık 50 granülünü uygun bir agar ortamına serperek. Morfolojik değişiklikleri ve patojenite kaybını önlemek için, alt kültür suşları reaktivasyondan sonra 3x'ten fazla değildir. Patates dekstroz agar (PDA; Malzeme Tablosuna bakınız) rutin olarak C. graminicola kültüründe kullanılırken, yulaf ezmeli agar (OA; Malzeme Tablosuna bakınız) S. maydis için kullanılır.
- Mantar stoklarını kültürlemek için PDA'yı hazırlamak için, 500 mL deiyonize (DI) su içinde ticari olarak hazırlanmış 19.5 g susuz pda'yı askıya alın. OA yapmak için, ticari olarak hazırlanmış 36 g kurutulmuş OA'yı DI suda 15-30 dakika kaynatın, üç kat tülbentten süzün ve süzüntüyü DI su ile 500 mL'ye getirin. Sterilize etmek için otoklav ortamı.
- Transformant suşlarla çalışırken erimiş, soğutulmuş ortamı uygun bir antibiyotikle (örneğin, higromisin B, genetin) artırın. 500 mL ortamdaki nihai higromisin veya genetin konsantrasyonları sırasıyla 250 μg / mL ve 100 μg / mL'dir.
- Sporlanan bir miselyum gelişene kadar kültürleri en uygun koşullar altında inkübe edin. Colletotrichum graminicola ve S. maydis , sürekli floresan ışığı ve ortam nemi seviyeleri ile 23 ° C'de iyi büyür. Sporülasyon, S. maydis için aşılamadan (dai) 7 gün sonra veya C. graminicola için 14 dai gerçekleşir.
2. Yaprak kılıfı aşılamaları
- Camyünü filtre ünitesi montajı
- Kapağı ve 0.5 mL'lik bir mikrosantrifüj tüpünün konik tabanından yaklaşık 1.5 mm kesmek için ağır hizmet tipi makas veya makas kullanın (bkz.
- Şekil 0.5'de gösterildiği gibi, orta deliği kapatmak için kesilen tüpün içine bir parça cam yünü (yaklaşık 0.5 cm x 2 cm; Malzeme Tablosuna bakın) yerleştirin.
- Borosilikat cam tahrişe neden olabileceğinden cam yünü keserken eldiven giyin.
- Yaprak kılıf destek raflarının hazırlanması
- Eteksiz 96 oyuklu bir PCR plakasını (Malzeme Tablosuna bakın) Şekil 8A'da gösterildiği gibi altı adet iki sütunlu (2 x 3 oyuklu) destek rafına kesin.
- İki sütunlu rafları, kuyuların konik tabanları yukarı ve düz üst kısımları aşağı bakacak şekilde çevirin (Şekil 3B).
- Her bir desteği nemli filtre kağıdı içeren bir cam Petri plakasına yerleştirin ve kapakla kapatın (bkz. Bu ünite, kılıflar için küçük bir nem odası işlevi görür.
- Aşı hazırlama
- Her mantar suşu için, monte edilmiş bir cam yünü filtre ünitesini, Şekil 2'de gösterildiği gibi sağlam bir steril 1,5 mL mikrosantrifüj tüpüne yerleştirin. İkincisi, bir toplama tüpü olarak işlev görür.
- Tüpleri etiketleyin.
- Önce her bir plakayı 3-4 mL steril DI su ile doldurarak spor yapan kültürlerden conidia hasat edin. Bazı durumlarda koloni yüzeyinde bir sıvı tabakası oluşturmak için daha fazla su gerekebilir. Bu sistemde ıslatıcı maddelere gerek yoktur.
- Tüm plakayı eşit şekilde kazımak için steril bir konik uçlu havaneli ( Malzeme Tablosuna bakın) kullanarak agardaki sporları gevşetin.
- 1 mL spor süspansiyonunu aseptik olarak bir cam yünü filtre ünitesine uygulayın ve sporların yerçekimi ile toplama tüpüne akmasına izin verin.
- Filtrelenmiş spor süspansiyonlarını içeren toplama tüplerini 3.500 x g'da 5 dakika santrifüjleyin. Sporlar, mikrosantrifüj tüpünün dibinde peletlenmelidir.
NOT: C. graminicola sporlarının burada önerilenden daha yüksek hızlarda santrifüjlenmesi, önemli bir canlılık kaybına neden olur. - Sıvıyı otoklavlanabilir bir kaba dökün, 1 mL steril DI su ekleyin ve peletlenmiş sporları yeniden süspanse etmek için hafifçe çalkalayın. Adım 2.3.6'daki gibi santrifüjleyin.
- Çimlenmeyi veya penetrasyonu azaltabilecek otomatik inhibitörler içerebilecek herhangi bir konidiyal matrisi çıkarmak için sporları 3x yıkayın.
- Üçüncü yıkamadan sonra, miktar tayini için sporları yeniden süspanse etmek için 300-500 μL steril DI su ekleyin.
- Spor konsantrasyonunu belirlemek için 100x büyütmede bileşik mikroskop altında bir hemositometre kullanın. Saymadan önce spor boyama gerekli değildir.
- Steril DI su ile 5 x 105 spor/mL süspansiyon hazırlayın.
NOT: C. graminicola spor süspansiyonu, hızlı canlılık kaybından önce oda sıcaklığında 4 saatten fazla tutulamaz. Soğutma conidia canlılığı artırmaz.
- Kılıf aşıları
- Bitkileri mantar suşları ile aşılamadan önce ilgili biyogüvenlik uygulamalarını ve prosedürlerini kontrol edin.
- Kılıfın üst üste binen kenarı boyunca bir küçük resim geçirerek kılıfı V2 fidelerinin ilk gerçek yaprağından çıkarın ve sürgünden yavaşça gevşetin. Çıkarmaya çalışmadan önce kılıfı çekimin her iki tarafından gevşetin.
- Geri kazanılan yaprak kılıflarını 3-5 cm'lik parçalar halinde kesin. Aşılamadan önce kılıfların yüzeyini dezenfekte etmek gerekli değildir.
- İç (adaksiyal) epidermal tabakayı ortaya çıkarmak için her bir parçayı çok nazikçe açın.
- Kılıfları aşılama için hazırlarken, kurumasını önlemek için kalan eksize edilmiş kılıfları nemli bir kağıt havluyla sarılı tutun.
- Şekil 20'te gösterildiği gibi, kılıf parçasının ortasındaki iç yüzeye, doğrudan orta kaburganın üzerine 4 μL mantar sporu süspansiyonu yerleştirin.
- Aşılanmış yaprak kılıflarını, Şekil 5'te gösterildiği gibi nemli bir filtre kağıdı içeren bir cam Petri plakasının içindeki desteğe orta kaburga altta olacak şekilde yatay olarak yerleştirin.
- Her raf yedi adede kadar kılıf tutar. Numune hazırlama veya inkübasyon sırasında meydana gelebilecek kopya kaybını telafi etmek için suş başına en az beş kılıf aşılayın.
- Küçük nem odalarını nemli çimlenme kağıdıyla kaplı şeffaf bir saklama kutusuna yerleştirin (Malzeme Tablosuna bakın).
- Kutuyu kapakla örtün. Kutuyu 23 °C'de, mantara ve gözlemlenecek mantar gelişim aşamalarına bağlı olarak amaçlanan zaman boyunca sürekli aydınlatma ile inkübe edin. C. graminicola ile aşılanmış mısır kılıfları için zaman seyrinin bir özeti Tablo 1'de verilmiştir.
- Kılıflarda hastalık belirtileri/semptomları olup olmadığını her gün kontrol edin ve hem çimlenmeyi hem de filtre kağıtlarını nemli tutun. Yaprak kılıfları, aşılama yokluğunda belirgin bitki hücresi ölümü veya bozulması olmadan 6 güne kadar tutulabilir.
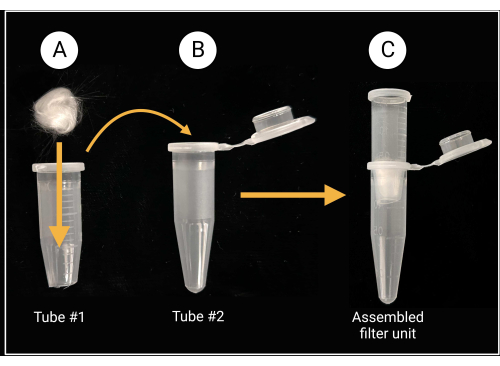
Şekil 2: Camyünü filtre ünitesinin hazırlanması. (A) Konik tabanı çıkarılmış mikrosantrifüj tüpü 1'in içine 0,5 cm x 0,5 cm'lik bir cam yünü top yerleştirilir. (İ.Ö.) Filtre tüpü daha sonra spor süspansiyon hazırlığı için monte edilmiş bir filtre ünitesi oluşturmak üzere mikrosantrifüj tüpü 2'ye yerleştirilir. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
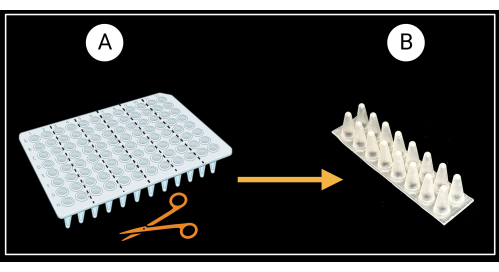
Şekil 3: Eteksiz 96 oyuklu bir PCR plakasını kesme yöntemi. (A) PCR plakası altı destek rafına kesilmiş, 8 x 2 kuyucuk. Tek bir kılıf desteği örneği (B )'de gösterilmiştir. Yaprak kılıfları destek üzerine yatay olarak döşenir. BioRender.com ile oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Kılıf aşılama yöntemi. Kılıf bölümünün adaksiyal yüzeyine doğrudan uygulanan tek damla aşılama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
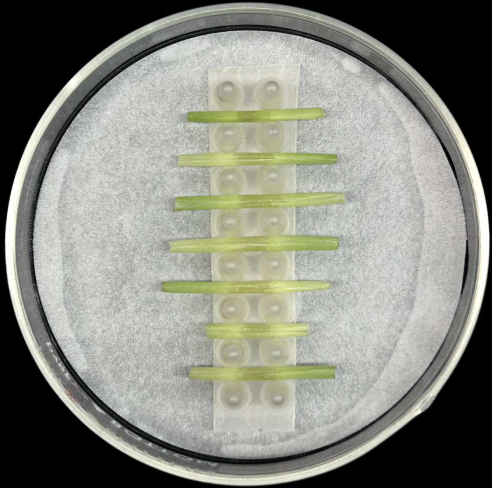
Şekil 5: Kılıf inkübasyon yöntemi. Aşılanmış yaprak kılıfları, nemlendirilmiş filtre kağıdı içeren bir cam Petri plakasının içindeki bir destek rafına yatay olarak yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Canlı hücre mikroskobu
- Mikroskopi için numune hazırlama
- Yapışmamış sporları veya yüzeysel mantar büyümesini gidermek için kılıf parçalarını steril DI suyla nazikçe durulayın.
- Kılıfı, kılıf parçasının adaksiyal (iç) yüzeyi aşağı bakacak ve abaksiyal (dış) yüzey en üstte olacak şekilde temiz bir cam mikroskop lamına ( Malzeme Tablosuna bakın) yerleştirin.
- Kılıf uçlarından yaklaşık 1 cm kesmek için yeni bir tek kenarlı tıraş bıçağı kullanın ( Malzeme Tablosuna bakın) ve orta damarın her iki tarafındaki lamina dokusunun çoğunu çıkarın.
- Abaksiyal orta damardan dokuyu tıraş etmek ve aşılanan noktanın üzerindeki adaksiyal yüzeydeki epidermal tabakayı ortaya çıkarmak için tıraş bıçağını kılıfa göre 90°'lik bir açıyla tutun. Düzgün bir kalınlık sağlamaya çalışın. Yaprak kılıfları traş edildikten sonra, numuneye zarar verebileceğinden daha fazla budamak önerilmez.
- Tıraşlanan bölümlerin 1 cm x 1 cm'den büyük olmamasına dikkat edin. Bu işlem sırasında kılıfın ortasına bastırmaktan kaçının. Farklı spor süspansiyonları ile aşılanmış kılıflarla çalışırken, eldivenleri dezenfekte edin ve numuneler arasında tıraş bıçağını değiştirin.
- Temiz bir cam mikroskop lamını hazır bulundurun. Kılıf bölümünü bir kenardan kaldırın ve dikkatlice yeni bir kızağa aktarın. Kılıfın aşılanmış (adaksiyal) yüzeyi, objektif merceğe en yakın olan en üstte olmalıdır. Mantar yapılarına zarar vermemek için bölümleri nazikçe monte edin.
- Bölüme 60 μL steril DI su uygulayın ve 24 mm x 60 mm'lik bir cam lamel ekleyin (bkz. Hava kabarcıklarını önlemek için bunu yavaşça yapın.
- Mikroskopi için hazır olduğunuzda, her bir kenara küçük bir damla koyarak ve ardından damlaları bir oje fırçasıyla birleştirerek lameli şeffaf oje ile kapatın ( Malzeme Tablosuna bakın).
NOT: Bu kılıf protokolü, sitolojik boyalarla, örneğin 4',6-diamidino-2-fenilindol (DAPI), nötr kırmızı veya tripan mavisi ile veya bitki hücresi canlılığını değerlendirmek için hücre plazmolizinin gözlemlenmesi için kullanılabilir. Kılıf boyama veya hücre plazmoliz deneyleri için lamel sızdırmaz hale getirmeyin. - Plazmoliz deneyleri için, lamel bir kenarına hipertonik bir çözelti (0.75 M sükroz veya 1 M sodyum klorür) ekleyin ve çözeltiyi numune boyunca lamel diğer kenarına çekmek için katlanmış tüy bırakmayan bir kağıt mendil kullanın. Boyama için, leke çözeltisini uygulamak için benzer bir yöntem kullanın.
- Geniş alan mikroskobu
- Yaprak kılıfları mikroskop lamlarına monte edildikten sonra, 400x büyütmede geniş alan ışık mikroskobu kullanarak mantar kolonizasyonu açısından inceleyin.
- Mantar yapılarını ayrıntılı olarak gözlemlemek için, numunelerin daha iyi görüntü kalitesi için yağ yerine suya daldırma objektifi kullanın. Kırılma indisi uyumsuzluğundan kaynaklanan küresel sapma görüntü bozulmasına neden olabilir. Geniş alan ışık mikroskopları ve konfokal mikroskoplar için su hedefleri mevcuttur.
- Kılıf başına nispi kolonizasyon miktarını belirlemek için, 100x büyütmede geniş alan ışık mikroskobu kullanarak her bir mantar penetrasyon bölgesinden istila edilen mısır hücrelerinin sayısını sayın. Bu niceleme, suşları, tedavileri ve/veya gelişim aşamalarını karşılaştıran herhangi bir istatistiksel analizden önce uygun bir tarama adımıdır.
- Konfokal lazer tarama mikroskobu
- Transgenik mantar suşlarının gelişimi sırasında mısır dokularındaki floresan proteinleri gözlemlemek için temel görüntü elde etme parametrelerini ayarlayın. Seçilen floresan işaretleyiciye göre en iyi uyarma/emisyon ayarlarını belirleyin.
NOT: Salgılanan proteinlerle oluşturulan floresan füzyonları analiz ederken 60x su hedefi tercih edilir. Modern konfokal mikroskoplar, artefaktları ve şekil sapmalarını önlemek için yüksek oranda düzeltilmiş suya daldırma hedeflerine sahiptir. - Floresan proteinlerin canlı hücre görüntülemesi amaçlanıyorsa, otofloresan için kontrol olarak dönüştürülmemiş mantar suşları kullanın. Ters konfokal mikroskopta ve mCherry floresan proteini için mantar-konak dinamiklerini yakalamak için aşağıdaki görüntü toplama parametrelerini kullanın. Lazer gücünü %5'e kadar ayarlayın, ifade seviyesine bağlı olarak 450-600 yüksek voltaj (HV), 1.375 X kazanç, %3 ofset, bölüm başına beş mısır hücresine kadar analiz için 1 optik yakınlaştırma faktörü ve bireysel hif için 2-5 optik yakınlaştırma faktörü.
NOT: Yüksek çözünürlüklü Z-yığını konfokal görüntüler, üç boyutlu veriler ve konakçı ile patojen arasındaki gerçek zamanlı etkileşimlerin daha iyi bir görünümünü sağlar. - Salgılanan füzyon proteinlerine karşılık gelen floresan yoğunluklarının ölçülmesi için, konfokal üreticinin görüntü analiz yazılımını veya çevrimiçi olarak ücretsiz olarak indirilebilen ImageJ gibi bir görüntü işleme programını kullanın. Floresan sinyallerinin buna göre nasıl ölçüleceğine ilişkin ayrıntılar için bir kılavuza bakın.
- Transgenik mantar suşlarının gelişimi sırasında mısır dokularındaki floresan proteinleri gözlemlemek için temel görüntü elde etme parametrelerini ayarlayın. Seçilen floresan işaretleyiciye göre en iyi uyarma/emisyon ayarlarını belirleyin.
Sonuçlar
Aşağıdaki örnekler, mısır yaprağı kılıfı aşılama yönteminin kullanılmasını takiben temsili sonuçları açıklamaktadır. Bu örnekler, bu optimize edilmiş tahlil ile mısır-mantar etkileşimlerinin gözlemlenmesi ve karşılaştırılmasının gerçek zamanlı olarak gerçekleştirilebileceği kolaylık, hız ve hassasiyeti göstermektedir. Canlı hücre görüntüleme ayrıca nicel bilgilerin çıkarılmasına izin vererek karşılaştırmalı moleküler, sitolojik ve fizyolojik çalışmalar için y...
Tartışmalar
Burada açıklanan optimize edilmiş yaprak kılıfı aşılama yöntemi, pirinç yaprağı kılıfları6,8,36 için geliştirilmiş ve uygulanmış olan orijinal bir protokolden değiştirilmiştir. Geniş alan veya konfokal mikroskopi ile canlı bitki hücrelerinde mantar büyümesi ve gelişiminin doğrudan, ayrıntılı gözlemlerine izin verir. Protokol, mısır kolonizasyonu sırasında, uyumlu ve uyumsuz etkileşimler sı...
Açıklamalar
Yazarlar, rekabet eden hiçbir mali çıkarları olmadığını ve ifşa edecek hiçbir şeyleri olmadığını beyan ederler.
Teşekkürler
Yazarlar mali destekleri için USDA-NIFA'ya teşekkür eder (hibe numaraları 2018-67013-28489 ve 2020-70410-32901). Bu yazıda ifade edilen herhangi bir görüş, bulgu, sonuç veya öneri yalnızca yazarlara aittir ve ABD Tarım Bakanlığı'nın görüşlerini yansıtmayabilir. Brezilya'dan Sınır Tanımayan Bilim misafir öğrencisi Mayara de Silva'ya Şekil 6A ve Şekil 7D'de yer alan görüntüler için teşekkür ederiz. Ayrıca, Olympus konfokal mikroskoplarına erişim sağladığı için Kentucky Üniversitesi Bitki Patolojisi Bölümü'ne de teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
Referanslar
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır