需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于真菌叶面玉米病原体感染的活细胞成像的分离玉米鞘
摘要
这份手稿详细介绍了一种优化的接种方案,该方案使用分离的玉米叶鞘对玉米与真菌植物病原体的相互作用进行可重复的细胞学、生理学和分子学研究。叶鞘有助于实时观察未固定组织中活植物和真菌之间的细胞相互作用。
摘要
我们优化了一种方案,用半生物营养和坏死性叶面病原真菌接种玉米叶鞘。该方法从最初应用于水稻叶鞘的方法进行了修改,并允许直接在显微镜下观察活植物细胞中的真菌生长和发育。从具有两个完全出现的叶领的玉米幼苗收集的叶鞘接种20μL滴5×105 孢子/ mL真菌孢子悬浮液,并在连续荧光下在23°C的湿度室中孵育。24-72小时后,用剃须刀片去除多余的组织,留下单层表皮细胞,这是一种光学透明的样品,可以直接成像,无需化学固定或清除。植物和真菌细胞在实验期间保持活力,相互作用可以实时可视化。可以对鞘进行染色或进行等离子体分解,以研究感染和定植过程中宿主和病原体细胞的发育细胞学和活力。转化为表达荧光蛋白的真菌菌株可以接种或共接种在鞘上,以提高分辨率并促进竞争或协同相互作用的评估。表达荧光融合蛋白的真菌菌株可用于跟踪和量 化植物中这些单个蛋白的产生和靶向。可以提取接种的鞘组织以表征核酸、蛋白质或代谢物。这些鞘测定的使用极大地推进了对玉米真菌致病机制以及真菌蛋白效应物和次生代谢物的详细研究。
引言
细胞水平的空间和时间分析对于理解真菌-植物相互作用的生理学和细胞学至关重要。过去曾使用化学固定的叶面组织 1,2,3 或清除和染色 4 以及人造膜5 来研究叶面病原体发育和植物-真菌相互作用的细胞学。然而,由于与制备用于成像的光学透明样品相关的技术问题,在不固定或清除的情况下实时研究活体宿主组织中的感染事件具有挑战性。
1940 年代后期开发了一种分离的叶鞘接种方案,用于明场显微镜研究活水稻表皮细胞对稻瘟病真菌 Magnaporthe oryza6 的抗性。最近,通过将这种叶鞘方法的改良版本与表达荧光蛋白的真菌转化体相结合,以及高性能活细胞成像方案(包括落射荧光和共聚焦显微镜)7,8,9,10,11,12,13.
本文详细介绍了一种优化的接种方案,该方案使用分离的玉米叶鞘来观察半生物营养和坏死性叶面真菌病原体的感染过程。我们专门用它来研究炭疽病叶枯病和茎腐病的病原体禾本科菌(C. graminicola)和引起双枯病叶枯病和茎腐病的Stenocarpella maydis。但该方法应适用于其他半生物营养性和坏死性叶面真菌病原体。这些切除的叶鞘在感染和定植事件期间的细胞学和生理反应与整个叶片中的细胞学和生理反应相似12,14,15。此外,禾谷梭菌对鞘状表皮细胞的半生物营养定植类似于茎髓细胞的定植16,17。与叶片或茎髓组织相比,分离的鞘显示出更大的真菌渗透和定植的同步性和实验可重复性14,16,17,18。大多数玉米品种可用于该协议。然而,鞘中紫色颜料过多的近交系或杂交种不太合适,因为颜料会干扰成像。金禧甜玉米对我们的研究特别有用,因为未经处理的种子是市售的,植物极易受到许多叶面病害的影响,而且它们在温室中生长良好。1970 年代,美国炭疽病茎腐病的第一次流行导致印第安纳州甜玉米作物完全损失19,20。这种叶鞘接种方法可用于直接观察和量化活细胞与局部杀死的植物细胞中的真菌生长和发育,以证明对真菌感染的相容/不相容反应中的抗性反应,并实时测试同一鞘上的真菌菌株之间的相互作用。
研究方案
注:该方法的工作流程如 图1所示。
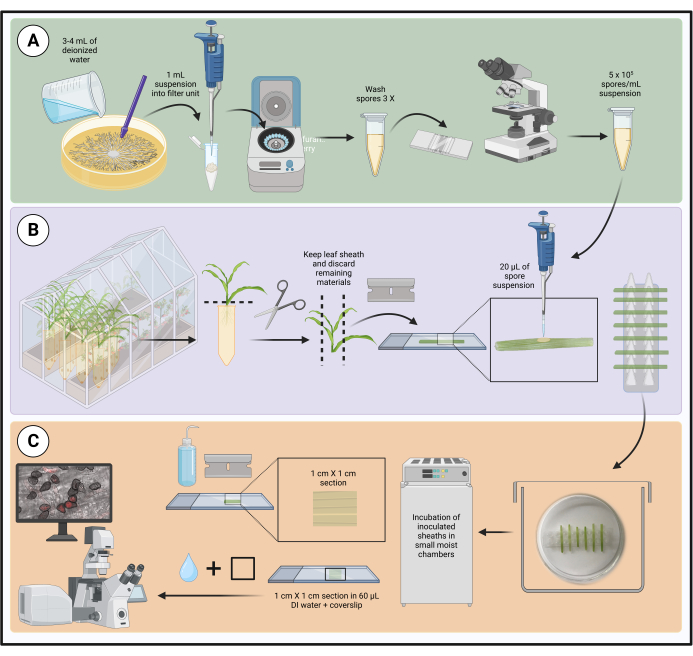
图1:使用分离的玉米叶鞘优化接种方案的步骤。 孢子悬浮液制备、叶鞘接种和活细胞显微镜样品制备分别以绿色 (A)、紫色 (B) 和橙色 (C) 框突出显示。用 BioRender.com 创建。 请点击这里查看此图的较大版本.
1.植物和真菌材料
- 植物生长
- 在SC10容器(见材料表)的温室(14小时光照/ 27°C和10小时黑暗/ 22°C)中种植玉米幼苗(见材料表)。使用由三份商业盆栽土(见材料表)和两份蒸汽灭菌表土组成的生长培养基。
- 每天早上用高架灌溉系统给幼苗浇水 2 分钟。
- 通过在土壤水平上切割幼苗,在 V2 阶段收获幼苗。当幼苗高 5 至 10 厘米并有两片可见的有领叶时,达到 V2 生长阶段21.
- 用湿纸巾包裹植物,然后将它们放入塑料袋中,以便运送到实验室进行进一步处理。
- 真菌培养物
- 通过在适当的琼脂培养基上撒上约50粒受感染的二氧化硅,在无菌条件下22重新激活储存的真菌二氧化硅原料培养物。为了避免形态变化和致病性丧失,传代菌株在重新激活后不超过 3 倍。马铃薯葡萄糖琼脂(PDA;见 材料表)通常用于培养 禾谷梭 菌,而燕麦琼脂(OA;见 材料表)用于 培养梅迪斯葡萄球菌。
- 为了制备用于培养真菌储备液的PDA,将19.5g商业制备的脱水PDA悬浮在500mL去离子(DI)水中。为了制备OA,将36g商业制备的脱水OA在去离子水中煮沸15-30分钟,过滤三层粗棉布,并用去离子水将滤液带入500毫升。高压灭菌培养基进行灭菌。
- 在处理转化菌株时,用适当的抗生素(例如潮霉素 B、遗传素)增强熔融的冷却培养基。500 mL 培养基中潮霉素或遗传素的最终浓度分别为 250 μg/mL 和 100 μg/mL。
- 在最佳条件下孵育培养物,直到孢子菌丝体发育。 Colletotrichum graminicola 和 S. maydis 在 23 °C 下生长良好,具有连续荧光和环境湿度水平。孢子形成发生在接种后 7 天 (dai) (S. maydis ) 或 14 dai ( C. graminicola) 接种后 14 天。
2.叶鞘接种
- 玻璃棉过滤单元总成
- 使用重型剪刀或剪刀剪掉盖子,距离 1.5 mL 微量离心管的锥形底部约 0.5 毫米(参见 材料表)。
- 将一块玻璃棉(约 0.5 cm x 0.5 cm;参见 材料表)放入切割管内以覆盖中心孔,如 图 2 所示。
- 切割玻璃棉时戴上手套,因为硼硅酸盐玻璃会引起刺激。
- 叶鞘支撑架的制备
- 如图3A所示,将无裙边的96孔PCR板(参见材料表)切成六个两柱(8×2孔)支持架。
- 翻转两柱架,使孔的锥形底部朝上,平顶朝下(图3B)。
- 将每个支架放入装有湿润滤纸的玻璃培养皿中,并用盖子盖住(参见 材料表)。该装置用作护套的小型湿度室。
- 接种物制备
- 对于每种真菌菌株,将一个组装好的玻璃棉过滤单元放入完整的无菌 1.5 mL 微量离心管中,如 图 2 所示。后者用作收集管。
- 给试管贴上标签。
- 首先用 3-4 mL 无菌 DI 水淹没每个板,从孢子培养物中收获分生孢子。在某些情况下,可能需要更多的水才能在菌落表面产生一层液体。该系统不需要润湿剂。
- 使用无菌锥形尖杵(参见 材料表)从琼脂中松开孢子,以均匀地刮擦整个平板。
- 无菌将 1 mL 孢子悬浮液施加到玻璃棉过滤装置上,并让孢子通过重力流入收集管。
- 将含有过滤的孢子悬浮液的收集管以3,500× g 离心5分钟。孢子应在微量离心管底部沉淀。
注意:以高于此处推荐的速度离心 禾谷梭 菌孢子会导致活力显着丧失。 - 将液体倒入可高压灭菌的容器中,加入 1 mL 无菌去离子水,轻轻搅拌以重悬沉淀的孢子。如步骤2.3.6所示离心。
- 洗涤孢子 3 次以去除任何可能含有可能减少发芽或渗透的自身抑制剂的分生孢子基质。
- 第三次洗涤后,加入 300-500 μL 无菌去离子水以重悬孢子进行定量。
- 在复合显微镜下以100倍放大倍率使用血细胞计数器测定孢子浓度。计数前不需要孢子染色。
- 用无菌去离子水制备 5 x 105 孢子/mL 悬浮液。
注意: C. graminicola 孢子悬浮液可以在室温下保持不超过 4 小时,然后迅速失去活力。冷藏分生孢子不会增加存活率。
- 鞘接种
- 在用真菌菌株接种植物之前,检查相关的生物安全实践和程序。
- 沿着鞘的重叠边缘运行拇指指甲,从 V2 幼苗的第一片真叶上取下鞘,然后轻轻地将其从枝条上松开。在尝试取下枝条之前,先松开枝条两侧的护套。
- 将回收的叶鞘切成 3-5 厘米的段。接种前无需对护套进行表面消毒。
- 非常轻柔地展开每个部分,露出内(近轴)表皮层。
- 在准备接种鞘时,请用湿纸巾包裹剩余的切除鞘,以免干燥。
- 将 20 μL 真菌孢子悬浮液放在鞘片中心的内表面上,中肋正上方,如 图 4 所示。
- 将接种的叶鞘水平放置,中肋位于底部,在含有湿润滤纸的玻璃培养皿内的支架中,如 图5所示。
- 每个机架最多可容纳七个护套。每个菌株至少接种五个鞘,以补偿样品制备或孵育过程中可能发生的重复损失。
- 将小湿度室放入衬有湿发芽纸的透明储物盒中(参见 材料表)。
- 用盖子盖住盒子。将盒子在23°C下连续照明孵育预期的时间过程,这取决于真菌和将要观察到的真菌发育阶段。表1总结了接种禾谷梭菌的玉米鞘的时程。
- 每天检查护套上是否有疾病的迹象/症状,并保持发芽纸和滤纸湿润。在没有接种的情况下,叶鞘可以保留长达 6 天,而不会出现明显的植物细胞死亡或降解。
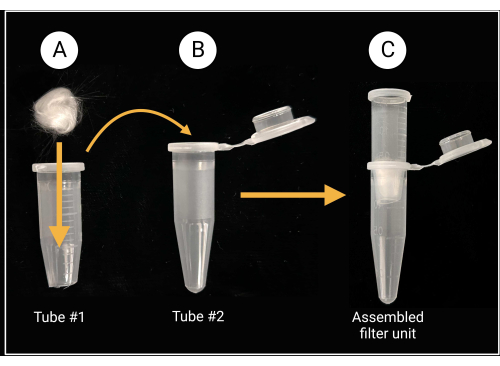
图 2:玻璃棉过滤装置的制备。(A) 将一个 0.5 cm x 0.5 cm 的玻璃棉球放置在微量离心管 1 内,该离心管 1 的锥形底部被移除。 (B-C) 然后将过滤管放入微量离心管2中,以产生用于孢子悬浮液制备的组装过滤单元。用 BioRender.com 创建。 请点击这里查看此图的较大版本.
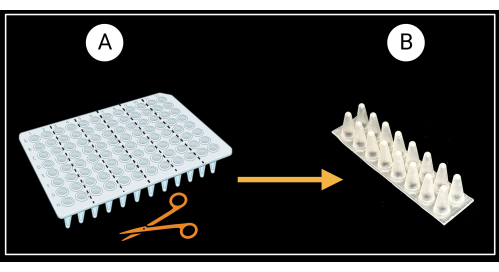
图 3:切割无裙边 96 孔 PCR 板的方法。(A) 将PCR板切成6个支撑架,8 x 2孔。 (B )中描述了单个护套支架的示例。叶鞘水平放置在支架上。用 BioRender.com 创建。 请点击这里查看此图的较大版本.

图4:鞘接种方法。 将单滴接种物直接施用于鞘切面的近轴表面。 请点击这里查看此图的较大版本.
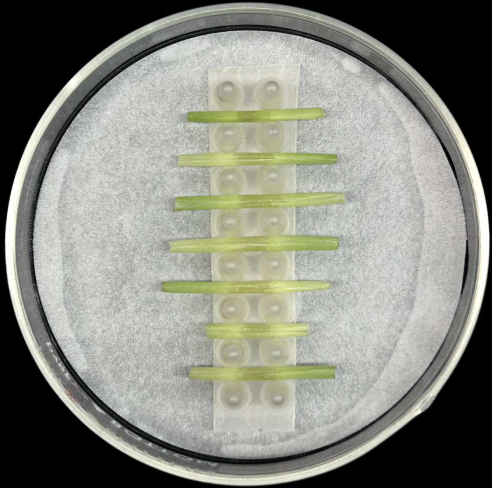
图5:鞘培养方法。 接种的叶鞘水平放置在装有湿滤纸的玻璃培养皿内的支撑架中。 请点击这里查看此图的较大版本.
3. 活细胞显微镜
- 显微镜样品制备
- 用无菌去离子水轻轻冲洗鞘片,以去除任何未粘附的孢子或浅表真菌生长。
- 将护套放在干净的玻璃显微镜载玻片上(参见 材料表),护套片的近轴(内)面朝下,背轴(外)表面最上方。
- 使用新的单刃剃须刀片(见 材料表)从鞘端修剪约 1 厘米,并去除中肋两侧的大部分椎板组织。
- 将剃须刀片与刀鞘成 90° 角,从远轴中肋上剃除组织,并暴露接种点上方近轴表面上的表皮层。尽量保持均匀的厚度。一旦叶鞘被剃掉,不建议进一步修剪,因为这可能会损坏样品。
- 确保剃光部分的尺寸不超过 1 厘米 x 1 厘米。在此过程中避免按压护套的中心。当使用接种有不同孢子悬浮液的护套时,请消毒手套并在样品之间更换剃须刀片。
- 准备好干净的玻璃显微镜载玻片。从一侧抬起护套部分,然后小心地将其转移到新的滑轨上。鞘的接种(近轴)表面应位于最上方,最靠近物镜。轻柔地安装部分以避免损坏真菌结构。
- 将 60 μL 无菌去离子水施加到切片中,并加入 24 mm x 60 mm 玻璃盖玻片(参见 材料表)。慢慢做以避免气泡。
- 准备进行显微镜检查时,用透明指甲油密封盖玻片(参见 材料表),在每个边缘放置一小滴,然后用指甲油刷将滴液连接在一起以形成无缝密封。
注:该鞘方案可用于细胞学染色,例如 4′,6-二脒基-2-苯基吲哚 (DAPI)、中性红或台盼蓝,或用于观察细胞等离子体分解以评估植物细胞活力。对于鞘染色或细胞浆溶解测定,不要密封盖玻片。 - 对于等离子体分解测定,将高渗溶液(0.75 M 蔗糖或 1 M 氯化钠)添加到盖玻片的一个边缘,并使用折叠的无绒薄纸将溶液穿过样品到盖玻片的另一边缘。对于染色,使用类似的方法涂抹染色溶液。
- 宽视场显微镜
- 将叶鞘安装在显微镜载玻片上后,使用400倍放大倍率的宽视场光学显微镜检查它们是否有真菌定植。
- 要详细观察真菌结构,请使用水浸物镜而不是油,以获得更好的样品图像质量。由于折射率不匹配导致的球面像差可能会导致图像质量下降。水物镜可用于宽视场光学显微镜和共聚焦显微镜。
- 为了确定每个鞘的相对定植量,使用100倍放大倍率的宽场光学显微镜计算从每个真菌穿透位点侵入的玉米细胞的数量。在比较菌株、治疗和/或发育阶段的任何统计分析之前,这种定量是一个适当的筛选步骤。
- 共聚焦激光扫描显微镜
- 为了观察转基因真菌菌株发育过程中玉米组织中的荧光蛋白,调整基本图像采集参数。根据所选荧光标记确定最佳激发/发射设置。
注意:在分析用分泌蛋白构建的荧光融合物时,最好使用 60 倍水物镜。现代共聚焦显微镜具有高度校正的水浸物镜,以避免伪影和形状像差。 - 如果打算对荧光蛋白进行活细胞成像,请使用未转化的真菌菌株作为自发荧光的对照。使用以下图像采集参数在倒置共聚焦显微镜上捕获真菌宿主动力学和 mCherry 荧光蛋白。根据表达水平,将激光功率设置为 5%,450-600 高压 (HV),1.375 倍增益,3% 偏移,光学变焦系数为 1,用于分析每个切片最多 5 个玉米细胞,光学变焦系数为 2-5 单个菌丝。
注意:高分辨率 Z 堆叠共聚焦图像提供三维数据,并更好地了解宿主与病原体之间的实时相互作用。 - 对于与分泌的融合蛋白相对应的荧光强度的定量,请使用共聚焦制造商的图像分析软件或图像处理程序,如ImageJ,可以在线免费下载。有关如何相应地量化荧光信号的详细信息,请参阅手册。
- 为了观察转基因真菌菌株发育过程中玉米组织中的荧光蛋白,调整基本图像采集参数。根据所选荧光标记确定最佳激发/发射设置。
结果
以下示例描述了使用玉米叶鞘接种方法后的代表性结果。这些示例表明,使用这种优化的检测方法可以实时完成玉米-真菌相互作用的观察和比较的便利性、速度和精确性。活细胞成像还可以提取定量信息,为比较分子、细胞学和生理学研究提供有用的工具。详情可参阅每份成功申请所引用的原始刊物。
示例数据1:在接种的叶鞘中使用染色和浆溶解来评估真菌状态和检测...
讨论
这里描述的优化的叶鞘接种方法是从为水稻叶鞘6,8,36开发并已应用于水稻叶鞘的原始方案修改而来的。它允许使用宽场或共聚焦显微镜直接、详细地观察活植物细胞中的真菌生长和发育。该方案适用于玉米定植过程中各种微观现象的表征、比较和定量,包括相容与不相容相互作用期间的真菌发育和宿主反应;植物中特定?...
披露声明
提交人声明,他们没有相互竞争的经济利益,也没有什么可披露的。
致谢
作者感谢USDA-NIFA的财政支持(资助号2018-67013-28489和2020-70410-32901)。本手稿中表达的任何意见、发现、结论或建议仅代表作者的观点,并不一定反映美国农业部的观点。我们感谢来自巴西的无国界科学访问学生Mayara de Silva提供的图像,这些图像出现在图 6A 和 图7D中。我们还要感谢肯塔基大学植物病理学系提供奥林巴斯共聚焦显微镜。
材料
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
参考文献
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。