Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Gaines de maïs détachées pour l’imagerie de cellules vivantes d’une infection par des agents pathogènes fongiques foliaires du maïs
Dans cet article
Résumé
Ce manuscrit détaille un protocole d’inoculation optimisé qui utilise des gaines de feuilles de maïs détachées pour des études cytologiques, physiologiques et moléculaires reproductibles des interactions du maïs avec les agents pathogènes fongiques des plantes. Les gaines foliaires facilitent l’observation en temps réel des interactions cellulaires entre la plante vivante et le champignon dans les tissus non fixés.
Résumé
Nous avons optimisé un protocole d’inoculation des gaines foliaires du maïs avec des champignons pathogènes foliaires hémibiotrophes et nécrotrophes. La méthode est modifiée par rapport à celle appliquée à l’origine aux gaines des feuilles de riz et permet une observation microscopique directe de la croissance et du développement fongiques dans les cellules végétales vivantes. Les gaines foliaires prélevées sur des semis de maïs dont le collet est entièrement levé sont inoculées avec 20 μL de suspensions de spores fongiques de 5 x 105 spores/mL et incubées dans des chambres humides à 23 °C sous une lumière fluorescente continue. Après 24 à 72 h, l’excès de tissu est retiré avec une lame de rasoir pour laisser une seule couche de cellules épidermiques, un échantillon optiquement clair qui peut être imagé directement sans qu’il soit nécessaire de fixer ou de nettoyer chimiquement. Les cellules végétales et fongiques restent vivantes pendant toute la durée de l’expérience et les interactions peuvent être visualisées en temps réel. Les gaines peuvent être colorées ou soumises à une plasmolyse pour étudier la cytologie du développement et la viabilité des cellules hôtes et pathogènes au cours de l’infection et de la colonisation. Les souches fongiques transformées pour exprimer des protéines fluorescentes peuvent être inoculées ou co-inoculées sur les gaines pour une résolution accrue et pour faciliter l’évaluation des interactions compétitives ou synergiques. Les souches fongiques exprimant des protéines de fusion fluorescentes peuvent être utilisées pour suivre et quantifier la production et le ciblage de ces protéines individuelles in planta. Les tissus de gaine inoculés peuvent être extraits pour caractériser les acides nucléiques, les protéines ou les métabolites. L’utilisation de ces essais de gaine a considérablement fait progresser les études détaillées des mécanismes de pathogénicité fongique chez le maïs, ainsi que des effecteurs protéiques fongiques et des métabolites secondaires contribuant à la pathogénicité.
Introduction
Les analyses spatiales et temporelles au niveau cellulaire sont essentielles pour comprendre la physiologie et la cytologie des interactions fongiques-plantes. Les tissus foliaires qui ont été fixés chimiquement 1,2,3 ou nettoyés et colorés4, ainsi que les membranes artificielles5, ont été utilisés dans le passé pour étudier la cytologie du développement des agents pathogènes foliaires et les interactions plantes-champignons. Cependant, l’étude des événements infectieux dans les tissus de l’hôte vivant en temps réel sans fixation ni nettoyage est difficile en raison de problèmes techniques liés à la préparation d’échantillons optiquement transparents pour l’imagerie.
À la fin des années 1940, un protocole d’inoculation de gaine foliaire détachée a été mis au point pour l’étude microscopique en fond clair de la résistance des cellules épidermiques vivantes du riz au champignon Magnaporthe oryza6. Plus récemment, des observations moléculaires, physiologiques et cytologiques détaillées de la colonisation de l’hôte par les espèces Colletotrichum et Magnaporthe ont été grandement facilitées par la combinaison de versions modifiées de cette méthode de gaine foliaire avec des transformants fongiques exprimant des protéines fluorescentes, et des protocoles d’imagerie de cellules vivantes à haute performance, y compris l’épifluorescence et la microscopie confocale 7,8,9,10,11,12,13.
Cet article détaille un protocole d’inoculation optimisé utilisant des gaines de feuilles de maïs détachées pour l’observation des processus d’infection par des agents pathogènes fongiques foliaires hémibiotrophes et nécrotrophes. Nous l’avons spécifiquement utilisé pour étudier Colletotrichum graminicola (C. graminicola), l’agent causal de la brûlure des feuilles anthracnose et de la pourriture de la tige, et Stenocarpella maydis, qui cause la brûlure des feuilles et la pourriture de la tige de Diplodia. Cependant, la méthode devrait être applicable à d’autres pathogènes fongiques foliaires hémibiotrophes et nécrotrophes. Les réponses cytologiques et physiologiques lors d’événements d’infection et de colonisation dans ces gaines foliaires excisées sont similaires à celles des limbes entiers12,14,15. De plus, la colonisation hémibiotrophe des cellules épidermiques de la gaine par C. graminicola est similaire à la colonisation des cellules de la moelle pédonculaire16,17. Les gaines détachées présentent une plus grande synchronicité et une plus grande reproductibilité expérimentale de la pénétration et de la colonisation fongiques que les limbes des feuilles ou les tissus de la moelle des tiges14,16,17,18. La plupart des variétés de maïs peuvent être utilisées pour ce protocole. Cependant, les consanguins ou les hybrides avec des pigments violets excessifs dans les gaines sont moins appropriés car les pigments interfèrent avec l’imagerie. Le maïs sucré du jubilé d’or a été particulièrement utile pour nos études, car les semences non traitées sont disponibles dans le commerce, les plantes sont très sensibles à de nombreuses maladies foliaires et elles poussent bien en serre. Les premières épidémies de pourriture de la tige par l’anthracnose aux États-Unis ont entraîné la perte totale des récoltes de maïs sucré dans l’Indiana dans les années1970 19,20. Cette méthode d’inoculation de la gaine foliaire peut être appliquée pour observer et quantifier directement la croissance et le développement fongiques dans les cellules végétales vivantes par rapport aux cellules végétales tuées localement, pour démontrer les réactions de résistance dans les réponses compatibles/incompatibles à l’infection fongique et pour tester les interactions entre les souches fongiques sur la même gaine en temps réel.
Protocole
REMARQUE : Le flux de travail de la méthode est illustré à la figure 1.
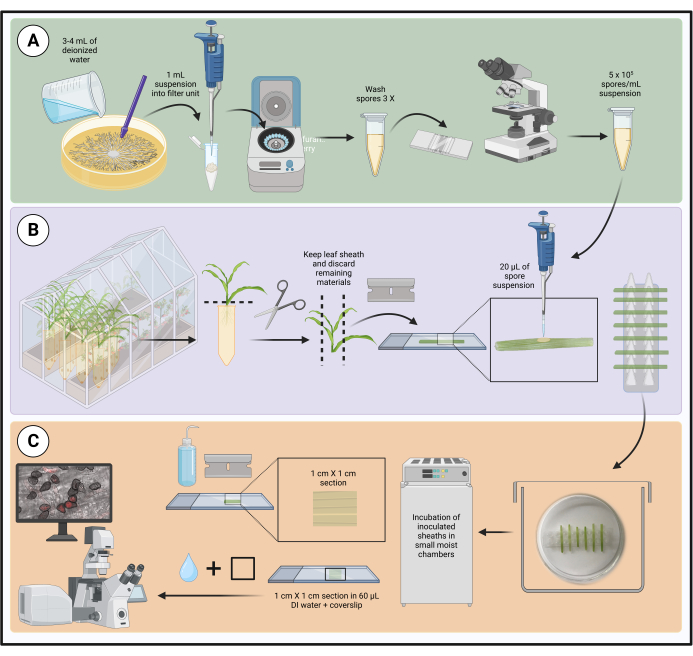
Figure 1 : Étapes du protocole d’inoculation optimisé à l’aide de gaines de feuilles de maïs détachées. La préparation de la suspension de spores, l’inoculation de la gaine foliaire et la préparation d’échantillons pour la microscopie de cellules vivantes sont surlignées dans des cases vertes (A), violettes (B) et oranges (C), respectivement. Créé avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Matériel végétal et fongique
- Croissance des plantes
- Cultivez les plants de maïs (voir tableau des matériaux) en serre (14 h lumière/27 °C et 10 h obscurité/22 °C) dans des conteneurs SC10 (voir tableau des matériaux). Utilisez un milieu de culture composé de trois parties de terreau commercial (voir le tableau des matériaux) et de deux parties de terre végétale stérilisée à la vapeur.
- Arrosez les semis pendant 2 min avec un système d’irrigation par aspersion une fois par jour, le matin.
- Récoltez les semis au stade V2 en les coupant au niveau du sol. Le stade de croissance V2 est atteint lorsque les plantules mesurent de 5 à 10 cm de haut et ont deux feuilles à collette visibles21.
- Enveloppez les plantes avec une serviette en papier humide et placez-les dans un sac en plastique pour les transporter au laboratoire pour un traitement ultérieur.
- Cultures fongiques
- Réactiver les cultures mères de silice fongique entreposées dans des conditions aseptiques22en saupoudrant environ 50 granules de silice infestée sur un milieu gélosé approprié. Pour éviter les changements morphologiques et la perte de pathogénicité, les souches de sous-culture ne dépassent pas 3 fois après la réactivation. La gélose au dextrose de pomme de terre (PDA ; voir le tableau des matériaux) est couramment utilisée pour la culture de C. graminicola, tandis que la gélose à l’avoine (OA ; voir le tableau des matériaux) est utilisée pour S. maydis.
- Pour préparer la PDA à la culture de souches fongiques, suspendre 19,5 g de PDA déshydraté préparé commercialement dans 500 mL d’eau déminéralisée (DI). Pour faire de l’arthrose, faites bouillir 36 g d’arthrose déshydratée préparée dans du commerce dans de l’eau déminéralisée pendant 15 à 30 minutes, filtrez à travers trois couches d’étamine et portez le filtrat à 500 ml avec de l’eau déminéralisée. Milieu autoclave à stériliser.
- Complétez le milieu fondu et refroidi avec un antibiotique approprié (p. ex., hygromycine B, génétique) lorsque vous travaillez avec des souches transformantes. Les concentrations finales d’hygromycine ou de génétique dans 500 mL de milieu sont respectivement de 250 μg/mL et de 100 μg/mL.
- Incuber les cultures dans des conditions optimales jusqu’à ce qu’un mycélium sporulant se soit développé. Colletotrichum graminicola et S. maydis poussent bien à 23 °C avec une lumière fluorescente continue et des niveaux d’humidité ambiante. La sporulation a lieu 7 jours après l’inoculation (dai) pour S. maydis ou 14 jours après l’inoculation pour C. graminicola.
2. Inoculations de la gaine foliaire
- Assemblage de l’unité de filtration en laine de verre
- À l’aide de ciseaux ou de cisailles robustes, coupez le capuchon à environ 0,5 mm du fond conique d’un tube de microcentrifugation de 1,5 ml (voir le tableau des matériaux).
- Placez un morceau de laine de verre (environ 0,5 cm x 0,5 cm ; voir le tableau des matériaux) à l’intérieur du tube coupé pour couvrir le trou central, comme illustré à la figure 2.
- Portez des gants lorsque vous coupez de la laine de verre, car le verre borosilicaté peut provoquer des irritations.
- Préparation des supports de gaine de vantail
- Découpez une plaque PCR à 96 puits sans jupe (voir le tableau des matériaux) en six racks de support à deux colonnes (8 x 2 puits), comme illustré à la figure 3A.
- Retournez les grilles à deux colonnes de manière à ce que les fonds coniques des puits soient orientés vers le haut et les sommets plats vers le bas (Figure 3B).
- Placez chaque support dans une plaque de Pétri en verre contenant du papier filtre humidifié et couvrez-la avec le couvercle (voir le tableau des matériaux). Cette unité fonctionne comme une petite chambre d’humidité pour les gaines.
- Préparation de l’inoculum
- Pour chaque souche fongique, placer une unité de filtration en laine de verre assemblée dans un tube de microcentrifugation stérile intact de 1,5 mL, comme illustré à la figure 2. Ce dernier fonctionne comme un tube de collecte.
- Étiquetez les tubes.
- Récoltez les conidies des cultures sporulées en inondant d’abord chaque plaque de 3 à 4 ml d’eau DI stérile. Dans certains cas, il peut être nécessaire d’avoir plus d’eau pour produire une couche de liquide à la surface de la colonie. Les agents mouillants ne sont pas nécessaires dans ce système.
- Détachez les spores de la gélose à l’aide d’un pilon stérile à pointe conique (voir le tableau des matériaux) pour racler uniformément toute la plaque.
- Appliquer 1 mL de suspension de spores sur une unité de filtration en laine de verre de manière aseptique et laisser les spores s’écouler dans le tube collecteur par gravité.
- Centrifuger les tubes de prélèvement contenant les suspensions de spores filtrées à 3 500 x g pendant 5 min. Les spores doivent être granulées au fond du tube de la microcentrifugeuse.
REMARQUE : Centrifuger les spores de C. graminicola à des vitesses plus élevées que celles recommandées ici entraîne une perte importante de viabilité. - Versez le liquide dans un récipient autoclavable, ajoutez 1 mL d’eau dépérissable stérile et agitez doucement pour remettre en suspension les spores granulées. Centrifugeuse comme à l’étape 2.3.6.
- Lavez les spores 3 fois pour éliminer toute matrice conidiale qui pourrait contenir des auto-inhibiteurs susceptibles de réduire la germination ou la pénétration.
- Après le troisième lavage, ajouter 300 à 500 μL d’eau stérile d’injection intraveineuse pour remettre les spores en suspension à des fins de quantification.
- Utilisez un hémocytomètre sous un microscope composé à un grossissement de 100x pour déterminer la concentration de spores. Il n’est pas nécessaire de colorer les spores avant de les compter.
- Préparer une suspension de 5 x 105 spores/mL avec de l’eau stérile.
REMARQUE : La suspension de spores de C. graminicola ne peut être conservée à température ambiante pendant 4 h maximum avant une perte rapide de viabilité. La réfrigération des conidies n’augmente pas la viabilité.
- Inoculations de gaine
- Vérifiez les pratiques et les procédures de biosécurité pertinentes avant d’inoculer des souches fongiques aux plantes.
- Retirez la gaine de la première vraie feuille des semis V2 en passant un ongle de pouce le long de la marge qui se chevauche de la gaine et détachez-la doucement de la pousse. Desserrez la gaine des deux côtés de la pousse avant d’essayer de la retirer.
- Coupez les gaines foliaires récupérées en segments de 3 à 5 cm. Il n’est pas nécessaire de désinfecter les gaines en surface avant l’inoculation.
- Déroulez chaque segment très doucement pour exposer la couche épidermique interne (adaxiale).
- Lors de la préparation des gaines pour l’inoculation, gardez les gaines excisées restantes enveloppées d’un essuie-tout humide pour éviter la dessiccation.
- Placez 20 μL de la suspension de spores fongiques sur la surface interne au centre de la gaine, directement au-dessus de la nervure médiane, comme illustré à la figure 4.
- Placez les gaines foliaires inoculées horizontalement, avec la nervure médiane placée en bas, dans le support à l’intérieur d’une boîte de Pétri en verre contenant un papier filtre humidifié, comme illustré à la figure 5.
- Chaque rack peut contenir jusqu’à sept gaines. Inoculer au moins cinq gaines par souche pour compenser la perte de répétitions qui peut se produire lors de la préparation ou de l’incubation de l’échantillon.
- Placez les petites chambres d’humidité dans une boîte de rangement transparente recouverte de papier de germination humidifié (voir le tableau des matériaux).
- Couvrez la boîte avec le couvercle. Incuber la boîte à 23 °C avec un éclairage continu pour l’évolution temporelle prévue, qui dépend du champignon et des stades de développement fongique qui seront observés. Le tableau 1 résume l’évolution temporelle des gaines de maïs inoculées avec C. graminicola.
- Vérifiez tous les jours s’il y a des signes ou des symptômes de maladie sur les gaines et gardez les papiers de germination et les papiers filtres humides. Les gaines foliaires peuvent être conservées jusqu’à 6 jours sans mort ou dégradation évidente des cellules végétales en l’absence d’inoculation.
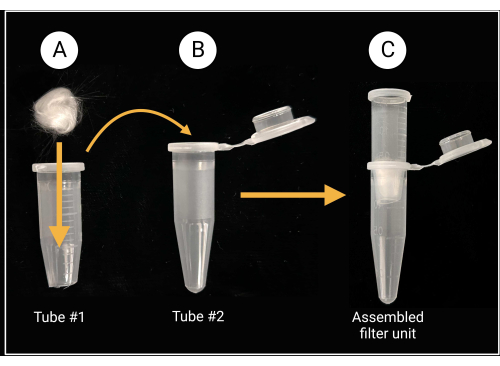
Figure 2 : Préparation de l’unité de filtration en laine de verre. (A) Une boule de laine de verre de 0,5 cm x 0,5 cm est placée à l’intérieur du tube de microcentrifugation 1 dont le fond conique a été retiré. (B-C) Le tube filtrant est ensuite placé dans le tube de microcentrifugation 2 pour générer une unité de filtration assemblée pour la préparation de la suspension des spores. Créé avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
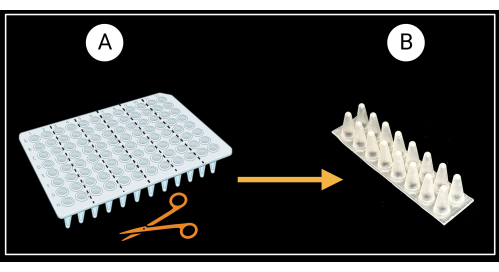
Figure 3 : Méthode de découpe d’une plaque PCR à 96 puits sans jupe. (A) Plaque PCR découpée en six racks de support, 8 x 2 puits. Un exemple d’un support de gaine unique est illustré en (B). Les gaines foliaires sont posées horizontalement sur le support. Créé avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Méthode d’inoculation de la gaine. Une seule goutte d’inoculum appliquée directement sur la surface adaxiale de la section de gaine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
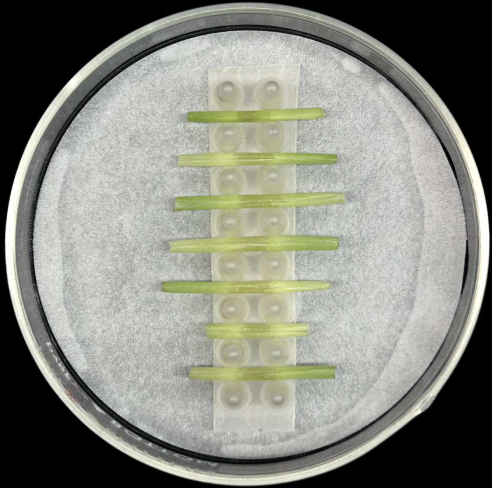
Figure 5 : Méthode d’incubation de la gaine. Gaines foliaires inoculées placées horizontalement dans un support à l’intérieur d’une boîte de Pétri en verre contenant du papier filtre humidifié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Microscopie de cellules vivantes
- Préparation d’échantillons pour la microscopie
- Rincez délicatement les pièces de la gaine avec de l’eau détritue stérile pour éliminer les spores non détectées ou les excroissances fongiques superficielles.
- Placez la gaine sur une lame de microscope en verre propre (voir le tableau des matériaux) avec la surface adaxiale (intérieure) de la gaine vers le bas et la surface abaxiale (extérieure) vers le haut.
- Utilisez une nouvelle lame de rasoir à un seul tranchant (voir le tableau des matériaux) pour couper environ 1 cm des extrémités de la gaine et enlever la majeure partie du tissu du limbe de chaque côté de la nervure médiane.
- Tenez la lame de rasoir à un angle de 90° par rapport à la gaine pour raser le tissu de la nervure médiane abaxiale et exposer la couche épidermique sur la surface adaxiale au-dessus de la tache inoculée. Essayez de maintenir une épaisseur uniforme. Une fois que les gaines foliaires sont rasées, il n’est pas recommandé de les tailler davantage car cela pourrait endommager l’échantillon.
- Assurez-vous que les sections rasées ne mesurent pas plus de 1 cm x 1 cm. Évitez d’appuyer sur le centre de la gaine pendant ce processus. Lorsque vous travaillez avec des gaines inoculées avec différentes suspensions de spores, désinfectez les gants et changez la lame de rasoir entre les échantillons.
- Gardez une lame de microscope en verre propre à portée de main. Soulevez la section de la gaine d’un bord et transférez-la soigneusement sur une nouvelle lame. La surface inoculée (adaxiale) de la gaine doit être la plus haute, la plus proche de la lentille de l’objectif. Montez les sections en douceur pour éviter d’endommager les structures fongiques.
- Appliquer 60 μL d’eau stérile sur la section et ajouter une lamelle en verre de 24 mm x 60 mm (voir le tableau des matériaux). Faites-le lentement pour éviter les bulles d’air.
- Lorsque vous êtes prêt pour la microscopie, scellez la lamelle avec du vernis à ongles transparent (voir le tableau des matériaux) en plaçant une petite goutte sur chaque bord, puis en reliant les gouttes ensemble avec un pinceau à vernis à ongles pour obtenir un joint homogène.
REMARQUE : Ce protocole de gaine peut être utilisé avec des colorants cytologiques, par exemple, le 4′,6-diamidino-2-phénylindole (DAPI), le rouge neutre ou le bleu trypan, ou pour l’observation de la plasmolyse cellulaire afin d’évaluer la viabilité des cellules végétales. Pour les essais de coloration de gaine ou de plasmolyse cellulaire, ne pas sceller la lamelle. - Pour les essais de plasmolyse, ajoutez une solution hypertonique (saccharose 0,75 M ou chlorure de sodium 1 M) sur un bord de la lamelle et utilisez un papier de soie non pelucheux plié pour aspirer la solution à travers l’échantillon jusqu’à l’autre bord de la lamelle. Pour la coloration, utilisez une méthode similaire pour appliquer la solution de teinture.
- Microscopie à champ large
- Une fois que les gaines foliaires sont montées sur des lames de microscope, inspectez-les pour détecter toute colonisation fongique à l’aide d’un microscope optique à grand champ à grossissement de 400x.
- Pour observer en détail les structures fongiques, utilisez un objectif à immersion dans l’eau plutôt que de l’huile pour une meilleure qualité d’image des échantillons. L’aberration sphérique due à un décalage de l’indice de réfraction peut entraîner une dégradation de l’image. Des objectifs à eau sont disponibles pour les microscopes optiques à grand champ ainsi que pour les microscopes confocaux.
- Pour déterminer la quantité relative de colonisation par gaine, comptez le nombre de cellules de maïs envahies à partir de chaque site de pénétration fongique à l’aide d’un microscope optique à grand champ à un grossissement de 100x. Cette quantification est une étape de dépistage appropriée avant toute analyse statistique comparant les souches, les traitements et/ou les stades de développement.
- Microscopie confocale à balayage laser
- Pour observer les protéines fluorescentes dans les tissus de maïs au cours du développement de souches fongiques transgéniques, ajustez les paramètres de base de l’acquisition d’images. Identifiez les meilleurs paramètres d’excitation/d’émission en fonction du marqueur fluorescent sélectionné.
REMARQUE : Un objectif d’eau 60x est préférable lors de l’analyse de fusions fluorescentes construites avec des protéines sécrétées. Les microscopes confocaux modernes ont des objectifs d’immersion dans l’eau hautement corrigés pour éviter les artefacts et les aberrations de forme. - Si l’imagerie de cellules vivantes de protéines fluorescentes est prévue, utiliser des souches fongiques non transformées comme témoins de l’autofluorescence. Utilisez les paramètres d’acquisition d’images suivants pour capturer la dynamique champignon-hôte sur un microscope confocal inversé et pour la protéine fluorescente mCherry. Réglez la puissance du laser jusqu’à 5 %, 450-600 haute tension (HV) selon le niveau d’expression, un gain de 1,375 X, un décalage de 3 %, un facteur de zoom optique de 1 pour l’analyse de jusqu’à cinq cellules de maïs par section et un facteur de zoom optique de 2 à 5 pour les hyphes individuels.
REMARQUE : Les images confococaux haute résolution de la pile Z fournissent des données tridimensionnelles et une meilleure vue des interactions en temps réel entre l’hôte et l’agent pathogène. - Pour quantifier les intensités de fluorescence correspondant aux protéines de fusion sécrétées, utilisez un logiciel d’analyse d’images du fabricant de confocaux ou un programme de traitement d’images tel que ImageJ, qui peut être téléchargé gratuitement en ligne. Consultez un manuel pour plus de détails sur la façon de quantifier les signaux fluorescents en conséquence.
- Pour observer les protéines fluorescentes dans les tissus de maïs au cours du développement de souches fongiques transgéniques, ajustez les paramètres de base de l’acquisition d’images. Identifiez les meilleurs paramètres d’excitation/d’émission en fonction du marqueur fluorescent sélectionné.
Résultats
Les exemples ci-dessous décrivent des résultats représentatifs de l’utilisation de la méthode d’inoculation de la gaine des feuilles de maïs. Ces exemples démontrent la facilité, la rapidité et la précision avec lesquelles l’observation et la comparaison des interactions maïs-champignon peuvent être réalisées en temps réel avec ce test optimisé. L’imagerie de cellules vivantes permet également d’extraire des informations quantitatives, ce qui constitue un outil utile pour les études moléculair...
Discussion
La méthode optimisée d’inoculation de la gaine foliaire décrite ici est modifiée à partir d’un protocole original qui a été développé et appliqué aux gaines foliaires du riz 6,8,36. Il permet des observations directes et détaillées de la croissance et du développement fongiques dans les cellules végétales vivantes par microscopie à grand champ ou confocale. Le protocole est adapté à la caractérisation, à ...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents et qu’ils n’ont rien à divulguer.
Remerciements
Les auteurs remercient l’USDA-NIFA pour son soutien financier (numéros de subvention 2018-67013-28489 et 2020-70410-32901). Les opinions, constatations, conclusions ou recommandations exprimées dans ce manuscrit sont uniquement celles des auteurs et ne reflètent pas nécessairement les points de vue du ministère de l’Agriculture des États-Unis. Nous remercions Mayara de Silva, étudiante invitée de Science Sans Frontières au Brésil, pour les images qui apparaissent dans les figures 6A et 7D. Nous remercions également le département de pathologie végétale de l’Université du Kentucky pour avoir fourni l’accès aux microscopes confocaux Olympus.
matériels
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
Références
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon