Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Отдельно взятые оболочки кукурузы для визуализации живых клеток инфекции, вызванной грибковыми листовыми патогенами кукурузы
В этой статье
Резюме
В данной рукописи подробно описан оптимизированный протокол инокуляции, в котором для воспроизводимых цитологических, физиологических и молекулярных исследований взаимодействия кукурузы с грибковыми патогенами растений используются отдельные оболочки листьев кукурузы. Влагалища листьев облегчают наблюдение в режиме реального времени за клеточными взаимодействиями между живым растением и грибом в нефиксированных тканях.
Аннотация
Оптимизирован протокол инокуляции влагалищ листьев кукурузы гемибиотрофными и некротрофными листовыми патогенными грибами. Этот метод является модификацией по сравнению с методом, первоначально примененным к влагалищу рисовых листьев, и позволяет проводить прямые микроскопические наблюдения за ростом и развитием грибов в живых клетках растений. Влагалища листьев, собранные с проростков кукурузы с двумя полностью раскрывшимися листовыми шейками, инокулируют 20 мкл капель суспензий спор грибов 5 x 105 спор /мл и инкубируют во влажных камерах при температуре 23 °C при непрерывном флуоресцентном свете. Через 24-72 ч лишняя ткань удаляется лезвием бритвы, оставляя один слой клеток эпидермиса, оптически чистый образец, который можно визуализировать непосредственно без необходимости химической фиксации или очистки. Клетки растений и грибов остаются живыми в течение всего эксперимента, а взаимодействия могут быть визуализированы в режиме реального времени. Оболочки могут быть окрашены или подвергнуты плазмолизу для изучения цитологии развития и жизнеспособности клеток хозяина и патогена во время инфекции и колонизации. Штаммы грибов, трансформируемые для экспрессии флуоресцентных белков, могут быть инокулированы или коинокулированы на оболочки для повышения разрешения и облегчения оценки конкурентных или синергетических взаимодействий. Штаммы грибов, экспрессирующие флуоресцентные белки слияния, могут быть использованы для отслеживания и количественной оценки производства и нацеливания этих отдельных белков в planta. Инокулированные ткани оболочки могут быть извлечены для определения характеристик нуклеиновых кислот, белков или метаболитов. Использование этих оболочечных анализов значительно продвинуло вперед детальные исследования механизмов патогенности грибов в кукурузе, а также эффекторов грибных белков и вторичных метаболитов, способствующих патогенности.
Введение
Пространственный и временной анализ на клеточном уровне имеет решающее значение для понимания физиологии и цитологии взаимодействий грибов и растений. Листовые ткани, которые были химически закреплены 1,2,3 или очищены и окрашены4, а также искусственные мембраны5 использовались в прошлом для изучения цитологии развития листовых патогенов и взаимодействия растений с грибами. Тем не менее, исследование инфекционных событий в тканях живого хозяина в режиме реального времени без фиксации или очистки является сложной задачей из-за технических проблем, связанных с подготовкой оптически прозрачных образцов для визуализации.
В конце 1940-х годов был разработан протокол инокуляции оболочек листьев для ярко-полевого микроскопического исследования резистентности живых клеток эпидермиса риса к рисовому бластному грибу Magnaporthe oryza6. В последнее время детальные молекулярные, физиологические и цитологические наблюдения за колонизацией хозяина видами Colletotrichum и Magnaporthe были значительно облегчены благодаря сочетанию модифицированных версий этого метода с грибными трансформантами, экспрессирующими флуоресцентные белки, и высокоэффективными протоколами визуализации живых клеток, включая эпифлуоресценцию и конфокальную микроскопию7,8,9,10.11,12,13.
В данной работе подробно описан оптимизированный протокол инокуляции с использованием отслоившихся влагалищ листьев кукурузы для наблюдения за процессами заражения гемибиотрофными и некротрофными листовыми грибковыми патогенами. Мы специально использовали его для изучения Colletotrichum graminicola (C. graminicola), возбудителя антракноза листьев и стеблевой гнили, и Stenocarpella maydis, которая вызывает фитофтороз листьев Diplodia и стеблевую гниль. Однако метод должен быть применим и к другим гемибиотрофным и некротрофным листовым грибковым патогенам. Цитологические и физиологические реакции во время инфекций и колонизации в этих иссеченных листовых влагалях аналогичны таковым в целых листовых пластинках12,14,15. Кроме того, гемибиотрофная колонизация клеток эпидермиса оболочки C. graminicola сходна с колонизацией клеток сердцевины стебля16,17. Отслоенные влагалища демонстрируют большую синхронность и экспериментальную воспроизводимость проникновения и колонизации грибов, чем листовые пластинки или ткани сердцевины стебля14,16,17,18. Для этого протокола можно использовать большинство сортов кукурузы. Тем не менее, инбредные или гибриды с избыточным количеством фиолетовых пигментов в влагалях менее подходят, поскольку пигменты мешают визуализации. Сладкая кукуруза «Золотой юбилей» была особенно полезна для наших исследований, потому что необработанные семена коммерчески доступны, растения очень восприимчивы ко многим листовым заболеваниям и хорошо растут в теплице. Первые эпидемии антракнозной стеблевой гнили в США привели к полной потере урожая сахарной кукурузы в Индиане в 1970-х годах19,20. Этот метод инокуляции влагалища листа может быть применен для непосредственного наблюдения и количественной оценки роста и развития грибков в живых и локально убитых растительных клетках, для демонстрации реакций резистентности в совместимых/несовместимых ответах на грибковую инфекцию, а также для тестирования взаимодействия между штаммами грибов на одной и той же оболочке в режиме реального времени.
протокол
ПРИМЕЧАНИЕ: Рабочий процесс для метода показан на рисунке 1.
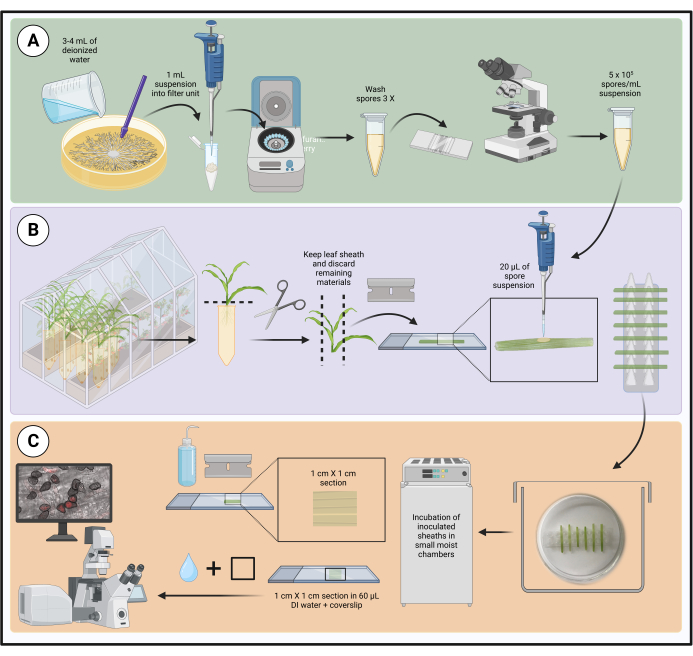
Рисунок 1: Этапы оптимизированного протокола инокуляции с использованием отсоединенных влагалищ листьев кукурузы. Приготовление споровой суспензии, инокуляция влагалища листа и подготовка образца для микроскопии живых клеток выделены зеленым (A), фиолетовым (B) и оранжевым (C) прямоугольниками соответственно. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
1. Растительный и грибковый материал
- Рост растений
- Выращивайте рассаду кукурузы (см. Таблицу материалов) в теплице (14 часов света/27 °C и 10 часов темноты/22 °C) в контейнерах SC10 (см. Таблицу материалов). Используйте питательную среду, состоящую из трех частей коммерческой горшечной почвы (см. Таблицу материалов) и двух частей стерилизованного паром верхнего слоя почвы.
- Поливайте рассаду на 2 мин с помощью системы верхнего орошения один раз в день, утром.
- Заготавливают саженцы на стадии V2, обрезая их на уровне почвы. Стадия роста V2 достигается, когда сеянцы достигают 5-10 см в высоту и имеют два видимых воротничковых листа21.
- Оберните растения влажным бумажным полотенцем и поместите в полиэтиленовый пакет для транспортировки в лабораторию для дальнейшей обработки.
- Грибковые культуры
- Реактивируют хранящиеся культуры грибкового кремнезема в асептических условиях22, посыпая примерно 50 гранулами зараженного кремнезема на соответствующую агаровую среду. Во избежание морфологических изменений и потери патогенности штаммы субкультуры после реактивации проводят не более 3 раз. Картофельный декстрозный агар (PDA; см. Таблицу материалов) обычно используется для культивирования C. graminicola, в то время как овсяный агар (OA; см. Таблицу материалов) используется для S. maydis.
- Для приготовления КПК для культивирования грибковых подвоев суспендируют 19,5 г промышленно приготовленного обезвоженного КПК в 500 мл деионизированной (ДИ) воды. Для получения ОА 36 г промышленно приготовленного обезвоженного ОА кипятят в деионизированной воде в течение 15-30 мин, процеживают через три слоя марли и доводят фильтрат до 500 мл децентрализованной водой. Автоклавная среда для стерилизации.
- При работе со штаммами-трансформантами дополняйте расплавленную охлажденную среду подходящим антибиотиком (например, гигромицином В, генетиком). Конечные концентрации гигромицина или генетицина в 500 мл среды составляют 250 мкг/мл и 100 мкг/мл соответственно.
- Инкубируют культуры в оптимальных условиях до тех пор, пока не разовьется спорулирующий мицелий. Colletotrichum graminicola и S. maydis хорошо растут при температуре 23 °C при постоянном флуоресцентном освещении и уровне влажности окружающей среды. Спороношение происходит через 7 дней после инокуляции (dai) для S. maydis или 14 dai для C. graminicola.
2. Прививки влагалища листа
- Монтаж фильтрующего блока из стекловаты
- С помощью сверхпрочных ножниц или ножниц отрежьте колпачок и примерно 0,5 мм от конического дна пробирки микроцентрифуги объемом 1,5 мл (см. Таблицу материалов).
- Поместите кусок стекловаты (примерно 0,5 см x 0,5 см; см. Таблицу материалов) внутрь отрезанной трубки, чтобы закрыть центральное отверстие, как показано на рисунке 2.
- При резке стекловаты надевайте перчатки, так как боросиликатное стекло может вызвать раздражение.
- Подготовка опорных стоек оболочки листа
- Разрежьте 96-луночную ПЦР-пластину без юбки (см. таблицу материалов) на шесть двухколонных (8 x 2 лунки) опорных стоек, как показано на рисунке 3A.
- Переверните стойки с двумя колоннами так, чтобы конические дно колодцев были обращены вверх, а плоские верхушки — вниз (Рисунок 3B).
- Поместите каждую опору в стеклянную чашку Петри, содержащую увлажненную фильтровальную бумагу, и накройте ее крышкой (см. Таблицу материалов). Этот блок функционирует как небольшая камера влажности для ножен.
- Подготовка посевного материала
- Для каждого штамма гриба поместите один собранный фильтрующий блок из стекловаты в неповрежденную стерильную микроцентрифужную пробирку объемом 1,5 мл, как показано на рисунке 2. Последний функционирует как сборная трубка.
- Промаркируйте трубки.
- Собирают конидии со спорулирующих культур, предварительно заливая каждую тарелку 3-4 мл стерильной деионизированной воды. В некоторых случаях может потребоваться больше воды для образования слоя жидкости на поверхности колонии. Смачивающие агенты в этой системе не требуются.
- Удалите споры из агара с помощью стерильного пестика с коническим кончиком (см. Таблицу материалов), чтобы равномерно соскрести по всей пластине.
- Нанесите 1 мл споровой суспензии на фильтр из стекловаты асептически и дайте спорам протечь в сборную трубку под действием силы тяжести.
- Центрифугируют пробирки для сбора отфильтрованных споровых суспензий при 3 500 x g в течение 5 мин. Споры должны быть гранулированы на дне пробирки микроцентрифуги.
ПРИМЕЧАНИЕ: Центрифугирование спор C. graminicola на более высоких скоростях, чем рекомендуется здесь, приводит к значительной потере жизнеспособности. - Перелейте жидкость в автоклавируемый контейнер, добавьте 1 мл стерильной деионизированной воды и осторожно перемешайте, чтобы ресуспендировать гранулированные споры. Центрифугу, как показано на шаге 2.3.6.
- Промойте споры 3 раза, чтобы удалить любой конидиальный матрикс, который может содержать аутоингибиторы, которые могут снизить прорастание или проникновение.
- После третьей промывки добавьте 300-500 мкл стерильной деионизированной воды, чтобы повторно суспендировать споры для количественного определения.
- Используйте гемоцитометр под составным микроскопом при 100-кратном увеличении для определения концентрации спор. Окрашивание спор перед подсчетом не требуется.
- Приготовьте суспензию 5 x 10 по5 спор/мл со стерильной деионизированной водой.
ПРИМЕЧАНИЕ: Суспензию спор C. graminicola можно хранить при комнатной температуре не более 4 ч до быстрой потери жизнеспособности. Охлаждение конидий не повышает жизнеспособность.
- Прививки влагалища
- Ознакомьтесь с соответствующими методами и процедурами биобезопасности перед инокуляцией растений штаммами грибов.
- Удалите влагалище с первого настоящего листа проростков V2, проведя ногтем большого пальца по перекрывающемуся краю влагалища, и аккуратно отсоедините его от побега. Ослабьте влагалище с обеих сторон побега, прежде чем пытаться его снять.
- Восстановленные влагалища листьев разрезать на отрезки по 3-5 см. Дезинфицировать поверхности влагалища перед прививкой не нужно.
- Очень осторожно разверните каждый сегмент, чтобы обнажить внутренний (адаксиальный) эпидермальный слой.
- Подготавливая влагалища к инокуляции, держите оставшиеся иссеченные влагалища обернутыми влажным бумажным полотенцем, чтобы избежать высыхания.
- Поместите 20 мкл суспензии спор гриба на внутреннюю поверхность в центре оболочки, непосредственно над средней жилкой, как показано на рисунке 4.
- Поместите инокулированные влагалища листьев горизонтально, поместив среднюю жилку внизу, в опору внутри стеклянной пластины Петри, содержащей увлажненную фильтровальную бумагу, как показано на рисунке 5.
- Каждая стойка вмещает до семи ножен. Инокулируйте не менее пяти оболочек для каждого штамма, чтобы компенсировать потерю репликатов, которая может произойти во время подготовки образца или инкубации.
- Поместите небольшие камеры влажности в прозрачный ящик для хранения, застеленный увлажненной бумагой для проращивания (см. Таблицу материалов).
- Накройте коробку крышкой. Инкубируйте ящик при температуре 23 °C при непрерывном освещении в течение предполагаемого периода времени, который зависит от грибка и от стадий развития грибка, которые будут наблюдаться. Краткая информация о динамике времени для влагалищ кукурузы, инокулированных C. graminicola, представлена в таблице 1.
- Каждый день проверяйте наличие признаков/симптомов заболевания на влагалищах и поддерживайте влажностью как всхожесть, так и фильтровальную бумагу. Влагалища листьев могут сохраняться до 6 дней без явной гибели или деградации растительных клеток при отсутствии инокуляции.
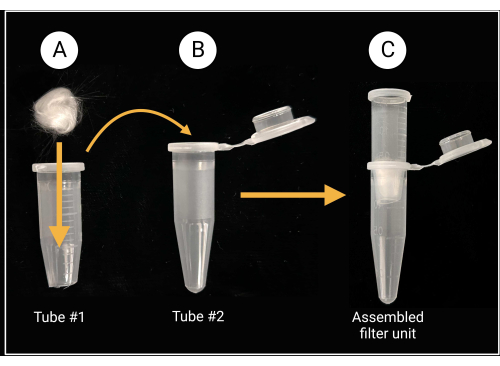
Рисунок 2: Подготовка стекловатного фильтрующего блока. (A) Шарик из стекловаты размером 0,5 см x 0,5 см помещается в микроцентрифужную пробирку 1 со снятым коническим дном. (В-В) Затем фильтрующая трубка помещается в микроцентрифужную трубку 2 для создания собранного фильтрующего блока для приготовления споровой суспензии. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
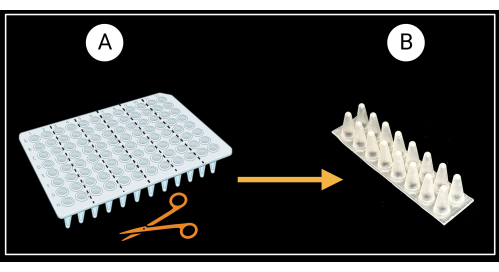
Рисунок 3: Способ разрезания 96-луночного ПЦР-планшета без юбки. (A) ПЦР-пластина, разрезанная на шесть опорных стоек, 8 x 2 лунки. Пример одинарной опоры оболочки изображен на рисунке (В). Влагалища листьев укладываются горизонтально на опору. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Способ инокуляции влагалища. Одна капля посевного материала наносится непосредственно на адаксиальную поверхность участка оболочки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
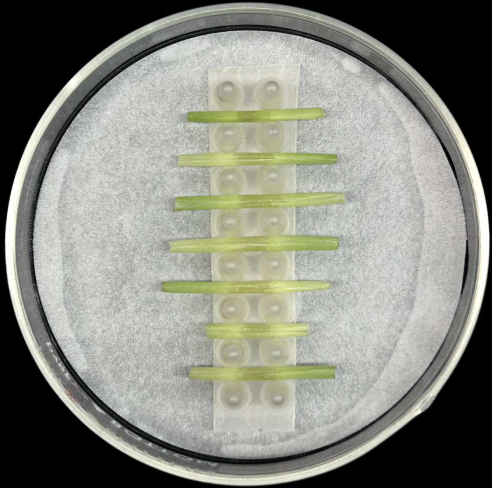
Рисунок 5: Метод инкубации влагалища. Влагалища инокулированных листьев помещают горизонтально в опорную стойку внутри стеклянной пластины Петри, содержащей смоченную фильтровальную бумагу. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Микроскопия живых клеток
- Подготовка образцов для микроскопии
- Аккуратно промойте кусочки оболочки стерильной деионизированной водой, чтобы удалить неприлипшие споры или поверхностный грибковый рост.
- Поместите оболочку на чистое предметное стекло микроскопа (см. Таблицу материалов) так, чтобы адаксиальная (внутренняя) поверхность оболочки была обращена вниз, а абаксиальная (внешняя) поверхность — сверху.
- Используйте новое лезвие бритвы с одной лезвием (см. Таблицу материалов), чтобы отрезать примерно 1 см от концов ножен и удалить большую часть ткани пластинки по обе стороны от средней жилки.
- Держите лезвие бритвы под углом 90° относительно ножен, чтобы сбрить ткань с абаксиальной средней жилки и обнажить эпидермальный слой на адаксиальной поверхности над привитым пятном. Старайтесь выдерживать равномерную толщину. После того, как влагалища листьев сбриты, дальнейшая обрезка не рекомендуется, так как это может повредить образец.
- Следите за тем, чтобы размер сбритых прядей не превышал 1 см х 1 см. Избегайте надавливания на центр ножен во время этого процесса. При работе с оболочками, инокулированными различными споровыми суспензиями, дезинфицируйте перчатки и меняйте лезвие бритвы между образцами.
- Держите наготове чистое стеклянное предметное стекло микроскопа. Поднимите секцию ножен с одного края и осторожно перенесите ее на новый салазки. Инокулированная (адаксиальная) поверхность оболочки должна быть самой верхней, ближайшей к линзе объектива. Монтируйте секции аккуратно, чтобы не повредить грибковые конструкции.
- Нанесите 60 мкл стерильной деионизированной воды на срез и добавьте стеклянный покровный лист размером 24 мм x 60 мм (см. Таблицу материалов). Делайте это медленно, чтобы избежать пузырьков воздуха.
- Когда все будет готово к микроскопии, запечатайте покровное стекло прозрачным лаком для ногтей (см. Таблицу материалов), поместив небольшую каплю на каждый край, а затем соединив капли вместе кистью для лака для ногтей, чтобы получить бесшовное уплотнение.
ПРИМЕЧАНИЕ: Этот протокол оболочки может быть использован с цитологическими красителями, например, 4′,6-диамидино-2-фенилиндол (DAPI), нейтральным красным или трипановым синим, или для наблюдения за клеточным плазмолизом для оценки жизнеспособности растительных клеток. Для окрашивания оболочки или анализа клеточного плазмолиза не запечатывайте покровное стекло. - Для плазмолизного анализа добавляют гипертонический раствор (0,75 М сахарозы или 1 М натрия хлорида) к одному краю покровного стекла и используют сложенную безворсовую папиросную бумагу, чтобы провести раствор по образцу к другому краю покровного стекла. Для окрашивания используйте аналогичный способ нанесения раствора для морилки.
- Широкопольная микроскопия
- После того, как влагалища листьев будут установлены на предметные стекла микроскопа, осмотрите их на предмет грибковой колонизации с помощью широкопольного светового микроскопа с 400-кратным увеличением.
- Для детального изучения грибковых структур используйте объектив для погружения в воду, а не масло для лучшего качества изображения образцов. Сферическая аберрация, вызванная несоответствием показателя преломления, может привести к ухудшению качества изображения. Водные объективы доступны как для широкопольных, так и для конфокальных микроскопов.
- Чтобы определить относительную степень колонизации на оболочке, подсчитайте количество клеток кукурузы, захваченных из каждого места проникновения гриба, используя широкопольный световой микроскоп при 100-кратном увеличении. Эта количественная оценка является подходящим этапом скрининга перед любым статистическим анализом, сравнивающим штаммы, методы лечения и/или стадии развития.
- Конфокальная лазерная сканирующая микроскопия
- Для наблюдения флуоресцентных белков в тканях кукурузы при развитии трансгенных штаммов грибов необходимо настроить основные параметры получения изображения. Определите наилучшие настройки возбуждения/излучения на основе выбранного флуоресцентного маркера.
ПРИМЕЧАНИЕ: Объектив с 60-кратным увеличением количества воды является предпочтительным при анализе флуоресцентных слияний, построенных с секретируемыми белками. Современные конфокальные микроскопы имеют высоко скорректированные объективы для погружения в воду, чтобы избежать артефактов и аберраций формы. - Если предполагается визуализация флуоресцентных белков живыми клетками, используйте нетрансформированные штаммы грибов в качестве контроля автофлуоресценции. Используйте следующие параметры получения изображения для регистрации динамики гриба-хозяина на инвертированном конфокальном микроскопе и для флуоресцентного белка mCherry. Установите мощность лазера до 5%, высокое напряжение (HV) 450-600 в зависимости от уровня экспрессии, усиление 1,375 X, смещение 3%, коэффициент оптического масштабирования 1 для анализа до пяти клеток кукурузы на секцию и коэффициент оптического увеличения 2-5 для отдельных гиф.
ПРИМЕЧАНИЕ: Конфокальные изображения Z-стека высокого разрешения предоставляют трехмерные данные и лучшее представление о взаимодействиях между хозяином и патогеном в режиме реального времени. - Для количественной оценки интенсивности флуоресценции, соответствующей секретируемым слияниям белков, используйте программное обеспечение для анализа изображений от производителя конфокальных изображений или программу обработки изображений, такую как ImageJ, которую можно бесплатно загрузить в Интернете. Обратитесь к руководству для получения подробной информации о том, как соответствующим образом количественно оценить флуоресцентные сигналы.
- Для наблюдения флуоресцентных белков в тканях кукурузы при развитии трансгенных штаммов грибов необходимо настроить основные параметры получения изображения. Определите наилучшие настройки возбуждения/излучения на основе выбранного флуоресцентного маркера.
Результаты
В приведенных ниже примерах описаны репрезентативные результаты при использовании метода инокуляции влагалища листьев кукурузы. Эти примеры демонстрируют легкость, скорость и точность, с которой наблюдение и сравнение взаимодействий кукурузы и грибов могут быть выполнены в режиме р...
Обсуждение
Оптимизированный метод инокуляции влагалища листа, описанный здесь, является модификацией оригинального протокола, который был разработан и применен для влагалищ листьев риса 6,8,36. Он позволяет проводить прямые, детальные наблюдения ...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов и им нечего раскрывать.
Благодарности
Авторы благодарят USDA-NIFA за финансовую поддержку (номера грантов 2018-67013-28489 и 2020-70410-32901). Любые мнения, выводы, выводы или рекомендации, выраженные в этой рукописи, принадлежат исключительно авторам и не обязательно отражают точку зрения Министерства сельского хозяйства США. Мы благодарим студентку программы «Наука без границ» из Бразилии Майяру де Сильва за изображения, представленные на рисунке 6A и на рисунке 7D. Мы также выражаем признательность кафедре патологии растений Университета Кентукки за предоставление доступа к конфокальным микроскопам Olympus.
Материалы
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
Ссылки
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены