A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
נדן תירס מנותק להדמיית תאים חיים של זיהום על ידי פתוגנים פטרייתיים של תירס פוליארי
In This Article
Summary
כתב יד זה מפרט פרוטוקול חיסון אופטימלי המשתמש בנדן עלי תירס מנותק למחקרים ציטולוגיים, פיזיולוגיים ומולקולריים הניתנים לשחזור של אינטראקציות תירס עם פתוגנים צמחיים פטרייתיים. מעטה העלים מאפשר תצפית בזמן אמת על אינטראקציות תאיות בין הצמח החי לפטרייה ברקמות לא מקובעות.
Abstract
ביצענו אופטימיזציה של פרוטוקול לחיסון נדן עלי תירס עם פטריות פתוגניות המיביוטרופיות ונקרוטרופיות. השיטה שונה משיטה שיושמה במקור על נדן עלי אורז ומאפשרת תצפית מיקרוסקופית ישירה על גדילה והתפתחות פטרייתיות בתאי צמחים חיים. נדני עלים שנאספו משתילי תירס עם שני צווארוני עלים מלאים מחוסנים בטיפות של 20 μL של 5 x 105 נבגים/מ"ל תרחיפים של נבגים פטרייתיים ומודגרים בתאי לחות ב -23 מעלות צלזיוס תחת אור פלואורסצנטי רציף. לאחר 24-72 שעות, רקמה עודפת מוסרת עם סכין גילוח כדי להשאיר שכבה אחת של תאי אפידרמיס, דגימה שקופה אופטית שניתן לצלם ישירות ללא צורך בקיבוע כימי או ניקוי. תאי צמחים ופטריות נשארים בחיים למשך הניסוי וניתן לדמיין אינטראקציות בזמן אמת. נדן יכול להיות מוכתם או נתון פלסמוליזה כדי לחקור את הציטולוגיה ההתפתחותית ואת הכדאיות של תאים מארח פתוגן במהלך זיהום וקולוניזציה. זנים פטרייתיים שעברו טרנספורמציה כדי לבטא חלבונים פלואורסצנטיים יכולים להיות מחוסנים או מחוסנים במשותף על הנדן לקבלת רזולוציה מוגברת וכדי להקל על הערכת אינטראקציות תחרותיות או סינרגטיות. זנים פטרייתיים המבטאים חלבוני היתוך פלואורסצנטיים יכולים לשמש למעקב וכימות הייצור והמיקוד של חלבונים בודדים אלה בצמח. ניתן לחלץ רקמות מעטפת מחוסנות כדי לאפיין חומצות גרעין, חלבונים או מטבוליטים. השימוש בבדיקות נדן אלה קידם מאוד את המחקרים המפורטים של מנגנוני הפתוגנניות הפטרייתית בתירס וגם של חלבונים פטרייתיים ומטבוליטים משניים התורמים לפתוגנים.
Introduction
ניתוחים מרחביים וזמניים ברמה התאית הם קריטיים להבנת הפיזיולוגיה והציטולוגיה של אינטראקציות פטרייתיות-צמחיות. רקמות פוליאריות שקובעו כימית 1,2,3 או נוקו ומוכתמות4, כמו גם קרומים מלאכותיים 5, שימשו בעבר לחקר הציטולוגיה של התפתחות פתוגן עלווה ואינטראקציות צמחיות-פטרייתיות. עם זאת, חקירת אירועי זיהום ברקמות מארחות חיות בזמן אמת ללא קיבוע או ניקוי היא מאתגרת בשל בעיות טכניות הקשורות להכנת דגימות שקופות אופטית להדמיה.
פרוטוקול חיסון נגד נדן עלים מנותק פותח בסוף שנות ה-40 של המאה ה-20 לצורך חקירה מיקרוסקופית בשדה בהיר של עמידות תאי אפידרמיס אורז חיים לפטריית פיצוץ האורז Magnaporthe oryza6. לאחרונה, תצפיות מולקולריות, פיזיולוגיות וציטולוגיות מפורטות של התיישבות פונדקאי על ידי מיני Colletotrichum ו- Magnaporthe הקלו מאוד על ידי שילוב גרסאות מותאמות של שיטת נדן עלים זו עם טרנספורמנטים פטרייתיים המבטאים חלבונים פלואורסצנטיים, ופרוטוקולי הדמיה של תאים חיים בעלי ביצועים גבוהים, כולל אפיפלואורסצנטיות ומיקרוסקופ קונפוקלי 7,8,9,10,11,12,13.
מאמר זה מפרט פרוטוקול חיסון אופטימלי באמצעות נדן עלי תירס מנותק לתצפית על תהליכי זיהום על ידי פתוגנים פטרייתיים המיביוטרופיים ונקרוטרופיים. השתמשנו בו במיוחד כדי לחקור Colletotrichum graminicola (C. graminicola), הגורם הסיבתי של כתם עלה anthracnose וריקבון גבעול, ו Stenocarpella maydis, אשר גורם לכתם עלה דיפלודיה וריקבון הגבעול. עם זאת, השיטה צריכה להיות ישימה לפתוגנים פטרייתיים אחרים hemibiotrophic ו necrotrophic. תגובות ציטולוגיות ופיזיולוגיות במהלך אירועי זיהום ונשאות בנדני עלים נכרתו אלה דומות לאלו שבלהבי עלים שלמים12,14,15. יתר על כן, התיישבות המיביוטרופית של תאי אפידרמיס מעטפת על ידי C. graminicola דומה להתיישבות של תאי פית גבעול16,17. נדן מנותק מראה סינכרוניות רבה יותר ושחזור ניסיוני של חדירה פטרייתית והתיישבות מאשר להבי עלים או רקמות פית גבעול14,16,17,18. רוב זני התירס יכולים לשמש לפרוטוקול זה. עם זאת, אינברדים או בני כלאיים עם פיגמנטים סגולים מוגזמים בנדן פחות מתאימים מכיוון שהפיגמנטים מפריעים להדמיה. תירס מתוק של יובל הזהב היה שימושי במיוחד במחקרים שלנו מכיוון שזרעים לא מטופלים זמינים מסחרית, הצמחים רגישים מאוד למחלות עלווה רבות, והם גדלים היטב בחממה. המגיפות הראשונות של ריקבון גבעול אנתרקנוז בארצות הברית גרמו לאובדן מוחלט של יבולי תירס מתוקים באינדיאנה בשנות השבעים19,20. ניתן ליישם שיטת חיסון זו של נדן עלים כדי לצפות ולכמת ישירות צמיחה והתפתחות פטרייתיות בתאי צמח חיים לעומת תאי צמח שהומתו באופן מקומי, כדי להדגים תגובות עמידות בתגובות תואמות/לא תואמות לזיהום פטרייתי, וכדי לבדוק אינטראקציות בין זנים פטרייתיים על אותו נדן בזמן אמת.
Protocol
הערה: זרימת העבודה עבור השיטה מוצגת באיור 1.
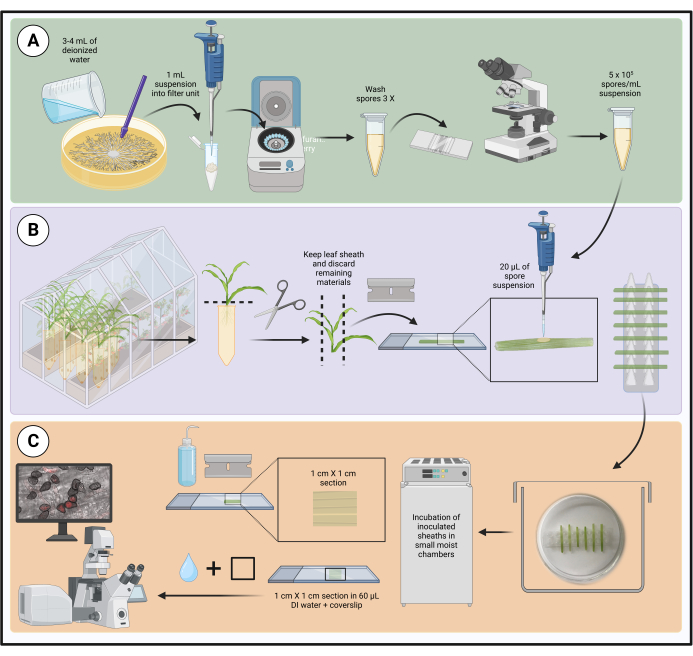
איור 1: שלבים בפרוטוקול החיסון הממוטב באמצעות נדן עלי תירס מנותק. הכנת תרחיף נבגים, חיסון נדן עלים והכנת דגימה למיקרוסקופ תאים חיים מודגשים בתיבות ירוקות (A), סגולות (B) וכתומות (C), בהתאמה. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. צמח וחומר פטרייתי
- גידול צמחים
- גידול שתילי תירס (ראו טבלת חומרים) בחממה (14 שעות אור/27°C ו-10 שעות כהות/22°C) במיכלי SC10 (ראו טבלת חומרים). השתמשו במצע גידול המורכב משלושה חלקים: אדמת עציץ מסחרית (ראו טבלת חומרים) ושני חלקים אדמה עליונה מעוקרת בקיטור.
- שתילי מים למשך 2 דקות עם מערכת השקיה עילית פעם ביום, בבוקר.
- קציר שתילים בשלב V2 על ידי חיתוך אותם בגובה הקרקע. שלב הצמיחה V2 מגיע כאשר השתילים הם בגובה 5 עד 10 ס"מ ויש להם שני עלים גלויים עם צווארון21.
- עטפו את הצמחים במגבת נייר לחה והניחו אותם בשקית ניילון להובלה למעבדה להמשך עיבוד.
- תרבויות פטרייתיות
- הפעל מחדש תרביות מלאי סיליקה פטרייתיות מאוחסנות בתנאים אספטיים22על ידי פיזור כ -50 גרגירים של הסיליקה השורצת על מדיום אגר מתאים. כדי למנוע שינויים מורפולוגיים ואובדן פתוגניות, תת-תרבית זנים לא יותר מ 3x לאחר הפעלה מחדש. אגר דקסטרוז תפוחי אדמה (PDA; ראו טבלת חומרים) משמש באופן שגרתי לתרבית C. graminicola ואילו אגר שיבולת שועל (OA; ראו טבלת חומרים) משמש לאגר S. maydis.
- כדי להכין מחשב כף יד לגידול מלאי פטרייתי, יש להשהות 19.5 גרם של מחשב כף יד מיובש שהוכן באופן מסחרי ב-500 מ"ל של מים שעברו דה-יוניזציה (DI). להכנת OA, הרתיחו 36 גרם של OA מיובש שהוכן מסחרית במי DI למשך 15-30 דקות, סננו דרך שלוש שכבות של בד גבינה והביאו את הסינון ל-500 מ"ל עם מי DI. מדיה Autoclave כדי לעקר.
- הגדילו את המדיה המותכת והמקוררת עם אנטיביוטיקה מתאימה (למשל, היגרומיצין B, גנטיקין) בעת עבודה עם זנים טרנספורמטיביים. הריכוזים הסופיים של היגרומיצין או גנטיצין ב-500 מ"ל מדיה הם 250 מיקרוגרם/מ"ל ו-100 מק"ג/מ"ל, בהתאמה.
- לדגור על תרביות בתנאים אופטימליים עד להתפתחות תפטיר נבג. Colletotrichum graminicola ו- S. maydis גדלים היטב ב 23 °C עם אור פלואורסצנטי רציף ורמות לחות הסביבה. הספורולציה מתרחשת 7 ימים לאחר החיסון (dai) עבור S. maydis או 14 dai עבור C. graminicola.
2. חיסונים נגד נדן עלים
- הרכבת יחידת מסנן זכוכית-צמר
- השתמש במספריים או גזירים כבדים כדי לחתוך את המכסה וכ- 0.5 מ"מ מהתחתית החרוטית של צינור מיקרוצנטריפוגה בנפח 1.5 מ"ל (ראה טבלת חומרים).
- הניחו פיסת צמר זכוכית (בערך 0.5 ס"מ x 0.5 ס"מ; ראו טבלת חומרים) בתוך הצינור החתוך כדי לכסות את החור המרכזי, כפי שמתואר באיור 2.
- ללבוש כפפות בעת חיתוך צמר זכוכית, כמו זכוכית borosilicate יכול לגרום לגירוי.
- הכנת מתלים לתמיכה בנדן עלים
- חתכו לוח PCR ללא חצאית של 96 בארות (ראו טבלת חומרים) לשישה מדפי תמיכה דו-טוריים (8 x 2 בארות) כמתואר באיור 3A.
- הפכו את המדפים בעלי שני העמודים כך שהתחתונים החרוטיים של הבארות פונים כלפי מעלה והצמרות השטוחות פונות כלפי מטה (איור 3B).
- הניחו כל תמיכה בצלחת פטרי מזכוכית המכילה נייר פילטר לח וכסו אותה במכסה (ראו טבלת חומרים). יחידה זו מתפקדת כתא לחות קטן לנדן.
- הכנת Inoculum
- עבור כל זן פטרייתי, הניחו יחידת מסנן אחת מורכבת מצמר זכוכית לתוך צינור מיקרוצנטריפוגה סטרילי שלם בנפח 1.5 מ"ל כפי שמתואר באיור 2. האחרון מתפקד כצינור איסוף.
- תייגו את הצינורות.
- קצרו קונידיה מתרביות נבגים על ידי הצפה ראשונה של כל צלחת ב-3-4 מ"ל של מים סטריליים מסוג DI. במקרים מסוימים ייתכן שיהיה צורך ביותר מים כדי לייצר שכבת נוזל על פני המושבה. חומרי הרטבה אינם נחוצים במערכת זו.
- שחררו את הנבגים מהאגר על ידי שימוש במזיק סטרילי בעל קצה חרוטי (ראו טבלת חומרים) כדי לגרד באופן שווה על פני הצלחת כולה.
- יש למרוח 1 מ"ל של תרחיף הנבגים על יחידת מסנן צמר זכוכית באופן אספטי ולאפשר לנבגים לזרום דרך צינור האיסוף באמצעות כוח הכבידה.
- צנטריפוגה את צינורות האיסוף המכילים את מתלי הנבגים המסוננים ב 3,500 x גרם למשך 5 דקות. הנבגים צריכים להיות כדוריים בתחתית צינור מיקרוצנטריפוגה.
הערה: צנטריפוגה של נבגי C. graminicola במהירויות גבוהות מהמומלץ כאן גורמת לאובדן משמעותי של הכדאיות. - יוצקים את הנוזל למיכל הניתן להרכבה, מוסיפים 1 מ"ל של מים סטריליים DI, ומתסיסים בעדינות כדי להשהות מחדש את הנבגים הכדוריים. צנטריפוגה כמו בשלב 2.3.6.
- יש לשטוף נבגים פי 3 כדי להסיר כל מטריצה קונידיאלית שעשויה להכיל מעכבים אוטומטיים שעשויים להפחית נביטה או חדירה.
- לאחר השטיפה השלישית, הוסיפו 300-500 מיקרוליטר של מי DI סטריליים כדי להשהות מחדש נבגים לצורך כימות.
- השתמש בהמוציטומטר תחת מיקרוסקופ מורכב בהגדלה של 100x כדי לקבוע את ריכוז הנבגים. אין צורך להכתים נבגים לפני הספירה.
- הכינו תרחיף 5 x 105 נבגים/מ"ל עם מים סטריליים DI.
הערה: ניתן לשמור את מתלה הנבג של C. graminicola בטמפרטורת החדר לא יותר מ-4 שעות לפני אובדן מהיר של הכדאיות. קירור קונידיה אינו מגביר את הכדאיות.
- חיסוני מעטפת
- בדוק שיטות ונהלי בטיחות ביולוגית רלוונטיים לפני חיסון צמחים בזנים פטרייתיים.
- הסר את הנדן מהעלה האמיתי הראשון של שתילי V2 על ידי העברת תמונה ממוזערת לאורך השוליים החופפים של הנדן, ושחרר אותו בעדינות מהנבט. שחררו את הנדן משני צידי הצילום לפני שתנסו להסיר אותו.
- חותכים את נדני העלים המשוחזרים למקטעים של 3-5 ס"מ. אין צורך לחטא את הנדן לפני החיסון.
- פתחו כל מקטע בעדינות רבה כדי לחשוף את שכבת האפידרמיס הפנימית (אדקסיאלית).
- בעת הכנת הנדן לחיסון, יש לשמור את שאר הנדן שנכרת עטוף במגבת נייר לחה כדי למנוע התייבשות.
- הניחו 20 μL של תרחיף הנבג הפטרייתי על המשטח הפנימי במרכז חתיכת הנדן, ישירות מעל הצלע האמצעית, כפי שמתואר באיור 4.
- הניחו את נדן העלים המחוסנים בצורה אופקית, כאשר הצלע האמצעית ממוקמת בתחתית, בתמיכה בתוך צלחת פטרי מזכוכית המכילה נייר סינון לח כפי שמתואר באיור 5.
- כל מדף מכיל עד שבעה נדנים. יש לחסן לפחות חמישה נדנים לכל זן כדי לפצות על אובדן העתקים שעלולים להתרחש במהלך הכנת הדגימה או הדגירה.
- הכניסו את תאי הלחות הקטנים לקופסת אחסון שקופה מרופדת בנייר נביטה לח (ראו טבלת חומרים).
- מכסים את הקופסה במכסה. לדגור את התיבה ב 23 מעלות צלזיוס עם תאורה רציפה עבור מסלול הזמן המיועד, אשר תלוי בפטרייה ובשלבי התפתחות פטרייתית כי יהיה נצפה. סיכום של מסלול הזמן עבור נדן תירס שחוסנו ב-C. graminicola מובא בטבלה 1.
- בדוק כל יום סימנים / סימפטומים של מחלה על הנדן ולשמור על נייר נביטה ומסנן לח. נדני עלים יכולים להישמר עד 6 ימים ללא מוות ברור של תאי הצמח או התפרקות בהיעדר חיסון.
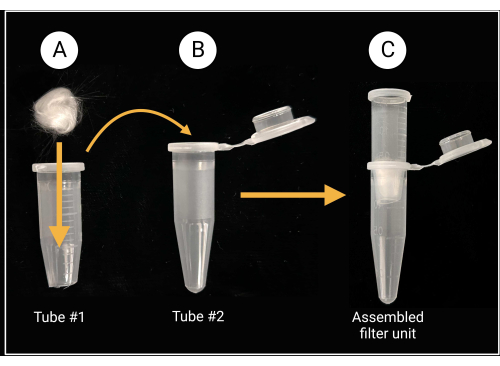
איור 2: הכנת יחידת סינון צמר זכוכית. (A) כדור צמר זכוכית בגודל 0.5 ס"מ x 0.5 ס"מ מונח בתוך צינור מיקרוצנטריפוגה 1 שתחתיתו החרוטית מוסרת. (ב-ג) לאחר מכן מכניסים את צינור המסנן לצינור מיקרוצנטריפוגה 2 כדי ליצור יחידת סינון מורכבת להכנת תרחיף נבגים. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
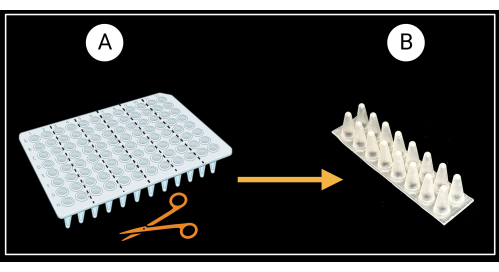
איור 3: שיטה לחיתוך צלחת PCR ללא חצאית של 96 בארות. (A) לוחית PCR חתוכה לשישה ארונות תמיכה, 8 x 2 בארות. דוגמה לתמיכה בנדן יחיד מתוארת ב- (B). נדני העלים מונחים אופקית על התמיכה. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: שיטת חיסון מעטפת. טיפה אחת של inoculum מוחל ישירות על פני השטח adaxial של קטע הנדן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
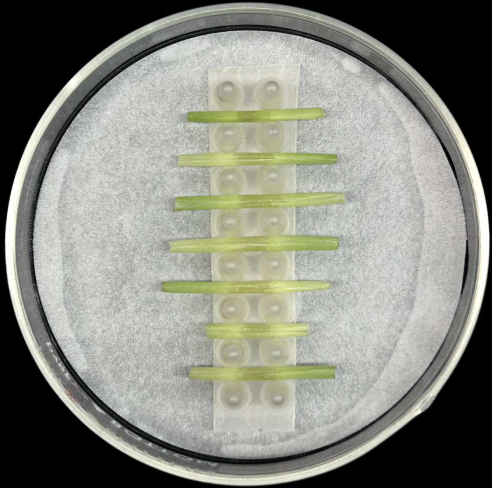
איור 5: שיטת הדגירה של מעטפת. נדני עלים מחוסנים מונחים אופקית במדף תמיכה בתוך צלחת פטרי זכוכית המכילה נייר סינון לח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. מיקרוסקופ תאים חיים
- הכנת דגימה למיקרוסקופ
- יש לשטוף את חתיכות הנדן בעדינות במים סטריליים DI כדי להסיר נבגים לא דבוקים או צמיחה פטרייתית שטחית.
- הניחו את הנדן על שקופית מיקרוסקופ זכוכית נקייה (ראו טבלת חומרים) כאשר המשטח האדקסיאלי (הפנימי) של הנדן פונה כלפי מטה והמשטח האבקסיאלי (החיצוני) העליון ביותר.
- השתמש בסכין גילוח חדש בעל קצה יחיד (ראה טבלת חומרים) כדי לחתוך כ-1 ס"מ מקצות הנדן ולהסיר את רוב רקמת הלמינה משני צדי הצלע האמצעית.
- החזיקו את סכין הגילוח בזווית של 90° ביחס לנדן כדי לגלח את הרקמה מהצלע האמצעית האבקסיאלית וחשפו את שכבת האפידרמיס על פני השטח האדקסיאליים מעל הנקודה המחוסנת. נסו לשמור על עובי אחיד. לאחר גילוח נדן העלים, גיזום נוסף אינו מומלץ מכיוון שהדבר עלול לפגוע בדגימה.
- ודא שהחלקים המגולחים אינם עולים על 1 ס"מ x 1 ס"מ. הימנעו מלחיצה על מרכז הנדן במהלך תהליך זה. כאשר עובדים עם נדן מחוסן עם מתלים נבגים שונים, לחטא כפפות ולשנות את סכין הגילוח בין דגימות.
- הכינו מגלשה של מיקרוסקופ זכוכית נקי. הרימו את קטע הנדן מקצה אחד והעבירו אותו בזהירות לשקופית חדשה. המשטח המחוסן (אדקסיאלי) של הנדן צריך להיות עליון, הקרוב ביותר לעדשה האובייקטיבית. הר חלקים בעדינות כדי למנוע נזק למבנים פטרייתיים.
- יש למרוח 60 מיקרוליטר מים סטריליים DI על המקטע ולהוסיף כיסוי זכוכית בגודל 24 מ"מ x 60 מ"מ (ראו טבלת חומרים). עשו זאת לאט כדי למנוע בועות אוויר.
- כאשר המוצר מוכן למיקרוסקופיה, אטמו את הכיסוי בלק שקוף (ראו טבלת חומרים) על ידי הנחת טיפה קטנה על כל קצה ולאחר מכן חיבור הטיפות יחד עם מברשת לק ליצירת אטימה חלקה.
הערה: פרוטוקול נדן זה יכול לשמש עם כתמים ציטולוגיים, למשל, 4′,6-diamidino-2-phenylindole (DAPI), אדום נייטרלי, או כחול טריפאן, או לתצפית של פלסמוליזה התא כדי להעריך את הכדאיות של תאי הצמח. לבדיקת צביעת נדן או פלסמוליזה של תאים, אין לאטום את הכיסוי. - לבדיקות פלסמוליזה, הוסף תמיסה היפרטונית (0.75 M סוכרוז או 1 M נתרן כלורי) לקצה אחד של הכיסוי והשתמש בנייר טישו מקופל ללא מוך כדי למשוך את התמיסה על פני הדגימה לקצה השני של הכיסוי. עבור צביעה, השתמש בשיטה דומה כדי להחיל את תמיסת הכתם.
- מיקרוסקופ שדה רחב
- לאחר שנדני העלים מורכבים על שקופיות מיקרוסקופ, בדקו אותם להתיישבות פטרייתית באמצעות מיקרוסקופ אור רחב שדה בהגדלה של פי 400.
- כדי לצפות במבנים פטרייתיים בפירוט, השתמש במטרה טבילה במים ולא בשמן לקבלת איכות תמונה טובה יותר של הדגימות. סטייה כדורית עקב אי-התאמה של אינדקס השבירה עלולה לגרום לירידה באיכות התמונה. מטרות מים זמינות עבור מיקרוסקופ אור רחב שדה כמו גם מיקרוסקופים קונפוקליים.
- כדי לקבוע את הכמות היחסית של התיישבות לנדן, ספרו את מספר תאי התירס שפלשו מכל אתר חדירה פטרייתי באמצעות מיקרוסקופ אור רחב שדה בהגדלה של פי 100. כימות זה הוא שלב סינון מתאים לפני כל ניתוח סטטיסטי המשווה זנים, טיפולים ו / או שלבים התפתחותיים.
- מיקרוסקופ סריקת לייזר קונפוקלי
- כדי לצפות בחלבונים פלואורסצנטיים ברקמות תירס במהלך התפתחות זנים פטרייתיים טרנסגניים, התאם את הפרמטרים הבסיסיים של רכישת תמונה. זהה את הגדרות העירור/הפליטה הטובות ביותר בהתבסס על סמן הפלואורסצנט שנבחר.
הערה: יעד מים של פי 60 עדיף בעת ניתוח איחוי פלואורסצנטי הבנוי מחלבונים מופרשים. למיקרוסקופים קונפוקליים מודרניים יש מטרות טבילה מתוקנות מאוד במים כדי למנוע ממצאים וסטיות צורה. - אם הכוונה היא להדמיית תאים חיים של חלבונים פלואורסצנטיים, השתמשו בזנים פטרייתיים שלא עברו טרנספורמציה כאמצעי בקרה לאוטופלואורסצנטיות. השתמש בפרמטרים הבאים של רכישת תמונה כדי ללכוד דינמיקה פטרייתית-מארחת במיקרוסקופ קונפוקלי הפוך ועבור חלבון פלואורסצנטי mCherry. הגדר עוצמת לייזר של עד 5%, 450-600 מתח גבוה (HV) בהתאם לרמת הביטוי, רווח X 1.375, קיזוז של 3%, מקדם זום אופטי של 1 לניתוח של עד חמישה תאי תירס לכל קטע, ומקדם זום אופטי של 2-5 עבור קורים בודדים.
הערה: תמונות קונפוקליות Z-stack ברזולוציה גבוהה מספקות נתונים תלת-ממדיים ותצוגה טובה יותר של אינטראקציות בזמן אמת בין המארח לפתוגן. - לכימות עוצמות פלואורסצנטיות המתאימות לחלבוני היתוך מופרשים, השתמשו בתוכנת ניתוח תמונה של יצרן הקונפוקל או בתוכנת עיבוד תמונה כגון ImageJ, אותה ניתן להוריד באופן חופשי באינטרנט. עיין במדריך לקבלת פרטים כיצד לכמת אותות פלואורסצנטיים בהתאם.
- כדי לצפות בחלבונים פלואורסצנטיים ברקמות תירס במהלך התפתחות זנים פטרייתיים טרנסגניים, התאם את הפרמטרים הבסיסיים של רכישת תמונה. זהה את הגדרות העירור/הפליטה הטובות ביותר בהתבסס על סמן הפלואורסצנט שנבחר.
תוצאות
הדוגמאות שלהלן מתארות תוצאות מייצגות בעקבות השימוש בשיטת החיסון נגד נדן עלי תירס. דוגמאות אלה מדגימות את הקלות, המהירות והדיוק שבהם ניתן לבצע תצפית והשוואה של אינטראקציות תירס-פטרייה בזמן אמת באמצעות בדיקה אופטימלית זו. הדמיה של תאים חיים מאפשרת גם חילוץ מידע כמותי, ומספקת כלי שימושי למח?...
Discussion
שיטת החיסון האופטימלית של נדן העלים המתוארת כאן שונה מפרוטוקול מקורי שפותח ויושם על נדן עלי אורז 6,8,36. הוא מאפשר תצפיות ישירות ומפורטות על גדילה והתפתחות פטרייתיות בתאי צמח חיים באמצעות מיקרוסקופ רחב או קונפוקלי. הפרוטוקול מתאים לאפיון, ?...
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים ואין להם מה לחשוף.
Acknowledgements
המחברים מודים למשרד החקלאות האמריקאי על תמיכתם הכספית (מספרי המענקים 2018-67013-28489 ו-2020-70410-32901). כל הדעות, הממצאים, המסקנות או ההמלצות המובעות בכתב יד זה הן אך ורק של המחברים ואינן משקפות בהכרח את השקפותיו של משרד החקלאות האמריקאי. אנו מודים לסטודנטית מברזיל המבקרת ב"מדע ללא גבולות", מיארה דה סילבה, על התמונות שמופיעות באיור 6A ובאיור 7D. אנו מודים גם למחלקה לפתולוגיה של צמחים באוניברסיטת קנטקי על מתן גישה למיקרוסקופים קונפוקליים של אולימפוס.
Materials
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
References
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved