Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Vainas de maíz desprendidas para la obtención de imágenes de células vivas de la infección por patógenos fúngicos foliares del maíz
En este artículo
Resumen
En este manuscrito se detalla un protocolo de inoculación optimizado que utiliza vainas de hojas de maíz desprendidas para estudios citológicos, fisiológicos y moleculares reproducibles de las interacciones del maíz con los patógenos fúngicos de las plantas. Las vainas de las hojas facilitan la observación en tiempo real de las interacciones celulares entre la planta viva y el hongo en tejidos no fijados.
Resumen
Hemos optimizado un protocolo para inocular vainas foliares de maíz con hongos patógenos foliares hemibiotróficos y necrótrofos. El método es una modificación de uno aplicado originalmente a las vainas de las hojas de arroz y permite la observación microscópica directa del crecimiento y desarrollo de hongos en células vegetales vivas. Las vainas foliares recolectadas de plántulas de maíz con dos collares foliares completamente emergidos se inoculan con 20 μL de suspensiones de esporas fúngicas de 5 x 105 esporas/mL y se incuban en cámaras de humedad a 23 °C bajo luz fluorescente continua. Después de 24-72 h, el exceso de tejido se elimina con una cuchilla de afeitar para dejar una sola capa de células epidérmicas, una muestra ópticamente clara que se puede obtener directamente sin necesidad de fijación química o aclaramiento. Las células vegetales y fúngicas permanecen vivas durante la duración del experimento y las interacciones se pueden visualizar en tiempo real. Las vainas pueden teñirse o someterse a plasmólisis para estudiar la citología del desarrollo y la viabilidad de las células huésped y patógena durante la infección y la colonización. Las cepas fúngicas transformadas para expresar proteínas fluorescentes pueden ser inoculadas o co-inoculadas en las vainas para aumentar la resolución y facilitar la evaluación de interacciones competitivas o sinérgicas. Las cepas fúngicas que expresan proteínas de fusión fluorescentes se pueden utilizar para rastrear y cuantificar la producción y el objetivo de estas proteínas individuales en la planta. Los tejidos de la vaina inoculados se pueden extraer para caracterizar ácidos nucleicos, proteínas o metabolitos. El uso de estos ensayos de vaina ha hecho avanzar en gran medida los estudios detallados de los mecanismos de patogenicidad fúngica en el maíz y también de los efectores proteicos fúngicos y los metabolitos secundarios que contribuyen a la patogenicidad.
Introducción
Los análisis espaciales y temporales a nivel celular son fundamentales para comprender la fisiología y la citología de las interacciones entre hongos y plantas. Los tejidos foliares que han sido fijados químicamente 1,2,3 o aclarados y teñidos4, así como las membranas artificiales5, se han utilizado en el pasado para investigar la citología del desarrollo de patógenos foliares y las interacciones planta-hongo. Sin embargo, la investigación de eventos de infección en tejidos vivos del huésped en tiempo real sin fijación o aclaramiento es un desafío debido a problemas técnicos relacionados con la preparación de muestras ópticamente transparentes para la obtención de imágenes.
A finales de la década de 1940 se desarrolló un protocolo de inoculación de la vaina de la hoja separada para la investigación microscópica de campo claro de la resistencia de las células epidérmicas vivas del arroz al hongo del brusone del arroz Magnaporthe oryza6. Más recientemente, las observaciones moleculares, fisiológicas y citológicas detalladas de la colonización del huésped por las especies Colletotrichum y Magnaporthe se han facilitado en gran medida mediante la combinación de versiones modificadas de este método de vaina foliar con transformadores fúngicos que expresan proteínas fluorescentes y protocolos de imágenes de células vivas de alto rendimiento, incluida la epifluorescencia y la microscopía confocal 7,8,9,10.11,12,13.
En este trabajo se detalla un protocolo de inoculación optimizado utilizando vainas foliares de maíz separadas para la observación de procesos de infección por patógenos fúngicos foliares hemibiotróficos y necrótrofos. Lo hemos utilizado específicamente para estudiar Colletotrichum graminicola (C. graminicola), el agente causal del tizón de la hoja y la pudrición del tallo de la antracnosis, y Stenocarpella maydis, que causa el tizón de la hoja y la pudrición del tallo por Diplodia. Sin embargo, el método debe ser aplicable a otros patógenos fúngicos foliares hemibiotróficos y necrótrofos. Las respuestas citológicas y fisiológicas durante los eventos de infección y colonización en estas vainas foliares extirpadas son similares a las de las láminas foliares enteras12,14,15. Además, la colonización hemibiotrófica de las células epidérmicas de la vaina por C. graminicola es similar a la colonización de las células de la médula del tallo16,17. Las vainas desprendidas muestran mayor sincronicidad y reproducibilidad experimental de la penetración y colonización fúngica que las láminas foliares o los tejidos de la médula del tallo14,16,17,18. La mayoría de las variedades de maíz se pueden utilizar para este protocolo. Sin embargo, los endogámicos o híbridos con exceso de pigmentos púrpuras en las vainas son menos adecuados, ya que los pigmentos interfieren con las imágenes. El maíz dulce del Jubileo de Oro ha sido particularmente útil para nuestros estudios porque las semillas no tratadas están disponibles comercialmente, las plantas son altamente susceptibles a muchas enfermedades foliares y crecen bien en el invernadero. Las primeras epidemias de pudrición del tallo por antracnosis en los Estados Unidos provocaron la pérdida total de las cosechas de maíz dulce en Indiana en la década de 197019,20. Este método de inoculación de la vaina foliar se puede aplicar para observar y cuantificar directamente el crecimiento y desarrollo de hongos en células vegetales vivas frente a células vegetales muertas localmente, para demostrar reacciones de resistencia en respuestas compatibles/incompatibles a la infección fúngica y para probar las interacciones entre cepas fúngicas en la misma vaina en tiempo real.
Protocolo
NOTA: El flujo de trabajo del método se muestra en la Figura 1.
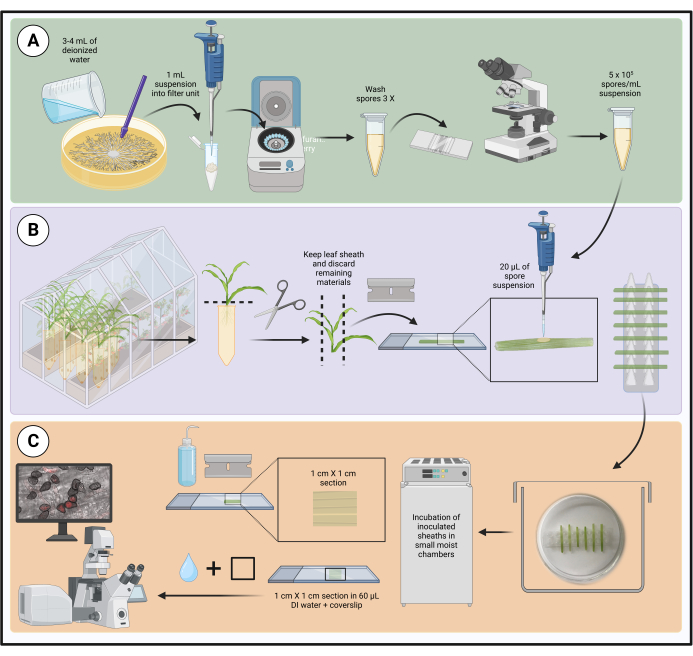
Figura 1: Pasos del protocolo de inoculación optimizado utilizando vainas de hojas de maíz desprendidas. La preparación de la suspensión de esporas, la inoculación de la vaina foliar y la preparación de la muestra para la microscopía de células vivas se resaltan en los cuadros verde (A), púrpura (B) y naranja (C), respectivamente. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
1. Material vegetal y fúngico
- Crecimiento de las plantas
- Cultive plántulas de maíz (ver Tabla de Materiales) en invernadero (14 h de luz/27 °C y 10 h de oscuridad/22 °C) en recipientes SC10 (ver Tabla de Materiales). Use un medio de cultivo que consista en tres partes de tierra para macetas comerciales (consulte la Tabla de materiales) y dos partes de tierra vegetal esterilizada con vapor.
- Riegue las plántulas durante 2 minutos con un sistema de riego por aspersión una vez al día, por la mañana.
- Coseche las plántulas en la etapa V2 cortándolas a nivel del suelo. La etapa de crecimiento V2 se alcanza cuando las plántulas miden de 5 a 10 cm de altura y tienen dos hojas visibles con collar21.
- Envuelva las plantas con una toalla de papel húmeda y colóquelas en una bolsa de plástico para transportarlas al laboratorio para su posterior procesamiento.
- Cultivos fúngicos
- Reactivar los cultivos madre de sílice fúngica almacenados en condiciones asépticas22rociando aproximadamente 50 gránulos de la sílice infestada en un medio de agar apropiado. Para evitar cambios morfológicos y pérdida de patogenicidad, las cepas del subcultivo no superan las 3 veces después de la reactivación. El agar papa dextrosa (PDA; ver Tabla de Materiales) se usa rutinariamente para cultivar C. graminicola, mientras que el agar avena (OA; ver Tabla de Materiales) se usa para S. maydis.
- Para preparar PDA para el cultivo de poblaciones de hongos, suspenda 19,5 g de PDA deshidratado preparado comercialmente en 500 mL de agua desionizada (DI). Para hacer artrosis, hierva 36 g de artrosis deshidratada preparada comercialmente en agua desionizada durante 15-30 minutos, filtre a través de tres capas de gasa y lleve el filtrado a 500 ml con agua desionizada. Medios de autoclave para esterilizar.
- Aumente el medio fundido y enfriado con un antibiótico apropiado (p. ej., higromicina B, genética) cuando trabaje con cepas transformantes. Las concentraciones finales de higromicina o genética en 500 mL de medio son 250 μg/mL y 100 μg/mL, respectivamente.
- Incubar los cultivos en condiciones óptimas hasta que se haya desarrollado un micelio esporulante. Colletotrichum graminicola y S. maydis crecen bien a 23 °C con luz fluorescente continua y niveles de humedad ambiental. La esporulación ocurre a los 7 días después de la inoculación (dai) para S. maydis o 14 dai para C. graminicola.
2. Inoculación de la vaina foliar
- Conjunto de la unidad de filtro de lana de vidrio
- Utilice tijeras o tijeras de alta resistencia para cortar la tapa y aproximadamente a 0,5 mm del fondo cónico de un tubo de microcentrífuga de 1,5 ml (consulte la tabla de materiales).
- Coloque un pedazo de lana de vidrio (aproximadamente 0.5 cm x 0.5 cm; ver Tabla de Materiales) dentro del tubo cortado para cubrir el orificio central, como se muestra en la Figura 2.
- Use guantes mientras corta lana de vidrio, ya que el vidrio de borosilicato puede causar irritación.
- Preparación de los bastidores de soporte de la vaina de las hojas.
- Corte una placa de PCR de 96 pocillos sin faldón (consulte la Tabla de materiales) en seis bastidores de soporte de dos columnas (8 x 2 pocillos) como se muestra en la Figura 3A.
- Voltee las rejillas de dos columnas de modo que los fondos cónicos de los pocillos miren hacia arriba y los superiores planos miren hacia abajo (Figura 3B).
- Coloque cada soporte en una placa de Petri de vidrio que contenga papel de filtro humedecido y cúbralo con la tapa (consulte la Tabla de materiales). Esta unidad funciona como una pequeña cámara de humedad para las vainas.
- Preparación del inóculo
- Para cada cepa fúngica, coloque una unidad de filtro de lana de vidrio ensamblada en un tubo de microcentrífuga estéril intacto de 1,5 ml como se muestra en la Figura 2. Este último funciona como un tubo de recolección.
- Etiqueta los tubos.
- Coseche los conidios de los cultivos esporulados inundando primero cada placa con 3-4 ml de agua desionizada estéril. En algunos casos, puede ser necesaria más agua para producir una capa de líquido en la superficie de la colonia. Los agentes humectantes no son necesarios en este sistema.
- Afloje las esporas del agar usando un mortero estéril de punta cónica (consulte la Tabla de materiales) para raspar uniformemente en toda la placa.
- Aplique 1 ml de la suspensión de esporas a una unidad de filtro de lana de vidrio de forma aséptica y deje que las esporas fluyan por gravedad hacia el tubo de recolección.
- Centrifugar los tubos de recolección que contienen las suspensiones de esporas filtradas a 3.500 x g durante 5 min. Las esporas deben peletizarse en el fondo del tubo de microcentrífuga.
NOTA: La centrifugación de esporas de C. graminicola a velocidades superiores a las recomendadas aquí da como resultado una pérdida significativa de viabilidad. - Vierta el líquido en un recipiente esterilizable en autoclave, agregue 1 ml de agua desionizada estéril y agite suavemente para resuspender las esporas granuladas. Centrífuga como en el paso 2.3.6.
- Lave las esporas 3 veces para eliminar cualquier matriz conidial que pueda contener inhibidores automáticos que puedan reducir la germinación o la penetración.
- Después del tercer lavado, agregue 300-500 μL de agua desionizada estéril para resuspender las esporas para su cuantificación.
- Utilice un hemocitómetro bajo un microscopio compuesto con un aumento de 100x para determinar la concentración de esporas. No es necesario teñir las esporas antes de contar.
- Prepare una suspensión de 5 x 105 esporas/ml con agua desionizada estéril.
NOTA: La suspensión de esporas de C. graminicola puede mantenerse a temperatura ambiente durante no más de 4 horas antes de una rápida pérdida de viabilidad. Refrigerar los conidios no aumenta la viabilidad.
- Inoculaciones de vaina
- Verifique las prácticas y procedimientos de bioseguridad pertinentes antes de inocular las plantas con cepas fúngicas.
- Retire la vaina de la primera hoja verdadera de las plántulas V2 pasando una uña del pulgar a lo largo del margen superpuesto de la vaina y aflójela suavemente del brote. Afloje la funda de ambos lados del brote antes de intentar quitarla.
- Corta las vainas de las hojas recuperadas en segmentos de 3-5 cm. No es necesario desinfectar las vainas antes de la inoculación.
- Desenrolle cada segmento muy suavemente para exponer la capa epidérmica interna (adaxial).
- Mientras prepara las vainas para la inoculación, mantenga las vainas restantes extirpadas envueltas con una toalla de papel húmeda para evitar la desecación.
- Coloque 20 μL de la suspensión de esporas de hongos en la superficie interna en el centro de la pieza de la vaina, directamente encima de la nervadura central, como se muestra en la Figura 4.
- Coloque las vainas de las hojas inoculadas horizontalmente, con la nervadura central colocada en la parte inferior, en el soporte dentro de una placa de Petri de vidrio que contenga un papel de filtro humedecido como se muestra en la Figura 5.
- Cada estante tiene capacidad para siete fundas. Inocular al menos cinco vainas por cepa para compensar la pérdida de réplicas que pueda producirse durante la preparación de la muestra o la incubación.
- Coloque las pequeñas cámaras de humedad en una caja de almacenamiento transparente forrada con papel de germinación humedecido (consulte la Tabla de materiales).
- Cubre la caja con la tapa. Incubar la caja a 23 °C con iluminación continua durante el tiempo previsto, que depende del hongo y de las etapas de desarrollo del hongo que se observarán. En la Tabla 1 se presenta un resumen de la evolución temporal de las vainas de maíz inoculadas con C. graminicola.
- Revise todos los días si hay signos / síntomas de enfermedad en las vainas y mantenga húmedos tanto la germinación como los papeles de filtro. Las vainas de las hojas pueden retenerse hasta 6 días sin que se produzca una muerte o degradación evidente de las células vegetales en ausencia de inoculación.
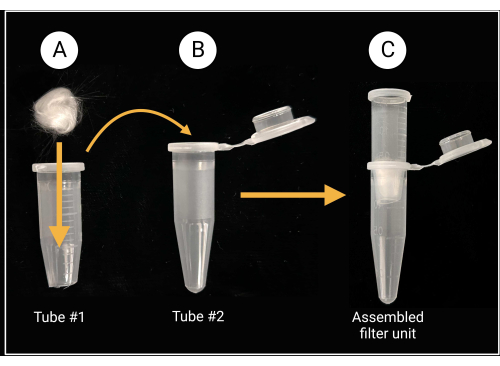
Figura 2: Preparación de la unidad de filtro de lana de vidrio. (A) Se coloca una bola de lana de vidrio de 0,5 cm x 0,5 cm dentro del tubo de microcentrífuga 1 al que se le quita el fondo cónico. (B-C) A continuación, el tubo de filtro se coloca en el tubo de microcentrífuga 2 para generar una unidad de filtro ensamblada para la preparación de la suspensión de esporas. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
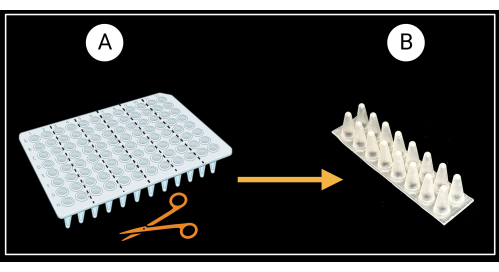
Figura 3: Método de corte de una placa de PCR de 96 pocillos sin faldón. (A) Placa de PCR cortada en seis bastidores de soporte, 8 x 2 pocillos. Un ejemplo de un solo soporte de vaina se muestra en (B). Las vainas de las hojas se colocan horizontalmente sobre el soporte. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Método de inoculación de la vaina. Una sola gota de inóculo aplicada directamente a la superficie adaxial de la sección de la vaina. Haga clic aquí para ver una versión más grande de esta figura.
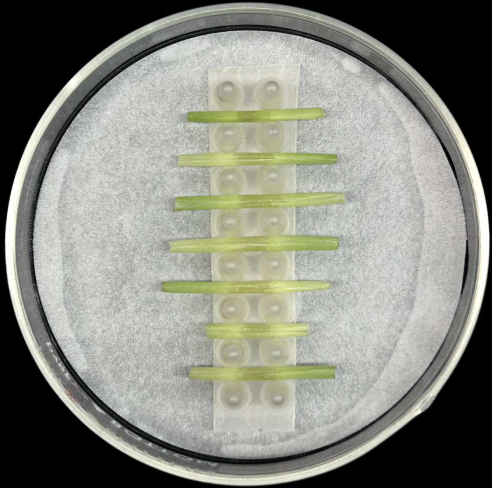
Figura 5: Método de incubación de la vaina. Vainas de hojas inoculadas colocadas horizontalmente en una rejilla de soporte dentro de una placa de Petri de vidrio que contiene papel de filtro humedecido. Haga clic aquí para ver una versión más grande de esta figura.
3. Microscopía de células vivas
- Preparación de muestras para microscopía
- Enjuague suavemente las piezas de la vaina con agua desionizada estéril para eliminar las esporas no adheridas o el crecimiento de hongos superficiales.
- Coloque la vaina en un portaobjetos de microscopio de vidrio limpio (ver Tabla de Materiales) con la superficie adaxial (interior) de la pieza de la vaina hacia abajo y la superficie abaxial (exterior) hacia arriba.
- Utilice una nueva hoja de afeitar de un solo filo (consulte la Tabla de materiales) para recortar aproximadamente 1 cm de los extremos de la vaina y eliminar la mayor parte del tejido de la lámina a ambos lados de la nervadura central.
- Sostenga la hoja de afeitar en un ángulo de 90° con respecto a la vaina para afeitar el tejido de la nervadura central abaxial y exponer la capa epidérmica en la superficie adaxial por encima del punto inoculado. Trate de mantener un grosor uniforme. Una vez afeitadas las vainas de las hojas, no se recomienda recortar más, ya que esto puede dañar la muestra.
- Asegúrese de que las secciones afeitadas no tengan más de 1 cm x 1 cm de tamaño. Evite presionar el centro de la funda durante este proceso. Cuando trabaje con vainas inoculadas con diferentes suspensiones de esporas, desinfecte los guantes y cambie la hoja de afeitar entre muestras.
- Tenga listo un portaobjetos de microscopio de vidrio limpio. Levante la sección de la funda desde un borde y transfiérala con cuidado a una nueva guía. La superficie inoculada (adaxial) de la vaina debe estar más arriba, más cerca de la lente del objetivo. Monte las secciones suavemente para evitar daños en las estructuras fúngicas.
- Aplique 60 μL de agua desionizada estéril a la sección y agregue un cubreobjetos de vidrio de 24 mm x 60 mm (ver Tabla de Materiales). Hazlo lentamente para evitar burbujas de aire.
- Cuando esté listo para la microscopía, selle el cubreobjetos con esmalte de uñas transparente (consulte la Tabla de materiales) colocando una pequeña gota en cada borde y luego conectando las gotas con un cepillo de esmalte de uñas para hacer un sellado perfecto.
NOTA: Este protocolo de vaina se puede utilizar con tinciones citológicas, por ejemplo, 4′,6-diamidino-2-fenilindol (DAPI), rojo neutro o azul de tripano, o para la observación de la plasmólisis celular para evaluar la viabilidad de las células vegetales. Para la tinción de la vaina o los ensayos de plasmólisis celular, no selle el cubreobjetos. - Para los ensayos de plasmólisis, agregue una solución hipertónica (0,75 M de sacarosa o 1 M de cloruro de sodio) a un borde del cubreobjetos y use un papel de seda doblado sin pelusa para extraer la solución a través de la muestra hasta el otro borde del cubreobjetos. Para teñir, use un método similar para aplicar la solución de tinción.
- Microscopía de campo amplio
- Una vez que las vainas de las hojas estén montadas en portaobjetos de microscopio, inspecciónelas en busca de colonización fúngica utilizando un microscopio óptico de campo amplio con un aumento de 400x.
- Para observar las estructuras fúngicas en detalle, utilice un objetivo de inmersión en agua en lugar de aceite para obtener una mejor calidad de imagen de las muestras. La aberración esférica debida a un desajuste del índice de refracción puede causar degradación de la imagen. Los objetivos de agua están disponibles para microscopios ópticos de campo amplio, así como para microscopios confocal.
- Para determinar la cantidad relativa de colonización por vaina, cuente el número de células de maíz invadidas desde cada sitio de penetración fúngica utilizando un microscopio óptico de campo amplio con un aumento de 100x. Esta cuantificación es un paso de cribado adecuado antes de cualquier análisis estadístico que compare cepas, tratamientos y/o etapas de desarrollo.
- Microscopía de barrido láser confocal
- Para observar las proteínas fluorescentes en los tejidos de maíz durante el desarrollo de cepas fúngicas transgénicas, ajuste los parámetros básicos de adquisición de imágenes. Identifique los mejores ajustes de excitación/emisión en función del marcador fluorescente seleccionado.
NOTA: Es preferible un objetivo de agua de 60x cuando se analizan fusiones fluorescentes construidas con proteínas secretadas. Los microscopios confocales modernos tienen objetivos de inmersión en agua altamente corregidos para evitar artefactos y aberraciones de forma. - Si se pretende obtener imágenes de células vivas de proteínas fluorescentes, utilice cepas fúngicas no transformadas como controles de autofluorescencia. Utilice los siguientes parámetros de adquisición de imágenes para capturar la dinámica fúngico-huésped en un microscopio confocal invertido y para la proteína fluorescente mCherry. Ajuste la potencia del láser hasta el 5%, 450-600 de alto voltaje (HV) según el nivel de expresión, ganancia de 1.375X, desplazamiento del 3%, un factor de zoom óptico de 1 para el análisis de hasta cinco células de maíz por sección y un factor de zoom óptico de 2-5 para hifas individuales.
NOTA: Las imágenes confocales Z-stack de alta resolución proporcionan datos tridimensionales y una mejor visión de las interacciones en tiempo real entre el huésped y el patógeno. - Para la cuantificación de las intensidades de fluorescencia correspondientes a las proteínas de fusión secretadas, utilice un software de análisis de imágenes del fabricante confocal o un programa de procesamiento de imágenes como ImageJ, que se puede descargar gratuitamente en línea. Consulte un manual para obtener detalles sobre cómo cuantificar las señales fluorescentes en consecuencia.
- Para observar las proteínas fluorescentes en los tejidos de maíz durante el desarrollo de cepas fúngicas transgénicas, ajuste los parámetros básicos de adquisición de imágenes. Identifique los mejores ajustes de excitación/emisión en función del marcador fluorescente seleccionado.
Resultados
En los ejemplos siguientes se describen resultados representativos tras el uso del método de inoculación de la vaina foliar de maíz. Estos ejemplos demuestran la facilidad, velocidad y precisión con la que se puede observar y comparar las interacciones maíz-hongo en tiempo real con este ensayo optimizado. Las imágenes de células vivas también permiten la extracción de información cuantitativa, proporcionando una herramienta útil para estudios moleculares, citológicos y fisiológicos comparativos. Se pueden en...
Discusión
El método optimizado de inoculación de la vaina foliar descrito aquí es una modificación de un protocolo original que se desarrolló y se ha aplicado a las vainas foliares de arroz 6,8,36. Permite observaciones directas y detalladas del crecimiento y desarrollo de hongos en células vegetales vivas con microscopía de campo amplio o confocal. El protocolo es adecuado para la caracterización, comparación y cuantificación d...
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos y nada que revelar.
Agradecimientos
Los autores agradecen al USDA-NIFA por su apoyo financiero (números de subvención 2018-67013-28489 y 2020-70410-32901). Todas las opiniones, hallazgos, conclusiones o recomendaciones expresadas en este manuscrito pertenecen exclusivamente a los autores y no reflejan necesariamente los puntos de vista del Departamento de Agricultura de los Estados Unidos. Agradecemos a la estudiante visitante de Ciencia Sin Fronteras de Brasil, Mayara de Silva, por las imágenes que aparecen en la Figura 6A y en la Figura 7D. También reconocemos al Departamento de Patología Vegetal de la Universidad de Kentucky por proporcionar acceso a los microscopios confocales Olympus.
Materiales
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
Referencias
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados