È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Guaine di mais staccate per l'imaging su cellule vive dell'infezione da patogeni fungini del mais fogliare
In questo articolo
Riepilogo
Questo manoscritto descrive in dettaglio un protocollo di inoculazione ottimizzato che utilizza guaine fogliari di mais staccate per studi citologici, fisiologici e molecolari riproducibili delle interazioni del mais con i patogeni fungini delle piante. Le guaine fogliari facilitano l'osservazione in tempo reale delle interazioni cellulari tra la pianta vivente e il fungo nei tessuti non fissati.
Abstract
Abbiamo ottimizzato un protocollo per inoculare guaine fogliari di mais con funghi patogeni fogliari emibiotrofi e necrotrofi. Il metodo è modificato da quello originariamente applicato alle guaine delle foglie di riso e consente l'osservazione microscopica diretta della crescita e dello sviluppo dei funghi nelle cellule vegetali viventi. Le guaine fogliari raccolte da piantine di mais con due colletti fogliari completamente emersi vengono inoculate con gocce da 20 μL di 5 x 105 spore/mL di sospensioni di spore fungine e incubate in camere di umidità a 23 °C sotto luce fluorescente continua. Dopo 24-72 ore, il tessuto in eccesso viene rimosso con una lama di rasoio per lasciare un singolo strato di cellule epidermiche, un campione otticamente trasparente che può essere visualizzato direttamente senza la necessità di fissazione chimica o pulizia. Le cellule vegetali e fungine rimangono in vita per tutta la durata dell'esperimento e le interazioni possono essere visualizzate in tempo reale. Le guaine possono essere colorate o sottoposte a plasmolisi per studiare la citologia dello sviluppo e la vitalità delle cellule ospiti e patogene durante l'infezione e la colonizzazione. I ceppi fungini trasformati per esprimere proteine fluorescenti possono essere inoculati o co-inoculati sulle guaine per una maggiore risoluzione e per facilitare la valutazione di interazioni competitive o sinergiche. I ceppi fungini che esprimono proteine di fusione fluorescenti possono essere utilizzati per tracciare e quantificare la produzione e il targeting di queste singole proteine nelle piante. I tessuti della guaina inoculati possono essere estratti per caratterizzare acidi nucleici, proteine o metaboliti. L'uso di questi saggi di guaina ha notevolmente fatto progredire gli studi dettagliati dei meccanismi di patogenicità fungina nel mais e anche degli effettori proteici fungini e dei metaboliti secondari che contribuiscono alla patogenicità.
Introduzione
Le analisi spaziali e temporali a livello cellulare sono fondamentali per comprendere la fisiologia e la citologia delle interazioni fungo-pianta. I tessuti fogliari che sono stati fissati chimicamente 1,2,3 o eliminati e colorati4, così come le membrane artificiali 5, sono stati utilizzati in passato per studiare la citologia dello sviluppo dei patogeni fogliari e le interazioni pianta-fungo. Tuttavia, lo studio degli eventi di infezione nei tessuti viventi dell'ospite in tempo reale senza fissazione o chiarificazione è impegnativo a causa di problemi tecnici relativi alla preparazione di campioni otticamente trasparenti per l'imaging.
Alla fine degli anni '40 è stato sviluppato un protocollo di inoculazione con guaina fogliare staccata per l'indagine microscopica in campo chiaro della resistenza delle cellule epidermiche di riso viventi al fungo dell'esplosione del riso Magnaporthe oryza6. Più recentemente, osservazioni molecolari, fisiologiche e citologiche dettagliate della colonizzazione dell'ospite da parte delle specie Colletotrichum e Magnaporthe sono state notevolmente facilitate dalla combinazione di versioni modificate di questo metodo di guaina fogliare con trasformanti fungini che esprimono proteine fluorescenti e protocolli di imaging di cellule vive ad alte prestazioni, tra cui l'epifluorescenza e la microscopia confocale 7,8,9,10.11,12,13.
Questo documento descrive in dettaglio un protocollo di inoculazione ottimizzato utilizzando guaine fogliari di mais staccate per l'osservazione dei processi di infezione da parte di patogeni fungini fogliari emibiotrofi e necrotrofi. Lo abbiamo utilizzato in particolare per studiare Colletotrichum graminicola (C. graminicola), l'agente causale della peronospora delle foglie antracnosi e del marciume del gambo, e della Stenocarpella maydis, che causa la peronospora delle foglie di Diplodia e il marciume del gambo. Tuttavia, il metodo dovrebbe essere applicabile ad altri patogeni fungini fogliari emibiotrofi e necrotrofi. Le risposte citologiche e fisiologiche durante gli eventi di infezione e colonizzazione in queste guaine fogliari asportate sono simili a quelle delle lame fogliari intere12,14,15. Inoltre, la colonizzazione emibiotrofica delle cellule epidermiche della guaina da parte di C. graminicola è simile alla colonizzazione delle cellule del midollo del gambo16,17. Le guaine distaccate mostrano una maggiore sincronicità e riproducibilità sperimentale della penetrazione e della colonizzazione fungina rispetto alle lame fogliari o ai tessuti del midollo del gambo14,16,17,18. La maggior parte delle varietà di mais può essere utilizzata per questo protocollo. Tuttavia, gli inbred o gli ibridi con eccessivi pigmenti viola nelle guaine sono meno adatti poiché i pigmenti interferiscono con l'imaging. Il mais dolce Golden Jubilee è stato particolarmente utile per i nostri studi perché i semi non trattati sono disponibili in commercio, le piante sono altamente suscettibili a molte malattie fogliari e crescono bene in serra. Le prime epidemie di marciume del gambo dell'antracnosi negli Stati Uniti hanno provocato la perdita totale dei raccolti di mais dolce in Indiana negli anni '7019,20. Questo metodo di inoculazione della guaina fogliare può essere applicato per osservare e quantificare direttamente la crescita e lo sviluppo fungino nelle cellule vegetali viventi rispetto a quelle uccise localmente, per dimostrare le reazioni di resistenza nelle risposte compatibili/incompatibili all'infezione fungina e per testare le interazioni tra ceppi fungini sulla stessa guaina in tempo reale.
Protocollo
NOTA: il flusso di lavoro per il metodo è illustrato nella Figura 1.
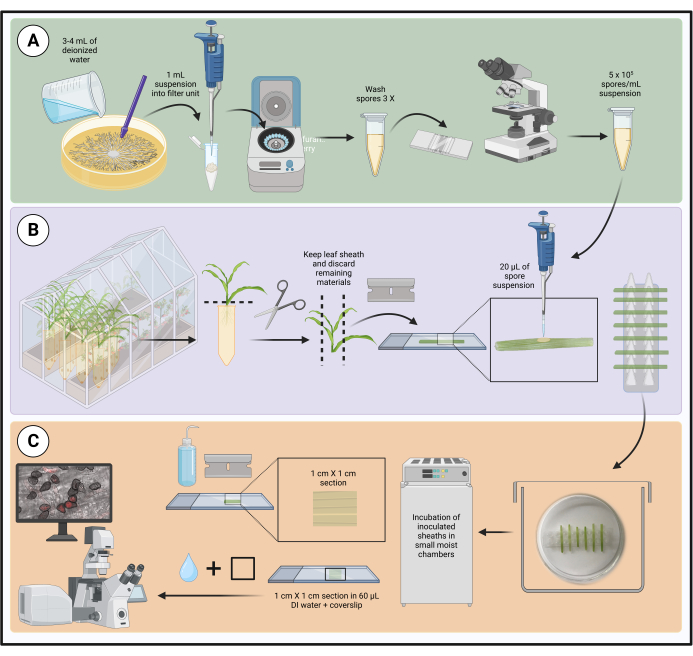
Figura 1: Fasi del protocollo di inoculo ottimizzato utilizzando guaine fogliari di mais staccate. La preparazione della sospensione di spore, l'inoculazione della guaina fogliare e la preparazione del campione per la microscopia su cellule vive sono evidenziate rispettivamente nelle caselle verde (A), viola (B) e arancione (C). Creato con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Materiale vegetale e fungino
- Crescita delle piante
- Coltivare piantine di mais (vedi Tabella dei materiali) in serra (14 h luce/27 °C e 10 h buio/22 °C) in contenitori SC10 (vedi Tabella dei materiali). Utilizzare un terreno di coltura composto da tre parti di terriccio commerciale (vedi Tabella dei materiali) e due parti di terriccio sterilizzato a vapore.
- Innaffia le piantine per 2 minuti con un sistema di irrigazione dall'alto una volta al giorno, al mattino.
- Raccogli le piantine allo stadio V2 tagliandole a livello del terreno. Lo stadio di crescita V2 viene raggiunto quando le piantine sono alte da 5 a 10 cm e hanno due foglie a collare visibili21.
- Avvolgere le piante con un tovagliolo di carta umido e metterle in un sacchetto di plastica per il trasporto in laboratorio per ulteriori lavorazioni.
- Colture fungine
- Riattivare le colture di silice fungina immagazzinate in condizioni asettiche22cospargendo circa 50 granuli di silice infestata su un terreno di agar appropriato. Per evitare cambiamenti morfologici e perdita di patogenicità, la sottocoltura ceppa non più di 3 volte dopo la riattivazione. L'agar destrosio di patate (PDA; vedi Tabella dei materiali) è usato abitualmente per la coltura di C. graminicola, mentre l'agar di farina d'avena (OA; vedi Tabella dei materiali) è usato per S. maydis.
- Per preparare il PDA per la coltura di ceppi fungini, sospendere 19,5 g di PDA disidratato preparato in commercio in 500 mL di acqua deionizzata (DI). Per produrre OA, far bollire 36 g di OA disidratato preparato commercialmente in acqua deionizzata per 15-30 minuti, filtrare attraverso tre strati di garza e portare il filtrato a 500 ml con acqua deionizzata. Mezzi di sterilizzazione in autoclave.
- Aumentare il terreno fuso e raffreddato con un antibiotico appropriato (ad es. igromicina B, geneticina) quando si lavora con ceppi trasformanti. Le concentrazioni finali di igromicina o geneticina in 500 mL di terreno sono rispettivamente di 250 μg/mL e 100 μg/mL.
- Incubare le colture in condizioni ottimali fino allo sviluppo di un micelio sporulante. Colletotrichum graminicola e S. maydis crescono bene a 23 °C con luce fluorescente continua e livelli di umidità ambientale. La sporulazione avviene entro 7 giorni dall'inoculazione (dai) per S. maydis o 14 dai per C. graminicola.
2. Inoculazioni della guaina fogliare
- Gruppo unità filtro in lana di vetro
- Utilizzare forbici o cesoie per impieghi gravosi per tagliare il tappo e a circa 0,5 mm dal fondo conico di una provetta per microcentrifuga da 1,5 mL (vedere la tabella dei materiali).
- Posizionare un pezzo di lana di vetro (circa 0,5 cm x 0,5 cm; vedere la tabella dei materiali) all'interno del tubo tagliato per coprire il foro centrale, come illustrato nella Figura 2.
- Indossare guanti durante il taglio della lana di vetro, poiché il vetro borosilicato può causare irritazione.
- Preparazione delle rastrelliere di supporto della guaina fogliare
- Tagliare una piastra PCR a 96 pozzetti senza bordatura (vedere la Tabella dei materiali) in sei rack di supporto a due colonne (8 x 2 pozzetti) come illustrato nella Figura 3A.
- Capovolgere i rack a due colonne in modo che i fondi conici dei pozzetti siano rivolti verso l'alto e le parti superiori piatte rivolte verso il basso (Figura 3B).
- Mettere ogni supporto in una piastra di Petri di vetro contenente carta da filtro inumidita e coprirla con il coperchio (vedi Tabella dei materiali). Questa unità funziona come una piccola camera di umidità per le guaine.
- Preparazione dell'inoculo
- Per ciascun ceppo fungino, posizionare un'unità filtrante in lana di vetro assemblata in una provetta sterile intatta da 1,5 mL per microcentrifuga, come illustrato nella Figura 2. Quest'ultimo funge da provetta di raccolta.
- Etichettare i tubi.
- Raccogliere i conidi dalle colture sporulanti inondando prima ogni piastra con 3-4 ml di acqua deionizzata sterile. In alcuni casi può essere necessaria più acqua per produrre uno strato di liquido sulla superficie della colonia. Gli agenti bagnanti non sono necessari in questo sistema.
- Staccare le spore dall'agar utilizzando un pestello sterile a punta conica (vedi Tabella dei materiali) per raschiare uniformemente l'intera piastra.
- Applicare 1 mL di sospensione di spore su un'unità filtrante in lana di vetro in modo asettico e lasciare che le spore fluiscano per gravità nella provetta di raccolta.
- Centrifugare le provette di raccolta contenenti le sospensioni di spore filtrate a 3.500 x g per 5 min. Le spore devono essere pellettate sul fondo della provetta della microcentrifuga.
NOTA: La centrifugazione delle spore di C. graminicola a velocità più elevate di quelle qui raccomandate comporta una significativa perdita di vitalità. - Versare il liquido in un contenitore autoclavabile, aggiungere 1 ml di acqua deionizzata sterile e agitare delicatamente per risospendere le spore pellettate. Centrifugare come al punto 2.3.6.
- Lavare le spore 3 volte per rimuovere qualsiasi matrice conidiale che possa contenere autoinibitori che potrebbero ridurre la germinazione o la penetrazione.
- Dopo il terzo lavaggio, aggiungere 300-500 μL di acqua deionizzata sterile per risospendere le spore per la quantificazione.
- Utilizzare un emocitometro al microscopio composto con un ingrandimento di 100x per determinare la concentrazione di spore. La colorazione delle spore non è necessaria prima del conteggio.
- Preparare una sospensione 5 x 105 spore/mL con acqua deionizzata sterile.
NOTA: La sospensione di spore di C. graminicola può essere mantenuta a temperatura ambiente per non più di 4 ore prima di una rapida perdita di vitalità. La refrigerazione dei conidi non aumenta la vitalità.
- Inoculazioni di guaine
- Verificare le pratiche e le procedure di biosicurezza pertinenti prima di inoculare le piante con ceppi fungini.
- Rimuovi la guaina dalla prima foglia vera delle piantine V2 facendo scorrere una miniatura lungo il margine sovrapposto della guaina e allentala delicatamente dal germoglio. Allentare la guaina da entrambi i lati del tiro prima di provare a rimuoverlo.
- Tagliare le guaine fogliari recuperate in segmenti di 3-5 cm. Non è necessario disinfettare le guaine in superficie prima dell'inoculazione.
- Srotolare ogni segmento molto delicatamente per esporre lo strato epidermico interno (assiale).
- Durante la preparazione delle guaine per l'inoculazione, tenere le guaine asportate rimanenti avvolte con un tovagliolo di carta umido per evitare l'essiccazione.
- Posizionare 20 μL della sospensione di spore fungine sulla superficie interna al centro del pezzo di guaina, direttamente sopra la nervatura centrale, come illustrato nella Figura 4.
- Posizionare le guaine fogliari inoculate orizzontalmente, con la nervatura centrale posta in basso, nel supporto all'interno di una piastra di Petri di vetro contenente una carta da filtro inumidita come illustrato nella Figura 5.
- Ogni rack può contenere fino a sette guaine. Inoculare almeno cinque guaine per ceppo per compensare la perdita di repliche che può verificarsi durante la preparazione o l'incubazione del campione.
- Metti le piccole camere di umidità in una scatola trasparente rivestita con carta di germinazione inumidita (vedi Tabella dei materiali).
- Copri la scatola con il coperchio. Incubare la scatola a 23 °C con illuminazione continua per il tempo previsto, che dipende dal fungo e dagli stadi di sviluppo del fungo che verranno osservati. Un riassunto dell'andamento temporale delle guaine di granturco inoculate con C. graminicola è riportato nella tabella 1.
- Controlla ogni giorno la presenza di segni/sintomi di malattia sulle guaine e mantieni umide sia la germinazione che la carta da filtro. Le guaine fogliari possono essere conservate fino a 6 giorni senza evidente morte o degradazione delle cellule vegetali in assenza di inoculazione.
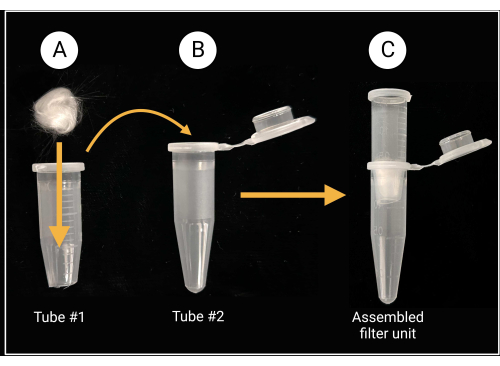
Figura 2: Preparazione dell'unità filtrante in lana di vetro. (A) Una pallina di lana di vetro di 0,5 cm x 0,5 cm viene posizionata all'interno della provetta per microcentrifuga 1 a cui è stato rimosso il fondo conico. (B-C) Il tubo filtrante viene quindi inserito nel tubo di microcentrifuga 2 per generare un'unità filtrante assemblata per la preparazione della sospensione di spore. Creato con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.
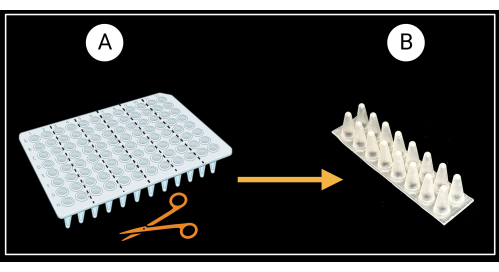
Figura 3: Metodo di taglio di una piastra PCR a 96 pozzetti senza bordatura. (A) Piastra PCR tagliata in sei rack di supporto, 8 x 2 pozzetti. Un esempio di supporto a guaina singola è raffigurato in (B). Le guaine fogliari sono disposte orizzontalmente sul supporto. Creato con BioRender.com. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Metodo di inoculazione della guaina. Singola goccia di inoculo applicata direttamente sulla superficie adassiale della sezione della guaina. Fare clic qui per visualizzare una versione più grande di questa figura.
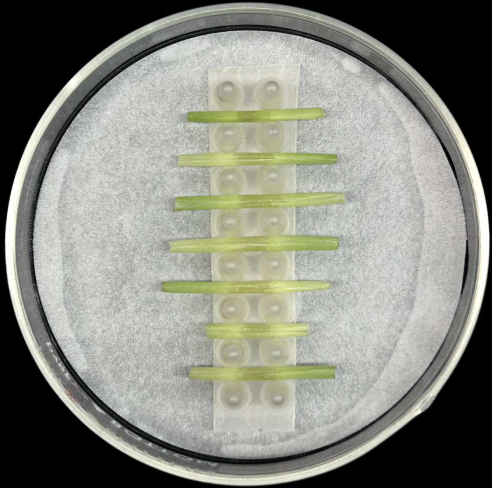
Figura 5: Metodo di incubazione della guaina. Guaine fogliari inoculate poste orizzontalmente in una rastrelliera di supporto all'interno di una piastra di Petri di vetro contenente carta da filtro inumidita. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Microscopia a cellule vive
- Preparazione del campione per microscopia
- Sciacquare delicatamente i pezzi della guaina con acqua deionizzata sterile per rimuovere eventuali spore non aderenti o crescita fungina superficiale.
- Posizionare la guaina su un vetrino da microscopio pulito (vedere Tabella dei materiali) con la superficie adassiale (interna) del pezzo di guaina rivolta verso il basso e la superficie abassiale (esterna) rivolta verso l'alto.
- Utilizzare una nuova lama di rasoio a filo singolo (vedere la tabella dei materiali) per tagliare circa 1 cm dalle estremità della guaina e rimuovere la maggior parte del tessuto della lamina su entrambi i lati della nervatura centrale.
- Tenere la lama del rasoio con un angolo di 90° rispetto alla guaina per radere il tessuto dalla costola mediana abassiale ed esporre lo strato epidermico sulla superficie adassiale sopra il punto inoculato. Cerca di mantenere uno spessore uniforme. Una volta rasate le guaine fogliari, non è consigliabile un'ulteriore potatura in quanto ciò potrebbe danneggiare il campione.
- Assicurarsi che le sezioni rasate non superino le dimensioni di 1 cm x 1 cm. Evitare di premere al centro della guaina durante questo processo. Quando si lavora con guaine inoculate con diverse sospensioni di spore, disinfettare i guanti e cambiare la lama del rasoio tra un campione e l'altro.
- Tenere a portata di mano un vetrino da microscopio pulito. Sollevare la sezione della guaina da un bordo e trasferirla con cura su una nuova slitta. La superficie inoculata (assiale) della guaina deve essere più in alto, più vicina alla lente dell'obiettivo. Montare le sezioni delicatamente per evitare danni alle strutture fungine.
- Applicare 60 μL di acqua deionizzata sterile sulla sezione e aggiungere un vetrino coprioggetti di 24 mm x 60 mm (vedere la tabella dei materiali). Fallo lentamente per evitare bolle d'aria.
- Quando si è pronti per la microscopia, sigillare il vetrino coprioggetto con uno smalto trasparente (vedere la tabella dei materiali) posizionando una piccola goccia su ciascun bordo e quindi collegando le gocce con un pennello per smalto per ottenere una sigillatura perfetta.
NOTA: Questo protocollo di guaina può essere utilizzato con colorazioni citologiche, ad es. 4′,6-diamidino-2-fenilindolo (DAPI), rosso neutro o blu tripano, o per l'osservazione della plasmolisi cellulare per valutare la vitalità delle cellule vegetali. Per la colorazione della guaina o i saggi di plasmolisi cellulare, non sigillare il vetrino coprioggetto. - Per i saggi di plasmolisi, aggiungere una soluzione ipertonica (0,75 M di saccarosio o 1 M di cloruro di sodio) su un bordo del vetrino coprioggetto e utilizzare una carta velina piegata priva di lanugine per aspirare la soluzione attraverso il campione fino all'altro bordo del vetrino coprioggetto. Per la colorazione, utilizzare un metodo simile per applicare la soluzione antimacchia.
- Microscopia a campo largo
- Una volta che le guaine fogliari sono montate sui vetrini del microscopio, ispezionarle per la colonizzazione fungina utilizzando un microscopio ottico a campo largo con un ingrandimento di 400x.
- Per osservare le strutture fungine in dettaglio, utilizzare un obiettivo a immersione in acqua anziché l'olio per una migliore qualità dell'immagine dei campioni. L'aberrazione sferica dovuta a una mancata corrispondenza dell'indice di rifrazione può causare la degradazione dell'immagine. Gli obiettivi per l'acqua sono disponibili sia per i microscopi ottici a campo largo che per i microscopi confocali.
- Per determinare la quantità relativa di colonizzazione per guaina, contare il numero di cellule di mais invase da ciascun sito di penetrazione fungina utilizzando un microscopio ottico a campo largo con un ingrandimento di 100x. Questa quantificazione è una fase di screening appropriata prima di qualsiasi analisi statistica che confronti i ceppi, i trattamenti e/o le fasi di sviluppo.
- Microscopia confocale a scansione laser
- Per osservare le proteine fluorescenti nei tessuti di mais durante lo sviluppo di ceppi fungini transgenici, regolare i parametri di base di acquisizione delle immagini. Identificare le migliori impostazioni di eccitazione/emissione in base al marcatore fluorescente selezionato.
NOTA: Un obiettivo d'acqua 60x è preferibile quando si analizzano fusioni fluorescenti costruite con proteine secrete. I moderni microscopi confocali sono dotati di obiettivi a immersione in acqua altamente corretti per evitare artefatti e aberrazioni di forma. - Se si intende l'imaging di proteine fluorescenti su cellule vive, utilizzare ceppi fungini non trasformati come controlli per l'autofluorescenza. Utilizzare i seguenti parametri di acquisizione delle immagini per acquisire la dinamica dell'ospite fungino su un microscopio confocale invertito e per la proteina fluorescente mCherry. Impostare la potenza del laser fino al 5%, 450-600 alta tensione (HV) a seconda del livello di espressione, guadagno 1,375 X, offset 3%, un fattore di zoom ottico di 1 per l'analisi di un massimo di cinque celle di mais per sezione e un fattore di zoom ottico di 2-5 per le singole ife.
NOTA: Le immagini confocali Z-stack ad alta risoluzione forniscono dati tridimensionali e una migliore visione delle interazioni in tempo reale tra l'ospite e l'agente patogeno. - Per quantificare le intensità di fluorescenza corrispondenti alle proteine di fusione secrete, utilizzare un software di analisi delle immagini del produttore del confocale o un programma di elaborazione delle immagini come ImageJ, che può essere scaricato gratuitamente online. Consultare un manuale per i dettagli su come quantificare i segnali fluorescenti di conseguenza.
- Per osservare le proteine fluorescenti nei tessuti di mais durante lo sviluppo di ceppi fungini transgenici, regolare i parametri di base di acquisizione delle immagini. Identificare le migliori impostazioni di eccitazione/emissione in base al marcatore fluorescente selezionato.
Risultati
Gli esempi seguenti descrivono i risultati rappresentativi in seguito all'uso del metodo di inoculazione della guaina fogliare di mais. Questi esempi dimostrano la facilità, la velocità e la precisione con cui l'osservazione e il confronto delle interazioni mais-funghi possono essere realizzati in tempo reale con questo saggio ottimizzato. L'imaging di cellule vive consente anche l'estrazione di informazioni quantitative, fornendo uno strumento utile per studi molecolari, citologici e fisiologici comparativi. Ulteriori...
Discussione
Il metodo di inoculazione della guaina fogliare ottimizzato qui descritto è modificato da un protocollo originale che è stato sviluppato ed è stato applicato alle guaine fogliari di riso 6,8,36. Consente osservazioni dirette e dettagliate della crescita e dello sviluppo fungino nelle cellule vegetali viventi con microscopia a campo largo o confocale. Il protocollo è adatto per la caratterizzazione, il confronto e la quantifi...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti e nulla da rivelare.
Riconoscimenti
Gli autori ringraziano l'USDA-NIFA per il loro sostegno finanziario (numeri di sovvenzione 2018-67013-28489 e 2020-70410-32901). Tutte le opinioni, i risultati, le conclusioni o le raccomandazioni espresse in questo manoscritto sono esclusivamente quelle degli autori e non riflettono necessariamente le opinioni del Dipartimento dell'Agricoltura degli Stati Uniti. Ringraziamo la studentessa brasiliana di Science Without Borders, Mayara de Silva, per le immagini che appaiono nella Figura 6A e nella Figura 7D. Ringraziamo anche il Dipartimento di Patologia Vegetale dell'Università del Kentucky per aver fornito l'accesso ai microscopi confocali Olympus.
Materiali
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
Riferimenti
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon