JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
곰팡이 잎 옥수수 병원체에 의한 감염의 살아있는 세포 이미징을 위한 분리된 옥수수 덮개
요약
이 원고는 곰팡이 식물 병원체와의 옥수수 상호 작용에 대한 재현 가능한 세포학적, 생리학적, 분자적 연구를 위해 분리된 옥수수 잎 덮개를 사용하는 최적화된 접종 프로토콜을 자세히 설명합니다. 잎 덮개는 고정되지 않은 조직에서 살아있는 식물과 곰팡이 사이의 세포 상호 작용을 실시간으로 관찰할 수 있도록 합니다.
초록
우리는 옥수수 잎 덮개에 hemibiotrophic 및 necrotrophic foliar pathogenic fungi를 접종하기 위한 프로토콜을 최적화했습니다. 이 방법은 원래 벼 잎 덮개에 적용되었던 방법에서 변형되어 살아있는 식물 세포의 곰팡이 성장 및 발달을 직접 현미경으로 관찰할 수 있습니다. 두 개의 완전히 나온 잎 고리가 있는 옥수수 묘목에서 채취한 잎초는 5 x 105 포자/mL 곰팡이 포자 현탁액의 20μL 방울을 접종하고 연속 형광등 아래에서 23°C의 습도 챔버에서 배양합니다. 24-72시간 후, 과도한 조직을 면도날로 제거하여 표피 세포의 단일 층을 남기며, 화학적 고정이나 투명화 없이 직접 이미지를 얻을 수 있는 광학적으로 투명한 샘플입니다. 식물과 곰팡이 세포는 실험 기간 동안 살아 있으며 상호 작용을 실시간으로 시각화할 수 있습니다. 외피는 감염 및 집락화 중 숙주 및 병원체 세포의 발달 세포학 및 생존력을 연구하기 위해 염색하거나 형질분해를 실시할 수 있습니다. 형광 단백질을 발현하도록 형질전환된 곰팡이 균주는 분리능을 높이고 경쟁적 또는 시너지 상호작용의 평가를 용이하게 하기 위해 외피에 접종하거나 동시 접종할 수 있습니다. 형광 융합 단백질을 발현하는 곰팡이 균주는 planta에서 이러한 개별 단백질의 생산 및 표적화를 추적하고 정량화하는 데 사용할 수 있습니다. 접종된 수초 조직을 추출하여 핵산, 단백질 또는 대사 산물을 특성화할 수 있습니다. 이러한 외피 분석법의 사용은 옥수수의 곰팡이 병원성 메커니즘과 병원성에 기여하는 곰팡이 단백질 효과기 및 2차 대사 산물의 메커니즘에 대한 자세한 연구를 크게 발전시켰습니다.
서문
세포 수준에서의 공간적 및 시간적 분석은 곰팡이-식물 상호 작용의 생리학 및 세포학을 이해하는 데 매우 중요합니다. 화학적으로 고정된1,2,3 또는 투명화 및 염색4된 엽면 조직(folar tissue)4과 인공 막(artificial membrane)5은 과거에 엽면 병원균 발달 및 식물-진균 상호작용의 세포학을 조사하기 위해 사용되었다. 그러나 고정이나 투명화 없이 살아있는 숙주 조직의 감염 사건을 실시간으로 조사하는 것은 이미징을 위한 광학적으로 투명한 샘플 준비와 관련된 기술적 문제로 인해 어렵습니다.
분리형 잎집 접종 프로토콜은 1940년대 후반에 벼 돌풍균 Magnaporthe oryza6에 대한 살아있는 벼 표피 세포의 내성에 대한 명시야 현미경 조사를 위해 개발되었습니다. 보다 최근에, Colletotrichum 및 Magnaporthe 종에 의한 숙주 집락화에 대한 상세한 분자, 생리학 및 세포학적 관찰은 형광 단백질을 발현하는 곰팡이 형질전환체와 이 잎집 방법의 변형된 버전, 및 epifluorescence 및 confocal microscopy를 포함한 고성능 살아있는 세포 이미징 프로토콜을 결합함으로써 크게 촉진되었습니다 7,8,9,10,11,12,13.
이 논문은 hemibiotrophic 및 necrotrophic foliar fungal pathogens에 의한 감염 과정을 관찰하기 위해 분리된 옥수수 잎 덮개를 사용하는 최적화된 접종 프로토콜을 자세히 설명합니다. 우리는 특히 탄저병 잎마름병과 줄기썩음병의 원인균인 콜레토트리쿰 그라미니콜라(C. graminicola)와 디플로디아 잎마름병과 줄기썩음병을 유발하는 스테노카펠라 마이디스를 연구하는 데 사용했습니다. 그러나 이 방법은 다른 반생물영양 및 괴사영양성 엽면 곰팡이 병원체에도 적용할 수 있어야 합니다. 이러한 절제된 잎초에서 감염 및 집락화 사건 동안의 세포학적 및 생리학적 반응은 전체 잎 잎의 반응과 유사하다12,14,15. 또한, C. graminicola에 의한 외피 피복 세포의 hemibiotrophic colonization은 stalk pith cell16,17의 colonization과 유사합니다. 분리된 외피는 잎 잎 또는 줄기 속조직보다 곰팡이 침투 및 집락화의 더 큰 동시성과 실험적 재현성을 보여준다14,16,17,18. 대부분의 옥수수 품종은 이 프로토콜에 사용할 수 있습니다. 그러나 외피에 과도한 보라색 안료가 있는 근친 교배나 잡종은 안료가 이미징을 방해하기 때문에 적합하지 않습니다. Golden Jubilee sweet corn은 처리되지 않은 씨앗이 상업적으로 이용 가능하고 식물이 많은 잎 질병에 매우 취약하며 온실에서 잘 자라기 때문에 우리 연구에 특히 유용했습니다. 미국에서 탄저병 줄기 썩음병의 첫 번째 전염병은 1970 년대 인디애나에서 옥수수 작물의 완전한 손실을 초래했습니다19,20. 이 잎집 접종 방법은 살아있는 식물 세포와 국소 사멸된 식물 세포에서 곰팡이 성장 및 발달을 직접 관찰 및 정량화하고, 곰팡이 감염에 대한 양립/비호환 반응의 내성 반응을 입증하고, 동일한 잎집에서 곰팡이 균주 간의 상호 작용을 실시간으로 테스트하는 데 적용할 수 있습니다.
프로토콜
참고: 이 방법의 작업 흐름은 그림 1에 나와 있습니다.
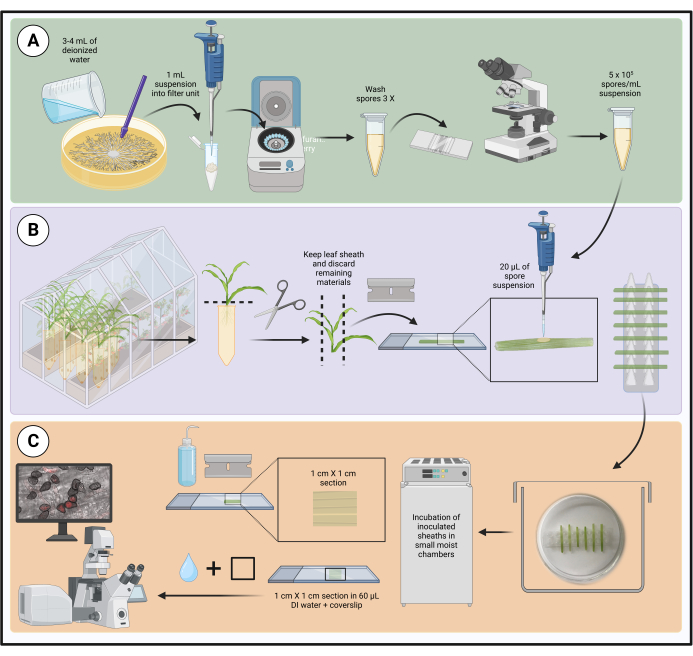
그림 1: 분리된 옥수수 잎 덮개를 사용한 최적화된 접종 프로토콜의 단계. 포자 현탁액 준비, 잎집 접종 및 살아있는 세포 현미경을 위한 샘플 준비는 각각 녹색(A), 보라색(B) 및 주황색(C) 상자로 강조 표시됩니다. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 식물 및 곰팡이 물질
- 식물 성장
- SC10 용기의 온실(14시간 조명/27°C 및 10시간 어두움/22°C)에서 옥수수 묘목( 재료 표 참조)을 재배합니다( 재료 표 참조). 상업용 화분용 흙 3개(재료 표 참조)와 2개 부분의 증기 멸균 표토로 구성된 성장 배지를 사용하십시오.
- 매일 아침에 한 번 오버 헤드 관개 시스템으로 묘목에 2 분 동안 물을줍니다.
- V2 단계에서 묘목을 토양 수준에서 잘라 수확합니다. V2 성장 단계는 묘목의 높이가 5-10cm이고 두 개의 눈에 보이는 고리 모양의 잎이 있을 때 도달한다21.
- 젖은 종이 타월로 식물을 감싸고 추가 처리를 위해 실험실로 운반하기 위해 비닐 봉지에 넣습니다.
- 곰팡이 문화
- 감염된 실리카의 약 50 과립을 적절한 한천 배지에 뿌려서 무균 조건 하에서 저장된 곰팡이 실리카 스톡 배양액을 재활성화시킨다22. 형태학적 변화와 병원성 손실을 피하기 위해 하위 배양 변형은 재활성화 후 3배 이하입니다. 감자 포도당 한천(PDA, 재료 표 참조)은 C. graminicola 를 배양하는 데 일상적으로 사용되는 반면 오트밀 한천(OA, 재료 표 참조)은 S. maydis에 사용됩니다.
- 곰팡이 스톡을 배양하기 위한 PDA를 준비하려면 상업적으로 제조된 탈수된 PDA 19.5g을 500mL의 탈이온수(DI)에 현탁시킵니다. 골관절염을 만들려면 시중에서 판매되는 탈수 골수염 36g을 탈이온수에 넣고 15-30분 동안 끓인 다음 무명천을 세 겹 걸러낸 다음 탈이온수로 여과액을 500mL로 만듭니다. 멸균할 오토클레이브 배지.
- 형질전환 균주로 작업할 때 적절한 항생제(예: hygromycin B, geneticin)로 용융되고 냉각된 배지를 보강합니다. 500mL의 배지에서 히그로마이신 또는 제네티신의 최종 농도는 각각 250μg/mL 및 100μg/mL입니다.
- 포자 균사체가 발달할 때까지 최적의 조건에서 배양물을 배양합니다. Colletotrichum graminicola 와 S. maydis 는 지속적인 형광등 및 주변 습도 수준에서 23 °C에서 잘 자랍니다. 포자 형성은 S. maydis 의 경우 접종 후 7일(dai), C. graminicola의 경우 14일 후에 발생합니다.
2. 잎집 접종
- 유리솜 필터 장치 어셈블리
- 튼튼한 가위나 가위를 사용하여 캡을 잘라내고 1.5mL 미세 원심분리기 튜브의 원뿔형 바닥에서 약 0.5mm를 잘라냅니다( 재료 표 참조).
- 그림 0.5와 같이 절단 튜브 안에 유리솜 조각(약 0.5cm x 2cm, 재료 표 참조)을 놓아 중앙 구멍을 덮습니다.
- 유리솜을 절단하는 동안 붕규산 유리는 자극을 유발할 수 있으므로 장갑을 착용하십시오.
- 잎집 지지대 준비
- 그림 3A와 같이 스커트가 없는 96웰 PCR 플레이트(재료 표 참조)를 6개의 2컬럼(8 x 2웰) 지지 랙으로 자릅니다.
- 웰의 원뿔형 바닥이 위를 향하고 평평한 상단이 아래를 향하도록 2열 랙을 뒤집습니다(그림 3B).
- 각 지지대를 축축한 여과지가 들어 있는 유리 페트리 플레이트에 놓고 뚜껑으로 덮습니다( 재료 표 참조). 이 장치는 덮개의 작은 습도 챔버 역할을 합니다.
- 접종 준비
- 각 곰팡이 균주에 대해 조립된 유리솜 필터 장치 하나를 그림 2와 같이 온전한 멸균 1.5mL 미세 원심분리기 튜브에 넣습니다. 후자는 수집 튜브 역할을 합니다.
- 튜브에 라벨을 붙입니다.
- 먼저 각 플레이트에 3-4mL의 멸균 DI 물을 주입하여 포자 배양액에서 분생포자를 수확합니다. 어떤 경우에는 콜로니 표면에 액체 층을 생성하기 위해 더 많은 물이 필요할 수 있습니다. 이 시스템에는 습윤제가 필요하지 않습니다.
- 멸균 원뿔형 팁 유봉( 재료 표 참조)을 사용하여 한천에서 포자를 풀어 전체 접시를 고르게 긁어냅니다.
- 포자 현탁액 1mL를 유리솜 필터 장치에 무균 상태로 적용하고 포자가 중력에 의해 수집 튜브로 흐르도록 합니다.
- 여과된 포자 현탁액이 포함된 수집 튜브를 3,500 x g 에서 5분 동안 원심분리합니다. 포자는 미세 원심분리기 튜브의 바닥에 펠릿화되어야 합니다.
참고: C. graminicola 포자를 여기에서 권장하는 것보다 더 빠른 속도로 원심분리하면 생존력이 크게 손실됩니다. - 액체를 오토클레이브 용기에 붓고 멸균 DI 물 1mL를 첨가한 다음 펠릿 포자를 재현탁하도록 부드럽게 저어줍니다. 2.3.6단계에서와 같이 원심분리기.
- 포자를 3번 씻어 발아 또는 침투를 감소시킬 수 있는 자동 억제제를 포함할 수 있는 원추형 매트릭스를 제거합니다.
- 세 번째 세척 후 300-500μL의 멸균 DI 물을 추가하여 정량을 위해 포자를 재현탁시킵니다.
- 포자 농도를 측정하기 위해 100x 배율의 복합 현미경 아래에서 혈구계를 사용합니다. 계산하기 전에 포자 염색이 필요하지 않습니다.
- 멸균 DI 워터로 5 x 105 포자/mL 현탁액을 준비합니다.
알림: C. graminicola 포자 현탁액은 생존력이 급격히 떨어지기 전에 실온에서 4시간 이상 보관할 수 없습니다. 분생포자를 냉장 보관한다고 해서 생존력이 증가하지는 않습니다.
- 시스 접종
- 곰팡이 균주를 식물에 접종하기 전에 관련 생물 안전 관행 및 절차를 확인하십시오.
- 외피의 겹치는 여백을 따라 엄지손톱을 실행하여 V2 묘목의 첫 번째 실제 잎에서 외피를 제거하고 싹에서 부드럽게 풉니다. 제거하기 전에 촬영의 양쪽에서 덮개를 풉니다.
- 회수된 잎 덮개를 3-5cm 조각으로 자릅니다. 접종 전에 칼집을 표면에서 소독할 필요는 없습니다.
- 각 세그먼트를 매우 부드럽게 풀어 안쪽(adaxial) 표피층을 노출시킵니다.
- 접종을 위해 칼집을 준비하는 동안 나머지 절제된 칼집은 젖은 종이 타월로 싸서 건조를 방지하십시오.
- 그림 20과 같이 곰팡이 포자 현탁액의 4μL를 중간 갈비뼈 바로 위의 외피 조각 중앙에 있는 내부 표면에 놓습니다.
- 그림 5와 같이 축축한 여과지가 들어 있는 유리 페트리 플레이트 내부의 지지대에 중간 갈비뼈가 바닥에 오도록 접종된 잎 덮개를 수평으로 놓습니다.
- 각 랙에는 최대 7개의 피복이 있습니다. 시료 전처리 또는 배양 중에 발생할 수 있는 복제 손실을 보상하기 위해 균주당 최소 5개의 칼집을 접종합니다.
- 작은 습도 챔버를 적신 발아지를 깐 투명한 보관 상자에 넣습니다( 재료 표 참조).
- 뚜껑으로 상자를 덮으십시오. 23 °C에서 상자를 의도 한 시간 동안 연속 조명으로 배양하며, 이는 곰팡이와 관찰 될 곰팡이 발달 단계에 따라 다릅니다. C. graminicola 를 접종한 옥수수 외피의 시간 경과에 대한 요약은 표 1에 나와 있습니다.
- 칼집에 질병의 징후/증상이 있는지 매일 확인하고 발아와 여과지를 모두 촉촉하게 유지하십시오. 잎초는 접종이 없을 때 명백한 식물 세포 사멸 또는 분해 없이 최대 6일 동안 유지될 수 있습니다.
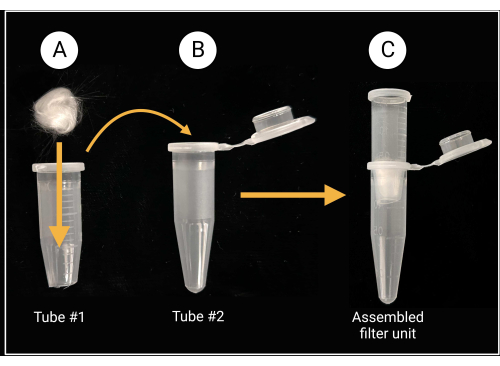
그림 2: 유리솜 필터 장치 준비. (A) 0.5cm x 0.5cm 유리솜 볼을 원뿔형 바닥이 제거된 미세 원심분리기 튜브(1) 내부에 배치합니다. (비씨) 그런 다음 필터 튜브를 마이크로 원심 분리기 튜브 (2)에 배치하여 포자 현탁액 준비를 위해 조립 된 필터 장치를 생성합니다. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
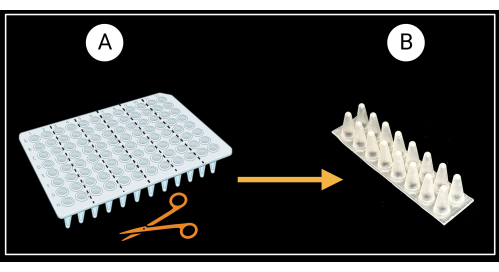
그림 3: 스커트가 없는 96웰 PCR 플레이트를 절단하는 방법. (A) PCR 플레이트를 6개의 지지 랙, 8 x 2 웰로 절단합니다. 단일 피복 지지대의 예가 (B) 에 설명되어 있습니다. 잎 덮개는 지지대에 수평으로 놓여 있습니다. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 칼집 접종 방법. 접종물 한 방울을 외피 부분의 인접 표면에 직접 도포합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
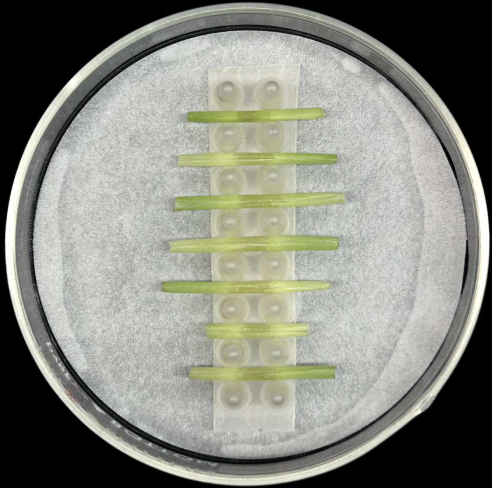
그림 5: 시스 배양 방법. 접종된 잎 덮개는 축축한 여과지가 들어 있는 유리 페트리 플레이트 내부의 지지 랙에 수평으로 배치됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 살아있는 세포 현미경 검사
- 현미경 검사를 위한 시료 전처리
- 칼집 조각을 멸균 DI 물로 부드럽게 헹구어 부착되지 않은 포자나 표재성 곰팡이 성장을 제거합니다.
- 외피 조각의 인접(내부) 표면이 아래를 향하고 축(외부) 표면이 가장 위에 있도록 깨끗한 유리 현미경 슬라이드( 재료 표 참조)에 외피를 놓습니다.
- 새로운 외날 면도날( 재료 표 참조)을 사용하여 외피 끝에서 약 1cm 잘라내고 중간 갈비뼈 양쪽에 있는 대부분의 라미나 조직을 제거합니다.
- 면도날을 칼집에 대해 90° 각도로 잡고 복축 중간 갈비뼈에서 조직을 면도하고 접종 부위 위의 부축 표면에 표피층을 노출시킵니다. 균일한 두께를 유지하십시오. 잎 덮개를 깎은 후에는 샘플이 손상될 수 있으므로 더 이상 다듬지 않는 것이 좋습니다.
- 면도한 부분의 크기가 1cm x 1cm를 넘지 않도록 하십시오. 이 과정에서 피복의 중앙을 누르지 마십시오. 다른 포자 현탁액이 접종 된 칼집으로 작업 할 때는 장갑을 소독하고 샘플 사이에 면도날을 교체하십시오.
- 깨끗한 유리 현미경 슬라이드를 준비하십시오. 한쪽 가장자리에서 피복 부분을 들어 올려 새 슬라이드로 조심스럽게 옮깁니다. 외피의 접종된(adaxial) 표면은 대물렌즈에 가장 가까운 맨 위에 있어야 합니다. 곰팡이 구조물의 손상을 방지하기 위해 섹션을 부드럽게 장착하십시오.
- 60μL의 멸균 DI 물을 섹션에 적용하고 24mm x 60mm 유리 커버슬립을 추가합니다( 재료 표 참조). 기포를 피하기 위해 천천히 수행하십시오.
- 현미경 검사를 할 준비가 되면 각 가장자리에 작은 방울을 떨어뜨린 다음 매니큐어 브러시로 방울을 연결하여 투명한 매니큐어( 재료 표 참조)로 커버슬립을 밀봉하여 매끄럽게 밀봉합니다.
참고: 이 시스 프로토콜은 4′,6-디아미디노-2-페닐린돌(DAPI), 중성 적색 또는 트리판 청색과 같은 세포학적 염색과 함께 사용하거나 식물 세포 생존율을 평가하기 위한 세포 형질 분해 관찰에 사용할 수 있습니다. 외피 염색 또는 세포 형질 분해 분석의 경우 커버슬립을 밀봉하지 마십시오. - 형질분해 분석의 경우 커버슬립의 한쪽 가장자리에 고긴장성 용액(0.75M 자당 또는 1M 염화나트륨)을 추가하고 접힌 보푸라기가 없는 티슈 페이퍼를 사용하여 샘플을 가로질러 커버슬립의 다른 쪽 가장자리로 용액을 그립니다. 염색의 경우 유사한 방법을 사용하여 염색 용액을 바르십시오.
- 광시야 현미경 검사
- 잎 덮개가 현미경 슬라이드에 장착되면 400x 배율의 광시야 광학 현미경을 사용하여 곰팡이 집락화를 검사합니다.
- 곰팡이 구조를 자세히 관찰하려면 샘플의 이미지 품질을 높이기 위해 오일 대신 물 침지 대물렌즈를 사용하십시오. 굴절률 불일치로 인한 구면 수차는 이미지 품질 저하를 유발할 수 있습니다. 물대물렌즈는 광시야 광학 현미경과 컨포칼 현미경에 사용할 수 있습니다.
- 외피당 집락화의 상대적 양을 결정하려면 광시야 광학 현미경을 사용하여 100x 배율로 각 곰팡이 침투 부위에서 침입한 옥수수 세포의 수를 계산합니다. 이 정량화는 균주, 치료 및/또는 발달 단계를 비교하는 통계 분석 전에 적절한 스크리닝 단계입니다.
- 컨포칼 레이저 스캐닝 현미경
- 형질전환 진균 균주가 발달하는 동안 옥수수 조직의 형광 단백질을 관찰하려면 기본 이미지 획득 매개변수를 조정하십시오. 선택한 형광 마커를 기반으로 최상의 여기/방출 설정을 식별합니다.
참고: 분비된 단백질로 구성된 형광 융합체를 분석할 때는 60x 물 대물렌즈가 바람직합니다. 최신 컨포칼 현미경은 아티팩트와 형상 수차를 방지하기 위해 고도로 보정된 수액 대물렌즈를 갖추고 있습니다. - 형광 단백질의 살아있는 세포 이미징을 의도하는 경우, 자가형광을 위한 대조군으로 비형질전환된 진균 균주를 사용하십시오. 다음 이미지 획득 파라미터를 사용하여 도립 컨포칼 현미경과 mCherry 형광 단백질에서 진균-숙주 역학을 캡처할 수 있습니다. 레이저 출력을 최대 5%, 발현 수준에 따라 450-600 고전압(HV), 1.375 X 게인, 3% 오프셋, 섹션당 최대 5개의 옥수수 세포 분석을 위한 광학 줌 계수 1, 개별 균사에 대한 광학 줌 계수 2-5로 설정합니다.
참고: 고해상도 Z 스택 공초점 이미지는 3차원 데이터와 숙주와 병원체 간의 실시간 상호 작용에 대한 더 나은 보기를 제공합니다. - 분비된 융합 단백질에 해당하는 형광 강도를 정량화하려면 컨포칼 제조업체의 이미지 분석 소프트웨어 또는 온라인에서 무료로 다운로드할 수 있는 ImageJ와 같은 이미지 처리 프로그램을 사용하십시오. 그에 따라 형광 신호를 정량화하는 방법에 대한 자세한 내용은 설명서를 참조하십시오.
- 형질전환 진균 균주가 발달하는 동안 옥수수 조직의 형광 단백질을 관찰하려면 기본 이미지 획득 매개변수를 조정하십시오. 선택한 형광 마커를 기반으로 최상의 여기/방출 설정을 식별합니다.
결과
아래 예는 옥수수 잎 외피 접종 방법을 사용한 후의 대표적인 결과를 설명합니다. 이 예는 이 최적화된 분석을 통해 옥수수-곰팡이 상호 작용의 관찰 및 비교를 실시간으로 수행할 수 있는 용이성, 속도 및 정밀도를 보여줍니다. 또한 살아있는 세포 이미징을 통해 정량적 정보를 추출할 수 있어 비교 분자, 세포학 및 생리학적 연구에 유용한 도구를 제공합니다. 자세한 내용은 각 성공적인 출원에 ?...
토론
여기에 설명된 최적화된 잎집 접종 방법은 쌀잎집6,8,36을 위해 개발되어 적용된 원래 프로토콜에서 수정되었습니다. 이를 통해 광시야 또는 컨포칼 현미경을 사용하여 살아있는 식물 세포의 곰팡이 성장 및 발달을 직접적이고 상세하게 관찰할 수 있습니다. 이 프로토콜은 옥수수 집락화 중 다양한 미세 현상의 특성화, 비교 및...
공개
저자들은 경쟁하는 재정적 이해관계가 없으며 공개할 것이 없다고 선언합니다.
감사의 말
저자는 USDA-NIFA의 재정 지원에 감사드립니다(보조금 번호 2018-67013-28489 및 2020-70410-32901). 이 원고에 표현된 모든 의견, 결과, 결론 또는 권장 사항은 전적으로 저자의 것이며 미국 농무부의 견해를 반드시 반영하는 것은 아닙니다. 그림 6A 와 그림 7D에 나타난 이미지에 대해 브라질의 방문 학생인 국경 없는 과학의 방문 학생인 Mayara de Silva에게 감사드립니다. 또한 Olympus 컨포칼 현미경에 대한 액세스를 제공한 켄터키 대학의 식물 병리학과에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
참고문헌
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D. A fine-structural study of the pea downy mildew fungus Peronospora pisi in its host Pisum sativum. Canadian Journal of Botany. 55 (23), 2845-2858 (1977).
- Wharton, P. S., Julian, A. M., O'Connell, R. J. Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum. Phytopathology. 91 (2), 149-158 (2001).
- Latunde-Dada, A. O., et al. Infection process and identity of the hemibiotrophic anthracnose fungus (Colletotrichum destructivum O'Gara) from cowpea (Vigna unguiculata (L) Walp.). Mycological Research. 100 (9), 1133-1141 (1996).
- Bourett, T. M., Howard, R. J. In vitro development of penetration structures in the rice blast fungus Magnaporthe grisea. Canadian Journal of Botany. 68 (2), 329-342 (1990).
- Sakamoto, M. On the new method of sheath inoculation of rice plants with blast fungus, Pyricularia oryzae Cav., for the studying of the disease-resistant nature of the plant. Bulletin of the Institute for Agricultural Research, Tōhoku University. 1 (3), 120-129 (1949).
- Buiate, E. A., et al. A comparative genomic analysis of putative pathogenicity genes in the host-specific sibling species Colletotrichum graminicola and Colletotrichum sublineola. BMC genomics. 18 (1), 1-24 (2017).
- Kankanala, P., Czymmek, K., Valent, B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus. The Plant Cell. 19 (2), 706-724 (2007).
- Khang, C. H., et al. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement. The Plant Cell. 22 (4), 1388-1403 (2010).
- Mosquera, G., Giraldo, M. C., Khang, C. H., Coughlan, S., Valent, B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease. The Plant Cell. 21 (4), 1273-1290 (2009).
- Sakulkoo, W., et al. A single fungal MAP kinase controls plant cell-to-cell invasion by the rice blast fungus. Science. 359 (6382), 1399-1403 (2018).
- Torres, M. F., Cuadros, D. F., Vaillancourt, L. J. Evidence for a diffusible factor that induces susceptibility in the Colletotrichum-maize disease interaction. Molecular Plant Pathology. 15 (1), 80-93 (2014).
- Valent, B., Khang, C. H. Recent advances in rice blast effector research. Current Opinion in Plant Biology. 13 (4), 434-441 (2010).
- Mims, C. W., Vaillancourt, L. J. Ultrastructural characterization of infection and colonization of maize leaves by Colletotrichum graminicola, and by a C. graminicola pathogenicity mutant. Phytopathology. 92 (7), 803-812 (2002).
- Vargas, W. A., et al. Plant defense mechanisms are activated during biotrophic and necrotrophic development of Colletotricum graminicola in maize. Plant Physiology. 158 (3), 1342-1358 (2012).
- Venard, C., Vaillancourt, L. Colonization of fiber cells by Colletotrichum graminicola in wounded maize stalks. Phytopathology. 97 (4), 438-447 (2007).
- Venard, C., Vaillancourt, L. Penetration and colonization of unwounded maize tissues by the maize anthracnose pathogen Colletotrichum graminicola and the related nonpathogen C. sublineolum. Mycologia. 99 (3), 368-377 (2007).
- Berruyer, R., Poussier, S., Kankanala, P., Mosquera, G., Valent, B. Quantitative and qualitative influence of inoculation methods on in planta growth of rice blast fungus. Phytopathology. 96 (4), 346-355 (2006).
- Belisário, R., Robertson, A. E., Vaillancourt, L. J. Maize anthracnose stalk rot in the genomic era. Plant Disease. 106 (9), 2281-2298 (2022).
- Warren, H. L., Nicholson, R. L., Ullstrup, A. J., Sharvelle, E. G. Observations of Colletotrichum graminicola on sweet corn in Indiana. Plant Disease Reporter. 57, 143-144 (1973).
- Ritchie, S. W., Hanway, J. J., Benson, G. O. How a corn plant develops. Special Report, Iowa State University. 48, (1986).
- Tuite, J. . Plant pathological methods: fungi and bacteria. , (1969).
- Wicklow, D. T., Rogers, K. D., Dowd, P. F., Gloer, J. B. Bioactive metabolites from Stenocarpella maydis, a stalk and ear rot pathogen of maize. Fungal Biology. 115 (2), 133-142 (2011).
- Daudi, A., O'Brien, J. A. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-protocol. 2 (18), e263-e263 (2012).
- Benhamou, R. I., Jaber, Q. Z., Herzog, I. M., Roichman, Y., Fridman, M. Fluorescent tracking of the endoplasmic reticulum in live pathogenic fungal cells. ACS Chemical Biology. 13 (12), 3325-3332 (2018).
- Lorang, J. M., et al. fluorescent protein is lighting up fungal biology. Applied and Environmental Microbiology. 67 (5), 1987-1994 (2001).
- Liu, C. Y., Zhu, J., Xie, Z. Visualizing yeast organelles with fluorescent protein markers. JoVE (Journal of Visualized Experiments). 182, e63846 (2022).
- Westermann, B., Neupert, W. Mitochondria-targeted green fluorescent proteins: convenient tools for the study of organelle biogenesis in Saccharomyces cerevisiae. Yeast. 16 (15), 1421-1427 (2000).
- Lee, A. S. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 35 (4), 373-381 (2005).
- Krishnakumar, V., et al. A maize database resource that captures tissue-specific and subcellular-localized gene expression, via fluorescent tags and confocal imaging (Maize Cell Genomics Database). Plant and Cell Physiology. 56 (1), e12-e12 (2015).
- Wu, Q., Luo, A., Zadrozny, T., Sylvester, A., Jackson, D. Fluorescent protein marker lines in maize: generation and applications. International Journal of Developmental Biology. 57 (6-7-8), 535-543 (2013).
- O'Connell, R. J., et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses. Nature Genetics. 44 (9), 1060-1065 (2012).
- Torres, M. F., et al. A Colletotrichum graminicola mutant deficient in the establishment of biotrophy reveals early transcriptional events in the maize anthracnose disease interaction. BMC Genomics. 17 (202), 1-24 (2016).
- Andrie, R. M., Martinez, J. P., Ciuffetti, L. M. Development of ToxA and ToxB promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes. Mycologia. 97 (5), 1152-1161 (2005).
- Gordon, C. L., et al. Glucoamylase:: green fluorescent protein fusions to monitor protein secretion in Aspergillus niger. Microbiology. 146 (2), 415-426 (2000).
- Koga, H., Dohi, K., Nakayachi, O., Mori, M. A novel inoculation method of Magnaporthe grisea for cytological observation of the infection process using intact leaf sheaths of rice plants. Physiological and Molecular Plant Pathology. 64 (2), 67-72 (2004).
- Xavier, K. V., Pfeiffer, T., Parreira, D. F., Chopra, S., Vaillancourt, L. Aggressiveness of Colletotrichum sublineola strains from Sorghum bicolor and S. halepense to sweet sorghum variety Sugar Drip, and their impact on yield. Plant Disease. 101 (9), 1578-1587 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유