A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام الأصباغ منخفضة التكلفة لتصور تراكم الجليكوجين وسلامة الأمعاء في Caenorhabditis elegans
* These authors contributed equally
In This Article
Summary
يمكن جعل تدريس العلوم البيولوجية أكثر تحفيزا للطلاب من خلال استخدام التجريب. تقدم هذه المخطوطة بروتوكولين مختلفين ولكنهما متكاملان يمكن استخدامهما في الفصل الدراسي لتشجيع الطلاب على صياغة واختبار الفرضيات المتعلقة بالوجبات الغذائية عالية السعرات الحرارية والجوع والشيخوخة.
Abstract
Caenorhabditis elegans (C. elegans) هو نيماتودا شفافة وغير طفيلية مع بيولوجيا بسيطة ، مما يجعلها أداة رائعة لتدريس العلوم البيولوجية من خلال تلطيخ الخلايا أو محتواها الجزيئي. تم استخدام صبغة Lugol (محلول يوديد اليود والبوتاسيوم) على نطاق واسع في الكيمياء الحيوية لتلطيخ مخازن الجليكوجين. في هذا السياق ، من الممكن ملاحظة الاختلافات بين التي تتغذى والجائعة ، إلى جانب تأثيرات الظروف المختلفة ، مثل الوجبات الغذائية المختلفة ومستويات الأكسجين. Erioglaucine هو صبغة زرقاء تشير إلى فقدان الحاجز المعوي. عندما يكون الحاجز المعوي سليما ، بقع الصبغة الزرقاء داخل التجويف. ومع ذلك ، عندما تتعطل هذه السلامة ، تتسرب الصبغة إلى تجويف الجسم. باستخدام المجهر المجسم أو المجهر ، يمكن للمدرسين إظهار التغيرات الفسيولوجية والكيميائية الحيوية ، أو يمكنهم تحريض الطلاب على طرح سؤال علمي وفرضية واختبار فرضيتهم باستخدام هذه المقايسات. يصف البروتوكول الحالي تقنيتين للتلطيخ في C. elegans يمكن للطلاب تنفيذها بسهولة.
Introduction
يمثل تدريس العلوم البيولوجية في المدرسة الثانوية تحديا مستمرا. والجدير بالذكر أن الوصول إلى التكنولوجيا واستخدامها قد حقق تقدما مهما في عملية التدريس والتعلم ، ومع ذلك ، فإن أدوات مثل روبوتات الدردشة بالذكاء الاصطناعي تجعل الترشيد والبحث عن الأدلة أكثر صعوبة بسبب الاستجابات السهلة (وغير الصحيحة في بعض الأحيان) التي تم الحصول عليها1. لهذا السبب ، فإن استخدام طريقة علمية مع التجريب العملي في نهج قائم على الاستفسار في الفصل الدراسي هو استراتيجية مهمة لتطوير أو تحفيز التفكير النقدي والإبداع والمهارات التقنية لدى الطلاب2.
في هذا السياق ، تم استخدام الديدان الخيطية الحية الحرة Caenorhabditis elegans بنجاح في التجريب لأغراض التدريس3 بسبب مزاياها الخاصة: إنه ليس طفيليا والإشريكية القولونية المستخدمة للتغذية هي مستوى السلامة البيولوجية -1 ، وبالتالي تقليل الخطر البيولوجي إلى ما يقرب من الصفر ؛ لديها حركة حركة أنيقة وقابلة للقياس الكمي ، وهو أمر مثير للاهتمام للطلاب لمراقبته ؛ وهو شفاف ، مما يسمح بمراقبة الأعضاء ، ولكن أيضا تلطيخ أصباغ يمكن أن تشير إلى وجود جزيئات حيوية أو حدوث تغيرات فسيولوجية4. لذلك ، من الممكن افتراض واختبار افتراضات بسيطة في الفصل الدراسي تتعلق بالكيمياء الحيوية والتغيرات الفسيولوجية مثل الشيخوخة.
الجليكوجين عبارة عن كربوهيدرات تخزين ، تتكون من سلسلة طويلة ومتفرعة من جزيئات الجلوكوز التي تتكون من بقايا الجلوكوزيل مع روابط خطية جليكوسيدية (1→4) -α و (1→6) -α روابط جليكوسيدية عند نقاط الفرع وهي مهمة بشكل خاص لتقلص العضلات وتمايز الخلايا والحفاظ على نسبة السكر في الدم5. يتم تصنيع الجليكوجين بعد الرضاعة بسبب تنشيط الأنسولين لإنزيم الجليكوجين سينسيز. أثناء التمرين أو الصيام ، يقوم الإبينفرين أو الجلوكاجون ، على التوالي ، بتنشيط فسفوريلاز الجليكوجين ، وبالتالي ، يقوم بتحطيم السكاريد لتوفير الجلوكوز 6 فوسفات لخلايا العضلات أو إطلاق الجلوكوز الحر للتحايل على نقص السكر في الدم 6,7. تؤثر التغيرات في مستويات الجليكوجين على تمايز الخلايا ، والإشارات ، وتنظيم الأكسدة والاختزال ، والجذع في ظل ظروف فسيولوجية وفسيولوجية مرضية مختلفة ، بما في ذلك السرطان8. في C. elegans ، يوجد الجليكوجين بشكل رئيسي في عضلات المريء ، تحت الجلد ، الأمعاء ، الخلايا العصبية وبشكل رئيسي في عضلات جدار الجسم9. يمكن قياس محتوى الجليكوجين باستخدام محلول اليود من Lugol ، حيث يرتبط اليود بالملفات الحلزونية التي تشكل مركب اليود والجليكوجين ، مما يعطي لونا أزرق-أسود حادا أو بني-أسود ، والذي تم استخدامه بنجاح لإظهار محتوى الجليكوجين في C. elegans10. لقد ثبت أن تراكم الجليكوجين الناجم عن ارتفاع تغذية الجلوكوز يمكن أن يقلل من عمر الدودة ، وبالتالي تسريع عملية الشيخوخة11,12. بالإضافة إلى ذلك ، يمكن أن تؤدي الاضطرابات الأيضية والهرمونات الأخرى والتعرض للأجانب إلى تغيير استقلاب الجليكوجين أيضا13,14. لذلك ، فإن التجريب على محتوى الجليكوجين في C. elegans مثير للاهتمام للغاية ، لأن العوامل المتنوعة قد تزعج عملية التمثيل الغذائي ويمكن أن تحفز مناقشة داخل الفصل حول الكيمياء الحيوية الأساسية المرتبطة بالموضوعات المستعرضة مثل التمارين الرياضية والوجبات الغذائية والأمراض والشيخوخة.
الشيخوخة هي انخفاض وظيفي يعتمد على الوقت بسبب تلف الخلايا. يمكن أن يرتبط هذا الضرر بالإجهاد التأكسدي ، واستنزاف التيلومير ، وفقدان البروتين ، والالتهاب ، وحتى عن طريق تراكم أجسام polyglucosan غير القابلة للذوبان15 ، على سبيل المثال لا الحصر. واحدة من السمات المميزة للشيخوخة هي الحد من سلامة الأمعاء ، المرتبطة بالعديد من الحالات المزمنة التي تحدث خلال حياة الكائنالحي 16. يعتمد الحفاظ على التوازن المعوي على سلامة ظهارة الأمعاء ، والتي تدعمها بروتينات الموصل التي تشكل حاجزا ماديا وتربط الخلايا الظهارية المجاورة. عندما يكون هناك تلف في هذه الظهارة ، يحدث تسرب المحتوى اللمعي في الخلالي17. بناء على هذه الآلية ، تم استخدام اختبار السنافر للتحقق من سلامة الأمعاء في العديد من النماذج الحيوانية ، لأن هذه الصبغة الزرقاء Erioglaucine ملح الصوديوم لا يعبر الغشاء المعوي ، ويبقى في التجويف18. عندما تصاب الديدان بمسببات الأمراض ، الملوثة ببعض المواد السامة أو العمر ، مما يغير السلامة الخلالية ، تعبر الصبغة الحاجز وتنتشر في جميع أنحاء الدودة ، والتي تصبح زرقاء بالكامل. يسمح هذا الفحص بمناقشة فسيولوجيا الشيخوخة وتجربة العوامل التي يمكن أن تسرع أو تؤخر هذه العملية عن طريق تعريض الديدان لظروف مختلفة. ستصف البروتوكولات هنا بالتفصيل هاتين الطريقتين القائمتين على الصبغة والتي يمكن القيام بها بسهولة في الفصل لتحريض الطلاب وتحفيزهم على صياغة واختبار الفرضيات المتعلقة بالكيمياء الحيوية وعلم وظائف الأعضاء.
يوضح الجزء الأول من البروتوكول قابليته للتطبيق لتحليل محتوى الجليكوجين نوعيا وكميا في نموذج C. elegans 10. الغرض من الجزء الثاني من البروتوكول هو تقييم سلامة الأمعاء C. elegans. تسمح هذه التقنية بمراقبة شيخوخة C. elegans من خلال تقييم سلامة الأغشية المعوية. علاوة على ذلك ، فإنه يسمح بتقييم ما إذا كانت المادة تسرع أو تؤخر الشيخوخة وما إذا كانت أي مواد لها إمكانات سامة على الحاجز المعوي19.
كانت سلالة C. elegans المستخدمة في الدراسة الحالية من النوع البري Bristol N2. ومع ذلك، يمكن تكرار الإجراء باستخدام سلالات تظهر معدلات نمو مماثلة، أو يجب تعديل الطريقة بناء على الحاجة إلى استبدال المعدات، بالنظر إلى أن لها نفس الوظيفة أو وظيفة مماثلة، أو اعتمادا على السلالة المستخدمة، حيث أن بعض السلالات لها متطلبات صيانة و/أو حساسية محددة؛ يمكن الحصول على هذه المعلومات من مركز Caenorhabditis Genetics Center (CGC) أو موقع WormBase. يجب ألا تؤثر هذه التغييرات على استنساخ الطريقة.
Protocol
ملاحظة: يمكن الحصول على بكتيريا الإشريكية القولونية OP50 (E. coli OP50) وسلالات بريستول N2 البرية من CGC ، جامعة مينيسوتا ، الولايات المتحدة الأمريكية أو من التبرع من مختبر C. elegans . من أجل سلامة الباحثين ، من الضروري استخدام معدات الحماية الشخصية. على الرغم من أن تركيزات الكواشف مثل هيبوكلوريت وهيدروكسيد الصوديوم منخفضة ، فمن الضروري ارتداء معدات الوقاية الشخصية الموصى بها ، كما هو موضح في المخطوطة ، لتقليل أي مخاطر محتملة مرتبطة بهذه المواد الكيميائية.
1. محتوى الجليكوجين
- تحضير لوحات الاختبار
- تحضير ستة ، 60 مم × 15 مم NGM أجار20 (10 مل من أجار وسائط نمو الديدان الخيطية ، NGM ، كما هو موضح في الجدول التكميلي 1) لكل سلالة دودة واتركها تجف لمدة يوم واحد في درجة حرارة الغرفة. أبق الألواح مغلقة لمنع التلوث.
- أضف 200 ميكرولتر من ثقافة سائل E. coli OP50 (بكثافة بصرية = 0.600 ، تقريبا بطول موجي 600 نانومتر) لكل لوحة لتلقيح ما مجموعه أربعة ، 60 مم × 15 مم NGM صفائح لكل سلالة في غطاء التدفق. السماح للألواح المغلقة لاحتضان في 37 درجة مئوية لمدة 1 يوم قبل الاستخدام.
ملاحظة: قم بإعداد ست لوحات (الخطوة 1.1) ولكن قم بتلقيح 4 فقط ببكتيريا E. coli OP50. احتفظ باللوحين المتبقيين عند 4 درجات مئوية لاستخدامها لاحقا عند وضع الديدان في ظروف الجوع. يمكن إجراء هذا التحليل في نسختين. - في يوم الاختبار ، أضف 200 ميكرولتر من 0.025 M D-Glucose إلى لوحين (6 مم × 15 مم) من أجار NGM لكل سلالة تم زرعها مسبقا ببكتيريا E. coli OP50. اترك الألواح تجف في درجة حرارة الغرفة في غطاء التدفق.
ملاحظة: يمكن أيضا تجفيف ألواح أجار NGM المصنفة ببكتيريا E. coli OP50 بالقرب من مصابيح الكحول كبديل لاستخدام غطاء التدفق.
- تزامن
- قبل 3 أيام تقريبا من التزامن ، انقل 3-4 قطع (3 سم × 3 سم) من أجار NGM للصيانة مع C. elegans Bristol N2 (النوع البري) في مراحل مختلفة (حوالي 500 دودة لكل قطعة) إلى صفيحة جديدة (150 مم × 90 مم) تم زرعها مسبقا ببكتيريا E. coli OP50.
- ضع اللوحة الجديدة مع الديدان في بيئة خاضعة للرقابة عند 20 درجة مئوية وحافظ على الرطوبة >95٪ لمدة 3 أيام (72 ساعة تسمح لمعظم الديدان بالوصول إلى مرحلة البالغين الجاذبية).
ملاحظة: قد تحتاج إلى تعديل درجة حرارة النمو اعتمادا على سلالة (سلالات) C. elegans المستخدمة. - باستخدام ماصة باستور ، اجمع الديدان من اللوحة المعدة باستخدام H2O المقطر وانقلها إلى أنبوب طرد مركزي سعة 50 مل.
- انتظر ترسيب الديدان عن طريق الجاذبية (حوالي 15 دقيقة) ثم قم بإزالة المادة الطافية. كرر هذه العملية 3x للقضاء على البكتيريا. بعد الغسيل الأخير ، قلل الحجم إلى 5 مل.
- أضف 10 مل من محلول التبييض (الجدول التكميلي 1) ورجه بقوة باستخدام اليدين لمدة 6 دقائق تقريبا.
- مباشرة بعد اكتمال الاهتزاز ، املأ الأنابيب بسعة 50 مل باستخدام المخزن المؤقت M9.
- أجهزة الطرد المركزي عند 1400 × جم لمدة 3 دقائق ، قم بإزالة المادة الطافية حتى 5 مل ثم أضف 45 مل من المخزن المؤقت M9 مرة أخرى. كرر هذه العملية 4x.
- بعد الغسيل الأخير ، قلل الحجم إلى 15 مل وحافظ عليه عند درجة حرارة محكومة (20 درجة مئوية) ورطوبة (>95٪) لمدة 14 ساعة تقريبا.
ملاحظة: يمكن استبدال عملية التزامن بالحصول على البيض من خلال وضع البيض: نقل ما يقرب من 20 دودة حامل بالغة إلى صفيحة NGM (6 مم × 15 مم) تم زرعها مسبقا ب 200 ميكرولتر من E. coli OP50. السماح للديدان لوضع البيض لمدة 1 يوم. بعد ذلك ، قم بإزالة الديدان الحامل وانتظر حتى يفقس البيض.
- تحضير الديدان
- باستخدام ماصة أوتوماتيكية ، أضف 10 ميكرولتر من الديدان المتزامنة (الخطوة 1.2.8) إلى شريحة مجهر واحسب عدد الديدان. احسب مقدار الحجم الذي يجب سحبه للحصول على 500-1000 دودة / ميكرولتر.
- نقل 500-1000 L1 الديدان المتزامنة (الخطوة 1.2.8) إلى ألواح أجار NGM (150 مم × 90 مم ، الجدول التكميلي 1) المصنفة ببكتيريا E. coli OP50 كمصدر للغذاء ، حتى تصل إلى مرحلة اليرقات 4 (L4) عند 20 درجة مئوية.
ملاحظة: يمكن نقل الديدان باستخدام ماصة أوتوماتيكية. في حالة عدم توفر ماصة أوتوماتيكية ، استخدم ماصة باستور الزجاجية ، ويمكن التحكم في الأحجام باستخدام ملصقات الأنابيب الدقيقة أو الماصات الزجاجية المتدرجة. - بعد 48 ساعة من التزامن20: اجمع يرقات L4 من الألواح ذات المخزن المؤقت M9 (الجدول التكميلي 1) ، بمساعدة ماصة باستور بلاستيكية إلى أنبوب مخروطي نظيف 50 مل واغسلها 3x بمحلول M9 طازج أو كرر الغسيل حتى تتم إزالة جميع بكتيريا E. coli OP50 المتبقية تماما (في درجة حرارة الغرفة).
ملاحظة: خطوة الغسيل مهمة لأن بعض الديدان ستعاني من الجوع أثناء العملية.
- تشغيل الفحص
- انقل 500-1000 دودة L4 (الخطوة 1.3.1) من كل لوحة من ألواح أجار NGM الجديدة (60 مم × 15 مم) المعدة مسبقا (الخطوتان 1.1.2 و 1.1.3). احتفظ بها عند 20 درجة مئوية لمدة 48 ساعة حتى يوم الاختبار. سينتج عن هذا الجدول ثلاث مجموعات تجريبية على النحو التالي ، في نسختين (الشكل 1):
أ- (الجوع): ستنمو الديدان على ألواح أجار NGM العادية بدون بكتيريا E. coli OP50 ؛
ب- (منتظم): تنمو الديدان على ألواح أجار NGM العادية المصنفة ببكتيريا E. coli OP50 ؛
C- (نسبة عالية من الجلوكوز): ستنمو الديدان على ألواح أجار NGM المصنفة ببكتيريا E. coli OP50 وتحتوي على 0.025 M D-glucose. - في يوم الاختبار (بعد 48 ساعة): اجمع الديدان وامنحها ثلاث غسلات قصيرة في المخزن المؤقت M9 (الخطوتان 1.2.2 و 1.2.3)
ملاحظة: هنا ، قم بإعداد ألواح أجار NGM مع إضافة D-glucose (الخطوة 1.3) وضعها جانبا حتى يحين وقت إضافة الديدان.- تلطيخ اليود: تحضير محلول اليود Lugol's Iodine بنسبة 5٪ (v / v) (محلول يوديد اليود / البوتاسيوم) باستخدام مخزن مؤقت M9 جديد.
ملاحظة: يمكن الحصول على محلول اليود Lugol من موردي الكواشف المحليين أو الصيدليات ، وبالتالي قد يختلف التركيز الأولي. إذا لزم الأمر ، احسب للحصول على حل 5٪ (v / v).
- تلطيخ اليود: تحضير محلول اليود Lugol's Iodine بنسبة 5٪ (v / v) (محلول يوديد اليود / البوتاسيوم) باستخدام مخزن مؤقت M9 جديد.
- نقل ما يقرب من 100 ميكرولتر من الديدان المغسولة (الخطوة 4.2) من كل مجموعة إلى الأنبوب الدقيق 1.5 مل الذي يحتوي على محلول Lugol المخفف (5٪ v / v). باستخدام ماصة أوتوماتيكية بنسبة 1: 5 ، قم بنقل 100 ميكرولتر من الديدان إلى 400 ميكرولتر من محلول Lugol ، متبوعا بتحريك لطيف في الخلاط لمدة 5 دقائق.
ملاحظة: في حالة عدم توفر الخلاط ، فمن الممكن هز الأنابيب الدقيقة بعناية باليدين. - مباشرة بعد هذه 5 دقائق ، أجهزة الطرد المركزي 1.5 مل microtube (الديدان + محلول Lugol) في 1400 × g لمدة 3 دقائق.
ملاحظة: إذا تم إجراء هذا الفحص على الديدان من مرحلة L4 أو ما بعدها ، فمن الممكن تحقيق ترسيب الجاذبية بدلا من استخدام جهاز طرد مركزي. اترك الأنابيب الدقيقة مفتوحة في رفوف على سطح الطاولة لمدة 10 دقائق حتى تستقر جميع الديدان في قاع الأنبوب الدقيق. - قم بإزالة المادة الطافية واغسل الديدان ب 1.0 مل من المخزن المؤقت M9 الطازج. كرر الغسيل حتى تتم إزالة كل اليود المتبقي من المحلول (بحد أدنى 3x).
- بعد خطوة الغسيل الأخيرة ، قم بإزالة المادة الطافية باستثناء بقايا حوالي 100 ميكرولتر. استخدم هذا لإعادة تعليق الديدان برفق وللتحليل المجهري.
- نقل ما يقرب من 50 ميكرولتر من محلول الدودة المعاد تعليقه إلى شرائح الفحص المجهري وتغطيتها بزلات الغطاء. راقب صور المجال الساطع باستخدام مجهر مجسم (عند 1.5x).
ملاحظة: في حالة عدم توفر المجهر المجسم، يمكن استخدام مجهر عادي، ويمكن التقاط الصور بكاميرا الهاتف الخلوي (بمعدل 3.4 ضعف) باستخدام محول. لمنع الأخطاء من الضوء / السطوع / التعرض ، من الأهمية بمكان أن تظل جميع إعدادات كاميرا الهاتف الخلوي متسقة لجميع الصور.
- انقل 500-1000 دودة L4 (الخطوة 1.3.1) من كل لوحة من ألواح أجار NGM الجديدة (60 مم × 15 مم) المعدة مسبقا (الخطوتان 1.1.2 و 1.1.3). احتفظ بها عند 20 درجة مئوية لمدة 48 ساعة حتى يوم الاختبار. سينتج عن هذا الجدول ثلاث مجموعات تجريبية على النحو التالي ، في نسختين (الشكل 1):
- فحص البيانات
- البيانات الكمية: حساب محتوى الجليكوجين على أساس تلطيخ اليود من الديدان.
- احفظ الصور من المجهر المجسم الذي يحتوي على ما لا يقل عن 10 ديدان لكل مجموعة كملف .jpeg لمزيد من المعالجة. قم بتنزيل برنامج ImageJ المجاني للقيام بذلك. وترد التفاصيل في الملف التكميلي 1، والشكل التكميلي 1، والشكل التكميلي 2.
- افتح الصورة .jpeg باستخدام برنامج ImageJ (الذي يمكن تنزيله مجانا على https://imagej.nih.gov/ij/download.html). انقر فوق خط مجزأ وحدد الخطوط العريضة للدودة (دودة واحدة في كل مرة). انقر فوق تحليل ، ثم حدد قياس للحصول على القياس الكمي للبقعة. سيتم عرض البيانات كمتوسط في الجدول. يشير المتوسط إلى البيانات المحسوبة من كثافة التلوين لكل منطقة دودة.
- البيانات النوعية: الحصول على صور من المجهر المجسم لكل مجموعة ومقارنة بصريا تلطيخ الديدان. إنشاء نظام تسجيل ، إذا لزم الأمر ، لتحليل تلطيخ: 0 عديم اللون ؛ 1 ملطخة قليلا. 2 ملطخة و 3 ملطخة بشدة. باستخدام المجهر المجسم ، عد يدويا ما يقرب من 10 ديدان لكل مجموعة (الحد الأدنى) باستخدام عداد اليد.
- البيانات الكمية: حساب محتوى الجليكوجين على أساس تلطيخ اليود من الديدان.
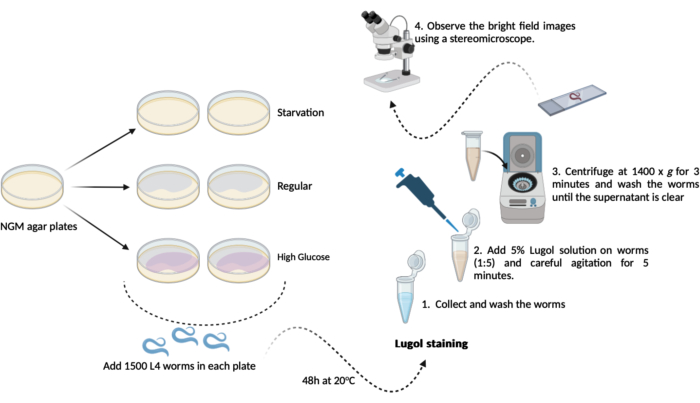
الشكل 1: مخطط فحص محتوى الجليكوجين الكلي في C. elegans. تم إجراء رسم تخطيطي للتجربة هنا لإجراء فحص محتوى الجليكوجين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تقييم نفاذية الأمعاء
- تحضير الديدان
- بعد حوالي 14 ساعة من التزامن (الخطوة 1.2.8) ، انقل 500-1000 دودة (الخطوة 1.3.1 و NOTE) في مرحلة اليرقات الأولى (L1) إلى كل صفيحة أجار NGM جديدة (60 مم × 15 مم) تم إعدادها مسبقا واحتفظ بها عند 20 درجة مئوية حتى يوم الاختبار. سيؤدي هذا الجدول إلى مجموعتين تجريبيتين على النحو التالي (الشكل 2):
A- (صغار): تنمو الديدان على ألواح أجار NGM المصنفة ببكتيريا E. coli OP50 حتى مرحلة اليرقات 4 (L4) ؛
ب- (قديم): ستنمو الديدان على ألواح أجار NGM المصنفة ببكتيريا E. coli OP50حتى اليوم السابع من مرحلة البلوغ.
ملاحظة: يجب غسل الديدان التي تم الاحتفاظ بهاحتى اليوم السابع من مرحلة البلوغ باستخدام مخزن مؤقت M9 كل يوم ونقلها إلى ألواح أجار NGM جديدة (60 مم × 15 مم) مع 200 ميكرولتر من بكتيريا E. coli OP50 التي تم زرعها مسبقا لاستبدال الطعام وإزالة النسل. تطفو الديدان الأصغر سنا أثناء الصب ويمكن فصلها عن طريق إزالة المادة الطافية. تزداد نسبة ديدان السنافر مع تقدم العمر. ومع ذلك ، يمكن إجراء تقييم نفاذية الأمعاء في أي مرحلة وعمر ، وهذا يتوقف على الغرض من الدراسة.
- بعد حوالي 14 ساعة من التزامن (الخطوة 1.2.8) ، انقل 500-1000 دودة (الخطوة 1.3.1 و NOTE) في مرحلة اليرقات الأولى (L1) إلى كل صفيحة أجار NGM جديدة (60 مم × 15 مم) تم إعدادها مسبقا واحتفظ بها عند 20 درجة مئوية حتى يوم الاختبار. سيؤدي هذا الجدول إلى مجموعتين تجريبيتين على النحو التالي (الشكل 2):
- تشغيل الفحص
- في يوم الاختبار ، اجمع ديدان L4 (يومين بعد الخطوة 2.1.1) وديدان البلوغفي اليوم السابع (الآنفي يومها التاسع) باستخدام المخزن المؤقت M9 (الجدول التكميلي 1) وانقله إلى الأنابيب الدقيقة المسمى 1.5 مل.
- أجهزة الطرد المركزي عند 1400 × جم لمدة 3 دقائق ، قم بإزالة المادة الطافية ، أضف 1.0 مل من M9 ، واخلطها برفق. كرر هذه العملية 3x لإزالة البكتيريا. بعد الغسيل الأخير ، قم بتقليل الحجم إلى 500 ميكرولتر.
- باستخدام ماصة أوتوماتيكية ، أضف 10 ميكرولتر من رواسب الدودة إلى شريحة مجهر واحسب عدد الديدان. احسب الحجم المراد سحبه للحصول على 100 دودة / ميكرولتر.
- تلطيخ السنافر: تحضير محلول ملح الصوديوم Erioglaucine بنسبة 25٪ (الجدول التكميلي 1) باستخدام الماء المقطر. إذا لزم الأمر ، استخدم الدوامة لتحسين الذوبان.
- في الأنابيب الدقيقة الجديدة التي تم تحديدها مسبقا ، باستخدام ماصة أوتوماتيكية ، أضف الحجم الذي يحتوي على 100 دودة ، و 100 ميكرولتر من محلول ملح الصوديوم Erioglaucine بنسبة 25٪ ، و 200 ميكرولتر من E. coli OP50 وكاملة مع مخزن مؤقت M9 لحجم نهائي يبلغ 500 ميكرولتر.
ملاحظة: يتم إصلاح أحجام ثنائي الصوديوم Erioglaucine والإشريكية القولونية وعدد الديدان. حجم المخزن المؤقت M9 متغير ويمكن استخدامه لإحضار الحجم النهائي إلى 500 ميكرولتر. - احتضان لمدة 3 ساعات مع التحريض في خلاط ، محمية من الضوء ، في درجة حرارة الغرفة.
ملاحظة: في حالة عدم توفر الخلاط ، هز الأنابيب الدقيقة بعناية بيديك كل 15 دقيقة. - بعد 3 ساعات ، قم بطرد مركزي الأنبوب الدقيق سعة 1.5 مل عند 1400 × جم لمدة 3 دقائق. قم بإزالة 1.0 مل من المادة الطافية واغسل الديدان ب 1.0 مل من المخزن المؤقت M9.
- كرر الغسيل حتى تتم إزالة محلول ملح الصوديوم Erioglaucine المتبقي من المحلول. بعد خطوة الغسيل الأخيرة ، قم بإزالة المادة الطافية باستثناء بقايا حوالي 250 ميكرولتر. استخدم هذا لإعادة تعليق الديدان بعناية ومعالجتها للتحليل المجهري.
- نقل ما يقرب من 50 دودة من محلول الدودة المعاد تعليقه إلى شرائح الفحص المجهري وتغطيتها بزلات الغطاء. احتضان الشرائح المجهرية في الثلاجة عند -20 درجة مئوية لمدة 10 دقائق لشل الديدان.
ملاحظة: بديل آخر لشل الديدان هو إضافة 10 ميكرولتر من محلول ليفاميزول هيدروكلوريد (10 mM ؛ الجدول التكميلي 1) وتغطيتها بزلات الغطاء. - راقب واحسب العدد الإجمالي للديدان والديدان المصبوغة بالكامل باستخدام الحقل الساطع في المجهر المجسم (عند 1.5x). يمكن الحصول على الصور من كاميرا الهاتف الخليوي (في 3.4x) إلى جانب محول. لمنع الأخطاء من الضوء / السطوع / التعرض ، من الأهمية بمكان أن تظل جميع إعدادات كاميرا الهاتف الخلوي متسقة لجميع الصور.
- فحص البيانات
- البيانات النوعية: الحصول على صور من المجهر المجسم لكل مجموعة (L4 و7 th day of مرحلة البلوغ) ومقارنة بصريا تلطيخ الديدان.
- احسب العدد الإجمالي للديدان وعدد ديدان السنافر (الديدان الزرقاء) باستخدام المجهر المجسم.
- التعبير عن النتائج كنسبة مئوية من ديدان السنافر من خلال مقارنة الديدان الصغيرة (L4 ، كمجموعة ضابطة) والديدان القديمة(اليوم السابع من مرحلة البلوغ):
أ س س = 100 (٪) × ب
س = 100 × ب / أ
حيث ، A = العدد الإجمالي للديدان
ب = عدد ديدان السنافر

الشكل 2: مخطط مقايسة نفاذية الأمعاء الشاملة في C. elegans. (أ) إعداد C. elegans . ب: التلوين بملح إريوجلوسين ثنائي الصوديوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يوفر فحص محتوى الجليكوجين طريقة قوية وسريعة لفحص ظروف الاختبار المختلفة ، مثل الدراسات المقارنة للسلالات المختلفة التي قد تؤثر على تخليق الجليكوجين أو تدهوره. في هذه الدراسة ، تعرضت ديدان L4 لثلاثة شروط اختبار متميزة: الصيام والتغذية والمجموعات المخصبة بالجلوكوز. تم إج?...
Discussion
باختصار ، يوفر هذا البروتوكول تقييما نوعيا لمحتوى الجليكوجين في ديدان C. elegans الفردية باستخدام تلطيخ Lugol: فحص مباشر وقوي وسريع. تلطيخ Lugol هو نهج خال من الملصقات وغير جراحي يسهل الحصول على البيانات الجزيئية بدقة تحت خلوية ، مما يسمح بمراقبة تقلبات محتوى الجليكوجين داخ?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تقر وزارة الصحة بالتمويل المقدم من Conselho Nacional de Pesquisa e Desenvolvimento (CNPq / البرازيل) ، رقم المنحة #301808 / 2018-0 ، # 313117 / 2019-5 ، Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS / البرازيل) ، رقم المنحة ، 21/2551-0001963-8 ، Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES ، رمز المالية 001 ل NSJ و ACS)
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
References
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved