Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de colorants à faible coût pour visualiser l’accumulation de glycogène et l’intégrité intestinale chez Caenorhabditis elegans
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’enseignement des sciences biologiques peut être rendu plus stimulant pour les élèves par l’utilisation de l’expérimentation. Ce manuscrit présente deux protocoles différents mais complémentaires qui peuvent être utilisés en classe pour encourager les élèves à formuler et à tester des hypothèses liées aux régimes riches en calories, à la famine et au vieillissement.
Résumé
Caenorhabditis elegans (C. elegans) est un nématode transparent, non parasite, de biologie simple, ce qui en fait un excellent outil pour l’enseignement des sciences biologiques grâce à la coloration des cellules ou à leur contenu moléculaire. Le colorant Lugol (solution d’iode d’iodure de potassium) a été largement utilisé en biochimie pour colorer les réserves de glycogène. Dans ce contexte, il est possible d’observer des différences entre les animaux nourris et affamés, en plus des effets de différentes conditions, telles que des régimes alimentaires et des niveaux d’oxygène différents. L’érioglaucine est un colorant bleu qui indique la perte de la barrière intestinale. Lorsque la barrière intestinale est intacte, le colorant bleu tache à l’intérieur de la lumière ; Cependant, lorsque cette intégrité est perturbée, le colorant s’infiltre dans la cavité corporelle. À l’aide d’un stéréomicroscope ou d’un microscope, les enseignants peuvent démontrer des altérations physiologiques et biochimiques, ou ils peuvent inciter les élèves à poser une question scientifique et à émettre des hypothèses et à tester leur hypothèse à l’aide de ces tests. Le présent protocole décrit deux techniques de coloration chez C. elegans qui peuvent être facilement réalisées par les étudiants.
Introduction
L’enseignement des sciences biologiques au secondaire est un défi permanent. Notamment, l’accès et l’utilisation de la technologie ont apporté d’importantes avancées dans le processus d’enseignement-apprentissage, cependant, des outils tels que les chatbots d’intelligence artificielle rendent la rationalisation et la recherche de preuves plus difficiles en raison des réponses faciles (et parfois incorrectes) obtenues1. Pour cette raison, l’utilisation d’une méthode scientifique avec une expérimentation pratique dans une approche basée sur l’enquête en classe est une stratégie importante pour développer ou stimuler la pensée critique, la créativité et les compétences techniques chez les élèves2.
Dans ce contexte, le nématode libre Caenorhabditis elegans a été utilisé avec succès à des fins d’expérimentation à des fins pédagogiques3 en raison de ses avantages particuliers : ce n’est pas un parasite et l’Escherichia coli utilisé pour l’alimentation est de niveau de biosécurité-1, réduisant ainsi presque à zéro le risque biologique ; Il a un mouvement de locomotion élégant et quantifiable, qui est intéressant à observer pour les étudiants ; Et il est transparent, ce qui permet l’observation des organes, mais aussi la coloration avec des pigments qui peuvent indiquer la présence de biomolécules ou l’apparition d’altérations physiologiques4. Par conséquent, il est possible d’émettre des hypothèses et de tester en classe des postulations simples liées à la biochimie et aux changements physiologiques tels que le vieillissement.
Le glycogène est un glucide de stockage, formé d’une longue chaîne ramifiée de molécules de glucose formées par des résidus glucosyles avec des liaisons linéaires glycosidiques (1→4)-α et des liaisons glycosidiques (1→6)-α aux points de ramification et est particulièrement important pour la contraction musculaire, la différenciation cellulaire et le maintien de la glycémie5. Le glycogène est synthétisé après l’alimentation en raison de l’activation par l’insuline de l’enzyme glycogène-synthase. Pendant l’exercice ou le jeûne, l’épinéphrine ou le glucagon, respectivement, activent la glycogène phosphorylase et, par conséquent, décomposent le polysaccharide pour fournir du glucose-6-phosphate aux cellules musculaires ou libérer du glucose libre pour contourner l’hypoglycémie 6,7. Les modifications des niveaux de glycogène ont un impact sur la différenciation cellulaire, la signalisation, la régulation redox et la souche dans diverses conditions physiologiques et physiopathologiques, y compris le cancer8. Chez C. elegans, le glycogène se trouve principalement dans les muscles de l’œsophage, l’hypoderme, l’intestin, les neurones et principalement dans les muscles de la paroi corporelle9. La teneur en glycogène peut être mesurée en utilisant la solution d’iode de Lugol, car l’iode se lie aux bobines hélicoïdales formant un complexe iode-glycogène, donnant une couleur bleu-noir ou brun-noir visible, qui a été utilisée avec succès pour démontrer la teneur en glycogène chez C. elegans10. Il a été démontré que l’accumulation de glycogène causée par une alimentation élevée en glucose peut réduire la durée de vie du ver, accélérant ainsi le processus de vieillissement11,12. De plus, les perturbations métaboliques, d’autres hormones et l’exposition aux xénobiotiques peuvent également modifier le métabolisme du glycogène13,14. Par conséquent, l’expérimentation sur la teneur en glycogène de C. elegans est très intéressante, car divers facteurs peuvent perturber son métabolisme et peuvent stimuler une discussion en classe sur la biochimie de base associée à des thèmes transversaux tels que l’exercice, les régimes alimentaires, les maladies et le vieillissement.
Le vieillissement est un déclin fonctionnel dépendant du temps causé par des dommages cellulaires. Ces dommages peuvent être associés au stress oxydatif, à l’attrition des télomères, à la perte de protéostasie, à l’inflammation et même à l’accumulation de corps polyglucosanes insolubles15, pour n’en nommer que quelques-uns. L’une des caractéristiques du vieillissement est la réduction de l’intégrité intestinale, associée à plusieurs affections chroniques qui surviennent au cours de la vie d’un organisme16. Le maintien de l’homéostasie intestinale dépend de l’intégrité de l’épithélium intestinal, qui est soutenu par des protéines jonctionnelles formant une barrière physique et reliant les cellules épithéliales adjacentes. Lorsque cet épithélium est endommagé, il y a une fuite de contenu luminal dans l’interstitium17. Sur la base de ce mécanisme, le test du schtroumpf a été utilisé pour vérifier l’intégrité intestinale dans plusieurs modèles animaux, car ce colorant bleu Erioglaucine sel disodique ne traverse pas la membrane intestinale, restant dans la lumière18. Lorsque les vers sont infectés par un agent pathogène, contaminés par des substances toxiques ou par l’âge, altérant l’intégrité interstitielle, le colorant traverse la barrière et se répand sur tout le ver, qui devient tout bleu. Ce test permet de discuter de la physiologie du vieillissement et d’expérimenter sur les facteurs qui peuvent accélérer ou retarder ce processus en exposant les vers à différentes conditions. Les protocoles ici décriront en détail ces deux méthodes à base de colorants qui peuvent être facilement mises en pratique en classe pour susciter et stimuler les étudiants à formuler et à tester des hypothèses liées à la biochimie et à la physiologie.
La première partie du protocole montre son applicabilité à l’analyse qualitative et quantitative de la teneur en glycogène dans le modèle10 de C. elegans. Le but de la deuxième partie du protocole est d’évaluer l’intégrité de l’intestin de C. elegans. Cette technique permet de suivre le vieillissement de C. elegans en évaluant l’intégrité des membranes intestinales. De plus, il permet d’évaluer si une substance accélère ou retarde le vieillissement et si des substances ont un potentiel toxique sur la barrière intestinale19.
La souche de C. elegans utilisée pour la présente étude était de type sauvage Bristol N2. Cependant, la procédure peut être reproduite en utilisant des souches qui présentent des taux de croissance comparables, ou la méthode doit être ajustée en fonction de la nécessité de remplacer l’équipement, étant donné qu’elles ont une fonction identique ou similaire, ou en fonction de la souche utilisée, car certaines souches ont des exigences spécifiques en matière d’entretien et/ou de sensibilité ; ces informations peuvent être obtenues auprès du Centre de génétique Caenorhabditis (CGC) ou du site Web WormBase. Ces modifications ne devraient pas avoir d’impact sur la reproductibilité de la méthode.
Protocole
REMARQUE : La bactérie Escherichia coli OP50 (E. coli OP50) et les souches sauvages de Bristol N2 peuvent être obtenues auprès du CGC, Université du Minnesota, États-Unis, ou grâce à un don d’un laboratoire de C. elegans . Pour la sécurité des chercheurs, il est impératif d’utiliser des équipements de protection individuelle. Bien que les concentrations de réactifs comme l’hypochlorite et l’hydroxyde de sodium soient faibles, il est essentiel de porter l’EPI recommandé, comme souligné dans le manuscrit, afin de minimiser les risques potentiels associés à ces produits chimiques.
1. Teneur en glycogène
- Préparation des plaques d’essai
- Préparezsix plaques de gélose NGM de 60 mm x 15 mm (10 mL de gélose gélose au milieu de croissance des nématodes, NGM, comme décrit dans le tableau supplémentaire 1) par souche de ver et laissez-les sécher pendant 1 jour à température ambiante. Gardez les plaques fermées pour éviter toute contamination.
- Ajouter 200 μL de culture liquide d’E. coli OP50 (avec une densité optique = 0,600, environ à une longueur d’onde de 600 nm) par plaque pour inoculer un total de quatre plaques NGM de 60 mm x 15 mm par souche dans la hotte d’écoulement. Laisser incuber les plaques fermées à 37 °C pendant 1 jour avant utilisation.
REMARQUE : Préparez six plaques (étape 1.1), mais n’en inoculez que 4 avec la bactérie E. coli OP50. Réservez les deux plaques restantes à 4 °C pour une utilisation ultérieure lorsque vous placez les vers dans des conditions de famine. Cette analyse peut être effectuée en double. - Le jour de l’essai, ajouter 200 μL de D-glucose 0,025 M à deux plaques de gélose NGM (6 mm x 15 mm) par souche qui ont déjà été ensemencées avec la bactérie E. coli OP50. Laissez sécher les plaques à température ambiante dans la hotte d’évacuation.
REMARQUE : Les plaques de gélose NGM ensemencées avec la bactérie E. coli OP50 peuvent également être séchées à proximité de lampes à alcool comme alternative à l’utilisation d’une hotte à flux.
- Synchronisation
- Environ 3 jours avant la synchronisation, transférez 3 à 4 morceaux (3 cm x 3 cm) d’une gélose d’entretien NGM avec C. elegans Bristol N2 (type sauvage) à différents stades (environ 500 vers par morceau) dans une nouvelle plaque (150 mm x 90 mm) qui a été préalablement ensemencée avec la bactérie E. coli OP50.
- Placez la nouvelle plaque avec les vers dans un environnement contrôlé à 20 °C et maintenez l’humidité >95% pendant 3 jours (72 h permettent à la plupart des vers d’atteindre le stade adulte gravide).
REMARQUE : Il peut être nécessaire d’ajuster la température de croissance en fonction de la ou des souches de C. elegans utilisées. - À l’aide d’une pipette Pasteur, prélever les vers de la plaque préparée avec du H2O distillé et les transférer dans un tube à centrifuger de 50 ml.
- Attendez la sédimentation des vers par gravité (environ 15 min) puis retirez le surnageant. Répétez ce processus 3 fois pour éliminer les bactéries. Après le dernier lavage, réduisez le volume à 5 ml.
- Ajouter 10 ml de solution de blanchiment (tableau supplémentaire 1) et agiter vigoureusement avec les mains pendant environ 6 minutes.
- Immédiatement après la fin de l’agitation, remplissez les tubes à une capacité de 50 ml avec un tampon M9.
- Centrifugez à 1400 x g pendant 3 min, retirez le surnageant jusqu’à 5 mL, puis ajoutez à nouveau 45 mL de tampon M9. Répétez ce processus 4 fois.
- Après le dernier lavage, réduisez le volume à 15 mL et maintenez-le à une température (20 °C) et une humidité (>95 %) contrôlées pendant environ 14 h.
REMARQUE : Le processus de synchronisation peut être remplacé par l’obtention d’œufs par ponte : Transférer environ 20 vers gravides adultes sur une plaque NGM (6 mm x 15 mm) préalablement ensemencée avec 200 μL d’E. coli OP50. Laissez les vers pondre des œufs pendant 1 jour. Après cela, retirez les vers enceintes et attendez que les œufs éclosent.
- Préparation des vers
- À l’aide d’une pipette automatique, ajoutez 10 μL de vers synchronisés (étape 1.2.8) à une lame de microscope et comptez le nombre de vers. Calculez le volume à pipeter pour obtenir 500-1000 vers/μL.
- Transvaser 500 à 1000 vers synchronisés L1 (étape 1.2.8) dans des plaques de gélose NGM (150 mm x 90 mm, tableau supplémentaire 1) ensemencées avec la bactérie E. coli OP50 comme source de nourriture, jusqu’à ce qu’elles atteignent le stade larvaire 4 (L4) à 20 °C.
REMARQUE : Les vers peuvent être transférés à l’aide d’une pipette automatique. Si vous ne disposez pas d’une pipette automatique, utilisez une pipette Pasteur en verre, et les volumes peuvent être contrôlés à l’aide d’étiquettes à microtubes ou de pipettes graduées en verre. - Après 48 h de synchronisation20 : prélever les larves L4 sur les plaques avec le tampon M9 (tableau supplémentaire 1), à l’aide d’une pipette Pasteur en plastique jusqu’à un tube conique propre de 50 mL et les laver 3 fois avec du tampon M9 frais ou répéter les lavages jusqu’à ce que toutes les bactéries E. coli OP50 restantes soient complètement éliminées (à température ambiante).
REMARQUE : L’étape de lavage est importante car certains vers souffriront de famine pendant la procédure.
- Exécution du test
- Transvaser 500 à 1000 vers L4 (étape 1.3.1) à partir de chacune des nouvelles plaques de gélose NGM (60 mm x 15 mm) précédemment préparées (étapes 1.1.2 et 1.1.3). Maintenez-les à 20 °C pendant 48 h jusqu’au jour du test. Ce calendrier aboutira à trois groupes expérimentaux comme suit, en double (Figure 1) :
A- (famine) : les vers se développeront sur des plaques de gélose NGM régulières sans la bactérie E. coli OP50 ;
B- (régulier) : les vers se développeront sur des plaques de gélose NGM régulières ensemencées avec la bactérie E. coli OP50 ;
C- (taux élevé de glucose) : les vers se développeront sur des plaques de gélose NGM ensemencées avec la bactérie E. coli OP50 et contenant 0,025 M de D-glucose. - Le jour du test (après 48 h) : récupérez les vers et faites-les passer trois brèves fois dans le tampon M9 (étapes 1.2.2 et 1.2.3)
REMARQUE : Ici, préparez des plaques de gélose NGM avec l’ajout de D-glucose (étape 1.3) et mettez-les de côté jusqu’à ce qu’il soit temps d’ajouter les vers.- Coloration à l’iode : préparer une solution d’iode de Lugol à 5 % (v/v) (solution d’iode/iodure de potassium) à l’aide d’un tampon M9 frais.
REMARQUE : La solution d’iode de Lugol peut être obtenue auprès de fournisseurs de réactifs locaux ou de pharmacies, donc la concentration initiale peut varier. Si nécessaire, calculez pour obtenir une solution à 5 % (v/v).
- Coloration à l’iode : préparer une solution d’iode de Lugol à 5 % (v/v) (solution d’iode/iodure de potassium) à l’aide d’un tampon M9 frais.
- Transférez environ 100 μL de vers lavés (étape 4.2) de chaque groupe dans le microtube de 1,5 mL contenant une solution de Lugol diluée (5 % v/v). À l’aide d’une pipette automatique dans une proportion de 1:5, transférez 100 μL de vers dans 400 μL de solution de Lugol, puis agitez doucement dans un mélangeur pendant 5 min.
REMARQUE : Si un mélangeur n’est pas disponible, il est possible de secouer soigneusement les microtubes à la main. - Juste après ces 5 min, centrifuger le microtube de 1,5 mL (vers + solution de Lugol) à 1400 x g pendant 3 min.
REMARQUE : Si ce test est effectué sur des vers de l’étage L4 ou au-delà, il est possible d’obtenir une sédimentation par gravité au lieu d’utiliser une centrifugeuse. Laissez les microtubes ouverts dans des grilles sur la paillasse pendant 10 minutes jusqu’à ce que tous les vers se soient déposés au fond du microtube. - Retirez le surnageant et lavez les vers avec 1,0 mL de tampon M9 frais. Répétez le lavage jusqu’à ce que tout l’iode restant soit retiré de la solution (minimum 3x).
- Après la dernière étape de lavage, retirez le surnageant, à l’exception d’un résidu d’environ 100 μL. Utilisez-le pour remettre doucement les vers en suspension et pour une analyse microscopique.
- Transférez environ 50 μL de la solution de ver en suspension sur des lames de microscopie et couvrez-les avec des lamelles. Observez les images en fond clair à l’aide d’un stéréomicroscope (à 1,5x).
REMARQUE : Si un stéréomicroscope n’est pas disponible, un microscope ordinaire peut être utilisé et les images peuvent être capturées avec l’appareil photo d’un téléphone portable (à 3,4x) à l’aide d’un adaptateur. Pour éviter les erreurs de lumière, de luminosité et d’exposition, il est essentiel que tous les paramètres de l’appareil photo du téléphone portable restent cohérents pour toutes les photos.
- Transvaser 500 à 1000 vers L4 (étape 1.3.1) à partir de chacune des nouvelles plaques de gélose NGM (60 mm x 15 mm) précédemment préparées (étapes 1.1.2 et 1.1.3). Maintenez-les à 20 °C pendant 48 h jusqu’au jour du test. Ce calendrier aboutira à trois groupes expérimentaux comme suit, en double (Figure 1) :
- Inspection des données
- Données quantitatives : Calculez la teneur en glycogène sur la base de la coloration à l’iode des vers.
- Enregistrez les images du stéréomicroscope contenant un minimum de 10 vers par groupe dans un fichier .jpeg pour un traitement ultérieur. Pour ce faire, téléchargez le logiciel gratuit ImageJ. Les détails sont fournis dans le Fichier supplémentaire 1, la Figure supplémentaire 1, la Figure supplémentaire 2.
- Ouvrez l’image .jpeg à l’aide du logiciel ImageJ (qui peut être téléchargé gratuitement sur https://imagej.nih.gov/ij/download.html). Cliquez sur Ligne segmentée et tracez le contour du ver (un ver à la fois). Cliquez sur Analyser, puis sélectionnez Mesurer pour obtenir la quantification de la tache. Les données seront affichées sous forme de moyenne dans le tableau. La moyenne indique les données calculées à partir de la densité de coloration par surface de ver.
- Données qualitatives : Obtenez des images du stéréomicroscope de chaque groupe et comparez visuellement la coloration des vers. Créez un système de notation, si nécessaire, pour analyser la coloration : 0 incolore ; 1 légèrement taché ; 2 tachés et 3 fortement tachés. À l’aide du stéréomicroscope, comptez manuellement environ 10 vers par groupe (minimum) à l’aide d’un compteur manuel.
- Données quantitatives : Calculez la teneur en glycogène sur la base de la coloration à l’iode des vers.
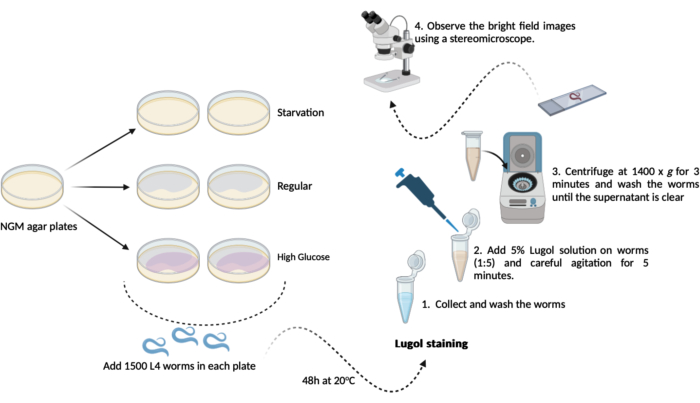
Figure 1 : Schéma de dosage de la teneur globale en glycogène chez C. elegans. Un schéma de l’expérience réalisée ici pour réaliser le dosage de la teneur en glycogène. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Évaluation de la perméabilité intestinale
- Préparation des vers
- Environ 14 h après la synchronisation (étape 1.2.8), transférez de 500 à 1000 vers (étape 1.3.1 et REMARQUE) au premier stade larvaire (L1) dans chaque nouvelle plaque de gélose NGM (60 mm x 15 mm) préalablement préparée et maintenez-les à 20 °C jusqu’au jour de l’essai. Ce calendrier mènera à deux groupes expérimentaux comme suit (Figure 2) :
A- (jeune) : les vers vont se développer sur des plaques de gélose NGM ensemencées avec la bactérie E. coli OP50 jusqu’au stade larvaire 4 (L4) ;
B- (vieux) : les vers vont se développer sur des plaques de gélose NGM ensemencées avec la bactérie E. coli OP50 jusqu’au 7ème jour de l’âge adulte.
REMARQUE : Les vers maintenus jusqu’au 7e jour de l’âge adulte doivent être lavés avec un tampon M9 tous les jours et transférés dans de nouvelles plaques de gélose NGM (60 mm x 15 mm) avec 200 μL de bactéries E. coli OP50 préalablement ensemencées pour le remplacement de la nourriture et l’élimination de la progéniture. Les vers plus jeunes flottent pendant la décantation et peuvent être séparés en éliminant le surnageant. La proportion de vers schtroumpfs augmente avec l’âge. Cependant, l’évaluation de la perméabilité intestinale peut être effectuée à n’importe quel stade et à n’importe quel âge, en fonction de l’objectif de l’étude.
- Environ 14 h après la synchronisation (étape 1.2.8), transférez de 500 à 1000 vers (étape 1.3.1 et REMARQUE) au premier stade larvaire (L1) dans chaque nouvelle plaque de gélose NGM (60 mm x 15 mm) préalablement préparée et maintenez-les à 20 °C jusqu’au jour de l’essai. Ce calendrier mènera à deux groupes expérimentaux comme suit (Figure 2) :
- Exécution du test
- Le jour de l’essai, prélever les vers L4 (2 jours après l’étape 2.1.1) et les vers adultes le 7e jour (maintenant dans leur 9e jour) avec un tampon M9 (tableau supplémentaire 1) et transférer dans des microtubes de 1,5 ml marqués.
- Centrifuger à 1400 x g pendant 3 min, retirer le surnageant, ajouter 1,0 mL de M9 et mélanger délicatement. Répétez ce processus 3 fois pour éliminer les bactéries. Après le dernier lavage, réduisez le volume à 500 μL.
- À l’aide d’une pipette automatique, ajoutez 10 μL de sédiments de vers à une lame de microscope et comptez le nombre de vers. Calculer le volume à pipeter pour obtenir 100 vers/μL.
- Coloration par schtroumpf : préparer une solution de sel disodique d’érioglaucine à 25 % (tableau supplémentaire 1) avec de l’eau distillée. Si nécessaire, utilisez le vortex pour une meilleure solubilisation.
- Dans les nouveaux microtubes précédemment identifiés, à l’aide d’une pipette automatique, ajouter le volume contenant 100 vers, 100 μL de solution de sel disodique d’érioglaucine à 25 %, 200 μL d’E. coli OP50 et compléter avec le tampon M9 pour un volume final de 500 μL.
REMARQUE : Les volumes d’Erioglaucine disodique, d’E. coli et le nombre de vers sont fixes. Le volume du tampon M9 est variable et peut être utilisé pour porter le volume final à 500 μL. - Incuber pendant 3 h avec agitation dans un mélangeur, à l’abri de la lumière, à température ambiante.
REMARQUE : Si un mélangeur n’est pas disponible, secouez soigneusement les microtubes avec vos mains toutes les 15 minutes. - Après 3 h, centrifuger le microtube de 1,5 mL à 1400 x g pendant 3 min. Retirer 1,0 mL de surnageant et laver les vers avec 1,0 mL de tampon M9.
- Répétez les lavages jusqu’à ce que la solution de sel disodique d’érioglaucine restante soit retirée de la solution. Après la dernière étape de lavage, retirez le surnageant, à l’exception d’un résidu d’environ 250 μL. Utilisez-le pour remettre soigneusement les vers en suspension et les traiter pour une analyse microscopique.
- Transférez environ 50 vers de la solution de vers en suspension sur des lames de microscopie et couvrez-les de lamelles. Incuber les lames de microscopie au réfrigérateur à -20 °C pendant 10 min pour paralyser les vers.
REMARQUE : Une autre alternative pour paralyser les vers est d’ajouter 10 μL de solution de chlorhydrate de lévamisole (10 mM ; Tableau supplémentaire 1) et couvrez-les de lamelles. - Observez et comptez le nombre total de vers et les vers totalement teints à l’aide du champ clair d’un stéréomicroscope (à 1,5x). Les images peuvent être obtenues à partir d’un appareil photo de téléphone portable (à 3,4x) couplé à un adaptateur. Pour éviter les erreurs de lumière, de luminosité et d’exposition, il est essentiel que tous les paramètres de l’appareil photo du téléphone portable restent cohérents pour toutes les photos.
- Inspection des données
- Données qualitatives : Obtenir des images au stéréomicroscope de chaque groupe (L4 et 7e jour de l’âge adulte) et comparer visuellement la coloration des vers.
- Comptez le nombre total de vers et le nombre de vers schtroumpfs (vers bleus) à l’aide d’un stéréomicroscope.
- Exprimer les résultats en pourcentage de vers schtroumpfs en comparant les jeunes vers (L4, en groupe témoin) et les vieux vers (7e jour de l’âge adulte) :
A x X = 100 (%) x B
X = 100 x B / A
Où, A = nombre total de vers
B= nombre de vers schtroumpfs

Figure 2 : Schéma du test de perméabilité intestinale globale chez C. elegans. (A) Préparation de C. elegans. (B) Coloration au sel disodique d’érioglaucine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Le dosage de la teneur en glycogène fournit une méthode robuste et rapide pour cribler diverses conditions d’essai, telles que des études comparatives de différentes souches susceptibles d’influencer la synthèse ou la dégradation du glycogène. Dans cette étude, les vers L4 ont été soumis à trois conditions de test distinctes : le jeûne, l’alimentation et les groupes enrichis en glucose. Le test a été effectué trois fois, chaque condition étant reproduite deux fois d...
Discussion
En résumé, ce protocole fournit une évaluation qualitative de la teneur en glycogène chez les vers C. elegans individuels à l’aide de la coloration Lugol : un test simple, robuste et rapide. La coloration Lugol est une approche sans marquage et non invasive qui facilite l’acquisition de données moléculaires à des résolutions subcellulaires, permettant de surveiller les fluctuations de la teneur en glycogène au sein d’un seul ver10. De plus...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
D.S.A prend acte du financement de Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brésil), numéro de subvention #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/Brésil), numéro de subvention, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Code des finances 001 pour N.S.J et A.C.S)
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
Références
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon