A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש בצבעים זולים כדי להמחיש הצטברות גליקוגן ושלמות המעי ב - Caenorhabditis elegans
* These authors contributed equally
In This Article
Summary
הוראת המדעים הביולוגיים יכולה להיות מגרה יותר עבור התלמידים באמצעות שימוש בניסויים. כתב יד זה מציג שני פרוטוקולים שונים אך משלימים שניתן להשתמש בהם בכיתה כדי לעודד תלמידים לנסח ולבדוק השערות הקשורות לתזונה עתירת קלוריות, רעב והזדקנות.
Abstract
Caenorhabditis elegans (C. elegans) היא נמטודה שקופה, לא טפילית עם ביולוגיה פשוטה, מה שהופך אותה לכלי נהדר להוראת מדעי הביולוגיה באמצעות צביעת התאים או התוכן המולקולרי שלהם. צבע לוגול (תמיסת יוד-אשלגן יודיד) נמצא בשימוש נרחב בביוכימיה כדי להכתים מאגרי גליקוגן. בהקשר זה ניתן להבחין בהבדלים בין בעלי חיים מוזנים למורעבים, מלבד ההשפעות של תנאים שונים, כגון דיאטות שונות ורמות חמצן שונות. Erioglaucine הוא צבע כחול המציין את אובדן מחסום המעי. כאשר מחסום המעי שלם, הצבע הכחול מכתים בתוך הלומן; עם זאת, כאשר שלמות זו מופרעת, הצבע דולף לתוך חלל הגוף. באמצעות סטריאומיקרוסקופ או מיקרוסקופ, מורים יכולים להדגים שינויים פיזיולוגיים וביוכימיים, או שהם יכולים לעורר תלמידים לשאול שאלה מדעית ולהעלות השערות ולבחון את ההשערה שלהם באמצעות בדיקות אלה. הפרוטוקול הנוכחי מתאר שתי טכניקות צביעה ב- C. elegans שיכולות להתבצע בקלות על ידי תלמידים.
Introduction
הוראת המדעים הביולוגיים בתיכון היא אתגר מתמשך. יש לציין כי הגישה והשימוש בטכנולוגיה הביאו להתקדמות חשובה בתהליך ההוראה-למידה, אולם כלים כגון צ'טבוטים של בינה מלאכותית מקשים על רציונליזציה וחיפוש ראיות בשל תגובות קלות (ולעיתים שגויות) המתקבלות1. בגלל זה, השימוש בשיטה מדעית עם ניסויים מעשיים בגישה מבוססת חקירה בכיתה היא אסטרטגיה חשובה לפתח או לעורר חשיבה ביקורתית, יצירתיות, ומיומנויות טכניות אצל התלמידים2.
בהקשר זה, הנמטודה החיה החופשית Caenorhabditis elegans שימשה בהצלחה בניסויים למטרות הוראה3 בגלל יתרונותיה המיוחדים: היא אינה טפיל וה - Escherichia coli המשמש להאכלה הוא ברמת בטיחות ביולוגית -1, ולכן מפחית קרוב לאפס את הסיכון הביולוגי; יש לו תנועת תנועה אלגנטית וניתנת לכימות, שמעניינת את התלמידים להתבונן; וזה שקוף, אשר מאפשר תצפית איברים, אלא גם מכתים עם פיגמנטים שיכולים להצביע על נוכחות של biomolecules או התרחשות של שינויים פיזיולוגיים4. לכן, ניתן לשער ולבדוק בכיתה הנחות פשוטות הקשורות לביוכימיה ושינויים פיזיולוגיים כגון הזדקנות.
גליקוגן הוא פחממת אחסון, הנוצרת על ידי שרשרת ארוכה ומסועפת של מולקולות גלוקוז שנוצרו על ידי שאריות גלוקוזיל עם (1→4)-α קשרים ליניאריים גליקוזידים ו (1→6)-α קשרים גליקוזידים בנקודות הסתעפות והוא חשוב במיוחד להתכווצות שרירים, התמיינות תאים ושמירה על גליקמיה5. גליקוגן מסונתז לאחר האכלה עקב הפעלת אינסולין של האנזים גליקוגן סינתאז. במהלך פעילות גופנית או צום, אפינפרין או גלוקגון, בהתאמה, מפעילים גליקוגן פוספורילאז, ולכן, לשבור את פוליסכריד כדי לספק גלוקוז-6-פוספט לתאי השריר או לשחרר גלוקוז חופשי כדי לעקוף היפוגליקמיה 6,7. שינויים ברמות הגליקוגן משפיעים על התמיינות תאים, איתות, ויסות חמצון-חיזור וגבעול במצבים פיזיולוגיים ופתופיזיולוגיים שונים, כולל סרטן8. ב C. elegans, גליקוגן נמצא בעיקר בשרירי הוושט, היפודרמיס, מעי, נוירונים ובעיקר בשרירי דופן הגוף9. ניתן למדוד את תכולת הגליקוגן באמצעות תמיסת יוד של לוגול, שכן יוד נקשר לסלילים הסליליים ויוצר קומפלקס יוד-גליקוגן, מה שנותן צבע כחול-שחור או חום-שחור חד נראה לעין, אשר שימש בהצלחה להדגמת תכולת הגליקוגן ב- C. elegans10. הוכח כי הצטברות גליקוגן הנגרמת על ידי הזנת גלוקוז גבוהה יכולה להפחית את תוחלת החיים של התולעת, ולכן להאיץ את תהליך ההזדקנות11,12. בנוסף, הפרעות מטבוליות, הורמונים אחרים וחשיפה לקסנוביוטיקה יכולים לשנות את חילוף החומרים של הגליקוגן גם כן13,14. לכן, ניסויים על תכולת הגליקוגן ב- C. elegans מעניינים למדי, שכן גורמים מגוונים עשויים להפריע לחילוף החומרים שלו ויכולים לעורר דיון בכיתה על ביוכימיה בסיסית הקשורה לנושאים רוחביים כגון פעילות גופנית, דיאטה, מחלות והזדקנות.
הזדקנות היא ירידה תפקודית תלוית זמן הנגרמת על ידי נזק תאי. נזק זה יכול להיות קשור לעקה חמצונית, שחיקת טלומרים, אובדן פרוטאוסטזיס, דלקת ואפילו על ידי הצטברות של גופים פוליגלוקוזיים בלתי מסיסים15, רק כדי להזכיר כמה. אחד מסימני ההיכר של ההזדקנות הוא הפחתת שלמות המעי, הקשורים למספר מצבים כרוניים המתרחשים במהלך חייו של אורגניזם16. שמירה על הומאוסטזיס המעי תלויה בשלמות אפיתל המעי, אשר נתמך על ידי חלבונים צומת היוצרים מחסום פיזי וחיבור תאי אפיתל סמוכים. כאשר יש נזק אפיתל זה, דליפה של תוכן לומינלי לתוך interstitium מתרחשת17. בהתבסס על מנגנון זה, בדיקת הדרדסים שימשה לאימות שלמות המעי במספר מודלים של בעלי חיים, שכן צבע כחול זה מלח דיסודיום אריוגלאוצין אינו חוצה את קרום המעי, ונותר בלומן18. כאשר תולעים נגועות בפתוגן, מזוהמות עם כמה רעילים או גיל, שינוי שלמות interstitial, הצבע חוצה את המחסום ומתפשט על כל התולעת, אשר הופך להיות כחול כולו. בדיקה זו מאפשרת דיון על הפיזיולוגיה של ההזדקנות והתנסות בגורמים שיכולים להאיץ או לעכב תהליך זה על ידי חשיפת תולעים לתנאים שונים. הפרוטוקולים כאן יתארו בפירוט את שתי השיטות הללו, מבוססות צבע, שניתן לעשות בקלות בכיתה כדי לעורר ולעורר את התלמידים לנסח ולבדוק השערות הקשורות לביוכימיה ופיזיולוגיה.
החלק הראשון של הפרוטוקול מראה את תחולתו לנתח איכותית וכמותית את תכולת הגליקוגן במודל C. elegans 10. מטרת החלק השני של הפרוטוקול היא להעריך את שלמות המעי של C. elegans. טכניקה זו מאפשרת מעקב אחר הזדקנות C. elegans על ידי הערכת שלמות קרומי המעי. יתר על כן, הוא מאפשר להעריך אם חומר מאיץ או מעכב הזדקנות ואם חומרים כלשהם יש פוטנציאל רעיל על מחסום המעי19.
זן C. elegans ששימש במחקר הנוכחי היה מסוג בריסטול N2 פראי. עם זאת, ניתן לשכפל את ההליך באמצעות זנים בעלי שיעורי גדילה דומים, או להתאים את השיטה בהתאם לצורך בהחלפת ציוד, בהתחשב בכך שיש להם תפקיד זהה או דומה, או בהתאם לזן בו נעשה שימוש, שכן לזנים מסוימים יש דרישות תחזוקה ו / או רגישות ספציפיות; ניתן לקבל מידע זה ממרכז Caenorhabditis Genetics Center (CGC) או מאתר WormBase. שינויים אלה לא אמורים להשפיע על יכולת השחזור של השיטה.
Protocol
הערה: ניתן להשיג חיידקי Escherichia coli OP50 (E. coli OP50) וזני בר מסוג Bristol N2 מ-CGC, אוניברסיטת מינסוטה, ארה"ב או מתרומה ממעבדת C. elegans . למען בטיחות החוקרים, חובה להשתמש בציוד מגן אישי. למרות שהריכוזים של ריאגנטים כמו היפוכלוריט ונתרן הידרוקסידי נמוכים, חיוני ללבוש את ה- PPE המומלץ, כפי שמודגש בכתב היד, כדי למזער את כל הסיכונים הפוטנציאליים הקשורים לכימיקלים אלה.
1. תכולת הגליקוגן
- הכנת לוחיות בדיקה
- הכינו שש פלטות אגר NGM בגודל 60 מ"מ x 15 מ"מ20 (10 מ"ל של אגר מדיה לגידול נמטודות, NGM, כמתואר בטבלה משלימה 1) לכל זן תולעת ואפשרו להן להתייבש במשך יום אחד בטמפרטורת החדר. שמור את הצלחות סגורות כדי למנוע זיהום.
- הוסף 200 μL של תרבית נוזלית E. coli OP50 (עם צפיפות אופטית = 0.600, בערך באורך גל של 600 ננומטר) לכל צלחת כדי לחסן בסך הכל ארבעה לוחות NGM בגודל 60 מ"מ x 15 מ"מ לכל זן במכסה המנוע של הזרימה. יש לדגור על הצלחות הסגורות בטמפרטורה של 37°C למשך יום אחד לפני השימוש.
הערה: הכינו שש צלחות (שלב 1.1) אך חסנו רק 4 בחיידקי E. coli OP50. שמרו את שתי הצלחות הנותרות בטמפרטורה של 4°C לשימוש מאוחר יותר בעת הנחת התולעים בתנאי רעב. ניתוח זה עשוי להתבצע כפול. - ביום הבדיקה, הוסף 200 μL של 0.025 M D-גלוקוז לשתי (6 מ"מ x 15 מ"מ) צלחות אגר NGM לכל זן שנזרעו בעבר עם חיידקי E. coli OP50. הניחו לצלחות להתייבש בטמפרטורת החדר במכסה המנוע.
הערה: ניתן גם לייבש את צלחות האגר NGM המכילות חיידקי E. coli OP50 בסמוך למנורות אלכוהול כחלופה לשימוש במכסה מנוע.
- סנכרון
- כ-3 ימים לפני הסנכרון, מעבירים 3-4 גושים (3X3 ס"מ) מאגר NGM תחזוקה עם C. elegans Bristol N2 (סוג בר) בשלבים שונים (כ-500 תולעים לכל נתח) לצלחת חדשה (150 מ"מ x 90 מ"מ) שנזרעה בעבר עם חיידקי E. coli OP50.
- מניחים את הצלחת החדשה עם התולעים בסביבה מבוקרת בטמפרטורה של 20 מעלות צלזיוס ושומרים על לחות >95% למשך 3 ימים (72 שעות מאפשרות לרוב התולעים להגיע לשלב הבוגר הגרביד).
הערה: ייתכן שיהיה צורך לכוונן את טמפרטורת הגידול בהתאם לזני C. elegans הנמצאים בשימוש. - באמצעות פיפטה פסטר, לאסוף את התולעים מן הצלחת מוכן עם מזוקק H2O ולהעביר אותם צינור צנטריפוגה 50 מ"ל.
- המתן לשקיעת התולעים על ידי כוח הכבידה (כ -15 דקות) ולאחר מכן להסיר את supernatant. חזור על תהליך זה 3x כדי לחסל את החיידקים. לאחר הכביסה האחרונה, להפחית את נפח ל 5 מ"ל.
- מוסיפים 10 מ"ל של תמיסת הלבנה (טבלה משלימה 1) ומנערים נמרצות בעזרת הידיים במשך כ-6 דקות.
- מיד לאחר השלמת הרעידה, מלא את הצינורות לקיבולת של 50 מ"ל עם מאגר M9.
- צנטריפוגה ב 1400 x גרם במשך 3 דקות, להסיר את supernatant עד 5 מ"ל ולאחר מכן להוסיף 45 מ"ל של חיץ M9 שוב. חזור על תהליך זה 4x.
- לאחר השטיפה האחרונה, הפחיתו את הנפח ל-15 מ"ל ושמרו עליו בטמפרטורה מבוקרת (20°C) ובלחות (>95%) למשך כ-14 שעות.
הערה: ניתן להחליף את תהליך הסנכרון על ידי קבלת ביציות באמצעות ביציות: העבירו כ-20 תולעים הרות בוגרות לצלחת NGM (6 מ"מ x 15 מ"מ) שנזרעה בעבר עם 200 μL של E. coli OP50. אפשר לתולעים להטיל ביצים במשך יום אחד. לאחר מכן, להסיר את התולעים ההרות ולחכות ביצים לבקוע.
- הכנת תולעים
- באמצעות פיפטה אוטומטית להוסיף 10 μL של התולעים המסונכרנות (שלב 1.2.8) לשקופית מיקרוסקופ ולספור את מספר התולעים. חשב כמה נפח צריך להיות pipeted כדי לקבל 500-1000 תולעים / μL.
- מעבירים 500-1000 תולעים מסונכרנות L1 (שלב 1.2.8) לצלחות אגר NGM (150 מ"מ x 90 מ"מ, טבלה משלימה 1) שנזרעו עם חיידקי E. coli OP50 כמקור מזון, עד שהם מגיעים לשלב 4 (L4) של הזחלים ב-20°C.
הערה: ניתן להעביר תולעים באמצעות פיפטה אוטומטית. אם פיפטה אוטומטית אינה זמינה, השתמש בפיפטת פסטר זכוכית, וניתן לשלוט בנפחים באמצעות תוויות מיקרו-צינור או פיפטות מדורגות זכוכית. - לאחר 48 שעות של סנכרון20: אספו את זחלי L4 מהלוחות בעזרת חיץ M9 (טבלה משלימה 1), בעזרת פיפטת פסטר מפלסטיק לצינור חרוטי נקי 50 מ"ל ושטפו אותם 3x עם חיץ M9 טרי או חזרו על השטיפות עד שכל חיידקי E. coli OP50 הנותרים יוסרו לחלוטין (בטמפרטורת החדר).
הערה: שלב הכביסה חשוב מכיוון שתולעים מסוימות יחוו רעב במהלך ההליך.
- הפעלת הבדיקה
- העבר 500-1000 תולעי L4 (שלב 1.3.1) מכל אחד מלוחות אגר NGM החדשים (60 מ"מ x 15 מ"מ) שהוכנו בעבר (שלבים 1.1.2 ו- 1.1.3). שמור אותם ב 20 ° C במשך 48 שעות עד יום הבדיקה. לוח זמנים זה יביא לשלוש קבוצות ניסוי כדלקמן, בכפילות (איור 1):
A- (רעב): תולעים יגדלו על צלחות אגר NGM רגילות ללא חיידקי E. coli OP50;
B- (רגיל): תולעים יגדלו על צלחות אגר NGM רגילות שנזרעו עם חיידקי E. coli OP50;
C- (גלוקוז גבוה): תולעים יגדלו על צלחות אגר NGM שנזרעו עם חיידקי E. coli OP50 ומכילים 0.025 M D-גלוקוז. - ביום הבדיקה (לאחר 48 שעות): אספו את התולעים ובצעו שלוש שטיפות קצרות במאגר M9 (שלבים 1.2.2 ו-1.2.3)
הערה: כאן, הכינו צלחות אגר NGM בתוספת D-גלוקוז (שלב 1.3) והניחו אותן בצד עד שהגיע הזמן להוסיף את התולעים.- צביעת יוד: הכינו תמיסת יוד 5% (v/v) של לוגול (תמיסת יוד/אשלגן יודי) באמצעות חיץ M9 טרי.
הערה: ניתן להשיג את תמיסת היוד של לוגול מספקי ריאגנטים מקומיים או מבתי מרקחת, ולכן הריכוז הראשוני עשוי להשתנות. במידת הצורך, חשב כדי לקבל פתרון של 5% (v/v).
- צביעת יוד: הכינו תמיסת יוד 5% (v/v) של לוגול (תמיסת יוד/אשלגן יודי) באמצעות חיץ M9 טרי.
- העבירו כ-100 מיקרוליטר של תולעים שטופות (שלב 4.2) מכל קבוצה למיקרו-צינור בנפח 1.5 מ"ל המכיל תמיסת לוגול מדוללת (5% v/v). שימוש בפיפט אוטומטי ביחס של 1:5 מעביר 100 מיקרוליטר תולעים ל-400 מיקרוליטר תמיסת לוגול, ולאחר מכן תסיסה עדינה במיקסר למשך 5 דקות.
הערה: אם מיקסר אינו זמין, ניתן לנער את המיקרו-צינורות בזהירות בידיים. - מיד לאחר 5 דקות אלה, צנטריפוגו את microtube 1.5 מ"ל (תולעים + תמיסת Lugol) ב 1400 x גרם במשך 3 דקות.
הערה: אם בדיקה זו מבוצעת על תולעים משלב L4 ואילך, ניתן להשיג שקיעת כבידה במקום להשתמש בצנטריפוגה. השאירו את המיקרו-צינוריות פתוחות במתלים על הספסל למשך 10 דקות עד שכל התולעים התיישבו בתחתית המיקרו-צינור. - הסר את supernatant ולשטוף את התולעים עם 1.0 מ"ל של חיץ M9 טרי. חזור על הכביסה עד שכל שאריות היוד יוסרו מהתמיסה (מינימום 3x).
- לאחר שלב השטיפה האחרון, הסירו את הסופרנאטנט למעט שאריות של כ-100 מיקרוליטר. השתמשו בו כדי להשהות מחדש בעדינות את התולעים ולאנליזה מיקרוסקופית.
- מעבירים כ-50 מיקרוליטר מתמיסת התולעת המרחפת לשקופיות מיקרוסקופיה ומכסים אותן בפתקי כיסוי. התבונן בתמונות השדה הבהיר באמצעות סטריאומיקרוסקופ (פי 1.5).
הערה: אם סטריאומיקרוסקופ אינו זמין, ניתן להשתמש במיקרוסקופ רגיל, וניתן לצלם תמונות באמצעות מצלמת טלפון סלולרי (ברזולוציה של 3.4x) באמצעות מתאם. כדי למנוע שגיאות של אור/בהירות/חשיפה, חיוני שכל הגדרות המצלמה בטלפון הסלולרי יישארו עקביות עבור כל התמונות.
- העבר 500-1000 תולעי L4 (שלב 1.3.1) מכל אחד מלוחות אגר NGM החדשים (60 מ"מ x 15 מ"מ) שהוכנו בעבר (שלבים 1.1.2 ו- 1.1.3). שמור אותם ב 20 ° C במשך 48 שעות עד יום הבדיקה. לוח זמנים זה יביא לשלוש קבוצות ניסוי כדלקמן, בכפילות (איור 1):
- בדיקת נתונים
- נתונים כמותיים: חישוב תכולת הגליקוגן בהתבסס על צביעת יוד של תולעים.
- שמור תמונות מסטריאומיקרוסקופ המכיל לפחות 10 תולעים לכל קבוצה כקובץ .jpeg לעיבוד נוסף. הורד את תוכנת ImageJ בחינם כדי לעשות זאת. הפרטים מופיעים בקובץ משלים 1, תרשים משלים 1, תרשים משלים 2.
- פתח את תמונת .jpeg באמצעות תוכנת ImageJ (אותה ניתן להוריד בחינם https://imagej.nih.gov/ij/download.html). לחץ על קו מקוטע ומתאר את התולעת (תולעת אחת בכל פעם). לחץ על נתח ולאחר מכן בחר מדידה כדי לקבל את כימות הכתם. הנתונים יוצגו כממוצע בטבלה. ממוצע מציין את הנתונים המחושבים מצפיפות הצביעה לכל אזור תולעת.
- נתונים איכותיים: קבל תמונות מהסטריאומיקרוסקופ של כל קבוצה והשווה חזותית את צביעת התולעים. צור מערכת ניקוד, במידת הצורך, כדי לנתח את הצביעה: 0 חסר צבע; 1 מוכתם קלות; 2 מוכתמים ו-3 מוכתמים בכבדות. באמצעות הסטריאומיקרוסקופ, ספור ידנית כ -10 תולעים לכל קבוצה (מינימום) עם מונה יד.
- נתונים כמותיים: חישוב תכולת הגליקוגן בהתבסס על צביעת יוד של תולעים.
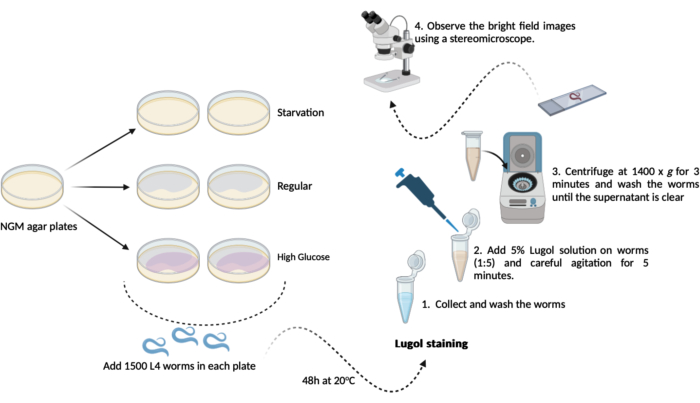
איור 1: סכמת תכולת הגליקוגן הכוללת ב-C. elegans. סכמטי של הניסוי שבוצע כאן לביצוע בדיקת תכולת הגליקוגן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הערכת חדירות המעי
- הכנת תולעים
- כ-14 שעות לאחר הסנכרון (שלב 1.2.8), העבירו 500-1000 תולעים (שלב 1.3.1 ו-NOTE) בשלב הזחל הראשון (L1) לכל צלחת אגר NGM חדשה (60 מ"מ x 15 מ"מ) שהוכנה קודם לכן ושמרו אותן בטמפרטורה של 20°C עד ליום הבדיקה. לוח זמנים זה יוביל לשתי קבוצות ניסוי כדלקמן (איור 2):
A- (צעיר): תולעים יגדלו על צלחות אגר NGM שנזרעו עם החיידק E. coli OP50 עד שלב הזחל 4 (L4);
B- (ישן): התולעים יגדלו על צלחות אגר NGM שנזרעו עם החיידק E. coli OP50 עד היוםהשביעי לבגרות.
הערה: יש לשטוף את התולעים המוחזקות עד היוםהשביעי לבגרות עם חיץ M9 מדי יום ולהעבירן לצלחות אגר NGM חדשות (60 מ"מ x 15 מ"מ) עם 200 μL של חיידקי E. coli OP50 שנזרעו בעבר לצורך החלפת מזון והסרת הצאצאים. תולעים צעירות יותר צפות במהלך הקנטה, וניתן להפריד ביניהן על ידי הסרת סופרנטנט. שיעור תולעי הדרדסים עולה עם הגיל. עם זאת, הערכה של חדירות המעי יכולה להתבצע בכל שלב וגיל, בהתאם למטרת המחקר.
- כ-14 שעות לאחר הסנכרון (שלב 1.2.8), העבירו 500-1000 תולעים (שלב 1.3.1 ו-NOTE) בשלב הזחל הראשון (L1) לכל צלחת אגר NGM חדשה (60 מ"מ x 15 מ"מ) שהוכנה קודם לכן ושמרו אותן בטמפרטורה של 20°C עד ליום הבדיקה. לוח זמנים זה יוביל לשתי קבוצות ניסוי כדלקמן (איור 2):
- הפעלת הבדיקה
- ביום הבדיקה, אספו תולעי L4 (יומיים לאחר שלב 2.1.1) ותולעי בגרות ביוםהשביעי (כעת ביוםהתשיעי לחייהם) עם חיץ M9 (טבלה משלימה 1) והעבירו למיקרו-צינוריות מסומנות של 1.5 מ"ל.
- צנטריפוגה ב 1400 x גרם במשך 3 דקות, להסיר את supernatant, להוסיף 1.0 מ"ל של M9, ומערבבים בעדינות. חזור על תהליך זה 3x כדי להסיר את החיידקים. לאחר הכביסה האחרונה, להפחית את נפח ל 500 μL.
- באמצעות פיפטה אוטומטית, להוסיף 10 μL של משקעי התולעת לשקופית מיקרוסקופ ולספור את מספר התולעים. חשב את נפח להיות pipeted כדי לקבל 100 תולעים/μL.
- צביעת דרדסים: הכינו תמיסת מלח דיסודיום אריוגלאוצין 25% (טבלה משלימה 1) במים מזוקקים. במידת הצורך, השתמש במערבולת למסיסות טובה יותר.
- במיקרו-צינוריות חדשות שזוהו בעבר, באמצעות פיפטה אוטומטית, הוסף את הנפח המכיל 100 תולעים, 100 μL של תמיסת מלח דיסודיום אריוגלאוצין 25%, 200 μL של E. coli OP50 והשלם עם חיץ M9 לנפח סופי של 500 μL.
הערה: הכרכים של Erioglaucine disodium, E. coli ומספר התולעים קבועים. נפח מאגר M9 משתנה וניתן להשתמש בו כדי להביא את הנפח הסופי ל -500 μL. - דוגרים במשך 3 שעות עם תסיסה במיקסר, מוגן מפני אור, בטמפרטורת החדר.
הערה: אם מיקסר אינו זמין, נערו את המיקרו-צינוריות בזהירות עם הידיים כל 15 דקות. - לאחר 3 שעות, צנטריפוגו את מיקרו-צינור 1.5 מ"ל ב 1400 x גרם למשך 3 דקות. הסר 1.0 מ"ל של supernatant ושטוף את התולעים עם 1.0 מ"ל של חיץ M9.
- יש לחזור על השטיפות עד להסרת תמיסת מלח הדיסודיום אריוגלאוצין הנותרת מהתמיסה. לאחר שלב השטיפה האחרון, הסירו את הסופרנאטנט למעט שאריות של כ-250 מיקרוליטר. השתמשו בו כדי להשהות מחדש בזהירות תולעים ולעבד אותן לניתוח מיקרוסקופי.
- העבירו כ-50 תולעים של תמיסת תולעת תלויה לשקופיות מיקרוסקופיה וכסו אותן בפתקי כיסוי. דוגרים על שקופיות המיקרוסקופ במקרר בטמפרטורה של -20 מעלות צלזיוס למשך 10 דקות כדי לשתק את התולעים.
הערה: חלופה נוספת לשיתוק התולעים היא להוסיף 10 μL של תמיסת הידרוכלוריד Levamisole (10 mM ; טבלה משלימה 1) וכסו אותם בפתקי כיסוי. - התבוננו וספרו את המספר הכולל של התולעים והתולעים הצבועות לחלוטין באמצעות השדה הבהיר במיקרוסקופ סטריאוסקופי (פי 1.5). ניתן לקבל תמונות ממצלמת טלפון סלולרי (ב 3.4x) יחד עם מתאם. כדי למנוע שגיאות של אור/בהירות/חשיפה, חיוני שכל הגדרות המצלמה בטלפון הסלולרי יישארו עקביות עבור כל התמונות.
- בדיקת נתונים
- נתונים איכותיים: קבל תמונות מסטריאומיקרוסקופ של כל קבוצה (L4ויום 7 לבגרות) והשווה חזותית את צביעת התולעים.
- ספרו את המספר הכולל של התולעים ואת מספר תולעי הדרדסים (תולעים כחולות) באמצעות סטריאומיקרוסקופ.
- ביטוי לתוצאות כאחוז תולעי הדרדסים על ידי השוואת התולעים הצעירות (L4, כקבוצת ביקורת) והתולעים הזקנות(היום השביעי לבגרות):
A x X = 100 (%) x B
X = 100 x B / A
כאשר, A = המספר הכולל של תולעים
B = מספר תולעי הדרדסים

איור 2: סכמת בדיקת חדירות מעיים כוללת ב- C. elegans. (א) הכנת ג. אלגנס . (B) צביעה במלח דיסודיום אריוגלאוצין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
בדיקת תכולת הגליקוגן מספקת שיטה חזקה ומהירה לסינון תנאי בדיקה שונים, כגון מחקרים השוואתיים של זנים שונים שעשויים להשפיע על סינתזת הגליקוגן או פירוקו. במחקר זה, תולעי L4 עברו שלושה תנאי בדיקה שונים: צום, האכלה וקבוצות מועשרות בגלוקוז. הבדיקה בוצעה שלוש פעמים, כאשר כל תנאי ש...
Discussion
לסיכום, פרוטוקול זה מספק הערכה איכותית של תכולת הגליקוגן בתולעי C. elegans בודדות באמצעות צביעת לוגול: בדיקה פשוטה, חזקה ומהירה. צביעת לוגול היא גישה נטולת תוויות ולא פולשנית המאפשרת רכישת נתונים מולקולריים ברזולוציות תת-תאיות, ומאפשרת ניטור תנודות בתכולת הגליקוגן בתו?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
D.S.A מכירה במימון מ- Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brazil), מספר מענק #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/Brazil), מספר מענק, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, קוד מימון 001 עבור N.S.J ו- A.C.S)
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
References
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved