このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
低コストの染料を使用して、線虫のグリコーゲン蓄積と腸の完全性を視覚化する
要約
生物科学を教えることは、実験を使用することで、学生にとってより刺激的なものにすることができます。この原稿は、高カロリー食、飢餓、老化に関連する仮説を立ててテストするように学生を奨励するために、教室で利用できる2つの異なる、しかし補完的なプロトコルを提示します。
要約
Caenorhabditis elegans(C.エレガンス) は、透明な非寄生性線虫で、単純な生物学を備えているため、細胞またはその分子含有量の染色を通じて生物科学を教えるのに最適なツールになります。ルゴール染料(ヨウ素-ヨウ化カリウム溶液)は、グリコーゲン貯蔵を染色するために生化学で広く使用されています。これに関連して、異なる食事や酸素レベルなどの異なる条件の影響に加えて、給餌された動物と飢餓状態の動物の違いを観察することが可能です。エリオグラウシンは、腸のバリアの喪失を示す青色の染料です。腸のバリアが損なわれていない場合、青い染料は内腔の内側に染みます。しかし、この完全性が損なわれると、染料は体腔内に漏れ出します。実体顕微鏡や顕微鏡を使用して、教師は生理学的および生化学的変化を実証したり、生徒に科学的な質問をするように促したり、これらのアッセイを使用して仮説を立てて仮説を立てたりテストしたりできます。本プロトコルは、学生が容易に実施できる C.エレガンス における2つの染色技術を記載している。
概要
高校での生物科学の教育は、絶え間ない課題です。特に、テクノロジーへのアクセスと使用は、教育学習プロセスに重要な進歩をもたらしましたが、人工知能チャットボットなどのツールは、簡単に(そして時には正しくない)応答が得られるため、合理化と証拠の検索をより困難にします1。そのため、教室での探究型アプローチで実践的な実験を伴う科学的方法を使用することは、学生の批判的思考、創造性、および技術的スキルを開発または刺激するための重要な戦略です2。
この文脈では、自由生活線虫 Caenorhabditis elegans は、その特定の利点のために、教育目的の実験 で成功裏に使用されてきました3:それは寄生虫ではなく、摂食に使用される 大腸菌 はバイオセーフティレベル1であるため、生物学的危険性をほぼゼロに減らします。エレガントで定量化可能な移動運動があり、学生が観察するのは興味深いものです。また、透明であるため、臓器の観察が可能になるだけでなく、生体分子の存在や生理学的変化の発生を示すことができる色素で染色することもできます4。したがって、生化学や老化などの生理学的変化に関連する簡単な仮定を教室で仮定し、検証することが可能です。
グリコーゲンは、グルコシル残基によって形成されるグルコース分子の長い分岐鎖によって形成される貯蔵炭水化物であり、(1→4)-αグリコシドの線形結合と分岐点での(1→6)-αグリコシド結合により形成され、筋肉の収縮、細胞分化、および血糖維持に特に重要です5。グリコーゲンは、酵素グリコーゲン合成酵素のインスリン活性化により、摂食後に合成されます。運動中または空腹時、エピネフリンまたはグルカゴンはそれぞれグリコーゲンホスホリラーゼを活性化し、したがって、多糖類を分解して筋肉細胞にグルコース-6-リン酸を提供するか、遊離グルコースを放出して低血糖を回避します6,7。グリコーゲンレベルの変化は、がんを含むさまざまな生理学的および病態生理学的条件下で、細胞の分化、シグナル伝達、酸化還元調節、および幹細胞性に影響を与えます8。 C.エレガンスでは、グリコーゲンは主に食道筋、皮下組織、腸、ニューロン、そして主に体壁の筋肉に見られます9。グリコーゲン含有量は、ヨウ素がらせん状のコイルに結合してヨウ素-グリコーゲン複合体を形成するため、ルゴールのヨウ素溶液を使用して測定でき、目に見えるシャープな青黒色または茶黒色になり、これはC.エレガンス10のグリコーゲン含有量を示すために成功裏に使用されています。高グルコース摂食によって引き起こされるグリコーゲン蓄積は、線虫の寿命を縮め、したがって老化プロセスを加速させる可能性があることが実証されています11,12。さらに、代謝障害、他のホルモン、および生体異物への曝露もグリコーゲン代謝を変化させる可能性があります13,14。したがって、C.エレガンスのグリコーゲン含有量に関する実験は、さまざまな要因がその代謝を乱し、運動、食事、病気、老化などの横断的なテーマに関連する基本的な生化学に関するクラス内の議論を刺激する可能性があるため、非常に興味深いものです。
老化は、細胞の損傷によって引き起こされる時間依存的な機能低下です。この損傷は、酸化ストレス、テロメアの消耗、タンパク質静止の喪失、炎症、さらには不溶性ポリグルコサン体の蓄積などに関連している可能性があります15。老化の特徴の一つは、生物の生涯に起こるいくつかの慢性疾患に関連する腸の完全性の低下である16。腸の恒常性の維持は、腸上皮の完全性に依存しており、腸上皮は、物理的障壁を形成し、隣接する上皮細胞を接続する結合タンパク質によって支えられています。この上皮に損傷があると、間質への管腔内容物の漏れが起こります17。このメカニズムに基づいて、スマーフ試験は、この青色染料エリオグラウシン二ナトリウム塩が腸膜を通過せず、内腔18に留まるため、いくつかの動物モデルにおける腸の完全性を検証するために使用されてきた。ワームが病原体に感染したり、毒物で汚染されたり、老化したりして間質の完全性が変化すると、染料はバリアを通過してワーム全体に広がり、ワーム全体が青色になります。このアッセイでは、老化の生理学についての議論や、線虫をさまざまな条件にさらすことでこのプロセスを加速または遅延させる要因についての実験が可能になります。ここでのプロトコルでは、生化学と生理学に関連する仮説を立ててテストするように学生を刺激し、刺激するためにクラスで簡単に実行できるこれら2つの染料ベースの方法について詳しく説明します。
プロトコールの最初の部分は、C.エレガンスモデル10のグリコーゲン含有量を定性的および定量的に分析するための適用性を示しています。プロトコルの第 2 部の目的は、C. elegans 腸の完全性を評価することです。この技術により、腸膜の完全性を評価することにより、C.エレガンスの老化をモニタリングすることができます。さらに、それは、物質が老化を加速または遅延させるかどうか、および任意の物質が腸バリア19に毒性の潜在性を有するかどうかを評価することを可能にする。
本研究に用いた C.エレガンス 株は、ブリストルN2野生型であった。ただし、手順は、同等の成長率を示す菌株を使用して再現することも、機器の交換の必要性に基づいて方法を調整する必要があります。それらは同じまたは類似の機能を持っていることを考慮し、または使用する菌株に応じて、特定の菌株には特定のメンテナンスおよび/または感度要件があるためです。この情報は、 Caenorhabditis Genetics Center(CGC)またはWormBaseのWebサイトから入手できます。これらの変更が分析法の再現性に影響を与えることはありません。
プロトコル
注: 大腸菌 OP50(E.coliOP50 )細菌およびブリストルN2野生型株は、米国ミネソタ大学のCGCから、または C.エレガンス 研究所からの寄付から入手できます。研究者の安全のためには、個人用保護具の使用が不可欠です。次亜塩素酸塩や水酸化ナトリウムなどの試薬の濃度は低いですが、これらの化学物質に関連する潜在的なリスクを最小限に抑えるために、原稿で強調されているように、推奨されるPPEを着用することが不可欠です。
1.グリコーゲン含有量
- テストプレートの準備
- 線虫株ごとに60 mm x 15 mmのNGM寒天プレート20( 補足表1に記載の線虫増殖培地寒天培地10 mL、NGM)を6枚調製し、室温で1日間乾燥させます。汚染を防ぐためにプレートを閉じたままにしてください。
- プレートあたり200 μLの 大腸菌 OP50液体培養液(光学濃度=0.600、波長約600 nm)を加えて、フローフード内の菌株あたり合計4枚のNGMプレートを接種します。閉じたプレートを37°Cで1日間インキュベートしてから使用してください。
注:6つのプレート(ステップ1.1)を準備しますが、 大腸菌 OP50細菌は4つだけに接種します。残りの2つのプレートは、後でワームを飢餓状態に置くときに使用するために4°Cで予約します。この分析は重複して実行できます。 - 試験日には、以前に 大腸菌 OP50細菌を播種した菌株ごとに2つの(6 mm x 15 mm)NGM寒天プレートに200 μLの0.025 M D-Glucoseを加えます。プレートをフローフード内で室温で乾燥させます。
注: 大腸菌 OP50細菌を播種したNGM寒天プレートは、フローフードを使用する代わりに、アルコールランプの近くで乾燥させることもできます。
- 同期
- 同期の約3日前に、 C. elegans Bristol N2(野生型)をさまざまな段階(チャンクあたり約500匹)で培養したメンテナンスNGM寒天培地から3〜4チャンク(3 cm x 3cm)を、以前に 大腸菌 OP50細菌を播種した新しいプレート(150 mm x 90 mm)に移します。
- 新しいプレートをワームと一緒に20°Cの制御された環境に置き、湿度>95%を3日間維持します(72時間でほとんどのワームが妊娠した成虫の段階に達するまで待ちます)。
注:成長温度は、使用されている C.エレガンス 株(複数可)に応じて調整する必要がある場合があります。 - パスツールピペットを使用して、蒸留H2Oで調製したプレートから線虫を回収し、50 mLの遠心チューブに移します。
- 重力によるワームの沈降を待ち(約15分)、上清を取り除きます。このプロセスを3回繰り返して、バクテリアを排除します。最後の洗浄後、容量を5mLに減らします。
- 漂白液 10mL(別表1)を加え、手で約6分間激しく振る。
- 振とうが完了した直後に、M9バッファーをチューブの容量50mLまで満たします。
- 1400 x g で3分間遠心分離し、上清を5 mLまで除去し、45 mLのM9バッファーを再度加えます。このプロセスを4回繰り返します。
- 最後の洗浄後、容量を15 mLに減らし、制御された温度(20 °C)と湿度(>95%)で約14時間維持します。
注:同期プロセスは、産卵を通じて卵子を得ることによって置き換えることができます:約20匹の成虫の妊娠虫を、以前に200μLの 大腸菌 OP50を播種したNGMプレート(6 mm x 15 mm)に移します。ワームが1日間卵を産むのを待ちます。その後、妊娠中のワームを取り除き、卵が孵化するのを待ちます。
- ワームの準備
- 自動ピペットを使用して、10 μLの同期ワーム(ステップ1.2.8)を顕微鏡スライドに加え、ワームの数をカウントします。500-1000 worms/μLを得るためにピペッティングする必要がある容量を計算します。
- 500-1000 L1同期線虫(ステップ1.2.8)を、大腸菌OP50細菌を食物源として播種したNGM寒天プレート(150 mm x 90 mm、補足表1)に移し、20°Cで幼虫ステージ4(L4)に到達するまで移します。
注:ワームは自動ピペットを使用して移すことができます。自動ピペットが利用できない場合は、ガラス製パスツールピペットを使用し、マイクロチューブラベルまたはガラス目盛りピペットを使用して容量を制御できます。 - 同期20の48時間後:プラスチック製のパスツールピペットを使用して、M9バッファー(補足表1)を含むプレートからL4幼虫を回収し、プラスチック製のパスツールピペットを使用して清潔な円錐管50 mLにし、新鮮なM9バッファーで3回洗浄するか、残りのすべての 大腸菌 OP50細菌が完全に除去されるまで洗浄を繰り返します(室温)。
注意: 一部のワームは手順中に飢餓を経験するため、洗浄ステップは重要です。
- アッセイの実行
- 500-1000 L4 ワーム(ステップ 1.3.1)を、以前に調製した新しい NGM 寒天プレート(60 mm x 15 mm)のそれぞれから移します(ステップ 1.1.2 および 1.1.3)。試験日まで20°Cで48時間保管します。このスケジュールにより、次のような3つの実験グループが重複して作成されます(図1)。
A-(飢餓):ワームは 、大腸菌 OP50細菌を含まない通常のNGM寒天プレートで増殖します。
B-(レギュラー):ワームは 、大腸菌 OP50バクテリアを播種した通常のNGM寒天プレートで増殖します。
C-(高グルコース):大 腸菌 OP50細菌を播種し、0.025 M D-グルコースを含むNGM寒天プレート上でワームが増殖します。 - テスト当日(48時間後):ワームを収集し、M9バッファーで3回短時間洗浄します(ステップ1.2.2および1.2.3)
注:ここでは、D-グルコースを添加したNGM寒天プレートを調製し(ステップ1.3)、ワームを追加するまで脇に置いておきます。- ヨウ素染色:新鮮なM9バッファーを使用して、5%(v / v)ルゴールのヨウ素溶液(ヨウ素/ヨウ化カリウム溶液)を調製します。
注:ルゴールのヨウ素溶液は、地元の試薬供給業者または薬局から入手できるため、初期濃度は異なる場合があります。必要に応じて、5%(v / v)の溶液が得られるように計算します。
- ヨウ素染色:新鮮なM9バッファーを使用して、5%(v / v)ルゴールのヨウ素溶液(ヨウ素/ヨウ化カリウム溶液)を調製します。
- 各グループから約100 μLの洗浄済み線虫(ステップ4.2)を、希釈したルゴール溶液(5% v / v)を含む1.5 mLマイクロチューブに移します。自動ピペットを1:5の割合で100μLのワームを400μLのルゴール溶液に移し、続いてミキサーで5分間穏やかに攪拌します。
注意: ミキサーが利用できない場合は、手でマイクロチューブを慎重に振ることができます。 - この5分間の直後に、1.5 mLマイクロチューブ(線虫+ルゴール溶液)を1400 x g で3分間遠心分離します。
注:このアッセイをL4ステージ以降の線虫に対して実施すると、遠心分離機を使用する代わりに重力沈降を達成することができます。すべてのワームがマイクロチューブの底に落ち着くまで、マイクロチューブをベンチトップのラックに10分間開いたままにします。 - 上清を取り除き、1.0 mLの新鮮なM9バッファーで線虫を洗います。残りのヨウ素がすべて溶液から除去されるまで(最低3回)、洗浄を繰り返します。
- 最後の洗浄ステップの後、約100μLの残留物を除いて上清を取り除きます。これを使用して、ワームを穏やかに再懸濁し、顕微鏡分析を行います。
- 再懸濁したワーム溶液約50μLを顕微鏡スライドに移し、カバースリップで覆います。実体顕微鏡(1.5倍)で明視野像を観察します。
注意: 実体顕微鏡が利用できない場合は、通常の顕微鏡を使用でき、アダプターを使用して携帯電話のカメラ(3.4倍)で画像をキャプチャできます。光/明るさ/露出によるエラーを防ぐためには、すべての写真ですべての携帯電話のカメラ設定を一貫していることが重要です。
- 500-1000 L4 ワーム(ステップ 1.3.1)を、以前に調製した新しい NGM 寒天プレート(60 mm x 15 mm)のそれぞれから移します(ステップ 1.1.2 および 1.1.3)。試験日まで20°Cで48時間保管します。このスケジュールにより、次のような3つの実験グループが重複して作成されます(図1)。
- データ検査
- 定量データ:線虫のヨウ素染色に基づいてグリコーゲン含有量を計算します。
- グループごとに最低10匹の線虫を含む実体顕微鏡からの画像を.jpegファイルとして保存し、さらに処理することができます。これを行うには、無料のImageJソフトウェアをダウンロードしてください。詳細は、 補足ファイル1、補足図1、補足図2に記載されています。
- ImageJソフトウェア(https://imagej.nih.gov/ij/download.html から無料でダウンロード可能)を使用して.jpegイメージを開きます。[セグメント化された線 ] をクリックし、ワームの輪郭を描きます (一度に 1 つのワーム)。 「Analyze」をクリックし、「 Measure 」を選択して染色の定量化を行います。データはテーブルに平均として表示されます。平均は、寄生虫面積あたりの染色密度から計算されたデータを示します。
- 定性的データ:各グループの実体顕微鏡から画像を取得し、線虫の染色を視覚的に比較します。必要に応じて、染色を分析するためのスコアリングシステムを作成します:0無色;1つは軽く汚れています。2人は汚れており、3人はひどく汚れています。実体顕微鏡を使用して、ハンドカウンターでグループあたり約10匹(最小)の線虫を手動で数えます。
- 定量データ:線虫のヨウ素染色に基づいてグリコーゲン含有量を計算します。
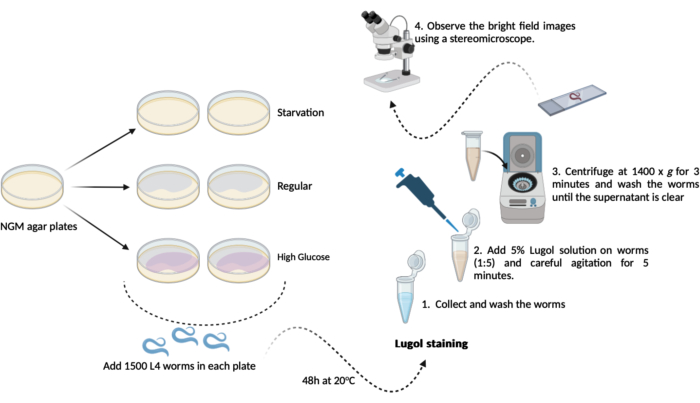
図1: C.エレガンスにおける全体的なグリコーゲン含量アッセイの概略図。 グリコーゲン含量アッセイを実施するためにここで行う実験の概略図です。 この図の拡大版を表示するには、ここをクリックしてください。
2. 腸管透過性の評価
- ワームの準備
- 同期(ステップ1.2.8)の約14時間後、最初の幼虫期(L1)の500〜1000匹の線虫(ステップ1.3.1および注)を、事前に準備した新しいNGM寒天プレート(60 mm x 15 mm)に移し、試験日まで20°Cに保ちます。このスケジュールにより、次のような2つの実験グループが作成されます(図2)。
A-(若い):ワームは、細菌 大腸菌 OP50を播種したNGM寒天プレート上で、幼虫期4(L4)まで成長します。
B-(旧):寄生虫は、成虫の7日目まで、細菌大腸菌OP50を播種したNGM寒天プレートで増殖します。
注:成体7日目まで 維持された線虫は、毎日M9バッファーで洗浄し、以前に食品の補充と子孫の除去のために播種した200μLの 大腸菌 OP50細菌を含む新しいNGM寒天プレート(60 mm x 15mm)に移す必要があります。若い線虫はデカンテーション中に浮遊し、上清を取り除くことで分離できます。スマーフワームの割合は年齢とともに増加します。ただし、腸透過性の評価は、研究の目的に応じて、どの段階や年齢でも行うことができます。
- 同期(ステップ1.2.8)の約14時間後、最初の幼虫期(L1)の500〜1000匹の線虫(ステップ1.3.1および注)を、事前に準備した新しいNGM寒天プレート(60 mm x 15 mm)に移し、試験日まで20°Cに保ちます。このスケジュールにより、次のような2つの実験グループが作成されます(図2)。
- アッセイの実行
- 試験日には、L4線虫(ステップ2.1.1の2日後)と7日目 (現在は9日目 )に成虫をM9バッファー(補足表1)で収集し、標識1.5mLマイクロチューブに移します。
- 1400 x g で3分間遠心分離し、上清を取り除き、M9 1.0 mLを加えて穏やかに混合します。このプロセスを3回繰り返して、バクテリアを取り除きます。最後の洗浄後、容量を500μLに減らします。
- 自動ピペットを使用して、10 μLのワーム沈殿物を顕微鏡スライドに加え、ワームの数をカウントします。ピペッティングする容量を計算して、100 worms/μLを取得します。
- スマーフ染色:蒸留水を使用して25%エリオグラウシン二ナトリウム塩(補足表1)溶液を調製します。必要に応じて、渦を使用して可溶化を改善します。
- これまでに同定した新しいマイクロチューブに、自動ピペットを使用して、100匹の線虫、100 μLの25%エリオグラウシン二ナトリウム塩溶液、200 μLの 大腸菌 OP50、M9バッファーを添加して最終容量500 μLにします。
注:エリオグラウシン二ナトリウム、 大腸菌 、およびワームの数の量は固定されています。M9バッファーの容量は可変であり、最終容量を500μLにするために使用できます。 - 光から保護されたミキサーで攪拌しながら、室温で3時間インキュベートします。
注意: ミキサーが利用できない場合は、15分ごとに手でマイクロチューブを慎重に振ってください。 - 3時間後、1.5 mLマイクロチューブを1400 x g で3分間遠心分離し、上清1.0 mLを除去し、線虫をM9バッファー1.0 mLで洗浄します。
- 残りのエリオグラウシン二ナトリウム塩溶液が溶液から除去されるまで、洗浄を繰り返します。.最後の洗浄ステップの後、約250 μLの残留物を除いて上清を取り除き、これを使用してワームを慎重に再懸濁し、顕微鏡分析のために処理します。
- 約50個のワームを再懸濁したウォーム溶液を顕微鏡スライドに移し、カバースリップで覆います。顕微鏡スライドを-20°Cの冷蔵庫で10分間インキュベートし、線虫を麻痺させます。
注:ワームを麻痺させる別の方法は、10μLの塩酸レバミゾール溶液(10 mM ; 補足表1)そして、カバースリップでそれらを覆います。 - 実体顕微鏡(1.5倍)の明視野を使用して、ワームの総数と完全に染色されたワームを観察してカウントします。画像は、アダプターと組み合わせた携帯電話のカメラ(3.4倍)から取得できます。光/明るさ/露出によるエラーを防ぐためには、すべての写真ですべての携帯電話のカメラ設定を一貫していることが重要です。
- データ検査
- 定性的データ:各グループ(成人期のL4および7日目) の実体顕微鏡から画像を取得し、線虫の染色を視覚的に比較します。
- 実体顕微鏡を使用して、ワームの総数とスマーフワーム(青いワーム)の数を数えます。
- 結果をスマーフワームの割合として表し、若いワーム(対照群としてのL4)と古いワーム(成人期の7日目) を比較します。
A x X = 100 (%) x B
X = 100 x B / A
ここで、A = ワームの総数
B= スマーフワームの数

図2: C.エレガンスにおける腸管透過性アッセイ全体の概略図。 (A) C.エレガンス の準備。(B)エリオグラウシン二ナトリウム塩による染色。 この図の拡大版を表示するには、ここをクリックしてください。
結果
グリコーゲン含有量アッセイは、グリコーゲンの合成または分解に影響を与える可能性のあるさまざまな菌株の比較研究など、さまざまな試験条件をスクリーニングするための堅牢で迅速な方法を提供します。この研究では、L4線虫を空腹時、摂食、グルコース強化グループの3つの異なる試験条件にさらしました。アッセイは3回実施され、各条件は各アッセイで2回?...
ディスカッション
要約すると、このプロトコルは、Lugol染色を使用して個々の C.エレガンス 線虫のグリコーゲン含有量を定性的に評価します:簡単で堅牢で迅速なアッセイです。ルゴール染色は、ラベルフリーで非侵襲的なアプローチであり、細胞内分解能での分子データの取得を容易にし、単一の線虫10内のグリコーゲン含有量の変動のモニタリングを可能に...
開示事項
著者は何も開示していません。
謝辞
D.S.Aは、Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brazil)、助成金番号 #301808/2018-0、#313117/2019-5、Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/ブラジル)、助成金番号、21/2551-0001963-8、Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES、N.S.JおよびA.C.Sの財務コード001)からの資金提供を認めています。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
参考文献
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved