Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Caenorhabditis elegans'ta Glikojen Birikimini ve Bağırsak Bütünlüğünü Görselleştirmek için Düşük Maliyetli Boyaların Kullanılması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Biyolojik bilimlerin öğretilmesi, deneylerin kullanılmasıyla öğrenciler için daha teşvik edici hale getirilebilir. Bu el yazması, öğrencileri yüksek kalorili diyetler, açlık ve yaşlanma ile ilgili hipotezleri formüle etmeye ve test etmeye teşvik etmek için sınıfta kullanılabilecek iki farklı ancak tamamlayıcı protokol sunmaktadır.
Özet
Caenorhabditis elegans (C. elegans), basit bir biyolojiye sahip şeffaf, parazitik olmayan bir nematoddur, bu da onu hücrelerin boyanması veya moleküler içerikleri yoluyla biyolojik bilimler öğretimi için harika bir araç haline getirir. Lugol boyası (iyot-potasyum iyodür çözeltisi), biyokimyada glikojen depolarını lekelemek için yaygın olarak kullanılmaktadır. Bu bağlamda, beslenen ve aç bırakılan hayvanlar arasında, farklı diyetler ve oksijen seviyeleri gibi farklı koşulların etkilerinin yanı sıra farklılıklar gözlemlemek mümkündür. Erioglausin, bağırsak bariyerinin kaybını gösteren mavi bir boyadır. Bağırsak bariyeri sağlam olduğunda, mavi boya lümenin içinde lekelenir; Ancak bu bütünlük bozulduğunda boya vücut boşluğuna sızar. Stereomikroskop veya mikroskop kullanarak, öğretmenler fizyolojik ve biyokimyasal değişiklikleri gösterebilir veya öğrencileri bilimsel bir soru sormaya ve bu tahlilleri kullanarak hipotezlerini hipotez kurmaya ve test etmeye teşvik edebilirler. Bu protokol, C. elegans'ta öğrenciler tarafından kolayca uygulanabilecek iki boyama tekniğini tanımlamaktadır.
Giriş
Lisede biyolojik bilimler öğretimi sürekli bir zorluktur. Özellikle, teknolojiye erişim ve kullanım, öğretme-öğrenme sürecinde önemli ilerlemeler sağlamıştır, ancak yapay zeka sohbet robotları gibi araçlar, elde edilen kolay (ve bazen yanlış) yanıtlar nedeniyle rasyonalize etmeyi ve kanıt aramayı daha zor hale getirmektedir1. Bu nedenle, sınıfta sorgulamaya dayalı bir yaklaşımda pratik deneylerle bilimsel bir yöntemin kullanılması, öğrencilerde eleştirel düşünme, yaratıcılık ve teknik becerileri geliştirmek veya teşvik etmek için önemli bir stratejidir2.
Bu bağlamda, serbest yaşayan nematod Caenorhabditis elegans , özel avantajları nedeniyleöğretim amaçlı deneylerde 3 başarıyla kullanılmıştır: Bir parazit değildir ve beslenme için kullanılan Escherichia coli biyogüvenlik seviyesi-1'dir, bu nedenle biyolojik tehlikeyi sıfıra yakın azaltır; Öğrencilerin gözlemlemesi ilginç olan zarif ve ölçülebilir bir hareket hareketine sahiptir; Ve şeffaftır, bu da organ gözlemine izin verir, aynı zamanda biyomoleküllerin varlığını veya fizyolojik değişikliklerin meydana geldiğini gösterebilen pigmentlerle boyanır4. Bu nedenle, biyokimya ve yaşlanma gibi fizyolojik değişikliklerle ilgili basit varsayımları sınıfta hipotez kurmak ve test etmek mümkündür.
Glikojen, dal noktalarında (1→4)-α glikozidik lineer bağlara ve (1→6)-α glikozidik bağlara sahip glukozil kalıntıları tarafından oluşturulan uzun ve dallı bir glikoz molekülleri zinciri tarafından oluşturulan bir depo karbonhidratıdır ve özellikle kas kasılması, hücre farklılaşması ve glisemi bakımı için önemlidir5. Glikojen, glikojen-sentaz enziminin insülin aktivasyonu nedeniyle beslenmeden sonra sentezlenir. Egzersiz veya oruç sırasında, sırasıyla epinefrin veya glukagon, glikojen fosforilazı aktive eder ve bu nedenle, kas hücrelerine glikoz-6-fosfat sağlamak için polisakkariti parçalar veya hipoglisemiyi atlatmak için serbest glikoz salgılar 6,7. Glikojen seviyelerindeki değişiklikler, kanser de dahil olmak üzere çeşitli fizyolojik ve patofizyolojik koşullar altında hücre farklılaşmasını, sinyalizasyonunu, redoks regülasyonunu ve saplılığını etkiler8. C. elegans'ta glikojen esas olarak yemek borusu kası, hipodermis, bağırsak, nöronlar ve esas olarak vücut duvarı kaslarındabulunur 9. Glikojen içeriği, Lugol'ün İyot çözeltisi kullanılarak ölçülebilir, çünkü iyot, bir iyot-glikojen kompleksi oluşturan sarmal bobinlere bağlanır ve görünür keskin mavi-siyah veya kahverengi-siyah bir renk verir, bu da glikojen içeriğini göstermek için başarıyla kullanılmıştır. Yüksek glikoz beslemesinin neden olduğu glikojen birikiminin solucanın ömrünü kısaltabildiği ve dolayısıyla yaşlanma sürecini hızlandırdığı gösterilmiştir11,12. Ek olarak, metabolik bozukluklar, diğer hormonlar ve ksenobiyotiklere maruz kalma, glikojen metabolizmasını da değiştirebilir13,14. Bu nedenle, C. elegans'taki glikojen içeriği üzerine deneyler oldukça ilginçtir, çünkü çeşitli faktörler metabolizmasını bozabilir ve egzersiz, diyetler, hastalıklar ve yaşlanma gibi enine temalarla ilişkili temel biyokimya hakkında sınıf içi bir tartışmayı teşvik edebilir.
Yaşlanma, hücresel hasarın neden olduğu zamana bağlı fonksiyonel bir düşüştür. Bu hasar, oksidatif stres, telomer aşınması, proteostaz kaybı, iltihaplanma ve hatta çözünmeyen poliglukozan cisimciklerinin15 birikmesi ile ilişkilendirilebilir. Yaşlanmanın ayırt edici özelliklerinden biri, bir organizmanın yaşamı boyunca ortaya çıkan çeşitli kronik durumlarla ilişkili bağırsak bütünlüğünün azalmasıdır16. Bağırsak homeostazının sürdürülmesi, fiziksel bir bariyer oluşturan ve bitişik epitel hücrelerini birbirine bağlayan bağlantı proteinleri tarafından desteklenen bağırsak epitelinin bütünlüğüne bağlıdır. Bu epitelde hasar olduğunda, luminal içeriğin interstisyuma sızması meydana gelir17. Bu mekanizmaya dayanarak, şirin testi, birkaç hayvan modelinde bağırsak bütünlüğünü doğrulamak için kullanılmıştır, çünkü bu mavi boya Erioglaucine disodyum tuzu, lümende18 kalan bağırsak zarını geçmez. Solucanlar bir patojenle enfekte olduğunda, bazı toksik maddelerle kontamine olduğunda veya yaşlandığında, interstisyel bütünlüğü değiştirdiğinde, boya bariyeri geçer ve solucanın her tarafına yayılır ve bu da tamamen mavi olur. Bu tahlil, yaşlanmanın fizyolojisi hakkında tartışmaya ve solucanları farklı koşullara maruz bırakarak bu süreci hızlandırabilecek veya geciktirebilecek faktörler üzerinde deneyler yapmaya izin verir. Buradaki protokoller, öğrencileri biyokimya ve fizyoloji ile ilgili hipotezleri formüle etmeye ve test etmeye teşvik etmek ve teşvik etmek için sınıfta kolayca yapılabilecek bu iki boya bazlı yöntemi ayrıntılı olarak açıklayacaktır.
Protokolün ilk kısmı, C. elegans model10'daki glikojen içeriğini kalitatif ve kantitatif olarak analiz etmenin uygulanabilirliğini göstermektedir. Protokolün ikinci bölümünün amacı C. elegans bağırsağının bütünlüğünü değerlendirmektir. Bu teknik, bağırsak zarlarının bütünlüğünü değerlendirerek C. elegans yaşlanmasının izlenmesine izin verir. Ayrıca, bir maddenin yaşlanmayı hızlandırıp hızlandırmadığını veya geciktirip geciktirmediğini ve herhangi bir maddenin bağırsak bariyeri19 üzerinde toksik potansiyele sahip olup olmadığını değerlendirmeye izin verir.
Bu çalışma için kullanılan C. elegans suşu, Bristol N2 yabani tipidir. Bununla birlikte, prosedür, karşılaştırılabilir büyüme oranları sergileyen suşlar kullanılarak tekrarlanabilir veya yöntem, aynı veya benzer işleve sahip oldukları göz önünde bulundurularak veya kullanılan suşa bağlı olarak, belirli suşların özel bakım ve/veya hassasiyet gereksinimlerine sahip olması nedeniyle, ekipman değiştirme ihtiyacına göre ayarlanmalıdır; bu bilgiler Caenorhabditis Genetik Merkezi'nden (CGC) veya WormBase web sitesinden edinilebilir. Bu değişiklikler yöntemin tekrarlanabilirliğini etkilememelidir.
Protokol
NOT: Escherichia coli OP50 (E. coli OP50) bakterileri ve Bristol N2 yabani tip suşları, CGC, Minnesota Üniversitesi, ABD'den veya bir C. elegans laboratuvarından bağış yoluyla elde edilebilir. Araştırmacıların güvenliği için Kişisel Koruyucu Donanımların kullanılması zorunludur. Hipoklorit ve sodyum hidroksit gibi reaktiflerin konsantrasyonları düşük olsa da, bu kimyasallarla ilişkili potansiyel riskleri en aza indirmek için makalede vurgulandığı gibi önerilen KKD'nin giyilmesi önemlidir.
1. Glikojen içeriği
- Test plakalarının hazırlanması
- Solucan suşu başına altı, 60 mm x 15 mm NGM agar plakası20 ( Ek Tablo 1'de açıklandığı gibi 10 mL nematod büyüme ortamı agar, NGM) hazırlayın ve oda sıcaklığında 1 gün kurumaya bırakın. Kontaminasyonu önlemek için plakaları kapalı tutun.
- Akış başlığındaki gerinim başına toplam dört, 60 mm x 15 mm NGM plakasını aşılamak için plaka başına 200 μL E. coli OP50 sıvı kültürü (optik yoğunluk = 0.600, yaklaşık 600 nm dalga boyunda) ekleyin. Kullanmadan önce kapalı plakaların 1 gün boyunca 37 °C'de inkübe etmesine izin verin.
NOT: Altı tabak hazırlayın (adım 1.1), ancak sadece 4'ünü E. coli OP50 bakterisi ile aşılayın. Kalan iki plakayı, solucanları açlık koşullarına yerleştirirken daha sonra kullanmak üzere 4 °C'de saklayın. Bu analiz iki nüsha olarak gerçekleştirilebilir. - Test gününde, daha önce E. coli OP50 bakterileri ile tohumlanmış olan suş başına iki (6 mm x 15 mm) NGM agar plakasına 200 μL 0.025 M D-Glikoz ekleyin. Plakaların akış davlumbazında oda sıcaklığında kurumasını bekleyin.
NOT: E. coli OP50 bakterisi ile tohumlanmış NGM agar plakaları, bir akış başlığı kullanmaya alternatif olarak alkol lambalarının yakınında da kurutulabilir.
- Senkronizasyon
- Senkronizasyondan yaklaşık 3 gün önce, 3-4 parçayı (3 cm x 3 cm) C . elegans Bristol N2 (yabani tip) ile farklı aşamalarda (yığın başına yaklaşık 500 solucan) bir bakım NGM agarından daha önce E. coli OP50 bakterileri ile tohumlanmış yeni bir plakaya (150 mm x 90 mm) aktarın.
- Yeni solucan plakasını 20 °C'de kontrollü bir ortama yerleştirin ve 3 gün boyunca nemi %>95) koruyun (72 saat, solucanların çoğunun gravid yetişkin aşamasına ulaşmasına izin verir).
NOT: Büyüme sıcaklığının, kullanılan C. elegans suş(lar)ına bağlı olarak ayarlanması gerekebilir. - Bir Pasteur pipeti kullanarak, solucanları damıtılmış H2O ile hazırlanan plakadan toplayın ve bunları 50 mL'lik bir santrifüj tüpüne aktarın.
- Solucanların yerçekimi ile çökelmesini bekleyin (yaklaşık 15 dakika) ve ardından süpernatanı çıkarın. Bakterileri yok etmek için bu işlemi 3 kez tekrarlayın. Son yıkamadan sonra hacmi 5 mL'ye düşürün.
- 10 mL ağartma solüsyonu ekleyin (Ek Tablo 1) ve ellerinizi yaklaşık 6 dakika boyunca kuvvetlice çalkalayın.
- Çalkalama tamamlandıktan hemen sonra, tüpleri M9 tamponu ile 50 mL kapasiteye kadar doldurun.
- 3 dakika boyunca 1400 x g'da santrifüjleyin, süpernatanı 5 mL'ye kadar çıkarın ve ardından tekrar 45 mL M9 tamponu ekleyin. Bu işlemi 4 kez tekrarlayın.
- Son yıkamadan sonra, hacmi 15 mL'ye düşürün ve yaklaşık 14 saat boyunca kontrollü bir sıcaklıkta (20 °C) ve nemde (%>95) tutun.
NOT: Senkronizasyon işlemi, yumurtlama yoluyla yumurta elde edilerek değiştirilebilir: Yaklaşık 20 yetişkin hamile solucanı, daha önce 200 μL E. coli OP50 ile tohumlanmış bir NGM plakasına (6 mm x 15 mm) aktarın. Solucanların 1 gün boyunca yumurta bırakmasına izin verin. Bundan sonra, hamile solucanları çıkarın ve yumurtaların çatlamasını bekleyin.
- Solucanların hazırlanması
- Otomatik bir pipet kullanarak, 10 μL senkronize solucanları (adım 1.2.8) bir mikroskop lamına ekleyin ve solucan sayısını sayın. 500-1000 solucan/μL elde etmek için ne kadar hacim pipetlenmesi gerektiğini hesaplayın.
- 500-1000 L1 senkronize solucanları (adım 1.2.8), besin kaynağı olarak E. coli OP50 bakterisi ile tohumlanmış NGM agar plakalarına (150 mm x 90 mm, Ek Tablo 1), 20 ° C'de larva aşaması 4'e (L4) ulaşana kadar aktarın.
NOT: Solucanlar otomatik bir pipet kullanılarak aktarılabilir. Otomatik bir pipet mevcut değilse, bir cam Pasteur pipeti kullanın ve hacimler mikrotüp etiketler veya cam dereceli pipetler kullanılarak kontrol edilebilir. - 48 saatlik senkronizasyondan20 sonra: L4 larvalarını M9 tamponlu plakalardan (Ek Tablo 1), plastik bir Pasteur pipeti yardımıyla 50 mL'lik temiz bir konik tüpe toplayın ve 3 kez taze M9 tamponu ile yıkayın veya kalan tüm E. coli OP50 bakterileri tamamen temizlenene kadar (oda sıcaklığında) yıkamaları tekrarlayın.
NOT: Yıkama aşaması önemlidir çünkü bazı solucanlar işlem sırasında açlık yaşayacaktır.
- Tahlili çalıştırma
- Önceden hazırlanmış yeni NGM agar plakalarının (60mm x 15mm) her birinden (adım 1.1.2 ve 1.1.3) 500-1000 L4 solucanını (adım 1.3.1) aktarın. Test gününe kadar 20 saat boyunca 48 °C'de tutun. Bu program, aşağıdaki gibi iki kopya halinde üç deney grubuyla sonuçlanacaktır (Şekil 1):
A- (açlık): solucanlar, E. coli OP50 bakterisi içermeyen normal NGM agar plakalarında büyüyecektir;
B- (normal): solucanlar, E. coli OP50 bakterileri ile tohumlanmış normal NGM agar plakalarında büyüyecektir;
C- (yüksek glikoz): solucanlar, E. coli OP50 bakterisi ile tohumlanmış ve 0.025 M D-glikoz içeren NGM agar plakaları üzerinde büyüyecektir. - Test gününde (48 saat sonra): solucanları toplayın ve M9 tamponunda üç kısa yıkama yapın (adım 1.2.2 ve 1.2.3)
NOT: Burada, D-glikoz ilavesiyle (adım 1.3) NGM agar plakalarını hazırlayın ve solucanları ekleme zamanı gelene kadar bir kenara koyun.- İyot boyama: taze M9 tamponu kullanarak% 5 (h / h) Lugol İyot çözeltisi (iyot / potasyum iyodür çözeltisi) hazırlayın.
NOT: Lugol'un İyot çözeltisi yerel reaktif tedarikçilerinden veya eczanelerden temin edilebilir, bu nedenle başlangıç konsantrasyonu değişebilir. Gerekirse, %5'lik (h/h) bir çözelti elde etmek için hesaplayın.
- İyot boyama: taze M9 tamponu kullanarak% 5 (h / h) Lugol İyot çözeltisi (iyot / potasyum iyodür çözeltisi) hazırlayın.
- Her gruptan yaklaşık 100 μL yıkanmış solucanı (adım 4.2) seyreltilmiş Lugol çözeltisi (% 5 v / v) içeren 1.5 mL mikrotüpe aktarın. 1:5 oranında otomatik bir pipet kullanarak 100 μL solucanı 400 μL Lugol çözeltisine aktarın, ardından bir karıştırıcıda 5 dakika boyunca hafifçe çalkalayın.
NOT: Bir karıştırıcı mevcut değilse, mikrotüpleri ellerle dikkatlice sallamak mümkündür. - Bu 5 dakikadan hemen sonra, 1.5 mL mikrotüpü (solucanlar + Lugol çözeltisi) 1400 x g'da 3 dakika boyunca santrifüjleyin.
NOT: Bu test, L4 aşamasından veya ötesinden solucanlar üzerinde gerçekleştirilirse, bir santrifüj kullanmak yerine yerçekimi sedimantasyonu elde etmek mümkündür. Mikrotüpleri, tüm solucanlar mikrotüpün dibine yerleşene kadar 10 dakika boyunca tezgah üzerindeki raflarda açık bırakın. - Süpernatanı çıkarın ve solucanları 1.0 mL taze M9 tamponu ile yıkayın. Kalan tüm iyot çözeltiden çıkana kadar yıkamayı tekrarlayın (en az 3x).
- Son yıkama adımından sonra, yaklaşık 100 μL'lik bir kalıntı dışında süpernatanı çıkarın. Solucanları nazikçe yeniden süspanse etmek ve mikroskobik analiz için bunu kullanın.
- Yeniden süspanse edilmiş solucan çözeltisinin yaklaşık 50 μL'sini mikroskopi slaytlarına aktarın ve üzerlerini kapak fişleri ile örtün. Stereomikroskop (1,5x'te) kullanarak parlak alan görüntülerini gözlemleyin.
NOT: Stereomikroskop mevcut değilse, normal bir mikroskop kullanılabilir ve görüntüler bir adaptör kullanılarak bir cep telefonu kamerasıyla (3.4x'te) yakalanabilir. Işık/parlaklık/pozlamadan kaynaklanan hataları önlemek için, tüm cep telefonu kamera ayarlarının tüm resimler için tutarlı kalması çok önemlidir.
- Önceden hazırlanmış yeni NGM agar plakalarının (60mm x 15mm) her birinden (adım 1.1.2 ve 1.1.3) 500-1000 L4 solucanını (adım 1.3.1) aktarın. Test gününe kadar 20 saat boyunca 48 °C'de tutun. Bu program, aşağıdaki gibi iki kopya halinde üç deney grubuyla sonuçlanacaktır (Şekil 1):
- Veri incelemesi
- Kantitatif veriler: Solucanların iyot lekelenmesine dayalı olarak glikojen içeriğini hesaplayın.
- Grup başına en az 10 solucan içeren stereomikroskoptan görüntüleri, daha sonraki işlemler için bir .jpeg dosyası olarak kaydedin. Bunu yapmak için ücretsiz ImageJ yazılımını indirin. Ayrıntılar Ek Dosya 1, Ek Şekil 1, Ek Şekil 2'de verilmiştir.
- ImageJ yazılımını (https://imagej.nih.gov/ij/download.html adresinden ücretsiz olarak indirilebilir) kullanarak .jpeg görüntüsünü açın. Segmentli satır'a tıklayın ve solucanı ana hatlarıyla belirtin (her seferinde bir solucan). Analiz Et'e tıklayın ve ardından leke miktarını elde etmek için Ölç'ü seçin. Veriler, tabloda Ortalama olarak görüntülenecektir. Ortalama, solucan alanı başına boyama yoğunluğundan hesaplanan verileri gösterir.
- Nitel veriler: Her grubun stereomikroskobundan görüntüler elde edin ve solucanların lekelenmesini görsel olarak karşılaştırın. Gerekirse, lekelenmeyi analiz etmek için bir puanlama sistemi oluşturun: 0 renksiz; 1 hafif lekeli; 2 lekeli ve 3 çok lekeli. Stereomikroskobu kullanarak, bir el sayacı ile grup başına (minimum) yaklaşık 10 solucanı manuel olarak sayın.
- Kantitatif veriler: Solucanların iyot lekelenmesine dayalı olarak glikojen içeriğini hesaplayın.
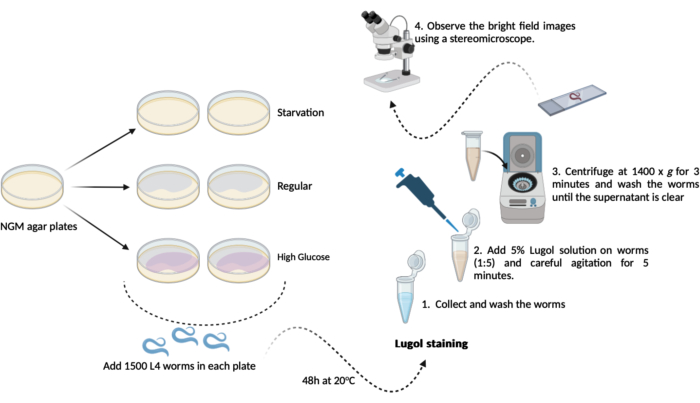
Şekil 1: C. elegans'ta genel glikojen içeriği analizi şeması. Glikojen içerik testini gerçekleştirmek için burada gerçekleştirilen deneyin bir şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Bağırsak geçirgenliğinin değerlendirilmesi
- Solucanların hazırlanması
- Senkronizasyondan yaklaşık 14 saat sonra (adım 1.2.8), ilk larva aşamasında (L1) 500-1000 solucanı (adım 1.3.1 ve NOT) daha önce hazırlanmış olan her yeni NGM agar plakasına (60 mm x 15 mm) aktarın ve test gününe kadar 20 °C'de tutun. Bu program aşağıdaki gibi iki deney grubuna yol açacaktır (Şekil 2):
A- (genç): solucanlar, larva evresi 4'e (L4) kadar E. coli OP50 bakterisi ile tohumlanmış NGM agar plakalarında büyüyecektir;
B- (eski): Solucanlar, yetişkinliğin 7. gününe kadar E. coli OP50 bakterisi ile tohumlanmış NGM agar plakalarında büyüyecektir.
NOT: Erişkin yaşamın 7. gününe kadar bakımı yapılan solucanlar her gün M9 tamponu ile yıkanmalı ve daha önce gıda yerine alınması ve döllerin uzaklaştırılması için tohumlanmış 200 μL E. coli OP50 bakterisi ile yeni NGM agar plakalarına (60 mm x 15mm) aktarılmalıdır. Daha genç solucanlar dekantasyon sırasında yüzer ve süpernatan çıkarılarak ayrılabilir. Şirin kurtlarının oranı yaşla birlikte artar. Bununla birlikte, bağırsak geçirgenliğinin değerlendirilmesi, çalışmanın amacına bağlı olarak herhangi bir aşamada ve yaşta yapılabilir.
- Senkronizasyondan yaklaşık 14 saat sonra (adım 1.2.8), ilk larva aşamasında (L1) 500-1000 solucanı (adım 1.3.1 ve NOT) daha önce hazırlanmış olan her yeni NGM agar plakasına (60 mm x 15 mm) aktarın ve test gününe kadar 20 °C'de tutun. Bu program aşağıdaki gibi iki deney grubuna yol açacaktır (Şekil 2):
- Tahlili çalıştırma
- Test gününde, L4 solucanlarını (adım 2.1.1'den 2 gün sonra) ve yetişkinlik solucanlarını 7. günde ( şimdi 9. günlerinde ) M9 tamponu (Ek Tablo 1) ile toplayın ve etiketli 1.5 mL mikrotüplere aktarın.
- 1400 x g'da 3 dakika santrifüjleyin, süpernatanı çıkarın, 1.0 mL M9 ekleyin ve hafifçe karıştırın. Bakterileri uzaklaştırmak için bu işlemi 3 kez tekrarlayın. Son yıkamadan sonra hacmi 500 μL'ye düşürün.
- Otomatik bir pipet kullanarak, bir mikroskop lamına 10 μL solucan tortusu ekleyin ve solucan sayısını sayın. 100 solucan/μL elde etmek için pipetlenecek hacmi hesaplayın.
- Şirin boyama: damıtılmış su kullanarak% 25 Erioglaucine disodyum tuzu (Ek Tablo 1) çözeltisi hazırlayın. Gerekirse, daha iyi çözünürlük için girdabı kullanın.
- Daha önce tanımlanmış yeni mikrotüplerde, otomatik bir pipet kullanarak, 100 solucan, 100 μL% 25 Erioglaucine disodyum tuzu çözeltisi, 200 μL E. coli OP50 içeren hacmi ekleyin ve 500 μL'lik bir nihai hacim için M9 tamponu ile tamamlayın.
NOT: Erioglaucine disodyum, E. coli hacimleri ve solucan sayısı sabittir. M9 tamponunun hacmi değişkendir ve nihai hacmi 500 μL'ye getirmek için kullanılabilir. - Oda sıcaklığında, ışıktan korunan bir karıştırıcıda çalkalama ile 3 saat inkübe edin.
NOT: Bir mikser yoksa, mikrotüpleri her 15 dakikada bir ellerinizle dikkatlice sallayın. - 3 saat sonra, 1.5 mL mikrotüpü 1400 x g'da 3 dakika santrifüjleyin. 1.0 mL süpernatanı çıkarın ve solucanları 1.0 mL M9 tamponu ile yıkayın.
- Kalan Erioglaucine disodyum tuzu çözeltisi çözeltiden çıkarılana kadar yıkamaları tekrarlayın. Son yıkama adımından sonra, yaklaşık 250 μL'lik bir kalıntı dışında süpernatanı çıkarın. Bunu, solucanları dikkatlice yeniden askıya almak ve mikroskobik analiz için işlemek için kullanın.
- Yaklaşık 50 solucan yeniden süspanse edilmiş solucan çözeltisini mikroskopi slaytlarına aktarın ve üzerlerini kapak fişleri ile örtün. Solucanları felç etmek için mikroskopi slaytlarını buzdolabında -20 °C'de 10 dakika inkübe edin.
NOT: Solucanları felç etmenin bir başka alternatifi, 10 μL Levamizol hidroklorür çözeltisi (10 mM; Ek Tablo 1) ve üzerlerini kapak fişleri ile örtün. - Bir stereomikroskopta (1.5x'te) parlak alanı kullanarak toplam solucan sayısını ve tamamen boyanmış solucanları gözlemleyin ve sayın. Görüntüler, bir adaptörle birleştirilmiş bir cep telefonu kamerasından (3.4x'te) elde edilebilir. Işık/parlaklık/pozlamadan kaynaklanan hataları önlemek için, tüm cep telefonu kamera ayarlarının tüm resimler için tutarlı kalması çok önemlidir.
- Veri incelemesi
- Nitel veriler: Her grubun stereomikroskoptan (L4 ve yetişkinliğin 7. günü) görüntüler elde edin ve solucanların lekelenmesini görsel olarak karşılaştırın.
- Stereomikroskop kullanarak toplam solucan sayısını ve şirin solucan sayısını (mavi solucanlar) sayın.
- Genç solucanları (L4, kontrol grubu olarak) ve yaşlı solucanları (yetişkinliğin 7. günü) karşılaştırarak şirin solucanlarının yüzdesi olarak sonuçları ifade edin:
A x X = 100 (%) x B
X = 100 x B / A
Nerede, A = toplam solucan sayısı
B= şirin solucan sayısı

Şekil 2: C. elegans'ta genel bağırsak geçirgenlik deneyi şeması. (A) C. elegans hazırlığı. (B) Erioglaucine disodyum tuzu ile boyama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Glikojen içeriği analizi, glikojen sentezini veya bozunmasını etkileyebilecek farklı suşların karşılaştırmalı çalışmaları gibi çeşitli test koşullarının taranması için sağlam ve hızlı bir yöntem sağlar. Bu çalışmada, L4 solucanları üç farklı test koşuluna tabi tutuldu: açlık, beslenme ve glikozla zenginleştirilmiş gruplar. Test üç kez gerçekleştirildi ve her koşul her testte iki kez tekrarlandı; Şekil 3'te temsi...
Tartışmalar
Özetle, bu protokol, Lugol boyaması kullanılarak tek tek C. elegans solucanlarındaki glikojen içeriğinin kalitatif bir değerlendirmesini sağlar: basit, sağlam ve hızlı bir test. Lugol boyama, hücre altı çözünürlüklerde moleküler verilerin elde edilmesini kolaylaştıran, tek solucanlar10 içindeki glikojen içeriği dalgalanmalarının izlenmesine izin veren, etiketsiz ve invaziv olmayan bir yaklaşımdır. Ayrıca tahlil, minimum ekipm...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
DSA, Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brezilya), hibe numarası #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/Brezilya), hibe numarası, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior'dan (CAPES, N.S.J ve ACS için Finans Kodu 001) fon sağladığını kabul eder
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
Referanslar
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır