需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用低成本染料可视化秀丽隐杆线虫中的糖原积累和肠道完整性
摘要
通过使用实验,可以使生物科学的教学对学生更具刺激性。本手稿提出了两种不同但互补的协议,可以在课堂上使用,以鼓励学生制定和测试与高热量饮食、饥饿和衰老相关的假设。
摘要
秀丽隐杆线虫 (C. elegans) 是一种透明的非寄生线虫,生物学原理简单,这使其成为通过细胞或其分子含量染色进行生物科学教学的绝佳工具。Lugol 染料(碘-钾碘化物溶液)已广泛用于生物化学中,以对糖原储存进行染色。在这种情况下,除了不同条件的影响(例如不同的饮食和氧气水平)之外,还可以观察到喂食动物和饥饿动物之间的差异。Erioglaucine 是一种蓝色染料,表明肠道屏障的丧失。当肠道屏障完好无损时,管腔内会染上蓝色染料;然而,当这种完整性被破坏时,染料会泄漏到体腔中。使用立体显微镜或显微镜,教师可以演示生理和生化变化,或者他们可以鼓励学生提出科学问题,并使用这些分析来假设和检验他们的假设。本方案描述了学生可以轻松进行的 秀丽隐杆线虫 中的两种染色技术。
引言
高中生物科学教学是一项持续的挑战。值得注意的是,技术的获取和使用为教学过程带来了重要进步,然而,人工智能聊天机器人等工具由于获得的简单(有时是不正确的)回答而使合理化和寻找证据变得更加困难1.正因为如此,在课堂上使用科学方法和基于探究的方法进行实际实验是培养或激发学生批判性思维、创造力和技术技能的重要策略2。
在这种情况下,自由生活的线虫秀 丽隐杆线 虫已成功用于教学目的的实验3 ,因为它具有特殊的优势:它不是寄生虫,用于喂养的大 肠杆菌 是生物安全 1 级,因此将生物危害降低到接近零;它具有优雅且可量化的运动动作,学生观察起来很有趣;它是透明的,可以观察器官,也可以用色素染色,这表明生物分子的存在或生理改变的发生4。因此,可以在课堂上假设和测试与生物化学和生理变化(如衰老)相关的简单假设。
糖原是一种储存碳水化合物,由葡萄糖基残基形成的葡萄糖分子长链支链形成,在分支点具有 (1→4)-α 糖苷线性键和 (1→6)-α 糖苷键,对肌肉收缩、细胞分化和血糖维持尤为重要5。糖原是在进食后由于糖原合酶的胰岛素激活而合成的。在运动或禁食期间,肾上腺素或胰高血糖素分别激活糖原磷酸化酶,因此分解多糖向肌肉细胞提供葡萄糖-6-磷酸或释放游离葡萄糖以规避低血糖 6,7。糖原水平的改变会影响各种生理和病理生理条件下(包括癌症)下的细胞分化、信号传导、氧化还原调节和干性8。在秀丽隐杆线虫中,糖原主要存在于食管肌肉、皮下组织、肠道、神经元中,主要存在于体壁肌肉中 9。可以使用 Lugol 碘溶液测量糖原含量,因为碘与螺旋线圈结合形成碘-糖原复合物,产生可见的清晰蓝黑色或棕黑色,这已成功用于证明秀丽隐杆线虫中的糖原含量 10。已经证明,高葡萄糖喂养引起的糖原积累会缩短蠕虫的寿命,从而加速衰老过程11,12。此外,代谢紊乱、其他激素和接触外源性物质也会改变糖原代谢13,14。因此,对秀丽隐杆线虫中糖原含量的实验非常有趣,因为不同的因素可能会干扰其新陈代谢,并且可以激发课堂上关于与横向主题(如运动、饮食、疾病和衰老)相关的基本生物化学的讨论。
衰老是由细胞损伤引起的时间依赖性功能下降。这种损伤可能与氧化应激、端粒磨损、蛋白质稳态丧失、炎症有关,甚至与不溶性聚葡聚糖体的积累有关15,仅举几例。衰老的标志之一是肠道完整性降低,这与生物体生命周期中发生的几种慢性病有关16。肠道稳态的维持取决于肠上皮的完整性,它由形成物理屏障并连接相邻上皮细胞的连接蛋白支持。当这个上皮受损时,管腔内容物会泄漏到间质中17。基于这种机制,smurf 测试已被用于验证几种动物模型中的肠道完整性,因为这种蓝色染料 Erioglaucine 二钠盐不会穿过肠膜,而是留在管腔18 中。当蠕虫感染病原体、被某些毒物污染或年龄改变间质完整性时,染料会穿过屏障并扩散到蠕虫全身,变成全蓝色。该测定允许讨论衰老的生理学,并试验可以通过将蠕虫暴露于不同条件来加速或延迟这一过程的因素。这里的协议将详细描述这两种基于染料的方法,这些方法可以在课堂上轻松完成,以激发和刺激学生制定和测试与生物化学和生理学相关的假设。
方案的第一部分显示了其对秀丽隐杆线虫模型10 中糖原含量进行定性和定量分析的适用性。该方案第二部分的目的是评估秀丽隐杆线虫肠道的完整性。该技术允许通过评估肠膜的完整性来监测秀丽隐杆线虫的衰老。此外,它还允许评估某种物质是否加速或延缓衰老,以及是否有任何物质对肠道屏障具有潜在毒性19。
本研究使用的 秀丽隐杆线 虫菌株是布里斯托尔 N2 野生型。然而,可以使用表现出可比生长速率的菌株来复制该程序,或者必须根据设备更换的需要调整方法,考虑到它们具有相同或相似的功能,或者取决于所使用的菌株,因为某些菌株具有特定的维护和/或敏感性要求;此信息可从 Caenorhabditis 遗传学中心 (CGC) 或 WormBase 网站获得。这些更改不应影响方法的重现性。
研究方案
注: 大肠杆菌 OP50(大肠杆菌 OP50)细菌和布里斯托尔 N2 野生型菌株可从美国明尼苏达大学的 CGC 获得,也可从 秀丽隐杆线 虫实验室的捐赠中获得。为了研究人员的安全,必须使用个人防护设备。尽管次氯酸盐和氢氧化钠等试剂的浓度较低,但正如手稿中强调的那样,必须佩戴推荐的 PPE,以尽量减少与这些化学品相关的任何潜在风险。
1. 糖原含量
- 测试板的制备
- 每个蠕虫菌株准备 6 个 60 mm x 15 mm NGM 琼脂板20(10 mL 线虫生长培养基琼脂,NGM,如 补充表 1 中所述),并让它们在室温下干燥 1 天。保持板关闭以防止污染。
- 每板添加 200 μL 大肠杆菌 OP50 液体培养物(光密度 = 0.600,大约波长为 600 nm),以在流动罩中接种每个菌株总共四个 60 mm x 15 mm NGM 板。使用前让封闭的板在 37 °C 下孵育 1 天。
注意:准备 6 个板(步骤 1.1),但仅用 大肠 杆菌 OP50 细菌接种 4 个。将剩余的两个板保留在 4 °C 下,以备后用时将蠕虫置于饥饿条件下。此分析可以重复执行。 - 在测试当天,将 200 μL 0.025 M D-葡萄糖添加到先前接种了大 肠杆菌 OP50 细菌的每株菌株的两个 (6 mm x 15 mm) NGM 琼脂平板中。让板在流动罩中在室温下干燥。
注:接种大 肠杆菌 OP50 细菌的 NGM 琼脂平板也可以在酒精灯附近干燥,作为使用流动罩的替代方法。
- 同步
- 在同步前大约 3 天,将 3-4 块(3 厘米 x 3 厘米) 从不同阶段 (每块约 500 条蠕虫)的维持 NGM 琼脂中转移至先前接种了大 肠杆菌 OP50 细菌的新板(150 毫米 x 90 毫米)。
- 将带有蠕虫的新板置于 20 °C 的受控环境中,并保持湿度 >95% 3 天(72 小时允许大多数蠕虫达到妊娠成虫阶段)。
注意:可能需要根据所使用的 秀丽隐杆线虫 菌株调整生长温度。 - 使用巴斯德移液器,用蒸馏的 H2O 从准备好的板中收集蠕虫,并将其转移到 50 mL 离心管中。
- 等待蠕虫在重力作用下沉降(约 15 分钟),然后去除上清液。重复此过程 3 次以消除细菌。最后一次洗涤后,将体积减少至 5 mL。
- 加入 10 mL 漂白溶液 (补充表 1)并用手剧烈摇晃约 6 分钟。
- 振荡完成后,立即用 M9 缓冲液填充试管至 50 mL 容量。
- 以 1400 x g 离心 3 分钟,去除上清液至 5 mL,然后再次加入 45 mL M9 缓冲液。重复此过程 4 次。
- 最后一次洗涤后,将体积减少至 15 mL,并在受控温度 (20 °C) 和湿度 (>95%) 下保持约 14 小时。
注:可以通过产卵获取虫卵来代替同步过程:将大约 20 条成年怀孕蠕虫转移到预先接种了 200 μL 大肠杆菌 OP50 的 NGM 板 (6 mm x 15 mm) 中。让蠕虫产卵 1 天。之后,取出怀孕的蠕虫并等待卵孵化。
- 蠕虫的制备
- 使用自动移液器将 10 μL 同步蠕虫(步骤 1.2.8)添加到显微镜载玻片中并计数蠕虫的数量。计算必须移液多少体积才能获得 500-1000 蠕虫/μL。
- 将 500-1000 个 L1 同步蠕虫(步骤 1.2.8)转移到以大肠杆菌 OP50 细菌作为食物来源接种的 NGM 琼脂平板(150 mm x 90 mm,补充表 1)中,直到它们在 20 °C 下达到幼虫第 4 阶段 (L4)。
注意:蠕虫可以使用自动移液器转移。如果没有自动移液器,请使用玻璃巴斯德移液器,并且可以使用微管标签或玻璃刻度移液器控制体积。 - 同步 48 小时后20:借助塑料巴斯德移液管将 L4 幼虫用 M9 缓冲液(补充表 1)从板中收集到干净的锥形管 50 mL 中,并用新鲜的 M9 缓冲液洗涤 3 次或重复洗涤,直到所有剩余的 大肠杆菌 OP50 细菌完全去除(在室温下)。
注意:洗涤步骤很重要,因为一些蠕虫在手术过程中会感到饥饿。
- 运行检测
- 从先前制备的每个新 NGM 琼脂板 (60 mm x 15 mm) 中转移 500-1000 个 L4 蠕虫(步骤 1.3.1)(步骤 1.1.2 和 1.1.3)。将它们在 20 °C 下保持 48 小时直至测试日。该时间表将导致以下三个实验组,一式两份(图 1):
A-(饥饿):蠕虫会在没有 大肠杆菌 OP50 细菌的常规 NGM 琼脂平板上生长;
B-(常规):蠕虫将在接种大 肠杆菌 OP50 细菌的常规 NGM 琼脂平板上生长;
C-(高葡萄糖):蠕虫会在接种有大 肠杆菌 OP50 细菌并含有 0.025 M D-葡萄糖的 NGM 琼脂平板上生长。 - 在测试日(48 小时后):收集蠕虫并在 M9 缓冲液中对它们进行三次短暂洗涤(步骤 1.2.2 和 1.2.3)
注意:在这里,准备添加 D-葡萄糖的 NGM 琼脂平板(步骤 1.3)并将它们放在一边,直到需要添加蠕虫。- 碘染色:使用新鲜的 M9 缓冲液制备 5% (v/v) Lugol 碘溶液(碘/碘化钾溶液)。
注:Lugol 的碘溶液可从当地试剂供应商或药房获得,因此初始浓度可能会有所不同。如有必要,计算以获得 5% (v/v) 的溶液。
- 碘染色:使用新鲜的 M9 缓冲液制备 5% (v/v) Lugol 碘溶液(碘/碘化钾溶液)。
- 将每组大约 100 μL 洗涤的蠕虫(步骤 4.2)转移到含有稀释的 Lugol 溶液 (5% v/v) 的 1.5 mL 微管中。使用自动移液器以 1:5 的比例将 100 μL 蠕虫转移到 400 μL Lugol 溶液中,然后在混合器中轻轻搅拌 5 分钟。
注意:如果没有混合器,可以用手小心摇晃微管。 - 5 分钟后,立即以 1400 x g 的速度离心 1.5 mL 微管(蠕虫 + Lugol 溶液)3 分钟。
注:如果对 L4 期或更高阶段的蠕虫进行此分析,则可以实现重力沉降而不是使用离心机。将微管放在工作台上的架子上打开 10 分钟,直到所有蠕虫都沉淀在微管底部。 - 去除上清液,用 1.0 mL 新鲜 M9 缓冲液洗涤蠕虫。重复洗涤,直到从溶液中去除所有剩余的碘(至少 3 次)。
- 在最后一个洗涤步骤之后,除去除约 100 μL 残留的上清液。使用它来轻轻重悬蠕虫并进行显微镜分析。
- 将大约 50 μL 重悬的蠕虫溶液转移到显微镜载玻片上,并用盖玻片盖住它们。使用立体显微镜(1.5 倍)观察明场图像。
注意:如果没有立体显微镜,可以使用普通显微镜,并且可以使用适配器用手机摄像头(3.4 倍)捕捉图像。为防止光线/亮度/曝光误差,所有照片的所有手机相机设置保持一致至关重要。
- 从先前制备的每个新 NGM 琼脂板 (60 mm x 15 mm) 中转移 500-1000 个 L4 蠕虫(步骤 1.3.1)(步骤 1.1.2 和 1.1.3)。将它们在 20 °C 下保持 48 小时直至测试日。该时间表将导致以下三个实验组,一式两份(图 1):
- 数据检查
- 定量数据:根据蠕虫的碘染色计算糖原含量。
- 将立体显微镜的图像保存为.jpeg文件,每组至少包含 10 个蠕虫,以供进一步处理。下载免费的 ImageJ 软件来执行此操作。详细信息见 补充文件 1、补充图 1、补充图 2。
- 使用 ImageJ 软件打开.jpeg图像(可在 https://imagej.nih.gov/ij/download.html 免费下载)。单击 Segmented line 并勾勒出蠕虫的轮廓(一次一个蠕虫)。单击 Analyze,然后选择 Measure 以获得污渍定量。数据将在表中显示为 Mean。平均值表示根据每个蠕虫区域的染色密度计算的数据。
- 定性数据:从每组的立体显微镜中获取图像,并目视比较蠕虫的染色。如果需要,创建一个评分系统来分析染色:0 无色;1 个轻微染色;2 个染色,3 个严重染色。使用立体显微镜,用手动计数器手动计数每组(最少)大约 10 条蠕虫。
- 定量数据:根据蠕虫的碘染色计算糖原含量。
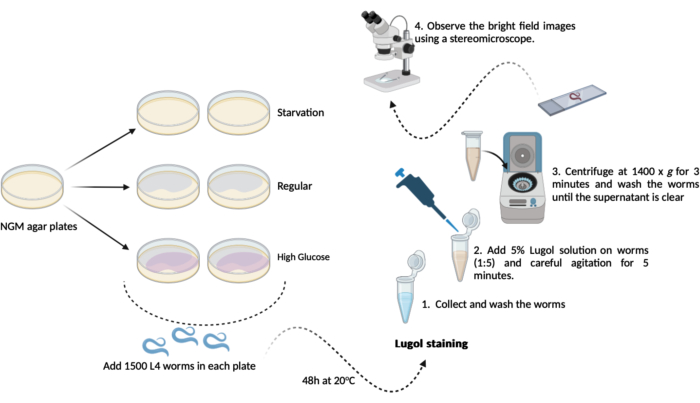
图 1: 秀丽隐杆线虫的总体糖原含量测定示意图。 此处进行的进行糖原含量测定的实验示意图。 请单击此处查看此图的较大版本。
2. 肠道通透性的评估
- 蠕虫的制备
- 同步后约 14 小时(步骤 1.2.8),将第一个幼虫阶段 (L1) 的 500-1000 条蠕虫(步骤 1.3.1 和注释)转移到先前制备的每个新 NGM 琼脂平板 (60 mm x 15 mm) 中,并将它们保持在 20 °C 直至测试当天。此时间表将导致以下两个实验组(图 2):
A-(幼虫):蠕虫将在接种大 肠杆菌 OP50 细菌的 NGM 琼脂平板上生长,直到幼虫阶段 4 (L4);
B-(老):蠕虫将在接种有 细菌大肠杆菌 OP50 的 NGM 琼脂平板上生长,直到成年的第 7 天。
注意:维持到成年第 7 天的蠕虫必须每天用 M9 缓冲液洗涤,并转移到新的 NGM 琼脂平板 (60 mm x 15mm) 中,其中含有 200 μL 大肠杆菌 OP50 细菌,先前接种用于食物替代和去除后代。年轻的蠕虫在倾析过程中漂浮,可以通过去除上清液来分离。蓝精灵蠕虫的比例随着年龄的增长而增加。然而,肠道通透性的评估可以在任何阶段和年龄进行,具体取决于研究的目的。
- 同步后约 14 小时(步骤 1.2.8),将第一个幼虫阶段 (L1) 的 500-1000 条蠕虫(步骤 1.3.1 和注释)转移到先前制备的每个新 NGM 琼脂平板 (60 mm x 15 mm) 中,并将它们保持在 20 °C 直至测试当天。此时间表将导致以下两个实验组(图 2):
- 运行检测
- 在测试当天,用 M9 缓冲液(补充表 1)收集 L4 蠕虫(步骤 2.1.1 后 2 天)和第7 天(现在是第 9 天)的成年蠕虫,并转移到标记的 1.5 mL 微管中。
- 以 1400 x g 离心 3 分钟,去除上清液,加入 1.0 mL M9,轻轻混合。重复此过程 3 次以去除细菌。最后一次洗涤后,将体积减少至 500 μL。
- 使用自动移液器,将 10 μL 蠕虫沉积物添加到显微镜载玻片中并计数蠕虫的数量。计算要移液的体积以获得 100 个蠕虫/μL。
- 蓝精灵染色:使用蒸馏水制备 25% 依立奥劳辛二钠盐(补充表 1)溶液。如有必要,使用涡旋以更好地溶解。
- 在先前新鉴定的微管中,使用自动移液管加入含有 100 条蠕虫的体积、100 μL 25% 艾瑞奥劳辛二钠盐溶液、200 μL 大肠杆菌 OP50 并加入 M9 缓冲液,最终体积为 500 μL。
注意:Erioglaucine 二钠、 大肠杆菌 和蠕虫数量的体积是固定的。M9 缓冲液的体积是可变的,可用于使最终体积达到 500 μL。 - 在室温下避光在混合器中搅拌孵育 3 小时。
注意:如果没有混合器,请每 15 分钟用手小心摇动微管。 - 3 小时后,将 1.5 mL 微管以 1400 x g 离心 3 分钟。去除 1.0 mL 上清液,并用 1.0 mL M9 缓冲液洗涤蠕虫。
- 重复洗涤,直到从溶液中去除剩余的 Erioglaucine 二钠盐溶液。在最后一个洗涤步骤之后,除去除约 250 μL 残留的上清液。使用它来小心地重悬蠕虫并处理它们以进行显微镜分析。
- 将大约 50 条重悬蠕虫溶液的蠕虫转移到显微镜载玻片上,并用盖玻片盖住它们。将显微镜载玻片在 -20 °C 的冰箱中孵育 10 分钟以麻痹蠕虫。
注意:麻痹蠕虫的另一种替代方法是添加 10 μL 盐酸左旋咪唑溶液(10 mM; 附表 1)并用盖玻片盖住它们。 - 使用立体显微镜(1.5 倍)中的明场观察和计数蠕虫的总数和完全染色的蠕虫。可以从手机摄像头(3.4 倍)和适配器获得图像。为防止光线/亮度/曝光误差,所有照片的所有手机相机设置保持一致至关重要。
- 数据检查
- 定性数据:从每组(成年的 L4 和第 7 天)的立体显微镜中获取图像,并目视比较蠕虫的染色。
- 使用立体显微镜计算蠕虫的总数和蓝精灵蠕虫(蓝色蠕虫)的数量。
- 通过比较年轻蠕虫(L4,作为对照组)和老蠕虫(成年第 7 天),将结果表示为蓝精灵蠕虫的百分比:
A x X = 100 (%) x B
X = 100 x B / A
其中,A = 蠕虫总数
B= 蓝精灵蠕虫的数量

图 2: 秀丽隐杆线虫的总体肠道通透性测定示意图。 (A) 秀丽隐杆线虫 制备。(B) 用 Erioglaucine 二钠盐染色。 请单击此处查看此图的较大版本。
结果
糖原含量测定为筛选各种检测条件提供了一种稳定而快速的方法,例如可能影响糖原合成或降解的不同菌株的比较研究。在这项研究中,L4 蠕虫接受了三种不同的测试条件:空腹组、进食组和富含葡萄糖组。该测定进行了 3 次,每个条件在每次测定中重复两次; 图 3 显示了一个具有代表性的图像。每次测定后,使用立体显微镜观察用 Lugol 碘溶液染色...
讨论
总之,该方案使用 Lugol 染色对单个 秀丽隐杆线虫 中的糖原含量进行了定性评估:一种简单、稳健且快速的测定。Lugol 染色是一种无标记、无创的方法,有助于以亚细胞分辨率采集分子数据,从而可以监测单个蠕虫内的糖原含量波动10。此外,由于其设备要求最低,该分析具有成本效益的优势。只需要显微镜或体视显微镜即可捕获图像,只要所有?...
披露声明
作者没有什么可披露的。
致谢
D.S.A 感谢来自 Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/巴西),资助号 #301808/2018-0、#313117/2019-5、Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/巴西),资助号,21/2551-0001963-8,Coordenação de Aperfeiçoamento de Pessoal de Nível Superior(CAPES,NSJ 和 A.C.S 的财务代码 001)
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
参考文献
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。