Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование недорогих красителей для визуализации накопления гликогена и целостности кишечника при Caenorhabditis elegans
* Эти авторы внесли равный вклад
В этой статье
Резюме
Преподавание биологических наук может быть более стимулирующим для студентов за счет использования экспериментов. В этой рукописи представлены два различных, но взаимодополняющих протокола, которые могут быть использованы в классе, чтобы побудить студентов формулировать и проверять гипотезы, связанные с высококалорийными диетами, голоданием и старением.
Аннотация
Caenorhabditis elegans (C. elegans) - это прозрачная, непаразитическая нематода с простой биологией, что делает ее отличным инструментом для преподавания биологических наук путем окрашивания клеток или их молекулярного содержимого. Краситель Люголя (раствор йода-йодида калия) широко используется в биохимии для окрашивания запасов гликогена. В этом контексте можно наблюдать различия между кормящими и голодными животными, помимо эффектов различных условий, таких как разный рацион и уровень кислорода. Эриоглауцин – это синий краситель, который указывает на потерю кишечного барьера. Когда кишечный барьер не поврежден, синий краситель окрашивается внутри просвета; Однако, когда эта целостность нарушается, краситель просачивается в полость тела. Используя стереомикроскоп или микроскоп, учителя могут продемонстрировать физиологические и биохимические изменения или побудить учащихся задать научный вопрос, выдвинуть гипотезу и проверить свою гипотезу с помощью этих анализов. В настоящем протоколе описаны два метода окрашивания у C. elegans , которые могут быть легко выполнены студентами.
Введение
Преподавание биологических наук в старших классах – это постоянная задача. Примечательно, что доступ к технологиям и их использование привели к важным достижениям в процессе преподавания и обучения, однако такие инструменты, как чат-боты с искусственным интеллектом, затрудняют рационализацию и поиск доказательств из-за простых (и иногда неправильных) полученных ответов. В связи с этим использование научного метода с практическими экспериментами в рамках исследовательского подхода в классе является важной стратегией для развития или стимулирования критического мышления, творчества и технических навыкову учащихся.
В этом контексте свободноживущая нематода Caenorhabditis elegans была успешно использована в экспериментах в учебных целях3 благодаря своим особым преимуществам: она не является паразитом, а кишечная палочка , используемая для кормления, имеет уровень биобезопасности-1, что снижает биологическую опасность почти до нуля; Он имеет элегантное и количественно измеримое движение передвижения, за которым студентам интересно наблюдать; и он прозрачный, что позволяет не только наблюдать за органами, но и окрашивать пигментами, которые могут указывать на наличие биомолекул или возникновение физиологических изменений4. Таким образом, можно выдвигать гипотезы и проверять в классе простые постулаты, связанные с биохимией и физиологическими изменениями, такими как старение.
Гликоген представляет собой запасной углевод, образованный длинной и разветвленной цепью молекул глюкозы, образованных глюкозильными остатками с (1→4)-α гликозидными линейными связями и (1→6)-α гликозидными связями в точках ветвления, и особенно важен для сокращения мышц, дифференцировки клеток и поддержания гликемии. Гликоген синтезируется после кормления за счет активации инсулином фермента гликоген-синтазы. Во время физических упражнений или голодания адреналин или глюкагон, соответственно, активируют гликогенфосфорилазу и, следовательно, расщепляют полисахарид для обеспечения глюкозо-6-фосфата мышечными клетками или высвобождают свободную глюкозу для обхода гипогликемии 6,7. Изменения уровня гликогена влияют на клеточную дифференцировку, передачу сигналов, окислительно-восстановительную регуляцию и стволовость при различных физиологических и патофизиологических условиях, включая рак8. У C. elegans гликоген в основном содержится в мышцах пищевода, гиподерме, кишечнике, нейронах и главным образом в мышцах стенок тела9. Содержание гликогена можно измерить с помощью раствора йода Люголя, поскольку йод связывается со спиральными спиралями, образуя йод-гликогеновый комплекс, придавая видимый резкий сине-черный или коричнево-черный цвет, который был успешно использован для демонстрации содержания гликогена в C. elegans10. Было продемонстрировано, что накопление гликогена, вызванное высоким содержанием глюкозы, может сократить продолжительность жизни червя, тем самым ускоряя процесс старения11,12. Кроме того, метаболические нарушения, другие гормоны и воздействие ксенобиотиков также могут изменить метаболизм гликогена13,14. Таким образом, эксперименты по содержанию гликогена в C. elegans весьма интересны, поскольку различные факторы могут нарушить его метаболизм и стимулировать обсуждение в классе основных биохимических процессов, связанных с такими сквозными темами, как физические упражнения, диеты, болезни и старение.
Старение — это зависящее от времени функциональное снижение, вызванное повреждением клеток. Это повреждение может быть связано с окислительным стрессом, истощением теломер, потерей протеостаза, воспалением и даже накоплением нерастворимых полиглюкозановых тел15, и это лишь некоторые из них. Одним из признаков старения является снижение целостности кишечника, связанное с несколькими хроническими состояниями, возникающими в течение жизниорганизма. Поддержание гомеостаза кишечника зависит от целостности кишечного эпителия, который поддерживается соединительными белками, образующими физический барьер и соединяющими соседние эпителиальные клетки. При повреждении этого эпителия происходит утечка содержимого люминала в интерстиций17. Основываясь на этом механизме, тест на смурф был использован для проверки целостности кишечника на нескольких животных моделях, поскольку этот синий краситель Erioglaucine disodium salt не пересекает кишечную мембрану, оставаясь в просвете18. Когда черви заражаются патогеном, контаминируются какими-либо токсикантами или стареют, изменяя целостность интерстициальных поверхностей, краситель пересекает барьер и распространяется по всему червю, который становится полностью синим. Этот анализ позволяет обсудить физиологию старения и экспериментировать с факторами, которые могут ускорить или замедлить этот процесс, подвергая червей воздействию различных условий. В приведенных здесь протоколах будут подробно описаны эти два метода, основанных на красителях, которые можно легко использовать в классе, чтобы побудить и стимулировать учащихся к формулированию и проверке гипотез, связанных с биохимией и физиологией.
Первая часть протокола показывает его применимость для качественного и количественного анализа содержания гликогена в модели C. elegans 10. Целью второй части протокола является оценка целостности кишечника C. elegans. Этот метод позволяет проводить мониторинг старения C. elegans путем оценки целостности кишечных оболочек. Кроме того, это позволяет оценить, ускоряет или замедляет старение вещество и обладают ли какие-либо вещества токсическим потенциалом на кишечном барьере.
Штамм C. elegans , использованный для настоящего исследования, был бристольским N2 дикого типа. Тем не менее, процедура может быть воспроизведена с использованием штаммов, которые демонстрируют сопоставимые темпы роста, или метод должен быть скорректирован в зависимости от потребности в замене оборудования, учитывая, что они имеют одинаковую или сходную функцию, или в зависимости от используемого штамма, поскольку определенные штаммы имеют специфические требования к обслуживанию и/или чувствительности; эту информацию можно получить в Центре генетики Caenorhabditis (CGC) или на веб-сайте WormBase. Эти изменения не должны влиять на воспроизводимость метода.
протокол
ПРИМЕЧАНИЕ: Бактерии Escherichia coli OP50 (E. coli OP50) и штаммы дикого типа Bristol N2 могут быть получены от CGC, Университет Миннесоты, США или за счет пожертвования в лаборатории C. elegans . Для безопасности исследователей крайне важно использовать средства индивидуальной защиты. Несмотря на то, что концентрации таких реагентов, как гипохлорит и гидроксид натрия, низкие, важно носить рекомендованные СИЗ, как указано в рукописи, чтобы свести к минимуму любые потенциальные риски, связанные с этими химическими веществами.
1. Содержание гликогена
- Подготовка тестовых планшетов
- Приготовьте шесть агаровых пластин размером 60 мм x 15 мм NGM по20 (10 мл нематодного агара для роста нематоды, NGM, как описано в дополнительной таблице 1) для каждого штамма червя и дайте им высохнуть в течение 1 дня при комнатной температуре. Держите пластины закрытыми, чтобы предотвратить загрязнение.
- Добавьте 200 мкл жидкой культуры E. coli OP50 (с оптической плотностью = 0,600, приблизительно при длине волны 600 нм) на планшет, чтобы инокулировать в общей сложности четыре планшета NGM размером 60 мм x 15 мм на штамм в проточном колпаке. Перед использованием дайте закрытым планшетам поинкубироваться при температуре 37 °C в течение 1 суток.
ПРИМЕЧАНИЕ: Подготовьте шесть планшетов (шаг 1.1), но завите только 4 из них бактериями E. coli OP50. Оставьте оставшиеся две пластины при температуре 4 °C для последующего использования при помещении червей в голодные условия. Этот анализ может быть выполнен в двух экземплярах. - В день испытания добавьте 200 мкл 0,025 M D-глюкозы в две (6 мм x 15 мм) агаровые пластины NGM для каждого штамма, которые ранее были засеяны бактериями E. coli OP50. Дайте пластинам высохнуть при комнатной температуре в проточной вытяжке.
ПРИМЕЧАНИЕ: Агаровые пластины NGM, засеянные бактериями E. coli OP50, также можно сушить рядом со спиртовыми лампами в качестве альтернативы использованию проточного колпака.
- Синхронизация
- Примерно за 3 дня до синхронизации перенесите 3-4 куска (3 см x 3 см) из поддерживающего NGM агара с C. elegans Bristol N2 (дикий тип) на разных стадиях (около 500 червей на кусок) на новую пластину (150 мм x 90 мм), которая ранее была засеяна бактериями E. coli OP50.
- Поместите новую пластину с червями в контролируемую среду при температуре 20 °C и поддерживайте влажность >95% в течение 3 дней (72 ч позволяют большинству червей достичь взрослой стадии).
ПРИМЕЧАНИЕ: Может потребоваться корректировка температуры роста в зависимости от используемого штамма (штаммов) C. elegans . - С помощью пастеровской пипетки соберите червей из подготовленной тарелки с дистиллированным H2O и перенесите их в центрифужную пробирку объемом 50 мл.
- Дождитесь оседания червей под действием силы тяжести (примерно 15 минут), а затем удалите надосадочную жидкость. Повторите этот процесс 3 раза, чтобы уничтожить бактерии. После последнего мытья уменьшите объем до 5 мл.
- Добавьте 10 мл отбеливающего раствора (Дополнительная таблица 1) и энергично встряхивайте руками в течение примерно 6 минут.
- Сразу после завершения встряхивания заполните пробирки до емкости 50 мл буфером M9.
- Центрифугируйте при 1400 х г в течение 3 минут, удалите надосадочную жидкость до 5 мл, а затем снова добавьте 45 мл буфера М9. Повторите этот процесс 4 раза.
- После последней стирки уменьшите объем до 15 мл и поддерживайте его на контролируемой температуре (20 °C) и влажности (>95%) в течение примерно 14 часов.
ПРИМЕЧАНИЕ: Процесс синхронизации может быть заменен получением яиц с помощью яйцекладки: Перенесите примерно 20 взрослых беременных червей в планшет NGM (6 мм x 15 мм), предварительно засеянный 200 μл E. coli OP50. Дайте глистам отложить яйца в течение 1 суток. После этого удалите беременных глистов и дождитесь вылупления яиц.
- Подготовка глистов
- С помощью автоматической пипетки добавьте 10 мкл синхронизированных червей (шаг 1.2.8) на предметное стекло микроскопа и подсчитайте количество червей. Рассчитайте, какой объем необходимо отпижать, чтобы получить 500-1000 червей/мкл.
- Перенесите 500-1000 синхронизированных червей L1 (шаг 1.2.8) в агаровые пластины NGM (150 мм x 90 мм, дополнительная таблица 1), засеянные бактериями E. coli OP50 в качестве источника пищи, до тех пор, пока они не достигнут стадии личинок 4 (L4) при 20 °C.
ПРИМЕЧАНИЕ: Червей можно переносить с помощью автоматической пипетки. Если автоматическая пипетка недоступна, используйте стеклянную дозатор Пастера, а объемы можно контролировать с помощью этикеток из микропробирок или стеклянных градуированных пипеток. - Через 48 ч синхронизации20: соберите личинки L4 из планшетов с буфером M9 (дополнительная таблица 1), с помощью пластиковой пипетки Пастера в чистую коническую пробирку объемом 50 мл и промойте их 3 раза свежим буфером M9 или повторите промывку до полного удаления всех оставшихся бактерий E. coli OP50 (при комнатной температуре).
ПРИМЕЧАНИЕ: Этап промывания важен, потому что некоторые черви будут испытывать голодание во время процедуры.
- Проведение анализа
- Перенесите 500-1000 червей L4 (шаг 1.3.1) с каждой из новых агаровых пластин NGM (60 мм x 15 мм), подготовленных ранее (шаги 1.1.2 и 1.1.3). Держите их при температуре 20 °C в течение 48 часов до дня испытания. В результате этого графика будут созданы три экспериментальные группы, как показано в двух экземплярах (рисунок 1):
А- (голодание): черви будут расти на обычных агаровых пластинах NGM без бактерий E. coli OP50;
B- (обычный): черви будут расти на обычных агаровых пластинах NGM, засеянных бактериями E. coli OP50;
С- (высокий уровень глюкозы): черви будут расти на агаровых пластинах NGM, засеянных бактериями E. coli OP50 и содержащих 0,025 М D-глюкозы. - В день теста (через 48 ч): соберите червей и дайте им три кратких промывки в буфере M9 (шаги 1.2.2 и 1.2.3)
ПРИМЕЧАНИЕ: Здесь приготовьте пластины с агаром NGM с добавлением D-глюкозы (шаг 1.3) и отложите их в сторону до тех пор, пока не придет время добавлять червей.- Окрашивание йодом: приготовьте 5% (v/v) раствор йода Люголя (раствор йода/йодида калия) с использованием свежего буфера M9.
ПРИМЕЧАНИЕ: Раствор йода Люголя можно получить у местных поставщиков реагентов или в аптеках, поэтому начальная концентрация может варьироваться. При необходимости рассчитайте получение 5% (v/v) раствора.
- Окрашивание йодом: приготовьте 5% (v/v) раствор йода Люголя (раствор йода/йодида калия) с использованием свежего буфера M9.
- Перенесите примерно 100 мкл промытых червей (шаг 4.2) из каждой группы в микропробирку объемом 1,5 мл, содержащую разбавленный раствор Люголя (5% v/v). С помощью автоматической пипетки в пропорции 1:5 переведите 100 мкл червей в 400 мкл раствора Люголя с последующим аккуратным перемешиванием в миксере в течение 5 мин.
ПРИМЕЧАНИЕ: Если миксер недоступен, можно осторожно встряхнуть микротрубки руками. - Сразу после этих 5 минут центрифугируйте микропробирку объемом 1,5 мл (черви + раствор Люголя) при 1400 x g в течение 3 минут.
ПРИМЕЧАНИЕ: Если этот анализ проводится на червях, начиная со стадии L4 или выше, можно добиться гравитационного осаждения вместо использования центрифуги. Оставьте микропробирки открытыми в решетках на столе на 10 минут, пока все черви не осядут на дне микропробирки. - Удалите надосадочную жидкость и промойте червей 1,0 мл свежего буфера M9. Повторяйте стирку до тех пор, пока из раствора не будет удален весь оставшийся йод (минимум 3 раза).
- После последнего этапа промывки удалите надосадочную жидкость, за исключением остатка примерно 100 μл. Используйте его для мягкого ресуспендирования червей и для микроскопического анализа.
- Перенесите примерно 50 мкл ресуспендированного раствора червя на предметные стекла для микроскопии и накройте их покровными стеклами. Наблюдайте за изображениями яркого поля с помощью стереомикроскопа (с кратностью 1,5x).
ПРИМЕЧАНИЕ: Если стереомикроскоп недоступен, можно использовать обычный микроскоп, а изображения можно получать с помощью камеры мобильного телефона (с кратностью 3,4x) с помощью адаптера. Чтобы предотвратить ошибки, связанные со светом/яркостью/экспозицией, крайне важно, чтобы все настройки камеры мобильного телефона оставались неизменными для всех изображений.
- Перенесите 500-1000 червей L4 (шаг 1.3.1) с каждой из новых агаровых пластин NGM (60 мм x 15 мм), подготовленных ранее (шаги 1.1.2 и 1.1.3). Держите их при температуре 20 °C в течение 48 часов до дня испытания. В результате этого графика будут созданы три экспериментальные группы, как показано в двух экземплярах (рисунок 1):
- Проверка данных
- Количественные данные: Рассчитайте содержание гликогена на основе йодного окрашивания червей.
- Сохраняйте изображения со стереомикроскопа, содержащего не менее 10 червей на группу, в виде файла .jpeg для дальнейшей обработки. Для этого загрузите бесплатное программное обеспечение ImageJ. Подробная информация представлена в Дополнительном файле 1, Дополнительном рисунке 1, Дополнительном рисунке 2.
- Откройте .jpeg изображение с помощью программы ImageJ (которую можно бесплатно скачать на сайте https://imagej.nih.gov/ij/download.html). Нажмите на Сегментированная линия и обведите червя (по одному червю за раз). Нажмите « Анализировать», а затем выберите «Измерить », чтобы получить количественную оценку пятен. Данные будут отображаться в таблице как Среднее. Среднее значение указывает на данные, рассчитанные на основе плотности окрашивания на площадь червяка.
- Качественные данные: Получите изображения со стереомикроскопа каждой группы и визуально сравните окрашивание червей. Создать систему подсчета баллов, при необходимости проанализировать окрашивание: 0 бесцветных; 1 слегка окрашенный; 2 окрашенных и 3 сильно окрашенных. С помощью стереомикроскопа вручную подсчитайте примерно 10 червей в группе (минимум) с помощью ручного счетчика.
- Количественные данные: Рассчитайте содержание гликогена на основе йодного окрашивания червей.
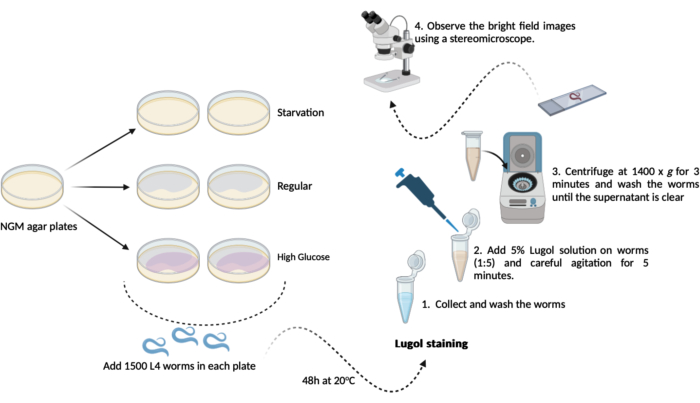
Рисунок 1: Схема анализа общего содержания гликогена у C. elegans. Приведена схема выполненного здесь эксперимента по проведению анализа содержания гликогена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Оценка проницаемости кишечника
- Подготовка глистов
- Примерно через 14 ч после синхронизации (шаг 1.2.8) перенесите 500-1000 червей (шаг 1.3.1 и ПРИМЕЧАНИЕ) на первой личиночной стадии (L1) на каждую новую ранее подготовленную агаровую пластину NGM (60 мм x 15 мм) и выдерживайте их при температуре 20 °C до дня испытания. Этот график приведет к разделению двух экспериментальных групп следующим образом (Рисунок 2):
A- (молодые): черви будут расти на пластинах NGM agar, засеянных бактерией E. coli OP50, до личиночной стадии 4 (L4);
B- (старый): черви будут расти на пластинах NGM-агара, засеянных бактерией E. coli OP50, до7-го дня взрослой жизни.
ПРИМЕЧАНИЕ: Червей, содержащихся до7-го дня взрослой жизни, необходимо ежедневно промывать буфером M9 и пересаживать на новые агаровые пластины NGM (60 мм x 15 мм) с 200 μл бактерий E. coli OP50, предварительно посеянных для замены пищи и удаления потомства. Более молодые черви плавают во время сцеживания и могут быть отделены путем удаления надосадочной жидкости. Доля червей смурфов увеличивается с возрастом. Однако оценка проницаемости кишечника может быть выполнена на любой стадии и в любом возрасте, в зависимости от цели исследования.
- Примерно через 14 ч после синхронизации (шаг 1.2.8) перенесите 500-1000 червей (шаг 1.3.1 и ПРИМЕЧАНИЕ) на первой личиночной стадии (L1) на каждую новую ранее подготовленную агаровую пластину NGM (60 мм x 15 мм) и выдерживайте их при температуре 20 °C до дня испытания. Этот график приведет к разделению двух экспериментальных групп следующим образом (Рисунок 2):
- Проведение анализа
- В день испытания соберите червей L4 (через 2 дня после шага 2.1.1) и взрослых червей на7-й день (сейчас на9-й день) с помощью буфера M9 (дополнительная таблица 1) и перенесите в меченые микропробирки объемом 1,5 мл.
- Центрифугируйте при 1400 x g в течение 3 минут, удалите надосадочную жидкость, добавьте 1,0 мл M9 и аккуратно перемешайте. Повторите этот процесс 3 раза, чтобы удалить бактерии. После последней стирки уменьшите объем до 500 μл.
- С помощью автоматической пипетки добавьте 10 μл осадка червей на предметное стекло микроскопа и подсчитайте количество червей. Рассчитайте объем, который необходимо пипетировать, чтобы получить 100 червей/мкл.
- Окрашивание смурфов: приготовьте 25% раствор динатриевой соли эриоглауцина (дополнительная таблица 1) с использованием дистиллированной воды. При необходимости используйте вихрь для лучшей солюбилизации.
- В новые ранее идентифицированные микропробирки с помощью автоматической пипетки добавляют объем, содержащий 100 червей, 100 мкл 25% раствора соли динатрия эриоглауцина, 200 мкл E. coli OP50 и в комплекте с буфером М9 для получения конечного объема 500 мкл.
ПРИМЕЧАНИЕ: Объемы эриоглауцина динатрия, кишечной палочки и количество червей фиксированы. Объем буфера M9 является переменным и может быть использован для доведения конечного объема до 500 μл. - Выдерживать в течение 3 ч с перемешиванием в смесителе, защищенном от света, при комнатной температуре.
ПРИМЕЧАНИЕ: Если миксер недоступен, осторожно встряхивайте микропробирки руками каждые 15 минут. - Через 3 ч центрифугируйте микропробирку объемом 1,5 мл при давлении 1400 x g в течение 3 мин. Удалите 1,0 мл надосадочной жидкости и промойте червей 1,0 мл буфера M9.
- Повторяйте промывания до тех пор, пока из раствора не будет удален оставшийся раствор соли Эриоглауцина динатрия. После последнего этапа промывки удалите надосадочную жидкость, за исключением остатка примерно 250 мкл. Используйте его для осторожной ресуспендации червей и обработки их для микроскопического анализа.
- Перенесите примерно 50 червей ресуспендированного раствора червей на предметные стекла для микроскопии и накройте их покровными стеклами. Инкубируйте предметные стекла для микроскопии в холодильнике при температуре -20 °C в течение 10 минут, чтобы парализовать червей.
ПРИМЕЧАНИЕ: Еще одной альтернативой для паралича червей является добавление 10 мкл раствора левамизола гидрохлорида (10 мМ; Дополнительная таблица 1) и накрываем их покровными листами. - Наблюдайте и подсчитывайте общее количество червей и полностью окрашенных червей с помощью светлого поля в стереомикроскопе (в 1,5 раза). Изображения могут быть получены с камеры мобильного телефона (с 3,4-кратным увеличением) в сочетании с адаптером. Чтобы предотвратить ошибки, связанные со светом/яркостью/экспозицией, крайне важно, чтобы все настройки камеры мобильного телефона оставались неизменными для всех изображений.
- Проверка данных
- Качественные данные: Получить изображения со стереомикроскопа каждой группы (L4 и7-й день взрослой жизни) и визуально сравнить окрашивание червей.
- Посчитайте общее количество червей и количество червей-смурфов (синих червей) с помощью стереомикроскопа.
- Выразите результаты в процентном соотношении червей-смурфов путем сравнения молодых червей (L4, как контрольная группа) и старых червей (7-й день взрослой жизни):
А х Х = 100 (%) х В
Х = 100 х Б / А
Где, A = общее количество червей
B= количество червей-смурфов

Рисунок 2: Схема анализа общей проницаемости кишечника у C. elegans. (А) Препарат C. elegans . (Б) Окрашивание солью динатрия эриоглауцина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Анализ содержания гликогена обеспечивает надежный и быстрый метод скрининга различных условий тестирования, таких как сравнительные исследования различных штаммов, которые могут влиять на синтез или деградацию гликогена. В этом исследовании черви L4 подвергались т?...
Обсуждение
Таким образом, этот протокол обеспечивает качественную оценку содержания гликогена в отдельных червях C. elegans с использованием окрашивания по Люголю: прямой, надежный и быстрый анализ. Окрашивание по методу Люголя представляет собой безметочный и неинвазивный п?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
D.S.A выражает благодарность за финансирование от Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brazil), номер гранта #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/Brazil), номер гранта, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Финансовый код 001 для N.S.J и A.C.S)
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
Ссылки
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены