É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando corantes de baixo custo para visualizar o acúmulo de glicogênio e a integridade intestinal em Caenorhabditis elegans
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O ensino de ciências biológicas pode ser mais estimulante para os alunos por meio do uso da experimentação. Este manuscrito apresenta dois protocolos diferentes, porém complementares, que podem ser utilizados em sala de aula para incentivar os alunos a formular e testar hipóteses relacionadas a dietas hipercalóricas, fome e envelhecimento.
Resumo
Caenorhabditis elegans (C. elegans) é um nematóide transparente, não parasita, com uma biologia simples, o que o torna uma ótima ferramenta para o ensino de ciências biológicas através da coloração das células ou de seu conteúdo molecular. O corante Lugol (solução de iodo-iodeto de potássio) tem sido amplamente utilizado em bioquímica para manchar os estoques de glicogênio. Nesse contexto, é possível observar diferenças entre animais alimentados e famintos, além dos efeitos de diferentes condições, como diferentes dietas e níveis de oxigênio. A erioglaucina é um corante azul que indica a perda da barreira intestinal. Quando a barreira intestinal está intacta, o corante azul mancha dentro do lúmen; no entanto, quando essa integridade é interrompida, o corante vaza para a cavidade do corpo. Usando um estereomicroscópio ou um microscópio, os professores podem demonstrar alterações fisiológicas e bioquímicas, ou podem instigar os alunos a fazer uma pergunta científica e hipotetizar e testar suas hipóteses usando esses ensaios. O presente protocolo descreve duas técnicas de coloração em C. elegans que podem ser facilmente realizadas pelos alunos.
Introdução
O ensino de ciências biológicas no ensino médio é um desafio contínuo. Notadamente, o acesso e o uso da tecnologia trouxeram avanços importantes no processo de ensino-aprendizagem, no entanto, ferramentas como os chatbots de inteligência artificial dificultam a racionalização e a busca de evidências devido às respostas fáceis (e às vezes incorretas) obtidas1. Por isso, o uso de um método científico com experimentação prática em uma abordagem baseada em investigação em sala de aula é uma estratégia importante para desenvolver ou estimular o pensamento crítico, a criatividade e as habilidades técnicas dos alunos2.
Nesse contexto, o nematóide de vida livre Caenorhabditis elegans tem sido usado com sucesso em experimentação para fins didáticos3 devido às suas vantagens particulares: Não é um parasita e a Escherichia coli usada para alimentação é de nível de biossegurança 1, reduzindo assim quase zero o risco biológico; tem um movimento de locomoção elegante e quantificável, que é interessante para os alunos observarem; e é transparente, o que permite a observação do órgão, mas também a coloração com pigmentos que podem indicar a presença de biomoléculas ou a ocorrência de alterações fisiológicas4. Portanto, é possível hipotetizar e testar em sala de aula postulações simples relacionadas à bioquímica e às alterações fisiológicas como o envelhecimento.
O glicogênio é um carboidrato de armazenamento, formado por uma cadeia longa e ramificada de moléculas de glicose formadas por resíduos de glicosil com ligações lineares glicosídicas (1→4)-α e ligações glicosídicas (1→6)-α em pontos de ramificação e é particularmente importante para a contração muscular, diferenciação celular e manutenção da glicemia5. O glicogênio é sintetizado após a alimentação devido à ativação da enzima glicogênio-sintase pela insulina. Durante o exercício ou jejum, a epinefrina ou o glucagon, respectivamente, ativam a glicogênio fosforilase e, portanto, quebram o polissacarídeo para fornecer glicose-6-fosfato às células musculares ou liberam glicose livre para contornar a hipoglicemia 6,7. Alterações nos níveis de glicogênio afetam a diferenciação celular, sinalização, regulação redox e estaminalidade sob várias condições fisiológicas e fisiopatológicas, incluindo câncer8. Em C. elegans, o glicogênio é encontrado principalmente no músculo esofágico, hipoderme, intestino, neurônios e principalmente nos músculos da parede corporal9. O conteúdo de glicogênio pode ser medido usando a solução de iodo de Lugol, uma vez que o iodo se liga às bobinas helicoidais formando um complexo iodo-glicogênio, dando uma cor azul-preta ou marrom-preta nítida visível, que tem sido usada com sucesso para demonstrar o conteúdo de glicogênio em C. elegans10. Foi demonstrado que o acúmulo de glicogênio causado pela alimentação com alto teor de glicose pode reduzir a vida útil do verme, acelerando o processo de envelhecimento11,12. Além disso, distúrbios metabólicos, outros hormônios e exposição a xenobióticos também podem alterar o metabolismo do glicogênio 13,14. Portanto, a experimentação sobre o conteúdo de glicogênio em C. elegans é bastante interessante, uma vez que diversos fatores podem perturbar seu metabolismo e podem estimular uma discussão em sala de aula sobre bioquímica básica associada a temas transversais como exercício, dietas, doenças e envelhecimento.
O envelhecimento é um declínio funcional dependente do tempo causado por danos celulares. Esse dano pode estar associado ao estresse oxidativo, ao desgaste dos telômeros, à perda de proteostase, à inflamação e até mesmo ao acúmulo de corpos insolúveis de poliglucosano15, apenas para citar alguns. Uma das marcas do envelhecimento é a redução da integridade intestinal, associada a diversas condições crônicas que ocorrem durante a vida de um organismo16. A manutenção da homeostase intestinal depende da integridade do epitélio intestinal, que é sustentado por proteínas juncionais que formam uma barreira física e conectam as células epiteliais adjacentes. Quando há dano a esse epitélio, ocorre vazamento de conteúdo luminal para o interstício17. Com base nesse mecanismo, o teste smurf tem sido utilizado para verificar a integridade intestinal em diversos modelos animais, uma vez que esse corante azul sal dissódico de Erioglaucina não atravessa a membrana intestinal, permanecendo no lúmen18. Quando os vermes são infectados com um patógeno, contaminados com alguns tóxicos ou idade, alterando a integridade intersticial, o corante atravessa a barreira e se espalha por todo o verme, que fica todo azul. Este ensaio permite discutir sobre a fisiologia do envelhecimento e experimentar fatores que podem acelerar ou retardar esse processo, expondo vermes a diferentes condições. Os protocolos aqui descreverão em detalhes esses dois métodos baseados em corantes que podem ser facilmente feitos em sala de aula para instigar e estimular os alunos a formular e testar hipóteses relacionadas à bioquímica e fisiologia.
A primeira parte do protocolo mostra sua aplicabilidade para analisar qualitativa e quantitativamente o conteúdo de glicogênio no modelo 10 de C. elegans. O objetivo da segunda parte do protocolo é avaliar a integridade do intestino de C. elegans. Esta técnica permite o monitoramento do envelhecimento de C. elegans avaliando a integridade das membranas intestinais. Além disso, permite avaliar se uma substância acelera ou retarda o envelhecimento e se alguma substância tem potencial tóxico na barreira intestinal19.
A cepa de C. elegans utilizada para o presente estudo foi Bristol N2 tipo selvagem. No entanto, o procedimento pode ser replicado utilizando cepas que apresentem taxas de crescimento comparáveis, ou o método deve ser ajustado com base na necessidade de substituição do equipamento, considerando que têm função igual ou semelhante, ou dependendo da cepa utilizada, pois certas cepas possuem requisitos específicos de manutenção e/ou sensibilidade; essas informações podem ser obtidas no Caenorhabditis Genetics Center (CGC) ou no site da WormBase. Essas alterações não devem afetar a reprodutibilidade do método.
Protocolo
NOTA: A bactéria Escherichia coli OP50 (E. coli OP50) e as cepas do tipo selvagem Bristol N2 podem ser obtidas no CGC, Universidade de Minnesota, EUA ou por doação de um laboratório de C. elegans . Para a segurança dos pesquisadores, é imprescindível o uso de Equipamentos de Proteção Individual. Embora as concentrações de reagentes como hipoclorito e hidróxido de sódio sejam baixas, é essencial usar o EPI recomendado, conforme destacado no manuscrito, para minimizar quaisquer riscos potenciais associados a esses produtos químicos.
1. Conteúdo de glicogênio
- Preparação de placas de teste
- Prepare seis placas de ágar NGM de 60 mm x 15 mm20 (10 mL de ágar meio de crescimento de nematóides, NGM, conforme descrito na Tabela Suplementar 1) por cepa de verme e deixe-as secar por 1 dia em temperatura ambiente. Mantenha as placas fechadas para evitar contaminação.
- Adicione 200 μL de cultura líquida de E. coli OP50 (com densidade óptica = 0,600, aproximadamente no comprimento de onda de 600 nm) por placa para inocular um total de quatro placas NGM de 60 mm x 15 mm por cepa na capela de fluxo. Deixe as placas fechadas incubarem a 37 °C por 1 dia antes de usar.
NOTA: Prepare seis placas (etapa 1.1), mas inocule apenas 4 com a bactéria E. coli OP50. Reservar as duas placas restantes a 4 °C para uso posterior ao colocar as minhocas em condições de fome. Esta análise pode ser efectuada em duplicado. - No dia do teste, adicione 200 μL de D-glicose 0,025 M a duas placas de ágar NGM (6 mm x 15 mm) por cepa que foram previamente semeadas com bactérias E. coli OP50. Deixe as placas secarem em temperatura ambiente na coifa de fluxo.
NOTA: As placas de ágar NGM semeadas com bactérias E. coli OP50 também podem ser secas perto de lâmpadas de álcool como alternativa ao uso de uma capa de fluxo.
- Sincronização
- Aproximadamente 3 dias antes da sincronização, transfira 3-4 pedaços (3 cm x 3 cm) de um ágar NGM de manutenção com C. elegans Bristol N2 (tipo selvagem) em diferentes estágios (cerca de 500 vermes por pedaço) para uma nova placa (150 mm x 90 mm) que foi previamente semeada com bactérias E. coli OP50.
- Coloque a nova placa com minhocas em um ambiente controlado a 20 °C e mantenha a umidade >95% por 3 dias (72 h permitem que a maioria das minhocas atinja o estágio adulto gravídico).
NOTA: A temperatura de crescimento pode precisar ser ajustada dependendo da(s) cepa( s) de C. elegans que está sendo usada. - Usando uma pipeta Pasteur, colete os vermes da placa preparada com H2O destilado e transfira-os para um tubo de centrífuga de 50 mL.
- Aguarde a sedimentação dos vermes por gravidade (aproximadamente 15 min) e depois remova o sobrenadante. Repita este processo 3x para eliminar as bactérias. Após a última lavagem, reduza o volume para 5 mL.
- Adicione 10 mL de solução clareadora (Tabela Suplementar 1) e agite vigorosamente com as mãos por aproximadamente 6 min.
- Imediatamente após a conclusão da agitação, encha os tubos até a capacidade de 50 mL com tampão M9.
- Centrifugue a 1400 x g durante 3 min, retire o sobrenadante até 5 ml e, em seguida, adicione novamente 45 ml de tampão M9. Repita este processo 4x.
- Após a última lavagem, reduza o volume para 15 mL e mantenha-o a temperatura (20 °C) e umidade (>95%) controladas por aproximadamente 14 h.
NOTA: O processo de sincronização pode ser substituído pela obtenção de ovos por oviposição: Transfira aproximadamente 20 vermes prenhes adultos para uma placa NGM (6 mm x 15 mm) previamente semeada com 200 μL de E. coli OP50. Deixe as minhocas botarem ovos por 1 dia. Depois disso, retire os vermes prenhes e espere os ovos eclodirem.
- Preparação de minhocas
- Usando uma pipeta automática, adicione 10 μL dos vermes sincronizados (etapa 1.2.8) a uma lâmina de microscópio e conte o número de vermes. Calcule quanto volume deve ser pipetado para obter 500-1000 vermes/μL.
- Transferir 500-1000 vermes sincronizados L1 (passo 1.2.8) para placas de ágar NGM (150 mm x 90 mm, Tabela Suplementar 1) semeadas com bactérias E. coli OP50 como fonte de alimento, até atingirem o estágio 4 (L4) da larva a 20 °C.
NOTA: Os vermes podem ser transferidos usando uma pipeta automática. Se uma pipeta automática não estiver disponível, use uma pipeta Pasteur de vidro e os volumes podem ser controlados usando rótulos de microtubos ou pipetas graduadas de vidro. - Após 48 h de sincronização20: coletar as larvas L4 das placas com tampão M9 (Tabela Suplementar 1), com o auxílio de uma pipeta plástica Pasteur para um tubo cônico limpo de 50 mL e lavá-las 3x com tampão M9 fresco ou repetir as lavagens até que todas as bactérias E. coli OP50 remanescentes sejam completamente removidas (em temperatura ambiente).
NOTA: A etapa de lavagem é importante porque alguns vermes passarão fome durante o procedimento.
- Executando o ensaio
- Transferir 500-1000 sem-fins L4 (passo 1.3.1) de cada uma das novas placas de ágar NGM (60mm x 15mm) previamente preparadas (passos 1.1.2 e 1.1.3). Mantenha-os a 20 °C durante 48 h até ao dia do ensaio. Este cronograma resultará em três grupos experimentais da seguinte forma, em duplicata (Figura 1):
A- (fome): os vermes crescerão em placas regulares de ágar NGM sem a bactéria E. coli OP50;
B- (regular): os vermes crescerão em placas regulares de ágar NGM semeadas com bactérias E. coli OP50;
C- (glicose alta): os vermes crescerão em placas de ágar NGM semeadas com bactérias E. coli OP50 e contendo 0,025 M de D-glicose. - No dia do teste (após 48 h): recolher as minhocas e dar-lhes três breves lavagens no tampão M9 (passos 1.2.2 e 1.2.3)
NOTA: Aqui, prepare placas de ágar NGM com a adição de D-glicose (etapa 1.3) e reserve-as até a hora de adicionar os vermes.- Coloração com iodo: prepare uma solução de iodo de lugol a 5% (v/v) (solução de iodo/iodeto de potássio) usando tampão M9 fresco.
NOTA: A solução de iodo de Lugol pode ser obtida em fornecedores locais de reagentes ou farmácias, portanto, a concentração inicial pode variar. Se necessário, calcule para obter uma solução a 5% (v/v).
- Coloração com iodo: prepare uma solução de iodo de lugol a 5% (v/v) (solução de iodo/iodeto de potássio) usando tampão M9 fresco.
- Transfira aproximadamente 100 μL de vermes lavados (etapa 4.2) de cada grupo para o microtubo de 1,5 mL contendo solução diluída de Lugol (5% v / v). Usando uma pipeta automática na proporção de 1:5, transfira 100 μL de vermes para 400 μL de solução de Lugol, seguida de agitação suave em um misturador por 5 min.
NOTA: Se um misturador não estiver disponível, é possível agitar os microtubos cuidadosamente com as mãos. - Logo após esses 5 min, centrifugue o microtubo de 1,5 mL (vermes + solução de Lugol) a 1400 x g por 3 min.
NOTA: Se este ensaio for realizado em vermes do estágio L4 ou além, é possível obter sedimentação por gravidade em vez de usar uma centrífuga. Deixe os microtubos abertos em racks na bancada por 10 min até que todos os vermes se assentem na parte inferior do microtubo. - Remova o sobrenadante e lave os vermes com 1,0 mL de tampão M9 fresco. Repita a lavagem até que todo o iodo restante seja removido da solução (mínimo 3x).
- Após a última etapa de lavagem, remova o sobrenadante, exceto por um resíduo de aproximadamente 100 μL. Use-o para ressuspender suavemente os vermes e para análise microscópica.
- Transfira aproximadamente 50 μL da solução de verme ressuspensa para lâminas de microscopia e cubra-as com lamínulas. Observe as imagens de campo claro usando um estereomicroscópio (a 1,5x).
NOTA: Se um estereomicroscópio não estiver disponível, um microscópio comum pode ser usado e as imagens podem ser capturadas com uma câmera de telefone celular (em 3.4x) usando um adaptador. Para evitar erros de luz/brilho/exposição, é crucial que todas as configurações da câmera do celular permaneçam consistentes para todas as fotos.
- Transferir 500-1000 sem-fins L4 (passo 1.3.1) de cada uma das novas placas de ágar NGM (60mm x 15mm) previamente preparadas (passos 1.1.2 e 1.1.3). Mantenha-os a 20 °C durante 48 h até ao dia do ensaio. Este cronograma resultará em três grupos experimentais da seguinte forma, em duplicata (Figura 1):
- Inspeção de dados
- Dados quantitativos: Calcule o conteúdo de glicogênio com base na coloração de iodo de vermes.
- Salve imagens do estereomicroscópio contendo um mínimo de 10 vermes por grupo como um arquivo .jpeg para processamento posterior. Baixe o software gratuito ImageJ para fazer isso. Os detalhes são fornecidos no Arquivo Suplementar 1, Figura Suplementar 1, Figura Suplementar 2.
- Abra a imagem .jpeg usando o software ImageJ (que pode ser baixado gratuitamente em https://imagej.nih.gov/ij/download.html). Clique em Linha segmentada e contorne o verme (um verme de cada vez). Clique em Analisar e selecione Medir para obter a quantificação da mancha. Os dados serão exibidos como a média na tabela. Média indica os dados calculados a partir da densidade de coloração por área de vermes.
- Dados qualitativos: Obtenha imagens do estereomicroscópio de cada grupo e compare visualmente a coloração dos vermes. Crie um sistema de pontuação, se necessário, para analisar a coloração: 0 incolor; 1 levemente manchado; 2 manchados e 3 muito manchados. Usando o estereomicroscópio, conte manualmente aproximadamente 10 vermes por grupo (mínimo) com um contador manual.
- Dados quantitativos: Calcule o conteúdo de glicogênio com base na coloração de iodo de vermes.
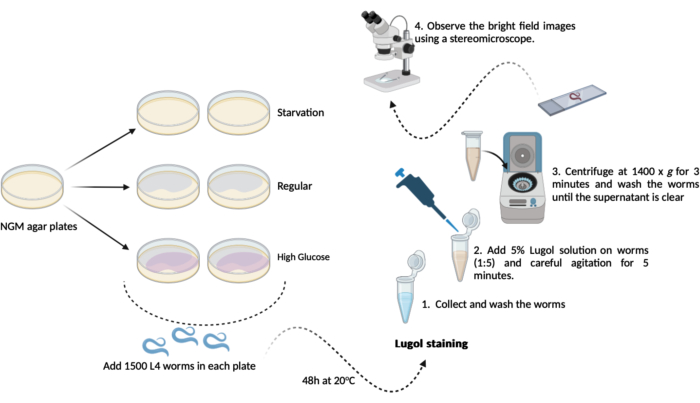
Figura 1: Esquema geral do ensaio de conteúdo de glicogênio em C. elegans. Um esquema do experimental realizado aqui para realizar o ensaio de conteúdo de glicogênio. Clique aqui para ver uma versão maior desta figura.
2. Avaliação da permeabilidade intestinal
- Preparação de minhocas
- Cerca de 14 h após a sincronização (passo 1.2.8), transferir 500-1000 vermes (passo 1.3.1 e NOTA) no primeiro estádio larval (L1) para cada nova placa de ágar NGM (60 mm x 15 mm) previamente preparada e mantê-los a 20 °C até ao dia do ensaio. Este cronograma levará a dois grupos experimentais da seguinte forma (Figura 2):
A- (jovem): os vermes crescerão em placas de ágar NGM semeadas com a bactéria E. coli OP50 até o estágio larval 4 (L4);
B- (velho): os vermes crescerão em placas de ágar NGM semeadas com a bactéria E. coli OP50 até o7º dia da idade adulta.
NOTA: Os vermes mantidos até o7º dia da idade adulta devem ser lavados com tampão M9 todos os dias e transferidos para novas placas de ágar NGM (60 mm x 15mm) com 200 μL de bactérias E. coli OP50 previamente semeadas para reposição alimentar e remoção da progênie. Os vermes mais jovens flutuam durante a decantação e podem ser separados removendo o sobrenadante. A proporção de vermes smurf aumenta com a idade. No entanto, a avaliação da permeabilidade intestinal pode ser realizada em qualquer fase e idade, dependendo do objetivo do estudo.
- Cerca de 14 h após a sincronização (passo 1.2.8), transferir 500-1000 vermes (passo 1.3.1 e NOTA) no primeiro estádio larval (L1) para cada nova placa de ágar NGM (60 mm x 15 mm) previamente preparada e mantê-los a 20 °C até ao dia do ensaio. Este cronograma levará a dois grupos experimentais da seguinte forma (Figura 2):
- Executando o ensaio
- No dia do teste, colete vermes L4 (2 dias após a etapa 2.1.1) e vermes da idade adulta no7º dia (agora no9º dia) com tampão M9 (Tabela Suplementar 1) e transfira para microtubos marcados de 1,5 mL.
- Centrifugue a 1400 x g por 3 min, remova o sobrenadante, adicione 1,0 mL de M9 e misture delicadamente. Repita este processo 3x para remover as bactérias. Após a última lavagem, reduza o volume para 500 μL.
- Usando uma pipeta automática, adicione 10 μL do sedimento do verme a uma lâmina de microscópio e conte o número de vermes. Calcule o volume a ser pipetado para obter 100 vermes/μL.
- Coloração Smurf: prepare uma solução de sal dissódico de erioglaucina a 25% (Tabela Suplementar 1) usando água destilada. Se necessário, use o vórtice para melhor solubilização.
- Em novos microtubos previamente identificados, usando uma pipeta automática, adicione o volume contendo 100 vermes, 100 μL de solução salina dissódica de erioglaucina a 25%, 200 μL de E. coli OP50 e complete com tampão M9 para um volume final de 500 μL.
NOTA: Os volumes de Erioglaucina dissódica, E. coli e número de vermes são fixos. O volume do tampão M9 é variável e pode ser usado para trazer o volume final para 500 μL. - Incubar durante 3 h com agitação num misturador, protegido da luz, à temperatura ambiente.
NOTA: Se um mixer não estiver disponível, agite os microtubos cuidadosamente com as mãos a cada 15 min. - Após 3 h, centrifugue o microtubo de 1,5 mL a 1400 x g por 3 min. Remova 1,0 mL de sobrenadante e lave os vermes com 1,0 mL de tampão M9.
- Repita as lavagens até que a solução de sal dissódico de erioglaucina restante seja removida da solução. Após a última etapa de lavagem, remova o sobrenadante, exceto por um resíduo de aproximadamente 250 μL. Use-o para ressuspender cuidadosamente os vermes e processá-los para análise microscópica.
- Transfira aproximadamente 50 vermes de solução de verme ressuspensa para lâminas de microscopia e cubra-os com lamínulas. Incube as lâminas de microscopia na geladeira a -20 °C por 10 min para paralisar os vermes.
NOTA: Outra alternativa para paralisar os vermes é adicionar 10 μL de solução de cloridrato de levamisol (10 mM; Tabela Suplementar 1) e cubra-os com lamínulas. - Observe e conte o número total de vermes e os vermes totalmente tingidos usando o campo claro em um estereomicroscópio (a 1,5x). As imagens podem ser obtidas a partir de uma câmera de celular (a 3,4x) acoplada a um adaptador. Para evitar erros de luz/brilho/exposição, é crucial que todas as configurações da câmera do celular permaneçam consistentes para todas as fotos.
- Inspeção de dados
- Dados qualitativos: Obter imagens do estereomicroscópio de cada grupo (L4 e7º dia de idade adulta) e comparar visualmente a coloração dos vermes.
- Conte o número total de vermes e o número de vermes smurf (vermes azuis) usando um estereomicroscópio.
- Expresse os resultados como a porcentagem de vermes smurfs comparando os vermes jovens (L4, como grupo de controle) e os vermes velhos (7º dia da idade adulta):
A x X = 100 (%) x B
X = 100 x B / A
Onde, A = número total de vermes
B= número de vermes smurf

Figura 2: Esquema geral do ensaio de permeabilidade intestinal em C. elegans. (A) Preparação de C. elegans . (B) Coloração com sal dissódico de eriogalacina. Clique aqui para ver uma versão maior desta figura.
Resultados
O ensaio de conteúdo de glicogênio fornece um método robusto e rápido para rastrear várias condições de teste, como estudos comparativos de diferentes cepas que podem influenciar a síntese ou degradação de glicogênio. Neste estudo, os vermes L4 foram submetidos a três condições de teste distintas: grupos em jejum, alimentação e enriquecidos com glicose. O ensaio foi realizado três vezes, com cada condição replicada duas vezes em cada ensaio; uma imagem representativa ?...
Discussão
Em resumo, este protocolo fornece uma avaliação qualitativa do conteúdo de glicogênio em vermes individuais de C. elegans usando a coloração de Lugol: um ensaio simples, robusto e rápido. A coloração de Lugol é uma abordagem sem marcação e não invasiva que facilita a aquisição de dados moleculares em resoluções subcelulares, permitindo o monitoramento das flutuações do conteúdo de glicogênio em vermes individuais10. Além disso, o ens...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
D.S.A reconhece financiamento do Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brasil), processo nº #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/Brasil), processo número, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES)
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
Referências
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados