È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Utilizzo di coloranti a basso costo per visualizzare l'accumulo di glicogeno e l'integrità intestinale in Caenorhabditis elegans
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'insegnamento delle scienze biologiche può essere reso più stimolante per gli studenti attraverso l'uso della sperimentazione. Questo manoscritto presenta due protocolli diversi ma complementari che possono essere utilizzati in classe per incoraggiare gli studenti a formulare e testare ipotesi relative alle diete ipercaloriche, alla fame e all'invecchiamento.
Abstract
Caenorhabditis elegans (C. elegans) è un nematode trasparente, non parassitario, con una biologia semplice, che lo rende un ottimo strumento per l'insegnamento delle scienze biologiche attraverso la colorazione delle cellule o il loro contenuto molecolare. Il colorante Lugol (soluzione iodio-ioduro di potassio) è stato ampiamente utilizzato in biochimica per colorare le riserve di glicogeno. In questo contesto, è possibile osservare differenze tra animali nutriti e affamati, oltre agli effetti di diverse condizioni, come diete diverse e livelli di ossigeno. L'erioglaucina è un colorante blu che indica la perdita della barriera intestinale. Quando la barriera intestinale è intatta, il colorante blu si macchia all'interno del lume; Tuttavia, quando questa integrità viene interrotta, il colorante fuoriesce nella cavità del corpo. Utilizzando uno stereomicroscopio o un microscopio, gli insegnanti possono dimostrare alterazioni fisiologiche e biochimiche, oppure possono istigare gli studenti a porre una domanda scientifica e ipotizzare e testare la loro ipotesi utilizzando questi saggi. Il presente protocollo descrive due tecniche di colorazione in C. elegans che possono essere facilmente eseguite dagli studenti.
Introduzione
L'insegnamento delle scienze biologiche nelle scuole superiori è una sfida continua. In particolare, l'accesso e l'uso della tecnologia hanno portato importanti progressi nel processo di insegnamento-apprendimento, tuttavia, strumenti come i chatbot di intelligenza artificiale rendono più difficile la razionalizzazione e la ricerca di prove a causa delle risposte facili (e talvolta errate) ottenute1. Per questo motivo, l'uso di un metodo scientifico con sperimentazione pratica in un approccio basato sull'indagine in classe è una strategia importante per sviluppare o stimolare il pensiero critico, la creatività e le competenze tecniche negli studenti2.
In questo contesto, il nematode a vita libera Caenorhabditis elegans è stato utilizzato con successo nella sperimentazione a scopo didattico3 a causa dei suoi particolari vantaggi: non è un parassita e l'Escherichia coli utilizzato per l'alimentazione è di livello di biosicurezza-1, riducendo quindi quasi a zero il rischio biologico; ha un movimento di locomozione elegante e quantificabile, che è interessante da osservare per gli studenti; ed è trasparente, il che consente l'osservazione d'organo, ma anche la colorazione con pigmenti che possono indicare la presenza di biomolecole o l'insorgenza di alterazioni fisiologiche4. Pertanto, è possibile ipotizzare e testare in aula semplici postulati legati alla biochimica e ai cambiamenti fisiologici come l'invecchiamento.
Il glicogeno è un carboidrato di deposito, formato da una lunga e ramificata catena di molecole di glucosio formata da residui glucosilici con legami lineari glicosidici (1→4)-α e legami glicosidici (1→6)-α nei punti di ramificazione ed è particolarmente importante per la contrazione muscolare, la differenziazione cellulare e il mantenimento della glicemia5. Il glicogeno viene sintetizzato dopo l'alimentazione a causa dell'attivazione insulinica dell'enzima glicogeno-sintasi. Durante l'esercizio fisico o il digiuno, l'epinefrina o il glucagone, rispettivamente, attivano la glicogeno fosforilasi e, quindi, scompongono il polisaccaride per fornire glucosio-6-fosfato alle cellule muscolari o rilasciano glucosio libero per eludere l'ipoglicemia 6,7. Le alterazioni dei livelli di glicogeno influiscono sulla differenziazione cellulare, sulla segnalazione, sulla regolazione redox e sulla staminalità in varie condizioni fisiologiche e fisiopatologiche, incluso il cancro8. In C. elegans, il glicogeno si trova principalmente nel muscolo esofageo, nell'ipoderma, nell'intestino, nei neuroni e principalmente nei muscoli della parete corporea9. Il contenuto di glicogeno può essere misurato utilizzando la soluzione di iodio di Lugol, poiché lo iodio si lega nelle bobine elicoidali formando un complesso iodio-glicogeno, dando un colore blu-nero o marrone-nero visibile e nitido, che è stato utilizzato con successo per dimostrare il contenuto di glicogeno in C. elegans10. È stato dimostrato che l'accumulo di glicogeno causato dall'alimentazione ad alto contenuto di glucosio può ridurre la durata della vita dei vermi, accelerando quindi il processo di invecchiamento11,12. Inoltre, i disturbi metabolici, altri ormoni e l'esposizione agli xenobiotici possono alterare anche il metabolismo del glicogeno 13,14. Pertanto, la sperimentazione sul contenuto di glicogeno in C. elegans è piuttosto interessante, poiché diversi fattori possono disturbare il suo metabolismo e possono stimolare una discussione in classe sulla biochimica di base associata a temi trasversali come l'esercizio fisico, le diete, le malattie e l'invecchiamento.
L'invecchiamento è un declino funzionale dipendente dal tempo causato da un danno cellulare. Questo danno può essere associato a stress ossidativo, attrito dei telomeri, perdita di proteostasi, infiammazione e persino dall'accumulo di corpi poliglucosani insolubili15, solo per citarne alcuni. Uno dei tratti distintivi dell'invecchiamento è la riduzione dell'integrità intestinale, associata a diverse condizioni croniche che si verificano durante la vita di un organismo16. Il mantenimento dell'omeostasi intestinale dipende dall'integrità dell'epitelio intestinale, che è supportato da proteine giunzionali che formano una barriera fisica e collegano le cellule epiteliali adiacenti. Quando c'è un danno a questo epitelio, si verifica una fuoriuscita di contenuto luminale nell'interstizio17. Sulla base di questo meccanismo, il test puffo è stato utilizzato per verificare l'integrità intestinale in diversi modelli animali, poiché questo colorante blu sale disodico Erioglaucina non attraversa la membrana intestinale, rimanendo nel lume18. Quando i vermi vengono infettati da un agente patogeno, contaminati da alcune sostanze tossiche o invecchiano, alterando l'integrità interstiziale, il colorante attraversa la barriera e si diffonde su tutto il verme, che diventa tutto blu. Questo test consente di discutere sulla fisiologia dell'invecchiamento e di sperimentare i fattori che possono accelerare o ritardare questo processo esponendo i vermi a diverse condizioni. I protocolli qui descritti descriveranno in dettaglio questi due metodi basati sui coloranti che possono essere facilmente eseguiti in classe per istigare e stimolare gli studenti a formulare e testare ipotesi relative alla biochimica e alla fisiologia.
La prima parte del protocollo mostra la sua applicabilità per analizzare qualitativamente e quantitativamente il contenuto di glicogeno nel modello10 di C. elegans. Lo scopo della seconda parte del protocollo è quello di valutare l'integrità dell'intestino di C. elegans. Questa tecnica consente di monitorare l'invecchiamento di C. elegans valutando l'integrità delle membrane intestinali. Inoltre, consente di valutare se una sostanza accelera o ritarda l'invecchiamento e se alcune sostanze hanno un potenziale tossico sulla barriera intestinale19.
Il ceppo di C. elegans utilizzato per il presente studio era Bristol N2 wild type. Tuttavia, la procedura può essere replicata utilizzando ceppi che presentano tassi di crescita comparabili, oppure il metodo deve essere adattato in base alla necessità di sostituzione dell'apparecchiatura, considerando che hanno la stessa funzione o simile, o a seconda del ceppo utilizzato, poiché alcuni ceppi hanno requisiti specifici di manutenzione e/o sensibilità; queste informazioni possono essere ottenute dal Caenorhabditis Genetics Center (CGC) o dal sito web di WormBase. Queste modifiche non dovrebbero influire sulla riproducibilità del metodo.
Protocollo
NOTA: I batteri Escherichia coli OP50 (E. coli OP50) e i ceppi wild type Bristol N2 possono essere ottenuti dal CGC, Università del Minnesota, USA o da donazione da un laboratorio di C. elegans . Per la sicurezza dei ricercatori, è imperativo utilizzare dispositivi di protezione individuale. Sebbene le concentrazioni di reagenti come l'ipoclorito e l'idrossido di sodio siano basse, è essenziale indossare i DPI raccomandati, come evidenziato nel manoscritto, per ridurre al minimo i potenziali rischi associati a queste sostanze chimiche.
1. Contenuto di glicogeno
- Preparazione delle piastre di prova
- Preparare sei piastre di agar NGMda 60 mm x 15 mm 20 (10 ml di agar del terreno di crescita dei nematodi, NGM, come descritto nella Tabella supplementare 1) per ceppo di verme e lasciarle asciugare per 1 giorno a temperatura ambiente. Tenere le piastre chiuse per evitare contaminazioni.
- Aggiungere 200 μl di coltura liquida OP50 di E. coli (con una densità ottica = 0,600, approssimativamente a una lunghezza d'onda di 600 nm) per piastra per inoculare un totale di quattro piastre NGM da 60 mm x 15 mm per deformazione nella cappa di flusso. Lasciare incubare le piastre chiuse a 37 °C per 1 giorno prima dell'uso.
NOTA: Preparare sei piastre (passaggio 1.1) ma inoculare solo 4 con il batterio E. coli OP50. Conservare le due piastre rimanenti a 4 °C per un uso successivo quando si posizionano i vermi in condizioni di fame. Questa analisi può essere eseguita in duplicato. - Il giorno del test, aggiungere 200 μl di D-glucosio 0,025 M a due piastre di agar NGM (6 mm x 15 mm) per ceppo precedentemente seminate con batteri E. coli OP50. Lasciare asciugare le piastre a temperatura ambiente nella cappa di flusso.
NOTA: Le piastre di agar NGM seminate con batteri E. coli OP50 possono anche essere essiccate vicino a lampade ad alcool come alternativa all'uso di una cappa a flusso.
- Sincronizzazione
- Circa 3 giorni prima della sincronizzazione, trasferire 3-4 pezzi (3 cm x 3 cm) da un agar NGM di mantenimento con C. elegans Bristol N2 (wild type) in diversi stadi (circa 500 vermi per pezzo) a una nuova piastra (150 mm x 90 mm) che è stata precedentemente seminata con batteri E. coli OP50.
- Posizionare la nuova piastra con le viti in un ambiente controllato a 20 °C e mantenere l'umidità >95% per 3 giorni (72 ore permettono alla maggior parte delle vermi di raggiungere lo stadio adulto gravido).
NOTA: Potrebbe essere necessario regolare la temperatura di crescita a seconda del ceppo o dei ceppi di C. elegans utilizzati. - Utilizzando una pipetta Pasteur, raccogliere i vermi dalla piastra preparata con H2O distillato e trasferirli in una provetta da centrifuga da 50 mL.
- Attendere la sedimentazione dei vermi per gravità (circa 15 minuti) e poi rimuovere il surnatante. Ripeti questo processo 3 volte per eliminare i batteri. Dopo l'ultimo lavaggio, ridurre il volume a 5 ml.
- Aggiungere 10 ml di soluzione decolorante (Tabella supplementare 1) e agitare energicamente con le mani per circa 6 minuti.
- Subito dopo aver completato l'agitazione, riempire le provette fino a una capacità di 50 ml con il tampone M9.
- Centrifugare a 1400 x g per 3 minuti, rimuovere il surnatante fino a 5 mL e quindi aggiungere nuovamente 45 mL di tampone M9. Ripeti questo processo 4 volte.
- Dopo l'ultimo lavaggio, ridurre il volume a 15 ml e mantenerlo a temperatura (20 °C) e umidità (>95%) controllate per circa 14 ore.
NOTA: Il processo di sincronizzazione può essere sostituito dall'ottenimento di uova attraverso l'ovideposizione: Trasferire circa 20 vermi adulti gravidi su una piastra NGM (6 mm x 15 mm) precedentemente seminata con 200 μL di E. coli OP50. Lasciare che i vermi depongano le uova per 1 giorno. Dopodiché, rimuovi i vermi gravidi e attendi che le uova si schiudano.
- Preparazione dei vermi
- Utilizzando una pipetta automatica, aggiungere 10 μL di vermi sincronizzati (passaggio 1.2.8) a un vetrino da microscopio e contare il numero di vermi. Calcola quanto volume deve essere pipettato per ottenere 500-1000 vermi/μL.
- Trasferire 500-1000 vermi sincronizzati L1 (passaggio 1.2.8) su piastre di agar NGM (150 mm x 90 mm, Tabella supplementare 1) seminate con batteri E. coli OP50 come fonte di cibo, fino a raggiungere lo stadio larvale 4 (L4) a 20 °C.
NOTA: I vermi possono essere trasferiti utilizzando una pipetta automatica. Se non è disponibile una pipetta automatica, utilizzare una pipetta Pasteur in vetro e i volumi possono essere controllati utilizzando etichette per microprovette o pipette graduate in vetro. - Dopo 48 ore di sincronizzazione20: raccogliere le larve L4 dalle piastre con tampone M9 (Tabella supplementare 1), con l'aiuto di una pipetta di plastica Pasteur in una provetta conica pulita da 50 mL e lavarle 3 volte con tampone M9 fresco o ripetere i lavaggi fino a quando tutti i batteri E. coli OP50 rimanenti sono completamente rimossi (a temperatura ambiente).
NOTA: La fase di lavaggio è importante perché alcuni vermi sperimenteranno la fame durante la procedura.
- Esecuzione del test
- Trasferire 500-1000 viti senza fine L4 (passaggio 1.3.1) da ciascuna delle nuove piastre di agar NGM (60 mm x 15 mm) precedentemente preparate (passaggi 1.1.2 e 1.1.3). Conservarli a 20 °C per 48 ore fino al giorno del test. Questo programma si tradurrà in tre gruppi sperimentali come segue, in duplice copia (Figura 1):
A- (fame): i vermi cresceranno su normali piastre di agar NGM senza batteri E. coli OP50;
B- (regolare): i vermi cresceranno su piastre di agar NGM regolari seminate con batteri E. coli OP50;
C- (alto glucosio): i vermi cresceranno su piastre di agar NGM seminate con batteri E. coli OP50 e contenenti 0,025 M di D-glucosio. - Il giorno del test (dopo 48 ore): raccogliere i vermi e somministrarli tre brevi lavaggi nel tampone M9 (fasi 1.2.2 e 1.2.3)
NOTA: Qui, preparare le piastre di agar NGM con l'aggiunta di D-glucosio (passaggio 1.3) e metterle da parte fino al momento di aggiungere i vermi.- Colorazione dello iodio: preparare una soluzione di iodio di Lugol al 5% (v/v) (soluzione di iodio/ioduro di potassio) utilizzando un tampone M9 fresco.
NOTA: La soluzione di iodio di Lugol può essere ottenuta da fornitori locali di reagenti o farmacie, pertanto la concentrazione iniziale può variare. Se necessario, calcolare per ottenere una soluzione al 5% (v/v).
- Colorazione dello iodio: preparare una soluzione di iodio di Lugol al 5% (v/v) (soluzione di iodio/ioduro di potassio) utilizzando un tampone M9 fresco.
- Trasferire circa 100 μL di vermi lavati (fase 4.2) da ciascun gruppo alla microprovetta da 1,5 mL contenente la soluzione diluita di Lugol (5% v/v). Utilizzando una pipetta automatica in proporzione 1:5, trasferire 100 μL di vermi in 400 μL di soluzione di Lugol, seguita da una leggera agitazione in un miscelatore per 5 minuti.
NOTA: Se non è disponibile un mixer, è possibile agitare accuratamente le microprovette con le mani. - Subito dopo questi 5 minuti, centrifugare la microprovetta da 1,5 mL (vermi + soluzione di Lugol) a 1400 x g per 3 minuti.
NOTA: Se questo test viene eseguito su vermi dallo stadio L4 o oltre, è possibile ottenere la sedimentazione per gravità invece di utilizzare una centrifuga. Lasciare le microprovette aperte in rack sul banco di lavoro per 10 minuti fino a quando tutti i vermi si sono depositati sul fondo della microprovetta. - Rimuovere il surnatante e lavare i vermi con 1,0 ml di tampone M9 fresco. Ripetere il lavaggio fino a rimuovere tutto lo iodio rimanente dalla soluzione (minimo 3 volte).
- Dopo l'ultima fase di lavaggio, rimuovere il surnatante ad eccezione di un residuo di circa 100 μl. Usalo per risospendere delicatamente i vermi e per l'analisi microscopica.
- Trasferire circa 50 μl della soluzione di verme risospeso su vetrini per microscopia e coprirli con vetrini coprioggetti. Osservare le immagini in campo chiaro utilizzando uno stereomicroscopio (a 1,5x).
NOTA: Se non è disponibile uno stereomicroscopio, è possibile utilizzare un normale microscopio e le immagini possono essere acquisite con la fotocamera di un telefono cellulare (a 3,4x) utilizzando un adattatore. Per evitare errori di luce/luminosità/esposizione, è fondamentale che tutte le impostazioni della fotocamera del telefono cellulare rimangano coerenti per tutte le immagini.
- Trasferire 500-1000 viti senza fine L4 (passaggio 1.3.1) da ciascuna delle nuove piastre di agar NGM (60 mm x 15 mm) precedentemente preparate (passaggi 1.1.2 e 1.1.3). Conservarli a 20 °C per 48 ore fino al giorno del test. Questo programma si tradurrà in tre gruppi sperimentali come segue, in duplice copia (Figura 1):
- Ispezione dei dati
- Dati quantitativi: Calcola il contenuto di glicogeno in base alla colorazione dello iodio dei vermi.
- Salva le immagini dallo stereomicroscopio contenenti un minimo di 10 vermi per gruppo come file .jpeg per un'ulteriore elaborazione. A tale scopo, scaricate il software gratuito ImageJ. I dettagli sono forniti nel file supplementare 1, nella figura supplementare 1, nella figura supplementare 2.
- Aprire l'immagine .jpeg utilizzando il software ImageJ (scaricabile gratuitamente all'indirizzo https://imagej.nih.gov/ij/download.html). Fare clic su Linea segmentata e delineare il verme (un verme alla volta). Fare clic su Analizza, quindi selezionare Misura per ottenere la quantificazione della macchia. I dati verranno visualizzati come media nella tabella. La media indica i dati calcolati dalla densità di colorazione per area del verme.
- Dati qualitativi: Ottenere immagini dallo stereomicroscopio di ciascun gruppo e confrontare visivamente la colorazione dei vermi. Creare un sistema di punteggio, se necessario, per analizzare la colorazione: 0 incolore; 1 leggermente macchiato; 2 macchiati e 3 fortemente macchiati. Utilizzando lo stereomicroscopio, contare manualmente circa 10 vermi per gruppo (minimo) con un contatore.
- Dati quantitativi: Calcola il contenuto di glicogeno in base alla colorazione dello iodio dei vermi.
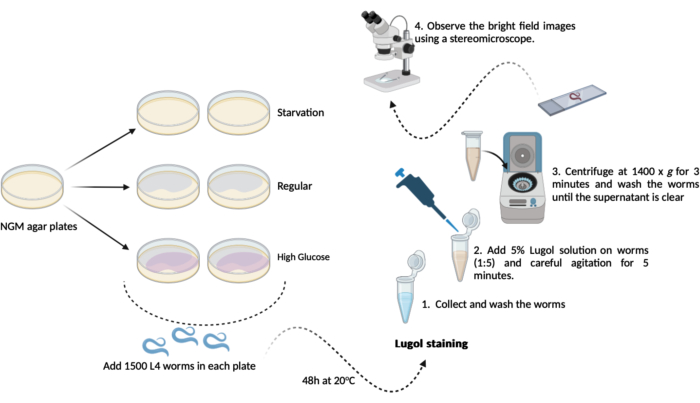
Figura 1: Schema del saggio del contenuto complessivo di glicogeno in C. elegans. Uno schema dell'esperimento qui eseguito per eseguire il saggio del contenuto di glicogeno. Clicca qui per visualizzare una versione più grande di questa figura.
2. Valutazione della permeabilità intestinale
- Preparazione dei vermi
- Circa 14 ore dopo la sincronizzazione (passaggio 1.2.8), trasferire 500-1000 vermi (passaggio 1.3.1 e NOTA) al primo stadio larvale (L1) su ciascuna nuova piastra di agar NGM (60 mm x 15 mm) precedentemente preparata e mantenerli a 20 °C fino al giorno del test. Questo programma porterà a due gruppi sperimentali come segue (Figura 2):
A- (giovani): i vermi cresceranno su piastre di agar NGM seminate con il batterio E. coli OP50 fino allo stadio larvale 4 (L4);
B- (vecchio): i vermi cresceranno su piastre di agar NGM seminate con il batterio E. coli OP50 fino al 7° giorno di età adulta.
NOTA: I vermi mantenuti fino al 7° giorno di età adulta devono essere lavati con tampone M9 ogni giorno e trasferiti su nuove piastre di agar NGM (60 mm x 15 mm) con 200 μL di batteri E. coli OP50 precedentemente seminati per la sostituzione alimentare e la rimozione della progenie. I vermi più giovani galleggiano durante la decantazione e possono essere separati rimuovendo il surnatante. La percentuale di vermi puffi aumenta con l'età. Tuttavia, la valutazione della permeabilità intestinale può essere eseguita in qualsiasi fase ed età, a seconda dello scopo dello studio.
- Circa 14 ore dopo la sincronizzazione (passaggio 1.2.8), trasferire 500-1000 vermi (passaggio 1.3.1 e NOTA) al primo stadio larvale (L1) su ciascuna nuova piastra di agar NGM (60 mm x 15 mm) precedentemente preparata e mantenerli a 20 °C fino al giorno del test. Questo programma porterà a due gruppi sperimentali come segue (Figura 2):
- Esecuzione del test
- Il giorno del test, raccogliere i vermi L4 (2 giorni dopo il passaggio 2.1.1) e i vermi dell'età adulta il 7° giorno ( ora al 9° giorno) con tampone M9 (Tabella supplementare 1) e trasferirli in microprovette da 1,5 ml etichettate.
- Centrifugare a 1400 x g per 3 minuti, rimuovere il surnatante, aggiungere 1,0 mL di M9 e mescolare delicatamente. Ripeti questo processo 3 volte per rimuovere i batteri. Dopo l'ultimo lavaggio, ridurre il volume a 500 μl.
- Utilizzando una pipetta automatica, aggiungere 10 μl di sedimento del verme a un vetrino da microscopio e contare il numero di vermi. Calcolare il volume da pipettare per ottenere 100 vermi/μL.
- Colorazione dei puffi: preparare una soluzione di sale disodico di erioglaucina al 25% (Tabella supplementare 1) utilizzando acqua distillata. Se necessario, utilizzare il vortice per una migliore solubilizzazione.
- Nelle nuove microprovette precedentemente identificate, utilizzando una pipetta automatica, aggiungere il volume contenente 100 vermi, 100 μL di soluzione di sale disodico di Erioglaucina al 25%, 200 μL di E. coli OP50 e completare con tampone M9 per un volume finale di 500 μL.
NOTA: I volumi di Erioglaucine disodium, E. coli e il numero di vermi sono fissi. Il volume del tampone M9 è variabile e può essere utilizzato per portare il volume finale a 500 μl. - Incubare per 3 h agitando in un miscelatore, al riparo dalla luce, a temperatura ambiente.
NOTA: Se non è disponibile un mixer, agitare accuratamente le microprovette con le mani ogni 15 minuti. - Dopo 3 ore, centrifugare la microprovetta da 1,5 mL a 1400 x g per 3 min. Rimuovere 1,0 mL di surnatante e lavare i vermi con 1,0 mL di tampone M9.
- Ripetere i lavaggi fino a rimuovere dalla soluzione la restante soluzione di sale disodico di erioglaucina. Dopo l'ultima fase di lavaggio, rimuovere il surnatante ad eccezione di un residuo di circa 250 μl. Utilizzarlo per risospendere con cura i vermi e processarli per l'analisi microscopica.
- Trasferire circa 50 vermi di soluzione di vermi risospesi su vetrini per microscopia e coprirli con vetrini coprioggetti. Incubare i vetrini per microscopia in frigorifero a -20 °C per 10 minuti per paralizzare i vermi.
NOTA: Un'altra alternativa per paralizzare i vermi è aggiungere 10 μL di soluzione di Levamisolo cloridrato (10 mM ; Tabella supplementare 1) e coprirli con vetrini. - Osservare e contare il numero totale di vermi e i vermi completamente colorati utilizzando il campo chiaro in uno stereomicroscopio (a 1,5x). Le immagini possono essere ottenute dalla fotocamera di un telefono cellulare (a 3,4x) accoppiata con un adattatore. Per evitare errori di luce/luminosità/esposizione, è fondamentale che tutte le impostazioni della fotocamera del telefono cellulare rimangano coerenti per tutte le immagini.
- Ispezione dei dati
- Dati qualitativi: Ottenere immagini dallo stereomicroscopio di ciascun gruppo (L4 e 7° giorno di età adulta) e confrontare visivamente la colorazione dei vermi.
- Conta il numero totale di vermi e il numero di vermi puffi (vermi blu) usando uno stereomicroscopio.
- Esprimi i risultati come percentuale di vermi puffi confrontando i vermi giovani (L4, come gruppo di controllo) e i vermi anziani (7° giorno di età adulta):
A x X = 100 (%) x B
X = 100 x B / A
Dove, A = numero totale di vermi
B= numero di vermi puffi

Figura 2: Schema del saggio di permeabilità intestinale complessiva in C. elegans. (A) Preparazione di C. elegans . (B) Colorazione con sale disodico di erioglaucina. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Il test del contenuto di glicogeno fornisce un metodo robusto e rapido per lo screening di varie condizioni di test, come studi comparativi di diversi ceppi che possono influenzare la sintesi o la degradazione del glicogeno. In questo studio, i vermi L4 sono stati sottoposti a tre distinte condizioni di test: digiuno, alimentazione e gruppi arricchiti di glucosio. Il test è stato eseguito tre volte, con ogni condizione replicata due volte in ogni test; un'immagine rappresentativa è mos...
Discussione
In sintesi, questo protocollo fornisce una valutazione qualitativa del contenuto di glicogeno nei singoli vermi C. elegans utilizzando la colorazione Lugol: un test semplice, robusto e rapido. La colorazione Lugol è un approccio label-free e non invasivo che facilita l'acquisizione di dati molecolari a risoluzioni subcellulari, consentendo il monitoraggio delle fluttuazioni del contenuto di glicogeno all'interno di singoli vermi10. Inoltre, il test offre...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
D.S.A riconosce il finanziamento da Conselho Nacional de Pesquisa e Desenvolvimento (CNPq/Brasile), numero di sovvenzione #301808/2018-0, #313117/2019-5, Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS/Brasile), numero di sovvenzione, 21/2551-0001963-8, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Codice finanziario 001 per N.S.J e A.C.S)
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Local suppliers | - | |
| 37-degree incubator | KS 4000i | 97014-816 | |
| 50 mL conical tube | Local suppliers | - | |
| 6 cm Petri plates | Local suppliers | - | |
| Agar bacteriological | Dinâmica Química Contemporânea Ltda. | 9002-18-0 | |
| C. elegans Bristol N2 (wild type) | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| CaCL2 | Dinâmica Química Contemporânea Ltda. | 10035-04-8 | |
| Cholesterol | Sigma-Aldrich Brasil Ltda | 57-88-5 | |
| D-(+)-Glucose anhydrous | Neon | 50-99-7 | |
| Distilled H2O | Local suppliers | - | |
| Erioglaucine disodium salt | Sigma-Aldrich Brasil Ltda | 3844-45-9 | |
| Escherichia coli OP50 | Caenorhabditis elegans Genetic Center (CGC, Minnesota, USA) | - | |
| Flow hood | Mylabor | ||
| Incubator | Panasonic Healthcare company of North America, MIR-254-PA. | - | |
| KH2PO4 | Dinâmica Química Contemporânea Ltda. | 7778-77-0 | |
| Levamisole hydrochloride | RIPERCOL L 150F | - | |
| Lugol solution | Sigma-Aldrich Brasil Ltda | L6146 | |
| MgSO4 | Synth | S1063-01-AH | |
| Microcentrifuge | Centrifuge 5425R Eppendorf SE, Germany | ||
| Na2HPO4 | Dinâmica Química Contemporânea Ltda. | 7558-79-4 | |
| NaCl | Dinâmica Química Contemporânea Ltda. | 7647-14-5 | |
| Nystatin | Sigma-Aldrich Brasil Ltda | N6261 | |
| Peptone bacteriological | êxodo científica | 91079-38-8 | |
| Stereomicroscope | Leica S8 Apo Stereomicroscope (São Paulo, Brazil) | ||
| Streptomycin Sulfate | Estreptomax | - |
Riferimenti
- Thorp, H. H. ChatGPT is fun, but not an author. Science. 379 (6630), 313 (2023).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. J Undergrad Neurosci Educ. 15 (1), A44-A55 (2016).
- Andersen, J., Krichevsky, A., Leheste, J. R., Moloney, D. J. Caenorhabditis elegans as an undergraduate educational tool for teaching RNAi. Biochem Mol Biol Educ. 36 (6), 417-427 (2008).
- Martins, R. R., McCracken, A. W., Simons, M. J. P., Henriques, C. M., Rera, M. How to catch a smurf? - Ageing and beyond... In vivo assessment of intestinal permeability in multiple model organisms. Bio Protoc. 8 (3), e2722 (2018).
- Ellingwood, S. S., Cheng, A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 238 (3), R131-R141 (2018).
- Cori, C. F., Cori, G. T. Glycogen formation in the liver from d-and l-lactic acid. J Bio Chem. 81 (2), 389-403 (1929).
- Wosilait, W. D., Sutherland, E. W. The relationship of epinephrine and glucagon to liver phosphorylase. II. Enzymatic inactivation of liver phosphorylase. J Biol Chem. 218 (1), 469-481 (1956).
- Zhang, H., Ma, J., Tang, K., Huang, B. Beyond energy storage: roles of glycogen metabolism in health and disease. FEBS J. 288 (12), 3772-3783 (2021).
- Liu, Q., et al. Characterization of glycogen molecular structure in the worm Caenorhabditis elegans. Carbohydr Polym. 237, 116181 (2020).
- Cherkas, A., et al. Label-free molecular mapping and assessment of glycogen in C. elegans.Analyst. 144 (7), 2367-2374 (2019).
- Gusarov, I., et al. Glycogen controls Caenorhabditis elegans lifespan and resistance to oxidative stress. Nat Commun. 8, 15868 (2017).
- Seo, Y., Kingsley, S., Walker, G., Mondoux, M. A., Tissenbaum, H. A. Metabolic shift from glycogen to trehalose promotes lifespan and healthspan in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 115 (12), E2791-E2800 (2018).
- Frazier, H. N., Roth, M. B. Adaptive sugar provisioning controls survival of C. elegans embryos in adverse environments. Curr Biol. 19 (10), 859-863 (2009).
- da Silva, F. N., Zimath, P. L., do Amaral, T. A., Martins, J. R. N., Rafacho, A. Coadministration of olanzapine causes minor impacts on the diabetogenic outcomes induced by dexamethasone treatment in rats. Life Sci. 322, 121660 (2023).
- Gusarov, I., Nudler, E. Glycogen at the crossroad of stress resistance, energy maintenance, and pathophysiology of aging. Bioessays. 40 (9), e1800033 (2018).
- Untersmayr, E., Brandt, A., Koidl, L., Bergheim, I. The intestinal barrier dysfunction as driving factor of inflammaging. Nutrients. 14 (5), 949 (2022).
- Lin, P. Y., Stern, A., Peng, H. H., Chen, J. H., Yang, H. C. Redox and metabolic regulation of intestinal barrier function and associated disorders. Int J Mol Sci. 23 (22), 14463 (2022).
- Dambroise, E., et al. Two phases of aging separated by the Smurf transition as a public path to death. Sci Rep. 6, 23523 (2016).
- Laranjeiro, R., et al. Swim exercise in Caenorhabditis elegans extends neuromuscular and gut healthspan, enhances learning ability, and protects against neurodegeneration. Proc Natl Acad Sci U S A. 116 (47), 23829-23839 (2019).
- Stiernagle, T. Maintenance of C. elegans.WormBook. , 1-11 (2006).
- McGhee, J. D. The C. elegans intestine. WormBook: The Online Review of C. elegans Biology. , (2007).
- McGee, M. D., et al. Loss of intestinal nuclei and intestinal integrity in aging C. elegans. Aging Cell. 10 (4), 699-710 (2011).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS genetics. 12 (7), e1006135 (2016).
- Rera, M., Clark, R. I., Walker, D. W. Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila. Proc Natl Acad Sci U S A. 109 (52), 21528-21533 (2012).
- Zhang, G., Gu, Y., Dai, X. Protective effect of bilberry anthocyanin extracts on dextran sulfate sodium-induced intestinal damage in Drosophila melanogaster. Nutrients. 14 (14), 2875 (2022).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genet. 12 (7), e1006135 (2016).
- Qu, M., Xu, K., Li, Y., Wong, G., Wang, D. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles. Sci Total Environ. 643, 119-126 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon