A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسة مقارنة لمصفوفات الغشاء القاعدي لصيانة الخلايا الجذعية البشرية وتوليد الأعضاء المعوية
In This Article
Summary
أصبحت المواد العضوية أدوات قيمة لنمذجة الأمراض. توجه المصفوفة خارج الخلية (ECM) مصير الخلية أثناء توليد الأعضاء ، ويمكن أن يؤدي استخدام نظام يشبه الأنسجة الأصلية إلى تحسين دقة النموذج. تقارن هذه الدراسة توليد العضويات المعوية البشرية المشتقة من الخلايا الجذعية المستحثة متعددة القدرات في ECM المشتقة من والهلاميات المائية الخالية من xeno.
Abstract
تلعب المصفوفة خارج الخلية (ECM) دورا مهما في سلوك الخلية وتطورها. المواد العضوية المتولدة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSCs) هي في دائرة الضوء في العديد من مجالات البحث. ومع ذلك ، فإن عدم وجود إشارات فسيولوجية في مواد زراعة الخلايا الكلاسيكية يعيق تمايز iPSC الفعال. يوفر دمج ECM المتاح تجاريا في زراعة الخلايا الجذعية إشارات فيزيائية وكيميائية مفيدة لصيانة الخلايا. تتكون منتجات الغشاء القاعدي المشتقة تجاريا من من بروتينات ECM وعوامل النمو التي تدعم صيانة الخلايا. نظرا لأن ECM يحمل خصائص خاصة بالأنسجة يمكنها تعديل مصير الخلية ، يتم استخدام المصفوفات الخالية من xeno لتدفق الترجمة إلى الدراسات السريرية. في حين أن المصفوفات المتاحة تجاريا تستخدم على نطاق واسع في hiPSC والعمل العضوي ، لم يتم تقييم معادلة هذه المصفوفات بعد. هنا ، أجريت دراسة مقارنة لصيانة hiPSC وتوليد العضويات المعوية البشرية (hIO) في أربع مصفوفات مختلفة: Matrigel (Matrix 1-AB) ، Geltrex (Matrix 2-AB) ، Cultrex (Matrix 3-AB) ، و VitroGel (Matrix 4-XF). على الرغم من أن المستعمرات تفتقر إلى شكل دائري تماما ، إلا أنه كان هناك حد أدنى من التمايز التلقائي ، حيث كان أكثر من 85٪ من الخلايا تعبر عن علامة الخلايا الجذعية SSEA-4. أدت المصفوفة 4-XF إلى تشكيل كتل مستديرة ثلاثية الأبعاد. أيضا ، أدت زيادة تركيز العوامل التكميلية والنمو في الوسائط المستخدمة لصنع محلول هيدروجيل Matrix 4-XF إلى تحسين تعبير hiPSC ل SSEA-4 بمقدار 1.3 ضعف. أدى تمايز Matrix 2-AB - الحفاظ على hiPSC إلى عدد أقل من الإطلاقات الكروية خلال المرحلة المتوسطة / الخلفية مقارنة بالأغشية القاعدية الأخرى المشتقة من. بالمقارنة مع الآخرين ، تؤدي المصفوفة العضوية الخالية من xeno (Matrix 4-O3) إلى hIO أكبر وأكثر نضجا ، مما يشير إلى أنه يمكن تسخير الخصائص الفيزيائية للهلاميات المائية الخالية من xeno لتحسين توليد المواد العضوية. إجمالا ، تشير النتائج إلى أن الاختلافات في تكوين المصفوفات المختلفة تؤثر على مراحل تمايز IO. تعمل هذه الدراسة على زيادة الوعي حول الاختلافات في المصفوفات المتاحة تجاريا وتوفر دليلا لتحسين المصفوفة أثناء عمل iPSC و IO.
Introduction
المصفوفة خارج الخلية (ECM) هي مكون ديناميكي ومتعدد الوظائف للأنسجة يلعب دورا مركزيا في تنظيم سلوك الخلية وتطورها. كشبكة معقدة ، فإنه يوفر الدعم الهيكلي ، والروابط اللاصقة للخلايا1 ، وتخزين عوامل النمو والسيتوكينات التي تنظم إشارات الخلية. على سبيل المثال ، أثناء التئام الجروح ، يعمل ECM كسقالة للخلايا المهاجرة وكخزان لعوامل النمو المشاركة في إصلاح الأنسجة2. وبالمثل ، يمكن أن يؤدي عدم التنظيم في ECM إلى زيادة في شدة الأمراض المختلفة مثل التليف والسرطان 3,4. أثناء التطور الجنيني ، يوجه ECM تشكل الأنسجة. على سبيل المثال ، في تطور القلب ، تلعب مكونات ECM دورا في إنشاء البنية والوظيفة الصحيحة لأنسجة القلب5. أظهر أكثر من عقد من الأبحاث أن صلابة البيئة المكروية وحدها 6,7 يمكنها التحكم في مواصفات نسب الخلايا الجذعية. لذلك ، ليس من المستغرب أنه أثناء تمايز الخلايا في المختبر ، يؤثر ECM على مصير الخلايا الجذعية من خلال توفير إشارات للتمايز.
يمكن توليد المواد العضوية من الخلايا الجذعية المستحثة متعددة القدرات (iPSCs). مطلوب البدء بخط iPSC مميز بشكل صحيح لتوليد المواد العضوية بنجاح. ومع ذلك ، فإن عدم وجود إشارات فسيولوجية في مواد زراعة الخلايا الكلاسيكية يعيق التمايز الفعال iPSC وتوليد المواد العضوية. علاوة على ذلك ، أكدت الأبحاث الحديثة على أهمية تكوين المصفوفة خارج الخلية (ECM) ، والتفاعلات بين الخلايا و ECM8 ، وكذلك الإشارات الميكانيكية والهندسية9،10،11 في سياق التوسع العضوي والتمايز12. سيتضمن تطوير التكنولوجيا العضوية من خلال تحسين قابلية التكاثر دمج إشارات فيزيائية وكيميائية خاصة بالأنسجة.
تهدف الكائنات العضوية إلى تلخيص الأنسجة الأصلية داخل بيئة دقيقة مماثلة من الناحية الفسيولوجية. يعد اختيار نظام ECM الذي يحاكي عن كثب الأنسجة الأصلية ECM أمرا بالغ الأهمية لتحقيق الأهمية الفسيولوجية فيما يتعلق بسلوك الخلية ووظيفتها والاستجابة للمنبهات13. يمكن أن يؤثر اختيار مكونات ECM على تمايز الخلايا الجذعية إلى أنواع معينة من الخلايا داخل الجهاز العضوي. يمكن أن توفر بروتينات ECM المختلفة ومجموعاتها إشارات توجه مصير الخلية14. على سبيل المثال ، أظهرت الدراسات أن استخدام مكونات ECM محددة يمكن أن يعزز تمايز الخلايا الجذعية المعوية إلى أنواع الخلايا المعوية الناضجة ، مما يؤدي إلى عضويات معوية ذات صلة من الناحية الفسيولوجية15. في حين أن المواد العضوية هي أداة قيمة أثناء نمذجة المرض واختبار الأدوية ، فإن اختيار نظام ECM مناسب أمر محوري لهذا التطبيق. يمكن لنظام ECM المناسب أن يعزز دقة نمذجة المرض من خلال إنشاء بيئة دقيقة تشبه الأنسجة المصابة16. علاوة على ذلك ، يمكن أن يساعد ECM الخاص بالأنسجة في توليد مواد عضوية تلخص بشكل أفضل الأنماط الظاهرية المرتبطة بالمرض والاستجابات الدوائية17. يعد تحسين نظام ECM المستخدم في التمايز العضوي أمرا بالغ الأهمية لتحقيق نتائج التمايز المرجوة.
تستخدم أنظمة الأغشية القاعدية المتاحة تجاريا والمشتقة من مصادر ECM الحيوانية (على سبيل المثال ، Matrigel ، Cultrex) والهيدروجيل الخالي من xeno (على سبيل المثال ، VitroGel) على نطاق واسع في iPSC وأبحاث المواد العضوية. وضعت الشركات التي تقوم بتسويقها والباحثون الذين يستخدمونها العديد من التعليمات لمنتجاتهم وتطبيقاتهم المحددة على مر السنين. العديد من هذه التعليمات بمثابة دليل لتوليد هذا البروتوكول. علاوة على ذلك ، فقد لوحظ الفوائد والنكسات المرتبطة بخصائصها الجوهرية بشكل فردي من قبل العديد من18،19،20،21. ومع ذلك ، لا يوجد سير عمل منهجي لتوجيه اختيار الأنظمة المثلى ل iPSC والعمل العضوي. هنا ، يتم توفير سير عمل لتقييم معادلة أنظمة ECM بشكل منهجي من مصادر مختلفة ل iPSC والعمل العضوي. هذه دراسة مقارنة لصيانة خطين مختلفين من iPSC البشري (hiPSC) وتوليد عضويات معوية بشرية (hIO) في أربع مصفوفات مختلفة: Matrigel (Matrix 1-AB) و Geltrex (Matrix 2-AB) و Cultrex (Matrix 3-AB) و VitroGel (Matrix 4-XF). بالنسبة للثقافة العضوية ، تم استخدام أربعة إصدارات من المصفوفة الخالية من xeno VitroGel التي تم تحسينها مسبقا للثقافة العضوية: ORGANOID 1 (Matrix 4-O1) ، ORGANOID 2 (Matrix 4-O2) ، ORGANOID 3 (Matrix 4-O3) ، ORGANOID 4 (Matrix 4-O4). أيضا ، تم استخدام المصفوفات المشتقة من المحسنة للعضويات: Matrigel عالية التركيز (Matrix 1-ABO) و Cultrex Type 2 (Matrix 3-ABO). تم استخدام وسائط زراعة الخلايا الجذعية المتاحة تجاريا (mTeSR Plus) ومجموعة التمايز العضوي (مجموعة STEMdiff العضوية المعوية). يجمع هذا البروتوكول بين التعليمات الفردية من الشركات المصنعة للمنتجات والخبرات المعملية لتوجيه القارئ نحو التحسين الناجح ل ECM لعملهم الخاص ب iPSC والعضوية. إجمالا ، يؤكد هذا البروتوكول والنتائج التمثيلية على أهمية اختيار البيئة المكروية المثلى لعمل الخلايا الجذعية والتمايز العضوي.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. صيانة hiPSC
تنبيه: تتم جميع الأعمال في خزانة السلامة البيولوجية (BSC) باتباع تقنيات التعقيم القياسية. يجب اتباع معايير السلامة OSHA للمختبرات ، بما في ذلك الاستخدام السليم لمعدات الحماية الشخصية مثل معاطف المختبر والقفازات والنظارات الواقية.
- إعداد حصصا المصفوفات ووسائط زراعة الخلايا
- بالنسبة للأغشية القاعدية المشتقة من المتاحة تجاريا (BMs; Matrix 1-AB ، Matrix 2-AB ، Matrix 3-AB) ، قم بإعداد حصص أحجام العمل وفقا لتوصية الشركة المصنعة الملخصة في الجدول 1 وتخزينها في -20 درجة مئوية أو -80 درجة مئوية للتخزين طويل الأجل. تجنب تشكيل الفقاعات. إذا تم تشكيل بعض الفقاعات ، قبل التخزين ، عينات أجهزة الطرد المركزي عند 4 °C ، عند <200 × g ، لمدة ~ 1-2 دقيقة لإجبار الفقاعة على الظهور على السطح.
ملاحظة: يساعد عمل الحصص ذات الاستخدام الواحد على تجنب دورات التجميد والذوبان المتكررة التي تعطل بنية ECM. نظرا لأن تركيز BM يختلف باختلاف عدد اللوت ، تأكد من اتباع توصية الشركة المصنعة لإعداد القسامات ذات الاستخدام الواحد وصنع محاليل الطلاء. BMs عالية التركيز لزجة ويصعب ماصة. استخدم الأطراف الباردة المخزنة مسبقا في -20 درجة مئوية. - تحضير وسط زراعة الخلايا الجذعية وفقا لتوصية الشركة المصنعة. لتحضير الوسائط الكاملة المحددة المتاحة تجاريا والمستخدمة في هذا البروتوكول ، أضف 100 مل من كوكتيل مكمل 5x إلى 400 مل من الوسط القاعدي. بعد ذلك ، امزج هذه الوسائط جيدا واحصل على القسمة في أحجام 40 مل ، مخزنة عند 20 درجة مئوية. للاستخدام ، قم بإذابة كل حصة من الوسائط الكاملة ، أو استخدم الوسط الكامل المقتبس على الفور ، أو قم بتخزينه في درجة حرارة 2-8 درجة مئوية لمدة تصل إلى أسبوعين. لا تقم بإعادة تجميده.
- تحضير حصص من وسط الخلايا الجذعية الكامل الذي يحتوي على 3x تركيز كوكتيل الملحق لتحضير Matrix 4-XE Hydrogel ، أي تمييع ملحق 5x إلى 3x.
- بالنسبة للأغشية القاعدية المشتقة من المتاحة تجاريا (BMs; Matrix 1-AB ، Matrix 2-AB ، Matrix 3-AB) ، قم بإعداد حصص أحجام العمل وفقا لتوصية الشركة المصنعة الملخصة في الجدول 1 وتخزينها في -20 درجة مئوية أو -80 درجة مئوية للتخزين طويل الأجل. تجنب تشكيل الفقاعات. إذا تم تشكيل بعض الفقاعات ، قبل التخزين ، عينات أجهزة الطرد المركزي عند 4 °C ، عند <200 × g ، لمدة ~ 1-2 دقيقة لإجبار الفقاعة على الظهور على السطح.
- طلاء بلاستيك زراعة الأنسجة ب BMs المشتقة من (Matrix 1-3AB)
- قم بإعداد ما يلي قبل البدء: احتفظ دائما بالمصفوفات في الثلج عند الذوبان والتعامل معها لمنعها من التبلور. استخدم الوسائط الباردة لتحضير المصفوفات المخففة. قم بإعداد ما يكفي من الآبار المكررة لكل حالة لفحص الخلايا قبل البدء وفي كل مرحلة من مراحل عملية تمايز hiPSC وتوليد hIO العضوي.
ملاحظة: هنا ، تم استخدام 24 لوحة بئر لهذه الدراسة. راجع الجدول 2 لمعرفة أحجام الطلاء الموصى بها لأحجام الألواح الأخرى. - لكل نوع من أنواع المصفوفات ، قم بإعداد 25 مل من DMEM / F-12 المتقدم على البارد تحتوي على 15 مللي متر HEPES في أنبوب مخروطي 50 مل. احتفظ بها على الجليد.
- أضف المصفوفات المذابة إلى DMEM / F-12 المتقدم على البارد واخلطها جيدا. حافظ على برودة الوسائط أثناء عملية الخلط. تحقق بصريا من الخلط المتجانس من خلال التأكد من عدم وجود كتل.
- استخدم على الفور محاليل المصفوفات المخففة لطلاء كل بئر محدد للاستخدام (250 ميكرولتر / بئر في حالة استخدام 24 لوحة بئر).
- قم بإمالة أدوات الاستزراع برفق لنشر محلول الطلاء بالتساوي عبر السطح. احتضان في درجة حرارة الغرفة (15 - 25 درجة مئوية) لمدة 1 ساعة على الأقل قبل الاستخدام.
ملاحظة: إذا لم يتم استخدامها على الفور ، يمكن تخزين اللوحة في 2-8 °C لمدة تصل إلى 1 أسبوع بعد الطلاء ، ولكن يجب أن تكون مختومة بغشاء شفاف لمنع التبخر. عند استخدام الأطباق المخزنة ، دعها تصل إلى درجة حرارة الغرفة (15 - 25 درجة مئوية) لمدة 30 دقيقة قبل الانتقال إلى الخطوة التالية. - قم بإزالة المحلول الزائد برفق باستخدام ماصة مصلية أو عن طريق الشفط. تأكد من عدم خدش السطح المطلي.
- أضف وسط الخلايا الجذعية الكامل الدافئ على الفور (50٪ من الحجم الكلي المطلوب لبئر معين ، على سبيل المثال ، 250 ميكرولتر / بئر في حالة استخدام لوحة 24 بئرا).
- قم بإعداد ما يلي قبل البدء: احتفظ دائما بالمصفوفات في الثلج عند الذوبان والتعامل معها لمنعها من التبلور. استخدم الوسائط الباردة لتحضير المصفوفات المخففة. قم بإعداد ما يكفي من الآبار المكررة لكل حالة لفحص الخلايا قبل البدء وفي كل مرحلة من مراحل عملية تمايز hiPSC وتوليد hIO العضوي.
- طلاء البلاستيك زراعة الأنسجة مع هيدروجيل ماتريكس 4-XE
- قم بإعداد ما يلي قبل البدء: أخرج هيدروجيل ماتريكس 4-XE من الثلاجة واتركه دافئا إلى درجة حرارة الغرفة (25 درجة مئوية). قم بإعداد ما يكفي من الآبار المكررة لكل حالة لفحص الخلايا قبل البدء وفي كل مرحلة من مراحل عملية تمايز hiPSC وتوليد hIO العضوي.
ملاحظة: هنا ، تم استخدام 24 لوحة بئر لهذه الدراسة. راجع الجدول 3 لمعرفة أحجام الطلاء الموصى بها لأحجام الألواح الأخرى. - قم بإعداد وسائط زراعة خلايا جذعية كاملة تحتوي على تركيز عامل نمو 3x مقارنة بالصيغة القياسية لزراعة الخلايا الجذعية (3x وسط الخلايا الجذعية).
- امزج هيدروجيل ماتريكس 4-XE ووسط الخلايا الجذعية 3x بنسبة خلط 2: 1 فولت / فولت وماصة بلطف لأعلى ولأسفل 5x-10x لخلطها جيدا.
- انقل خليط الهيدروجيل إلى طبق جيد وقم بإمالة أدوات الاستزراع بعناية لنشر الخليط بالتساوي على السطح. استخدم 250 ميكرولتر / بئر في حالة استخدام لوحة 24 بئر. انظر الجدول 3 للاطلاع على المجلدات الموصى بها.
- انتظر 10-15 دقيقة في درجة حرارة الغرفة لتشكيل هلام لينة. أثناء عملية تكوين الهيدروجيل ، لا تعطل الهيدروجيل عن طريق إمالة اللوحة أو هزها.
- قم بإعداد ما يلي قبل البدء: أخرج هيدروجيل ماتريكس 4-XE من الثلاجة واتركه دافئا إلى درجة حرارة الغرفة (25 درجة مئوية). قم بإعداد ما يكفي من الآبار المكررة لكل حالة لفحص الخلايا قبل البدء وفي كل مرحلة من مراحل عملية تمايز hiPSC وتوليد hIO العضوي.
- hiPSC خالية من الإنزيم التكتل تمرير والبذر
- قم بإعداد ما يلي قبل البدء: على الأقل 1 ساعة قبل المرور ، قم بتغطية الأواني البلاستيكية المرغوبة بالمصفوفات. القسمة كافية كاملة الخلايا الجذعية وسائل الإعلام ودافئة إلى درجة حرارة الغرفة (15 - 25 درجة مئوية). تجنب دورات التسخين المتعددة للوسائط الكاملة.
ملاحظة: تصف الخطوات أدناه مرور ثقافة متقاربة بالفعل و >90٪ من iPSCs على لوحة من 6 آبار وزرعها في لوحات 24 بئرا للتمييز بين الكائنات العضوية المعوية. - شطف الخلايا مع 1 مل من D-PBS (بدون Ca++ و Mg++) ونضح. أضف 1 مل من كاشف اختيار الخلايا الجذعية البشرية متعددة القدرات الخالي من الإنزيم ، وقم بتدوير بعناية لينتشر بالتساوي ، واستنشق في غضون دقيقة واحدة. تحتاج المستعمرات فقط إلى التعرض لطبقة رقيقة من السائل.
- احتضان في 37 درجة مئوية حتى تبدأ المستعمرات تبدو أقل ضغطا ، الأمر الذي سيستغرق ~ 3-8 دقائق.
ملاحظة: قد يختلف وقت الحضانة الأمثل حسب خط الخلية المستخدم. يجب تحديد وقت الحضانة الأمثل عند تمرير كل خط خلية بكاشف اختيار الخلايا الجذعية البشرية متعددة القدرات الخالية من الإنزيم لأول مرة. - أضف 1 مل من وسائط الخلايا الجذعية الكاملة. افصل المستعمرات عن طريق النقر بعناية بقوة على جانب اللوحة. تأكد من إمساك اللوحة باليد الأخرى.
- باستخدام ماصة سعة 1 مل أو أكبر ، انقل تعليق كتل الخلية إلى أنبوب مخروطي سعة 15 مل. تقييم حجم الكتل باستخدام مجهر برايت فيلد والتأكد من أن حجم كتلة الخلية يتراوح بين 50-200 ميكرومتر ؛ إذا كانت أكبر ، هز الأنبوب المخروطي برفق لتكسيرها.
- ارسم شبكة x-y في قاع كل بئر من صفيحة مسطحة القاع ذات 96 بئرا سيتم استخدامها لحساب التكتلات وإضافة 50 ميكرولتر من D-PBS إلى كل بئر. يوصى بحساب متوسط الكتل المحسوبة من 3 آبار.
- تأكد من توزيع كتل الخلايا بالتساوي عن طريق هز الأنبوب برفق ثم نقل 5 ميكرولتر من تعليق الكتلة إلى كل بئر من آبار اللوحة ذات القاع المسطح المكونة من 96 بئرا.
ملاحظة: لا يوصى باستخدام عداد خلايا تلقائي لحساب الكتل. يوصى بالعد اليدوي. - احسب العدد الإجمالي للكتل في كل بئر يبلغ قطرها 50-200 ميكرومتر. إذا كان قطر معظم كتل الخلايا > 200 ميكرومتر (انظر الشكل 1) ، كرر الخطوات 1.4.5 - 1.4.7.
- احسب الحجم (بالميكرولتر) للمعلق المتكتل المطلوب لبذر 6000 كتلة على النحو التالي:
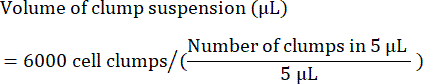
ملاحظة: يجب تحسين كثافة البذر المثلى مع كل خط خلية. لتحديد كثافة البذر المثلى ، يوصى بإجراء البذر الأولي في مجموعة من كثافات التكتل (على سبيل المثال ، 4000 و 5000 و 6000 كتلة لكل بئر) والتحقق من 24-48 ساعة بعد البذر إذا تم الوصول إلى التقاء 85٪ -90٪. - كمراقبة للجودة ، افصل عينة من الخلايا لفحص قياس التدفق الخلوي لعلامات الخلايا الجذعية. راجع الجدول 4 للحصول على قائمة بالعلامات الشائعة.
- افصل الحجم المطلوب من تعليق الكتلة iPSC للبذور على الآبار المطلية ب ECM مختلفة إلى أنابيب منفصلة سعة 15 مل.
- جهاز طرد مركزي الأنبوب الذي يحتوي على محلول التكتل iPSC عند 200 × جم لمدة 5 دقائق لإزالة الوسائط التي تحتوي على كاشف اختيار الخلايا الجذعية البشرية متعددة القدرات الخالية من الإنزيمات. أثناء انتظار الطرد المركزي ، أضف 50٪ من الحجم المطلوب لكل بئر إلى كل بئر إذا لم يتم ذلك بالفعل.
- قم بإعداد ما يلي قبل البدء: على الأقل 1 ساعة قبل المرور ، قم بتغطية الأواني البلاستيكية المرغوبة بالمصفوفات. القسمة كافية كاملة الخلايا الجذعية وسائل الإعلام ودافئة إلى درجة حرارة الغرفة (15 - 25 درجة مئوية). تجنب دورات التسخين المتعددة للوسائط الكاملة.
- استزراع iPSC في لوحات تحتوي على مصفوفات مشتقة من
- أعد تعليق كتل iPSCs برفق في الحجم المحسوب بنسبة 50٪ من وسائط الخلايا الجذعية الكاملة للحصول على الكثافة المطلوبة ولوحة خليط الخلية الكلي على آبار مطلية تحتوي على 50٪ من وسائط الخلايا الجذعية الكاملة المحسوبة.
ملاحظة: قد تكون إضافة مثبط ROCK-1 ضرورية لبعض خطوط الخلايا أو عندما تكون الكتل 50 ميكرومتر أو أصغر. يوصى بإضافة <10 ميكرومتر لتجنب المعدة المبكرة. - أضف بعناية وسيطا به خلايا أعلى المصفوفات ، 250 ميكرولتر / بئر في حالة استخدام لوحة 24 بئرا. لمعرفة الحجم الموصى به لوسط الخلية لألواح الآبار ذات الحجم الآخر ، تحقق من الجدول 2.
- قم بإمالة اللوحة في عدة حركات قصيرة ذهابا وإيابا ومن جانب إلى جانب لتوزيع كتل الخلية بالتساوي.
تنبيه: يؤدي التوزيع غير المتكافئ للمجاميع إلى زيادة التمايز التلقائي للiPSCs البشرية. يؤدي الانتشار الدائري لتعليق الكتل إلى تكتل كتل على حدود الآبار وكثافة أقل في المركز. - احتضان الصفيحة عند 37 درجة مئوية وإجراء تغييرات متوسطة باستخدام وسائط الخلايا الجذعية الكاملة يوميا أو كل يومين. عند إجراء تغييرات متوسطة ، قم بتقييم الثقافات بصريا لمراقبة النمو وتحديد ما إذا كانت الخلايا تتطلب وقتا للمرور أو جاهزة للتمايز. لتخطي يومين متتاليين من التغذية ، أضف 2x حجم الوسط المطلوب ليوم واحد.
- أعد تعليق كتل iPSCs برفق في الحجم المحسوب بنسبة 50٪ من وسائط الخلايا الجذعية الكاملة للحصول على الكثافة المطلوبة ولوحة خليط الخلية الكلي على آبار مطلية تحتوي على 50٪ من وسائط الخلايا الجذعية الكاملة المحسوبة.
- ثقافة iPSC في لوحات تحتوي على مصفوفة 4-XE
- أعد تعليق كتل iPSCs برفق في الحجم المحسوب الإجمالي لوسائط الخلايا الجذعية الكاملة 3x للحصول على الكثافة المطلوبة.
- أضف بعناية وسطا به خلايا أعلى الهيدروجيل 250 ميكرولتر / بئر إذا كنت تستخدم صفيحة 24 بئرا. لمعرفة الحجم الموصى به لوسط الخلية لألواح الآبار ذات الحجم الآخر ، راجع الجدول 3.
تنبيه: سوف ينتفخ الهيدروجيل ويشغل حجما أكبر من الحجم الطازج. سيتم تضمين مستعمرات iPSC جزئيا في الهيدروجيل الموجود أسفل اللوحة ، لذلك يوصى بتغيير 50٪ -80٪ من الوسط العلوي دون إزعاج الهيدروجيل. - حرك اللوحة في عدة حركات سريعة وقصيرة ذهابا وإيابا ومن جانب إلى آخر لتوزيع كتل الخلية بالتساوي.
- ضع اللوحة في حاضنة 37 درجة مئوية مع 5٪ CO2 و 95٪ رطوبة. قم بتغيير وسط الخلية باستخدام وسائط الخلايا الجذعية الكاملة. إجراء تغييرات متوسطة يوميا أو كل يوم ؛ بالنسبة للأخير ، أضف 2x حجم الوسيط.
- فحص الثقافات بصريا لتتبع نموها عند وصولها إلى المرحلة المناسبة للتمايز.
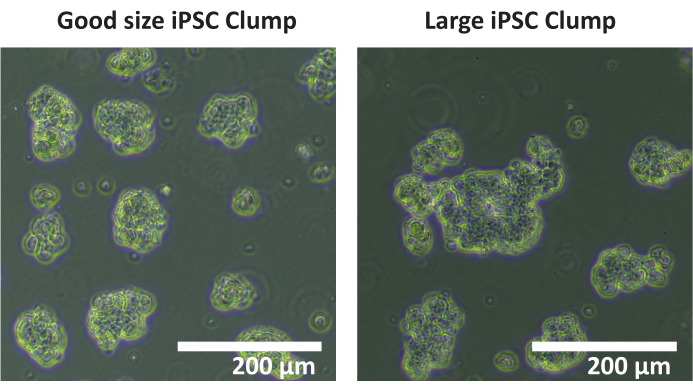
الشكل 1: الحجم الأمثل للتكتل. صور لكتل من خط خلية iPSC SCTi003A تصور مثالا على حجم التكتل الأمثل. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تمايز hiPSC وتوليد الأعضاء المعوية
تنبيه: تتم جميع الأعمال في خزانة السلامة البيولوجية (BSC) باتباع تقنيات التعقيم القياسية. يجب اتباع معايير السلامة OSHA للمختبرات ، بما في ذلك الاستخدام السليم لمعدات الحماية الشخصية مثل معاطف المختبر والقفازات والنظارات الواقية.
- قم بإعداد ما يلي قبل البدء: إعداد حصص وسط التمايز المطلوبة لكل مرحلة. بعد إذابة القسامات ، استخدمها على الفور. لا تعيد التجميد. اتبع الجدول 5 للحصول على دليل عام لكل نوع من أنواع وسائط المرحلة والأحجام اللازمة للوحة 24 بئرا.
ملاحظة: قد يختلف الوقت الأمثل في كل مرحلة تمايز لكل خط خلية. يوصى بالتحقق من تعبير كل علامة خلية مرحلة لتحسين فعالية التمايز. لم يتم تضمين التقييم الدوري للتعبير الجيني على مزارع iPSCS في هذا البحث لأننا استفدنا من الدفعات المؤهلة من البائعين في الممرات المنخفضة ، ولكن يوصى به كخطوة لمراقبة الجودة لخطوط iPSC الجديدة / غير المؤهلة بعد خلال خطوات التمايز اللاحقة. - المرحلة 1: الأديم الباطن النهائي (DE)
- لتقييم الاستعداد لبدء التمايز ، تحقق من المعايير التالية.
- باستخدام المجهر ، قم بتقييم التقاء مستعمرات الخلايا الجذعية ومقدار التمايز التلقائي في الثقافة. لا تعتمد فقط على التقييم المورفولوجي وحده. يجب أن يكون الالتقاء الأمثل بين 85٪ -90٪ (فوق ~ 105 خلايا / سم2) ، ويجب أن يكون الحد الأدنى من التمايز التلقائي الملاحظ <5٪ تمايز.
- اجمع الخلايا من بئر قرباني لتوصيف قياس التدفق الخلوي لعلامات hiPSC قبل متابعة الخطوة التالية. تم استخدام استراتيجية بوابات التشتت الأمامية والجانبية لتوصيف قياس التدفق الخلوي التمثيلي. إذا كانت الخلايا تفي بالمعايير المثلى ، فابدأ التمايز. معايير اجتياز الخلية هي تعبير بنسبة >85٪ عن 3 علامات مثالية (الجدول 4) ، خاصة في حالة خطوط iPSC الجديدة / غير المؤهلة بعد في المختبر.
ملاحظة: تخضع مزارع iPSC المزروعة على مصفوفات مختلفة لنفس العملية الشاملة مع نمو iPSC فقط على Matrix 4-XE ، مما يتطلب تغييرات وسائط أكثر رقة حتى لا تزعج الخلايا شبه المدمجة. من المتوقع موت الخلايا بشكل كبير أثناء تحريض الأديم الباطن النهائي ، حيث تكون الخلايا حساسة بشكل خاص في هذه المرحلة. توخي الحذر أثناء التغييرات المتوسطة ، بهدف تقليل المدة التي تتعرض فيها الخلايا خارج بيئة الحضانة التي تبلغ 37 درجة مئوية قدر الإمكان.
- ابدأ تمايز مستعمرات الخلايا كما هو موضح أدناه.
- اليوم 0: قم بتسخين حصة من DE متوسطة إلى 37 درجة مئوية. لتجنب تغيير طبيعة الوسائط من دورات الاحترار والتبريد، تأكد من تسخين الحجم المطلوب لليوم 0 فقط (0.7 مل/بئر).
- استنشاق الوسائط من hiPSCs. أضف بعناية 0.7 مل من DE Medium لكل بئر أسفل جانب البئر. تجنب السحب القاسي الذي يمكن أن يفصل المستعمرات أو يتلفها. احتضان اللوحة عند 37 درجة مئوية مع 5٪ CO2 و 95٪ رطوبة لمدة 24 ساعة.
- اليوم 1: قم بتسخين حصة من وسط DE تحتوي فقط على الحجم المطلوب لليوم 1 (0.5 مل / بئر) إلى 37 درجة مئوية. نضح وسط DE من الخلايا وأضف بعناية 0.5 مل من وسط DE لكل بئر أسفل جانب البئر. احتضان عند 37 درجة مئوية مع 5٪ CO2 و 95٪ رطوبة لمدة 24 ساعة.
- اليوم 3: الخلايا جاهزة للفحص لتشكيل الأديم الباطن النهائي. راجع الجدول 4 للاطلاع على العلامات الموصى بها. قبل الشروع في المرحلة التالية ، ضح ببئر لإجراء توصيف قياس التدفق الخلوي لعلامات محددة مرتبطة ب DE. تم استخدام استراتيجية بوابات التشتت الأمامية والجانبية لتوصيف قياس التدفق الخلوي التمثيلي. يوصى بفحص تعبير أكثر من علامة 1 ، خاصة في حالة خطوط iPSC الجديدة / غير المؤهلة بعد في المختبر.
- لتقييم الاستعداد لبدء التمايز ، تحقق من المعايير التالية.
- المرحلة 2: ميدجوت / هندجوت (MH)
- اليوم الثالث: قم بتسخين حجم وسط MH اللازم لليوم 3 فقط (0.5 مل / بئر) إلى 15 - 25 درجة مئوية. نضح وسط DE من الخلايا واستبدله ب 0.5 مل من وسط MH. احتضان عند 37 درجة مئوية مع 5٪ CO2 و 95٪ رطوبة لمدة 24 ساعة.
- الأيام 4 - 9: قبل التغييرات المتوسطة اليومية ، استخدم المجهر عند تكبير 2x أو 4x لتقييم تكوين الأجسام الكروية عن طريق التحقق من الهياكل ثلاثية الأبعاد المرئية (قد يحدث من اليوم 4) ؛ كرويات حرة الطفو (قد تحدث من اليوم 5).
- بمجرد أن تبدأ الأجسام الكروية في الانفصال ، استخدم ماصة سعة 1 مل لنقل الوسط برفق من الخلايا إلى أنبوب مخروطي معقم سعة 15 مل لتقييم عدد الأجسام الكروية المنفصلة عن الخلايا.
ملاحظة: تجنب أي قوة القص التي قد تفصل هياكل 3D من طبقة واحدة. بمجرد أن تصبح جاهزة ، سوف تنفصل الأجسام الكروية من تلقاء نفسها. - إذا تم فصل أقل من 50 كرويا ، فقم بطرد مركزي عند 200 × جم لمدة 5 دقائق ، وقم بإزالة الوسط القديم ، وأعد تعليق الكرات على 0.5 مل / بئر من الوسط وانقلها إلى البئر المعنية حتى تنضج ما يكفي من الكائنات الكروية.
ملاحظة: تلعب مدة التعرض لوسط الأمعاء الوسطى / الأمعاء الخلفية دورا حاسما في تحديد الهوية الإقليمية لتطوير عضويات معوية دقيقة ، مثل الاثني عشر (التعرض الأقصر) أو الدقاق (التعرض الأطول). لتحقيق ثقافات أكثر اتساقا بنفس الهوية ، استهدف جمع الأجسام الكروية المعرضة لوسط الأمعاء الوسطى / الأمعاء الخلفية في وقت واحد. - كرر الخطوة 2.3.3 حتى يتم فصل ما يكفي من الأجسام الكروية لتضمين وبدء ثقافة الأعضاء المعوية البشرية (hIO).
- قبل الشروع في المرحلة التالية ، افصل عينة من الأجسام الكروية وقم بإجراء توصيف قياس التدفق الخلوي لعلامات محددة مرتبطة ب Midgut / Hindgut (MH). تم استخدام استراتيجية بوابات التشتت الأمامية والجانبية لتوصيف قياس التدفق الخلوي التمثيلي. راجع الجدول 4 للحصول على قائمة بالعلامات شائعة الاستخدام. يوصى بفحص تعبير أكثر من علامة 1 ، خاصة في حالة خطوط iPSC الجديدة / غير المؤهلة بعد في المختبر.
- المرحلة 3: التضمين الكروي
- قم بإعداد ما يلي قبل البدء في الإجراء.
- إذابة حصص ماتريكس 1-ABO وماتريكس 3-ABO على الجليد. ضع في اعتبارك عدد الأجسام الكروية التي تم جمعها لتحديد الكمية الإجمالية للمصفوفة المطلوبة إذا كانت هناك حاجة إلى 30-40 ميكرولتر من المصفوفة لكل قبة.
- تحضير 25 مل من البرد Advance DMEM / F-12 تحتوي على 15 مللي متر HEPES. ECMs عالية التركيز لزجة ويصعب ماصة. ضع علبة من أطراف ماصة معقمة سعة 100 ميكرولتر عند -20 درجة مئوية لتحضير أطراف باردة يمكن أن تساعد في العملية. تحضير حصص وسط النمو العضوي المعوي (OGM) ، والذي يتطلب 4 رضعات (0.5 مل / بئر لكل تغذية). انظر الجدول 5 للاطلاع على التحضير.
- قم بإذابة حصة من ملحق OGM على الجليد. بعد إذابة القسامات ، استخدمها على الفور. لا تعيد التجميد. قم بتخزين OGM الكامل في درجة حرارة 2-8 درجة مئوية لمدة تصل إلى أسبوعين.
- تحضير OGM يحتوي على 3x من الملحق مقارنة بالصيغة القياسية ل (3x OGM). أخرج Matrix 4-XFO1 Matrix 4-XFO4 من الثلاجة واتركها دافئة إلى درجة حرارة الغرفة (25 درجة مئوية).
- بالنسبة للنظام المشتق من ، قم بتنفيذ الخطوات الموضحة أدناه.
- ضع صفيحة زراعة أنسجة معقمة مكونة من 24 بئرا في الحاضنة لتسخينها إلى 37 درجة مئوية أثناء تحضير الكرويات والمصفوفات. دع الكرويات المجمعة تستقر في قاع أنبوب مخروطي سعة 15 مل. نضح بعناية وتجاهل طاف .
ملاحظة: لإجراء مقارنة أكثر دقة لتأثير المصفوفات ، تأكد من إبقاء الكرويات التي تم جمعها من hiPSC متباينة على كل مصفوفة في أنابيب منفصلة. - أضف 1 مل من DMEM / F-12 مع 15 mM HEPES إلى الأجسام الكروية. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة (15 - 25 درجة مئوية).
- قم بإزالة أكبر قدر ممكن من المادة الطافية بعناية. يوصى بالبدء في الإزالة باستخدام ماصة سعة 1 مل والتبديل إلى ماصات 100 ميكرولتر وحتى 10 ميكرولتر لإزالة أكبر قدر ممكن دون إزعاج حبيبات الأجسام الكروية.
ملاحظة: كلما زاد حجم الوسائط المتبقية، زادت ضعف المصفوفات. يمكن أن تؤدي المصفوفات المخففة إلى مشاكل التبلور أو القباب اللينة. تؤدي القباب الأكثر ليونة إلى زيادة فرص الانهيار بأقل قدر من الاضطرابات. - باستخدام ماصة ذات طرف ماصة بارد 100 ميكرولتر ، أضف 40 ميكرولتر / 50 كروية من المصفوفة الباردة (2-8 درجة مئوية) 1-ABO أو Matrix 3-ABO إلى الأنبوب الخاص بها. قم بتوزيع المواد الكروية برفق في المصفوفة عن طريق السحب لأعلى ولأسفل ~ 5x. لا تفرغ طرف الماصة تماما ، مما قد يؤدي إلى ظهور فقاعات.
- أحضر اللوحة من الحاضنة ، وباستخدام طرف ماصة بارد ، انقل الأجسام الكروية المدمجة برفق إلى وسط اللوحة باتباع الخطوات الموضحة في الشكل 2. تجنب توزيع Matrix 1-ABO و Matrix 3-ABO بسرعة كبيرة في طبق الاستزراع ، لأن هذا سيؤدي إلى تسطيح القبة.
- انقل الطبق بعناية إلى حاضنة 37 درجة مئوية واحتضانها لمدة 30 دقيقة لضمان هلام القبة. كن حذرا بشكل خاص من أي اهتزاز أو حركة قاسية أثناء النقل وفي الحاضنة.
- أثناء احتضان القبة للتبلور ، قم بتسخين كمية كافية من OGM المعوي عند 37 درجة مئوية (0.5 مل / بئر) لعدد الآبار التي سيتم استخدامها.
ملاحظة: قم بتسخين الحجم المطلوب فقط. تجنب دورات الاحترار والتبريد. تأكد من أن الوسائط دافئة قبل إضافتها إلى القبة ؛ يمكن أن تؤدي الوسائط الباردة إلى انهيار القبة. - بعد 30 دقيقة ، أضف بعناية 0.5 مل من OGM المعوي إلى جانب البئر حتى لا تزعج القبة. احتضان في 37 درجة مئوية مع 5 ٪ CO2 و 95 ٪ الرطوبة. قم بإجراء تغيير كامل المتوسط كل 3 - 4 أيام عن طريق إزالة الوسيط ثم إضافة وسيط جديد.
- ضع صفيحة زراعة أنسجة معقمة مكونة من 24 بئرا في الحاضنة لتسخينها إلى 37 درجة مئوية أثناء تحضير الكرويات والمصفوفات. دع الكرويات المجمعة تستقر في قاع أنبوب مخروطي سعة 15 مل. نضح بعناية وتجاهل طاف .
- بالنسبة لأنظمة Matrix 4-XF العضوية ، اتبع الخطوات الموضحة.
ملاحظة: يتضمن نظام Matrix 4-XF العضوي أربعة خيارات مختلفة (O1-O4) ؛ تختلف صياغة كل نوع في الروابط الوظيفية الحيوية والصلابة والقابلية للتحلل. وبالتالي ، يوصى بإجراء تجارب أولية لتحديد النوع الأمثل للتطبيق المحدد. يصف هذا البروتوكول استخدام الخيارات الأربعة لإيجاد تركيبة مثالية للعضويات المعوية المشتقة من hiPSC. بالإضافة إلى ذلك ، في حين أن هناك العديد من بروتوكولات الاستزراع التي يمكن استخدامها (على سبيل المثال ، تغليف 3D ، تغليف القبة) ، يتضمن هذا البروتوكول استخدام طريقة القبة بحيث يمكن المقارنة مباشرة مع الطرق الشائعة المستخدمة عند العمل مع أنظمة الأغشية القاعدية المشتقة من.- أضف 1 مل / بئر من DMEM / F-12 المتقدم البارد الذي يحتوي على 16 mM HEPES إلى الأجسام الكروية المتولدة على نظام Matrix 4-XFO4. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة (15 - 25 درجة مئوية).
ملاحظة: للعثور على الصيغة المثلى للتطبيق ، تأكد من توزيع المواد الكروية في 4 أنابيب منفصلة قبل الطرد المركزي. يمكن أيضا أن تنضج الكائنات الكروية المتولدة على المصفوفات المشتقة من إلى عضويات معوية باستخدام هذا النظام. - باستخدام ماصة 1 مل ، قم بإزالة المادة الطافية دون إزعاج الكائنات الكروية. أضف 50 ميكرولتر من 3x OGM إلى حبيبات كروية (~ 100 كروية). أضف 100 ميكرولتر من Matrix 4-XFO المحدد إلى التعليق الكروي 50 ميكرولتر واخلطه برفق 5x-10x مرات. حافظ على Matrix 4-XFO إلى 3x OGM عند نسبة خلط 2: 1 فولت / فولت للحصول على تركيز نهائي يبلغ 1x.
- أضف 40 ميكرولتر من خليط هيدروجيل كروي إلى مركز صفيحة زراعة الأنسجة المكونة من 24 بئرا. انقل الأطباق بعناية إلى حاضنة 37 درجة مئوية واحتضانها لمدة 30 دقيقة.
ملاحظة: لا يتطلب Matrix 4-XFO حضانة 37 درجة مئوية للهلام. ومع ذلك ، يوصى بإبقاء الكائنات العضوية معرضة لظروف مماثلة عند مقارنتها بأنظمة Matrix 1-ABO و Matrix 3-ABO التي تتطلب 37 درجة مئوية لتحسين هلام القباب. - بعد 30 دقيقة ، أضف بعناية 0.5 مل من OGM المعوي إلى جانب البئر حتى لا تزعج القبة. احتضان في 37 درجة مئوية مع 5 ٪ CO2 و 95 ٪ الرطوبة. قم بإجراء تغيير كامل المتوسط كل 3 - 4 أيام عن طريق إزالة الوسيط ثم إضافة وسيط جديد.
- أضف 1 مل / بئر من DMEM / F-12 المتقدم البارد الذي يحتوي على 16 mM HEPES إلى الأجسام الكروية المتولدة على نظام Matrix 4-XFO4. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة (15 - 25 درجة مئوية).
- قم بإعداد ما يلي قبل البدء في الإجراء.
- hIO المرور والنضج
- تحضير نفس المواد الكيميائية والمحاليل والكواشف كما هو الحال في الخطوة 2.4.1.
- أضف 1-2 مل من محلول الشطف المضاد للالتصاق إلى أنبوب مخروطي سعة 15 مل (1 لكل حالة) وقم بالدوران لتغطية الأنبوب.
- قم بإزالة المحلول المضاد للالتصاق وشطف الأنابيب ب 5 مل من D-PBS (بدون Ca ++ و Mg ++). قم بتغطية جميع الأنابيب المطلية واحتفظ بها في درجة حرارة الغرفة (15 - 25 درجة مئوية) لحين الحاجة.
- نضح الوسيط من القباب. باستخدام ماصة 1 مل ، أضف 1 مل من DMEM / F-12 البارد إلى القبة مباشرة. الهدف هو فصل القباب عن اللوحة.
- أضف 1 مل إضافي من DMEM / F-12 البارد إلى البئر وماصة لأعلى ولأسفل لحصاد أي عضويات متبقية. نقل إلى الأنابيب المخروطية المغلفة 15 مل.
ملاحظة: تحقق من الحصاد الناجح للعضويات عن طريق فحص البئر بصريا تحت المجهر. إذا لوحظت أي عضويات متبقية ، كرر الخطوة 2.5.5. - باستخدام ماصة سعة 1 مل ، قم بإجراء سحب لأعلى ولأسفل للتعليق لتفكيك المواد العضوية حتى يتم تحقيق تعليق شظية موحد بالحجم العضوي المطلوب (على سبيل المثال ، 100 - 500 ميكرومتر).
ملاحظة: استخدم ماصة سعة 200 ميكرولتر للتحقق من توافق المواد العضوية مع الحجم الموصى به. يسهل استخدام ماصة سعة 200 ميكرولتر عمليات تجزئة إضافية حسب الحاجة ، مما يضمن أن الشظايا يمكن أن تمر بسلاسة عبر طرف ماصة سعة 200 ميكرولتر.
تنبيه: تجنب تفتيت الشظايا إلى خلايا مفردة عن طريق السحب القاسي أو المطول. - حدد الكثافة العضوية المطلوبة إما عن طريق عد الشظايا أو استخدام نسبة الانقسام. افصل القسمة وقم بإجراء العد باستخدام نفس الإجراء كما في الخطوات 1.4.6-1.4.9 لحساب التكتل.
ملاحظة: يجب تحسين الكثافة العضوية المثلى لكل سطر ؛ بشكل عام ، يوصى بكثافة 40-80 عضويا معويا لكل قبة. - تأكد من وضع الأنبوب على الثلج أثناء عملية عد المواد العضوية. بعد حوالي 5 دقائق ، ستستقر الشظايا العضوية في قاع الأنبوب بسبب الجاذبية.
ملاحظة: كلما زاد حجم المحلول العضوي ، كلما استغرق الأمر وقتا أطول للاستقرار في القاع. - تخلص برفق من أكبر قدر ممكن من المواد الطافية والطبقة الغائمة المتكونة فوق المواد العضوية. في الممرات المبكرة عندما تنضج الكائنات العضوية ، تشمل هذه المرحلة الغائمة مصفوفة وخلايا فردية.
- أضف 2 مل من DMEM / F-12 البارد عن طريق السحب مباشرة على الحبيبات. جهاز طرد مركزي عند 200 × جم لمدة 5 دقائق في درجة حرارة الغرفة (15-25 درجة مئوية).
- بالنسبة للنظام المشتق من، قم بإزالة المادة الطافية والتخلص منها بعناية باتباع نفس الخطوات الموضحة في الخطوات 2-4-2-4-2-9.
- بالنسبة لنظام Matrix 4-XFO ، قم بإزالة المادة الطافية والتخلص منها بعناية باتباع نفس الخطوات الموضحة في الخطوات 2.4.3.2-2.4.3.4.
ملاحظة: عند العمل مع نظام Matrix 4-XFO ، يوصى باستخدام محلول استرداد عضوي خال من الهيدروجين لإزالة بقايا الهيدروجيل الأمثل. يوصى بحل الاسترداد هذا بشكل خاص عند التبديل من أنظمة الهيدروجيل الحيوانية إلى أنظمة الهيدروجيل الخالية من الأجانب لضمان التخلص من أي مادة أجنبية.
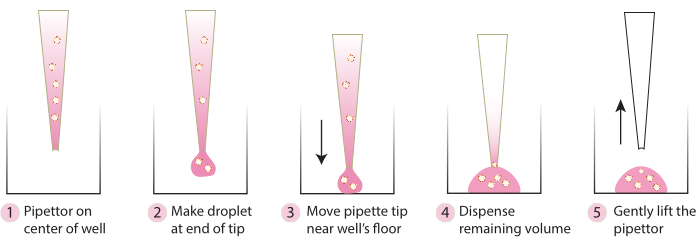
الشكل 2. رسم تخطيطي للتقنية الموصى بها لتشكيل القبة. يصف المخطط العملية خطوة بخطوة الموصى بها لتشكيل قبة ناجحة لجميع الأنظمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. توصيف حجم IO
ملاحظة: تميز حجم المواد العضوية بصور برايت فيلد التي تم التقاطها بمعدل 4x و 10x. تم أتمتة تحليل معالجة الصور باستخدام MATLAB. يتم وصف الخطوات العامة للعملية أدناه ، ويتم تضمين عينة من الكود في الملف التكميلي 1.
- حدد الدليل الذي يحتوي على الصور وقم بإدراج جميع ملفات الصور في الدليل. تهيئة الجدول لتخزين النتائج. اقرأ صور برايتفيلد في ملف.
- حدد تحويل البكسل إلى ميكرومتر واضبط المقياس. إذا كانت الصورة لا تحتوي على شريط مقياس، فاطلب من المستخدم عامل التحويل من بكسل إلى ميكرومتر.
- تحويل الصورة إلى تدرج الرمادي. قم بتطبيق مرشح Gaussian لتقليل التشويش في الصورة. قم بضبط عتبة الصورة المصفاة لفصل الكائنات العضوية عن الخلفية.
- املأ الثقوب الصغيرة وقم بإزالة الأشياء الصغيرة لتنظيف الصورة الثنائية. قم بإجراء تحليل المكونات المتصلة لتحديد الكائنات العضوية الفردية وحساب خصائصها مثل المساحة والسنترويد وطول المحور الرئيسي وطول المحور الثانوي.
- احسب حجم المحور العضوي بناء على أطوال المحاور الرئيسية والثانوية. اعرض المواد العضوية المجزأة على الصورة الأصلية وقم بتسميتها بحجمها. اطبع الأحجام العضوية وخزن النتائج في ملف .cvs.
ملاحظة: تم تحليل أول صورتين يدويا لتحديد المعلمات المثلى للانحراف المعياري لمرشح Gaussian والمنطقة إلى العتبة. يوفر الرمز الموجود في الملف التكميلي 1 مثالا على الإطار الأساسي لتحليل حجم الأعضاء من صور برايتفيلد. ومع ذلك ، هناك حاجة إلى مزيد من التحسين لتناسب المتطلبات المحددة لكل نوع صورة وجودتها. يمكن إجراء نفس العملية باستخدام برنامج مفتوح المصدر مثل FIJI من Image J. - اتبع الخطوات أدناه لاستخدام برنامج فيجي.
- حدد تحويل البكسل إلى ميكرومتر واضبط المقياس. إذا كانت الصورة لا تحتوي على شريط مقياس، فاطلب من المستخدم عامل تحويل البكسل إلى ميكرومتر بالنقر فوق تحليل > ضبط المقياس.
- قم بتحويل الصورة إلى تدرج الرمادي بالنقر فوق > الصورة اكتب > 8 بت. قم بتطبيق مرشح Gaussian لتقليل التشويش في الصورة بالنقر فوق > العملية تصفية > دعاية غاوسية > سيغما (نصف القطر) المستخدمة: 2.
- قم بضبط عتبة الصورة التي تمت تصفيتها لفصل الكائنات العضوية عن الخلفية بالنقر فوق > الصورة > MaxEntropy > تطبيق.
- املأ الثقوب الصغيرة وقم بإزالة الكائنات الصغيرة لتنظيف الصورة الثنائية بالنقر فوق معالجة > الضوضاء > إزالة القيم المتطرفة > 20 بكسل.
- قم بإجراء تحليل المكونات المتصلة لتحديد الكائنات العضوية الفردية وحساب خصائصها مثل المساحة والسنترويد وطول المحور الرئيسي وطول المحور الثانوي بالنقر فوق تحليل > تعيين > القياس تأكد من تضمين المساحة والمحيط والقطر > تحليل > تحليل الجسيمات > إظهار المخططات التفصيلية.
- التحليل الإحصائي
- قم بتقييم توزيع البيانات من أجل الحياة الطبيعية من خلال اختبار Saphiro-Wilk باستخدام برنامج JMP (SAS). لفحص الاختلافات الإحصائية بين المجموعات ، قم بإجراء ANOVA ثنائي الاتجاه ، وقم بإجراء اختبار لاحق باستخدام طريقة Wilcoxon غير البارامترية في برنامج JMP (SAS). تم تحديد الدلالة عند مستوى ألفا p ≤ 0.05.
Access restricted. Please log in or start a trial to view this content.
النتائج
باتباع هذا البروتوكول ، تم استخدام الأغشية القاعدية المتاحة تجاريا ونظام هيدروجيل خال من xeno بنجاح لزراعة خلايا hiPSC وتمييزها إلى hIO. كان الهدف الرئيسي من هذه التجارب هو التقييم المنهجي لتكافؤ المصفوفات من مصادر مختلفة لعمل hiPSC و hIO. ركز القسم الأول من هذا البروتوكول على الحفاظ على ثقافة iPSC ا?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يعد اختيار البيئة المكروية المثلى لعمل الخلايا الجذعية والأعضاء خطوة مبكرة محورية عند استخدام هذه المنصات لمجموعة واسعة من التطبيقات. تظهر نتائجنا التمثيلية أن Matrix 4-XFO3 ، إلى جانب تركيز أعلى من عوامل النمو ، يؤدي إلى عضويات أكبر ، مما يشير إلى أنه يمكن تسخير الخصائص الفيزيائية للهلاميات ا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الدكتور جون هوانغ هو المؤسس والرئيس التنفيذي لشركة TheWell Bioscience.
Acknowledgements
يقر المؤلفون بالتدريب السابق والتوصيات العامة المتعلقة ببدء عمل hiPSC والعمل العضوي من الدكاترة كريستينا باكاك وسيلفيلي سوسكي هاتانو وراسل ديسوزا. يشكرون الدكتورة تشيلسي سيمونز على توجيهاتها في استخدام أنظمة الهيدروجيل لعمل زراعة الخلايا في المختبر . أيضا ، يود المؤلفون أن يشكروا الدكتورة كريستين رودريغيز وتوماس أليسون من STEMCELL Technologies على توجيهاتهم حول ثقافة hiPSC. يشكر المؤلفون أيضا TheWell Bioscience لتغطية تكاليف النشر.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 24-Well Plate (Culture treated, sterile) | Falcon | 353504 | |
| 37 °C water bath | VWR | ||
| 96-well plate | Fisher Scientific | FB012931 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| Anti-adherence Rinsing Solutio | STEMCELL Technologies | 7010 | |
| Biological safety cabinet (BSC) | Labconco | Logic | |
| Brightfield Microscope | Echo Rebel | REB-01-E2 | |
| BXS0116 | ATCC | ACS-1030 | |
| Centrifuge with temperature control (4 °C capabilities) | ThermoScientific | 75002441 | |
| Conical tubes, 15 mL, sterile | Thermo Fisher Scientific | 339650 | |
| Conical tubes, 50 mL, sterile | Thermo Fisher Scientific | 339652 | |
| Cultrex RGF BME, Type 2 | Bio-techne | 3533-005-02 | |
| Cultrex Stem Cell Qualified RGF BME | Bio-techne | 3434-010-02 | |
| D-PBS (Without Ca++ and Mg++) | Thermo Fisher Scientific | 14190144 | |
| GeltrexLDEV-Free, hESC-Qualified Reduce Growth Factor | Gibco | A14133-02 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Guava Muse Cell Analyzer or another flow cytometry equipment (optional) | Luminex | 0500-3115 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Heralcell Vios Cell culture incubator (37 °C, 5% CO2) | Thermo Scientific | 51033775 | |
| JMP Software | SAS Institute | JMP 16 | |
| MATLAB | MathWorks, Inc | R2022b | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix LDEV free | Corning | 356231 | |
| Matrigel Matrix High Concentration (HC), Growth Factor Reduced (GFR) LDEV-free | Corning | 354263 | |
| mTeSR Plus Medium | STEMCELL Technologies | 100-0276 | |
| Nunclon Delta surface treated 24-well plate | Thermo Scientific | 144530 | |
| PE Mouse Anti-human CD326 (EpCAM) | BD Pharmingen | 566841 | |
| PE Mouse Anti-human CDX2 | BD Pharmingen | 563428 | |
| PE Mouse Anti-human FOXA2 | BD Pharmingen | 561589 | |
| PerCP-Cy 5.5 Mouse Anti-human SSEA4 | BD Pharmingen | 561565 | |
| ReLeSR | STEMCELL | 5872 | |
| SCTi003-A | STEMCELL Technologies | 200-0510 | |
| Serological pipettes (10 mL) | Fisher Scientific | 13-678-11E | |
| Serological pipettes (5 mL) | Fisher Scientific | 13-678-11D | |
| STEMdiff Intestinal Organoid Growth Medium | STEMCELL Technologies | 5145 | |
| STEMdiff Intestinal Organoid Kit | STEMCELL Technologies | 5140 | |
| Vitrogel Hydrogel Matrix | TheWell Bioscience | VHM01 | |
| VitroGel ORGANOID Discovery Kit | TheWell Bioscience | VHM04-K |
References
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. J Cell Sci. 123, Pt 24 4195-4200 (2010).
- Hinz, B., Gabbiani, G. Fibrosis: Recent advances in myofibroblast biology and new therapeutic perspectives. F1000 Biol Rep. 2, 78(2010).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 15 (12), 1243-1253 (2014).
- Rozario, T., DeSimone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol. 341 (1), 126-140 (2010).
- Even-Ram, S., Artym, V., Yamada, K. M. Matrix control of stem cell fate. Cell. 126 (4), 645-647 (2006).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Tran, O. N., et al. Organ-specific extracellular matrix directs trans-differentiation of mesenchymal stem cells and formation of salivary gland-like organoids in vivo. Stem Cell Res Ther. 13 (1), 306(2022).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., et al. Tissue geometry drives deterministic organoid patterning. Science. 375 (6576), (2022).
- Heo, J. H., Kang, D., Seo, S. J., Jin, Y. Engineering the extracellular matrix for organoid culture. Int J Stem Cells. 15 (1), 60-69 (2022).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15 (10), 647-664 (2014).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Huch, M., et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494 (7436), 247-250 (2013).
- Greenlee, A. R., Kronenwetter-Koepel, T. A., Kaiser, S. J., Liu, K. Comparison of Matrigel and gelatin substrata for feeder-free culture of undifferentiated mouse embryonic stem cells for toxicity testing. Toxicol In Vitro. 19 (3), 389-397 (2005).
- Geltrex LDEV-Free, HESC-Qualified, Reduced Growth Factor Basement Membrane Matrix User Guide (Pub.No. MAN0007336 3.0. Fisher Scientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.cn/TFS-Assets%2FLSG%2Fmanuals%2FGeltrex_LDEV_Free_hESC_qualified_PI.pdf (2024).
- biotechne R&D Systems. Cultrex Stem Cell Qualified Reduced Growth Factor. biotechne R&D Systems. , (2024).
- VitroGel Organoid Protocol. TheWell Bioscience. , Available from: https://www.thewellbio.com/video-protocols (2024).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Henderson, J. K., et al. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 20 (4), 329-337 (2002).
- Haruna, N. F., Huang, J. Investigating the dynamic biophysical properties of a tunable hydrogel for 3D cell culture. J Cytol Tissue Biol. 7, 30(2020).
- Cherne, M. D., et al. A synthetic hydrogel, VitroGel ORGANOID-3, improves immune cell-epithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells. Front Pharmacol. 12, 707891(2021).
- Stewart, D. C., et al. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 13, e0200377(2018).
- Hernandez-Gordillo, V., et al. Fully synthetic matrices for in vitro culture of primary human intestinal enteroids and endometrial organoids. Biomaterials. 254, 120125(2020).
- Broguiere, N., et al. Growth of epithelial organoids in a defined hydrogel. Adv Mater. 30, 1801621(2018).
- Barthes, J., et al. Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: The recent advances. BioMed Res Int. 2014, 921905(2014).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nat Rev Mater. 5 (7), 539-551 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved