A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מחקר השוואתי של מטריצות קרום מרתף לתחזוקת תאי גזע אנושיים ויצירת אורגנואידים במעי
In This Article
Summary
אורגנואידים הפכו לכלים רבי ערך למידול מחלות. המטריצה החוץ תאית (ECM) מנחה את גורל התא במהלך יצירת אורגנואידים, ושימוש במערכת הדומה לרקמה הטבעית יכול לשפר את דיוק המודל. מחקר זה משווה את הדור של אורגנואידי מעיים אנושיים המושרים פלוריפוטנטיים שמקורם בתאי גזע אנושיים ב- ECM שמקורו בבעלי חיים ובהידרוג'לים נטולי קסנו.
Abstract
מטריצה חוץ-תאית (ECM) ממלאת תפקיד קריטי בהתנהגות התא ובהתפתחותו. אורגנואידים המופקים מתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs) נמצאים באור הזרקורים של תחומי מחקר רבים. עם זאת, היעדר רמזים פיזיולוגיים בחומרים קלאסיים של תרביות תאים מעכב התמיינות יעילה של iPSC. שילוב ECM זמין מסחרית בתרבית תאי גזע מספק רמזים פיזיים וכימיים מועילים לתחזוקת התא. מוצרי ממברנות מרתף מסחריות שמקורם בבעלי חיים מורכבים מחלבוני ECM וגורמי גדילה התומכים בתחזוקת התא. מכיוון של-ECM יש תכונות ספציפיות לרקמות שיכולות לווסת את גורל התא, משתמשים במטריצות נטולות קסנו כדי להזרים תרגום למחקרים קליניים. בעוד שמטריצות זמינות מסחרית נמצאות בשימוש נרחב בעבודות hiPSC ואורגנואידים, השקילות של מטריצות אלה עדיין לא הוערכה. כאן נערך מחקר השוואתי של תחזוקת hiPSC ויצירת אורגנואידים במעיים אנושיים (hIO) בארבע מטריצות שונות: מטריג'ל (מטריקס 1-AB), גלטרקס (מטריקס 2-AB), קולטרקס (מטריקס 3-AB) וויטרוג'ל (מטריקס 4-XF). למרות שהמושבות חסרו צורה עגולה מושלמת, הייתה התמיינות ספונטנית מינימלית, כאשר מעל 85% מהתאים ביטאו את סמן תאי הגזע SSEA-4. מטריקס 4-XF הוביל להיווצרות גושים עגולים תלת ממדיים. כמו כן, הגדלת ריכוז תוספי התזונה וגורמי הגדילה במדיה המשמשת לייצור תמיסת ההידרוג'ל Matrix 4-XF שיפרה את ביטוי hiPSC של SSEA-4 פי 1.3. התמיינות של hiPSC מתוחזק על ידי מטריקס 2-AB הובילה לפחות שחרור ספרואידים בשלב האמצע/בטן אחורית בהשוואה לקרומי מרתף אחרים שמקורם בבעלי חיים. בהשוואה לאחרים, מטריצת אורגנואידים נטולי קסנו (Matrix 4-O3) מובילה ל-hIO גדול ובשל יותר, מה שמרמז על כך שניתן לרתום את התכונות הפיזיקליות של הידרוג'לים נטולי קסנו כדי לייעל את ייצור האורגנואידים. בסך הכל, התוצאות מצביעות על כך ששינויים בהרכב של מטריצות שונות משפיעים על שלבי התמיינות IO. מחקר זה מעלה את המודעות להבדלים במטריצות הזמינות מסחרית ומספק מדריך לאופטימיזציה של מטריצה במהלך עבודת iPSC וקלט/פלט.
Introduction
המטריצה החוץ תאית (ECM) היא מרכיב דינמי ורב-תכליתי של רקמות הממלא תפקיד מרכזי בוויסות התנהגות התא והתפתחותו. כרשת מורכבת, היא מספקת תמיכה מבנית, ליגנדות דבק תאים1, ואחסון של גורמי גדילה וציטוקינים המווסתים את האיתות התאי. לדוגמה, במהלך ריפוי פצעים, ECM משמש כפיגום לתאים נודדים וכמאגר של גורמי גדילה המעורבים בתיקון רקמות2. באופן דומה, חוסר ויסות ב- ECM יכול להוביל לעלייה בחומרת מחלות שונות כגון פיברוזיס וסרטן 3,4. במהלך ההתפתחות העוברית, ה- ECM מנחה מורפוגנזה של רקמות. לדוגמה, בפיתוח הלב, רכיבי ECM ממלאים תפקיד ביצירת הארכיטקטורה והתפקוד הנכונים של רקמת הלב5. יותר מעשור של מחקר הראה כי הנוקשות של המיקרו-סביבה לבדה 6,7 יכולה לשלוט במפרט שושלת תאי הגזע. לכן, אין זה מפתיע שבמהלך התמיינות תאי מבחנה, ECM משפיע על גורל תאי הגזע על ידי מתן אותות להתמיינות.
אורגנואידים יכולים להיווצר מתאי גזע פלוריפוטנטיים מושרים (iPSCs). החל מקו iPSC מאופיין כראוי נדרש כדי לייצר אורגנואידים בהצלחה. עם זאת, היעדר רמזים פיזיולוגיים בחומרים קלאסיים של תרביות תאים מעכב התמיינות iPSC יעילה ויצירת אורגנואידים. יתר על כן, מחקרים אחרונים הדגישו את המשמעות של הרכב המטריצה החוץ תאית (ECM), אינטראקציות בין תאים לבין ECM8, כמו גם רמזים מכניים וגיאומטריים 9,10,11 בהקשר של התפשטות והתמיינות אורגנואידים12. קידום טכנולוגיית אורגנואידים על ידי שיפור יכולת השחזור יכלול שילוב רמזים פיזיקליים וכימיים ספציפיים לרקמות.
אורגנואידים שואפים לשחזר את הרקמה הטבעית בתוך מיקרו-סביבה דומה מבחינה פיזיולוגית. בחירת מערכת ECM המחקה באופן הדוק את ECM הרקמה הטבעית היא חיונית להשגת רלוונטיות פיזיולוגית לגבי התנהגות התא, תפקודו ותגובתו לגירויים13. הבחירה של רכיבי ECM יכולה להשפיע על התמיינות תאי גזע לסוגי תאים ספציפיים בתוך האורגנואיד. חלבוני ECM שונים והשילובים שלהם יכולים לספק רמזים המנחים את גורל התא14. לדוגמה, מחקרים הראו כי שימוש ברכיבי ECM ספציפיים יכול לקדם את התמיינות תאי גזע המעי לסוגי תאי מעיים בוגרים, וכתוצאה מכך אורגנואידי מעיים רלוונטיים פיזיולוגית15. בעוד אורגנואידים הם כלי רב ערך במהלך מידול מחלות ובדיקות סמים, בחירת מערכת ECM מתאימה היא חיונית ליישום זה. מערכת ECM מתאימה יכולה לשפר את הדיוק של מידול מחלות על ידי יצירת מיקרו-סביבה הדומה לרקמה הפגועה16. יתר על כן, ECM ספציפי לרקמות יכול לסייע ביצירת אורגנואידים המשחזרים טוב יותר פנוטיפים הקשורים למחלות ותגובות תרופתיות17. אופטימיזציה של מערכת ECM המשמשת להתמיינות אורגנואידים היא קריטית להשגת תוצאות הבידול הרצויות.
מערכות ממברנות מרתף זמינות מסחרית שמקורן במקורות ECM של בעלי חיים (למשל, Matrigel, Cultrex) והידרוג'ל נטול קסנו (למשל, VitroGel) נמצאות בשימוש נרחב במחקר iPSC ואורגנואידים. חברות שממסחרות אותם וחוקרים המשתמשים בהם הציגו הוראות רבות למוצרים וליישומים הספציפיים שלהם לאורך השנים. רבות מהוראות אלה שימשו מדריך ליצירת פרוטוקול זה. יתר על כן, היתרונות והמכשולים הקשורים לתכונות המהותיות שלהם צוינו בנפרד על ידירבים 18,19,20,21. עם זאת, אין זרימת עבודה שיטתית שתנחה את הבחירה של מערכות אופטימליות עבור iPSC ואורגנואידים. כאן, זרימת עבודה כדי להעריך באופן שיטתי את השקילות של מערכות ECM ממקורות שונים עבור iPSC ואורגנואידים עבודה מסופק. זהו מחקר השוואתי של תחזוקה של שני קווי iPSC אנושיים שונים (hiPSC) ואורגנואידים במעיים אנושיים (hIO) בארבע מטריצות שונות: Matrigel (מטריקס 1-AB), Geltrex (מטריקס 2-AB), Cultrex (מטריקס 3-AB) ו VitroGel (מטריקס 4-XF). עבור תרבית אורגנואידים, נעשה שימוש בארבע גרסאות של VitroGel מטריצה נטולת קסנו שהותאמו בעבר לתרבית אורגנואידים: אורגנואיד 1 (מטריצה 4-O1), אורגנואיד 2 (מטריצה 4-O2), אורגנואיד 3 (מטריצה 4-O3), אורגנואיד 4 (מטריצה 4-O4). כמו כן, נעשה שימוש במטריצות מן החי המותאמות לאורגנואידים: Matrigel High Concentration (Matrix 1-ABO) ו-Cultrex Type 2 (Matrix 3-ABO). נעשה שימוש במדיה מסחרית לתרבית תאי גזע (mTeSR Plus) ובערכת התמיינות אורגנואידים (ערכת אורגנואיד מעיים STEMdiff). פרוטוקול זה משלב את ההוראות האישיות של יצרני המוצרים עם חוויות מעבדה כדי להנחות את הקורא לקראת אופטימיזציה מוצלחת של ECM עבור עבודת iPSC ואורגנואידים הספציפית שלהם. בסך הכל, פרוטוקול זה ותוצאות מייצגות מדגישים את החשיבות של בחירת המיקרו-סביבה האופטימלית לעבודה של תאי גזע והתמיינות אורגנואידים.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. תחזוקת hiPSC
זהירות: כל העבודה נעשית בארון בטיחות ביולוגית (BSC) בהתאם לטכניקות אספטיות סטנדרטיות. חייב לעמוד בתקני הבטיחות של OSHA למעבדות, כולל שימוש נאות בציוד מגן אישי כגון מעילי מעבדה, כפפות ומשקפי מגן.
- הכנת מטריצות, aliquots ומדיה תרבית התא
- עבור ממברנות מרתף שמקורן בבעלי חיים (BMs; Matrix 1-AB, Matrix 2-AB, Matrix 3-AB), להכין aliquots של נפחי עבודה בעקבות המלצת היצרן המסוכמת בטבלה 1 ולאחסן אותם ב -20 ° C או -80 ° C לאחסון לטווח ארוך. הימנע היווצרות של בועות. אם נוצרות כמה בועות, לפני האחסון, דגימות צנטריפוגות ב 4 ° C, ב <200 x גרם, במשך ~ 1-2 דקות כדי לאלץ את הבועה לעלות לפני השטח.
הערה: יצירת aliquots חד-פעמיים מסייעת למנוע מחזורי הקפאה-הפשרה חוזרים ונשנים המשבשים את ארכיטקטורת ECM. מכיוון שריכוז BM משתנה עם מספר הלוט, הקפד לעקוב אחר המלצת היצרן להכין aliquots חד פעמי ולעשות פתרונות ציפוי. BMs מרוכזים במיוחד צמיגים וקשים לפיפטה; השתמש טיפים קרים שאוחסנו בעבר ב -20 ° C. - הכינו מדיום תרבית תאי גזע בהתאם להמלצת היצרן. כדי להכין את המדיה המלאה הספציפית הזמינה מסחרית המשמשת בפרוטוקול זה, הוסף 100 מ"ל של קוקטייל תוסף 5x ל- 400 מ"ל של מדיום בסיסי. לאחר מכן, לערבב את המדיה ביסודיות aliquot לתוך 40 מ"ל נפחים, מאוחסן ב 20 ° C. לשימוש, להפשיר כל aliquot של מדיה מלאה, להשתמש המדיום המלא aliquoted מיד, או לאחסן ב 2 - 8 ° C עד 2 שבועות. אין להקפיא אותו מחדש.
- הכינו aliquots של המדיום המלא של תאי הגזע המכיל ריכוז פי 3 של קוקטייל התוסף להכנת הידרוג'ל Matrix 4-XE, כלומר, לדלל תוסף 5x ל 3x.
- עבור ממברנות מרתף שמקורן בבעלי חיים (BMs; Matrix 1-AB, Matrix 2-AB, Matrix 3-AB), להכין aliquots של נפחי עבודה בעקבות המלצת היצרן המסוכמת בטבלה 1 ולאחסן אותם ב -20 ° C או -80 ° C לאחסון לטווח ארוך. הימנע היווצרות של בועות. אם נוצרות כמה בועות, לפני האחסון, דגימות צנטריפוגות ב 4 ° C, ב <200 x גרם, במשך ~ 1-2 דקות כדי לאלץ את הבועה לעלות לפני השטח.
- ציפוי פלסטיק תרבית רקמות ב-BMs שמקורם בבעלי חיים (Matrix 1-3AB)
- הכינו את הדברים הבאים לפני שמתחילים: שמרו תמיד את המטריצות בקרח בעת ההפשרה והטיפול כדי למנוע מהן להתגלגל. השתמש במדיה קרה כדי להכין את המטריצות המדוללות. הכינו מספיק בארות משוכפלות לכל מצב כדי להעריך תאים לפני תחילת ובכל שלב של תהליך התמיינות hiPSC ויצירת אורגנואידים hIO.
הערה: כאן, צלחות 24 בארות שימשו למחקר זה. עיין בטבלה 2 לקבלת נפחי ציפוי מומלצים עבור גדלי לוחות אחרים. - עבור כל סוג של מטריצה, להכין 25 מ"ל של מתקדם קר DMEM/F-12 המכיל 15 mM HEPES בצינור חרוטי 50 מ"ל. שמור אותם על קרח.
- הוסיפו את המטריצות המופשרות ל-DMEM/F-12 המתקדם הקר שלהן וערבבו היטב. שמרו על מדיה קרה במהלך תהליך הערבוב. בדוק חזותית ערבוב הומוגני על ידי וידוא שאין גושים.
- השתמש מיד בתמיסות המטריצות המדוללות כדי לצפות כל באר שנבחרה לשימוש (250 μL / באר אם משתמשים ב -24 צלחות באר).
- הטו בעדינות את כלי התרבית כדי לפזר את תמיסת הציפוי באופן שווה על פני השטח. יש לדגור בטמפרטורת החדר (15 - 25 מעלות צלזיוס) לפחות שעה לפני השימוש.
הערה: אם לא נעשה שימוש מיידי, ניתן לאחסן את הצלחת בטמפרטורה של 2 - 8 מעלות צלזיוס למשך עד שבוע לאחר הציפוי, אך יש לאטום אותה בסרט שקוף כדי למנוע אידוי. בעת שימוש בצלחות מאוחסנות, תן להם להגיע לטמפרטורת החדר (15 - 25 ° C) במשך 30 דקות לפני שתמשיך לשלב הבא. - מוציאים בעדינות את התמיסה העודפת באמצעות פיפטה סרולוגית או על ידי שאיפה. ודא שהמשטח המצופה אינו שרוט.
- הוסף מיד מדיום תאי גזע שלמים חמים (50% מהנפח הכולל הדרוש לבאר ספציפית, למשל, 250 μL / well אם אתה משתמש בצלחת של 24 בארות).
- הכינו את הדברים הבאים לפני שמתחילים: שמרו תמיד את המטריצות בקרח בעת ההפשרה והטיפול כדי למנוע מהן להתגלגל. השתמש במדיה קרה כדי להכין את המטריצות המדוללות. הכינו מספיק בארות משוכפלות לכל מצב כדי להעריך תאים לפני תחילת ובכל שלב של תהליך התמיינות hiPSC ויצירת אורגנואידים hIO.
- ציפוי פלסטיק תרבית רקמה בהידרוג'ל Matrix 4-XE
- הכינו את הדברים הבאים לפני שמתחילים: הוציאו את ההידרוג'ל Matrix 4-XE מהמקרר ותנו לו להתחמם לטמפרטורת החדר (25°C). הכינו מספיק בארות משוכפלות לכל מצב כדי להעריך תאים לפני תחילת ובכל שלב של תהליך התמיינות hiPSC ויצירת אורגנואידים hIO.
הערה: כאן, צלחות 24 בארות שימשו למחקר זה. עיין בטבלה 3 לקבלת נפחי ציפוי מומלצים עבור גדלי לוחות אחרים. - הכינו מצע שלם של תרבית תאי גזע המכיל ריכוז של פי 3 מגורם גדילה בהשוואה לפורמולציה הסטנדרטית לתרבית תאי גזע (3x מדיום תאי גזע).
- יש לערבב הידרוג'ל 4-XE של Matrix ו-3x תאי גזע בינוניים ביחס ערבוב של 2:1 v/v ולערבב בעדינות פיפטה מעלה ומטה 5x-10x כדי לערבב היטב.
- מעבירים את תערובת ההידרוג'ל לצלחת היטב ומטים בזהירות את כלי התרבית לפיזור אחיד של התערובת על פני השטח. השתמש 250 μL / באר אם אתה משתמש צלחת 24 באר. ראה טבלה 3 לקבלת אמצעי אחסון מומלצים.
- יש להמתין 10-15 דקות בטמפרטורת החדר ליצירת כמוסת ג'ל. במהלך תהליך היווצרות ההידרוג'ל, אין להפריע להידרוג'ל על ידי הטיה או ניעור הצלחת.
- הכינו את הדברים הבאים לפני שמתחילים: הוציאו את ההידרוג'ל Matrix 4-XE מהמקרר ותנו לו להתחמם לטמפרטורת החדר (25°C). הכינו מספיק בארות משוכפלות לכל מצב כדי להעריך תאים לפני תחילת ובכל שלב של תהליך התמיינות hiPSC ויצירת אורגנואידים hIO.
- hiPSC נטול אנזימים גושים עוברים וזורעים
- הכינו את הדברים הבאים לפני שמתחילים: לפחות שעה לפני המעבר, צפו את כלי הפלסטיק הרצויים במטריצות. Aliquot מספיק מדיה מלאה תאי גזע חם לטמפרטורת החדר (15 - 25 ° C). הימנע ממחזורי חימום מרובים עבור המדיה המלאה.
הערה: השלבים הבאים מתארים את המעבר של תרבית מבוססת ו->90% של תאי גזע פלוריפוטנטיים מושרים על צלחת בעלת 6 בארות וזריעתם בצלחות של 24 בארות לצורך התמיינות של אורגנואידים במעיים. - לשטוף תאים עם 1 מ"ל של D-PBS (ללא Ca++ ו Mg++) ולשאוף. הוסף 1 מ"ל של מגיב בחירת תאי גזע פלוריפוטנטי אנושי ללא אנזימים, הסתחרר בזהירות כדי להתפשט באופן שווה, ושאפו תוך דקה אחת. מושבות צריכות להיחשף רק לסרט דק של נוזל.
- לדגור ב 37 ° C עד מושבות להתחיל להיראות פחות דחוס, אשר ייקח ~ 3-8 דקות.
הערה: זמן הדגירה האופטימלי עשוי להשתנות בהתאם לקו התאים שבו נעשה שימוש. זמן הדגירה האופטימלי חייב להיקבע כאשר עוברים כל קו תא עם מגיב בחירת תאי גזע אנושי פלוריפוטנטי ללא אנזים בפעם הראשונה. - הוסף 1 מ"ל של מדיה מלאה של תאי גזע. נתקו את המושבות על ידי הקשה בזהירות על צד הצלחת. הקפידו להחזיק את הצלחת ביד השנייה.
- עם פיפטה של 1 מ"ל ומעלה, מעבירים את ההשעיה של גושי התא לצינור חרוטי של 15 מ"ל. להעריך את גודל הגושים באמצעות מיקרוסקופ שדה בהיר ולוודא שגודל גוש התא הוא בין 50-200 מיקרומטר; אם הם גדולים יותר, נערו בעדינות את הצינור החרוטי כדי לפרק אותם.
- ציירו רשת x-y בתחתית כל באר של צלחת שטוחה בעלת 96 בארות שתשמש לספירת גושים והוסיפו 50 מיקרוליטר של D-PBS לכל אחת מהבארות. מומלץ לחשב ממוצע של הגושים שנספרו מ-3 בארות.
- ודא שגושי התאים מפוזרים באופן שווה על ידי ניעור עדין של הצינור ולאחר מכן העבר 5 μL של תרחיף גושי לכל אחת מהבארות של הצלחת בעלת 96 הבארות בעלות התחתית השטוחה.
הערה: לא מומלץ להשתמש במונה תאים אוטומטי כדי לספור גושים. מומלץ לבצע ספירה ידנית. - לספור את המספר הכולל של גושים בכל באר כי הם 50 - 200 מיקרומטר קוטר. אם רוב גושי התאים הם בקוטר > 200 מיקרומטר (ראו איור 1), חזרו על שלבים 1.4.5 - 1.4.7.
- חשב את הנפח (ב- μL) של תרחיף גושי הדרוש לזרע 6,000 גושים באופן הבא:
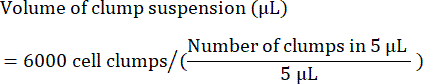
הערה: צפיפות זריעה אופטימלית חייבת להיות ממוטבת עם כל קו תא. כדי לקבוע צפיפות זריעה אופטימלית, מומלץ לבצע זריעה ראשונית בטווח של צפיפויות גושים (למשל, 4,000, 5,000 ו-6,000 גושים לבאר) ולבדוק 24-48 שעות לאחר הזריעה אם מגיעים למפגש של 85%-90%. - כבקרת איכות, יש להפריד דגימת תאים לבדיקת ציטומטריית זרימה של סמני תאי גזע. עיין בטבלה 4 לקבלת רשימה של סמנים נפוצים.
- הפרד את הנפח הנדרש של תרחיף גושי iPSC לזרעים על הבארות המצופות ב- ECM שונה לצינורות נפרדים של 15 מ"ל.
- צנטריפוגה את הצינור המכיל את תמיסת גוש iPSC ב 200 x גרם במשך 5 דקות כדי להסיר מדיה המכילה מגיב בחירת תאי גזע אנושי פלוריפוטנטי ללא אנזימים. בזמן ההמתנה לצנטריפוגה, להוסיף 50% מהנפח הרצוי לכל באר לכל באר אם זה לא נעשה כבר.
- הכינו את הדברים הבאים לפני שמתחילים: לפחות שעה לפני המעבר, צפו את כלי הפלסטיק הרצויים במטריצות. Aliquot מספיק מדיה מלאה תאי גזע חם לטמפרטורת החדר (15 - 25 ° C). הימנע ממחזורי חימום מרובים עבור המדיה המלאה.
- תרבית iPSC בצלחות המכילות מטריצות מן החי
- השהה מחדש בעדינות גושי iPSCs בנפח המחושב של 50% של מדיה מלאה של תאי גזע כדי לקבל את הצפיפות הרצויה וצלחת את תערובת צברי התאים על בארות מצופות המכילות 50% של מדיה מלאה מחושבת של תאי גזע.
הערה: הוספת מעכב ROCK-1 עשויה להיות נחוצה עבור שורות תאים מסוימות או כאשר הגושים הם 50 מיקרומטר או פחות. מומלץ להוסיף <10 מיקרומטר כדי למנוע גסטרולציה מוקדמת. - בזהירות להוסיף בינוני עם תאים על גבי מטריצות, 250 μL / טוב אם באמצעות צלחת 24 באר. לקבלת הנפח המומלץ של מדיום התא עבור לוחות באר בגודל אחר, עיין בטבלה 2.
- הטה את הצלחת במספר תנועות קצרות קדימה ואחורה ומצד לצד כדי לפזר את גושי התא באופן שווה.
זהירות: התפלגות לא אחידה של אגרגטים גורמת להתמיינות ספונטנית מוגברת של תאי גזע פלוריפוטנטיים מושרים אנושיים. התפשטות מעגלית של תרחיף הגושים גורמת להצטברות גושים בגבול הבארות ולצפיפות נמוכה יותר במרכז. - יש לדגור על הצלחת בטמפרטורה של 37°C ולבצע שינויים בינוניים באמצעות מדיה מלאה של תאי גזע מדי יום או פעם ביומיים. בעת ביצוע שינויים בינוניים, להעריך חזותית תרביות כדי לפקח על הצמיחה ולקבוע אם התאים דורשים זמן עובר או מוכנים להתמיינות. כדי לדלג על יומיים רצופים של האכלה, הוסיפו פי 2 מנפח המדיום הדרוש ליום אחד.
- השהה מחדש בעדינות גושי iPSCs בנפח המחושב של 50% של מדיה מלאה של תאי גזע כדי לקבל את הצפיפות הרצויה וצלחת את תערובת צברי התאים על בארות מצופות המכילות 50% של מדיה מלאה מחושבת של תאי גזע.
- תרבית iPSC בלוחות המכילים Matrix 4-XE
- השהה מחדש בעדינות גושי iPSCs לנפח המחושב הכולל של מדיה מלאה פי 3 של תאי גזע כדי לקבל את הצפיפות הרצויה.
- בזהירות להוסיף בינוני עם תאים על גבי הידרוג'ל 250 μL / באר אם באמצעות צלחת 24 באר. לקבלת הנפח המומלץ של מדיום התא עבור לוחות באר בגודל אחר, עיין בטבלה 3.
זהירות: ההידרוג'ל יתנפח ויתפוס נפח גדול יותר מאשר תוצרת טרייה. מושבות iPSC ישובצו חלקית בהידרוג'ל שבתחתית הצלחת, ולכן מומלץ להחליף 50%-80% מהתווך העליון מבלי להפריע להידרוג'ל. - הזיזו את הצלחת בכמה תנועות מהירות, קצרות, קדימה ואחורה ומצד לצד כדי לפזר את גושי התא באופן שווה.
- מניחים את הצלחת באינקובטור של 37°C עם 5%CO2 ו-95% לחות. שנה את תווך התא באמצעות מדיה מלאה של תאי גזע. לבצע שינויים בינוניים מדי יום או כל יומיים; עבור האחרון, להוסיף 2x נפח של המדיום.
- לבחון חזותית את התרבויות כדי לעקוב אחר צמיחתן כאשר הן מגיעות לשלב המתאים לבידול.
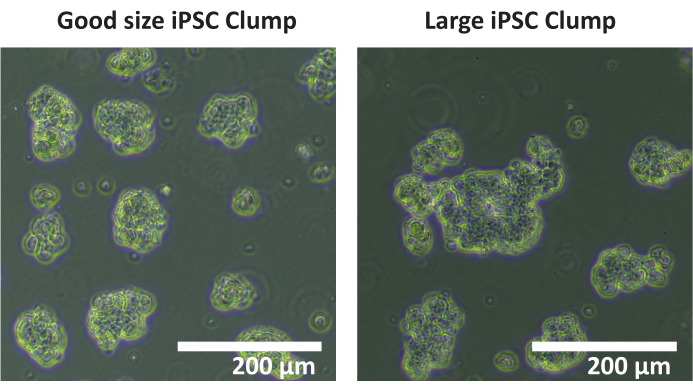
איור 1: גודל גושי אופטימלי. תמונות של גושים של קו תאי iPSC SCTi003A המתארות דוגמה לגודל גושי אופטימלי. סרגל קנה מידה = 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. התמיינות hiPSC ויצירת אורגנואידים במעיים
זהירות: כל העבודה נעשית בארון בטיחות ביולוגית (BSC) בהתאם לטכניקות אספטיות סטנדרטיות. חייב לעמוד בתקני הבטיחות של OSHA למעבדות, כולל שימוש נאות בציוד מגן אישי כגון מעילי מעבדה, כפפות ומשקפי מגן.
- הכינו את הדברים הבאים לפני שמתחילים: הכינו אליציטוטים של מדיום בידול הנדרש לכל שלב. לאחר הפשרת aliquots, להשתמש בהם מיד. אין להקפיא מחדש. עקוב אחר טבלה 5 לקבלת מדריך כללי של כל סוג מדיה שלב ונפחים הדרושים ללוח בן 24 קידוחים.
הערה: הזמן האופטימלי בכל שלב התמיינות עשוי להשתנות בהתאם לקו התא. מומלץ לבדוק את הביטוי של כל סמן תא שלב כדי לשפר את יעילות ההתמיינות. הערכה תקופתית של ביטוי גנים בתרביות iPSCS לא נכללה במחקר זה מכיוון שמינפנו אצוות מוסמכות ספק במעברים נמוכים, אך היא מומלצת כשלב בקרת איכות עבור קווי iPSC חדשים/עדיין לא מוסמכים במהלך שלבי ההתמיינות הבאים. - שלב 1: אנדודרם סופי (DE)
- כדי להעריך את המוכנות להתחיל בידול, בדוק את הקריטריונים הבאים.
- באמצעות מיקרוסקופ, להעריך את המפגש של מושבות תאי גזע ואת כמות התמיינות ספונטנית בתרבית. אין להסתמך רק על הערכה מורפולוגית בלבד. המפגש האופטימלי צריך להיות בין 85%-90% (מעל ~105 תאים לסמ"ר2), והתמיינות ספונטנית מינימלית שנצפתה צריכה להיות <5% התמיינות.
- לאסוף תאים מבאר הקרבה לאפיון ציטומטריית זרימה של סמני hiPSC לפני שתמשיך לשלב הבא. אסטרטגיית פיזור קדימה וצידית שימשה לאפיון ציטומטריית הזרימה המייצגת. אם התאים עומדים בקריטריונים האופטימליים, התחל התמיינות. קריטריוני מעבר תאים הם >85% ביטוי אידיאלי של 3 סמנים (טבלה 4), במיוחד במקרה של קווי iPSC חדשים/עדיין לא מוסמכים במעבדה.
הערה: תרביות iPSC הגדלות על מטריצות שונות עוברות את אותו תהליך כולל עם גידול iPSC בלבד ב- Matrix 4-XE, הדורש שינויי מדיה עדינים יותר כדי לא להפריע לתאים המשובצים למחצה. מוות תאי משמעותי צפוי במהלך השראת אנדודרם סופי, מכיוון שהתאים רגישים במיוחד בשלב זה. יש לנקוט משנה זהירות במהלך שינויים בינוניים, במטרה למזער ככל האפשר את משך הזמן שבו התאים נחשפים מחוץ לסביבת הדגירה של 37 מעלות צלזיוס.
- התחלת התמיינות של מושבות תאים כמתואר להלן.
- יום 0: לחמם aliquot של DE בינוני עד 37 °C (77 °F). כדי למנוע דנטורציה של מדיה ממחזורי התחממות-קירור, הקפד לחמם רק את הנפח הדרוש ליום 0 (0.7 מ"ל / באר).
- שאפו את התקשורת מ-hiPSCs. בזהירות להוסיף 0.7 מ"ל של DE בינוני לכל באר בצד של הבאר. הימנעו מצנרת קשה שעלולה לנתק או לפגוע במושבות. יש לדגור על הצלחת בטמפרטורה של 37°C עם 5%CO2 ו-95% לחות למשך 24 שעות.
- יום 1: לחמם aliquot של מדיום DE המכיל רק את הנפח הדרוש ליום 1 (0.5 מ"ל / באר) עד 37 ° C. שואפים את מדיום DE מתאים ומוסיפים בזהירות 0.5 מ"ל של מדיום DE לכל באר בצד הבאר. יש לדגור ב-37°C עם 5%CO2 ו-95% לחות למשך 24 שעות.
- יום 3: התאים מוכנים לבדיקה לצורך יצירת אנדודרם סופי. עיין בטבלה 4 לקבלת סמנים מומלצים. לפני שתמשיך לשלב הבא, להקריב באר כדי לבצע אפיון ציטומטריה זרימה של סמנים ספציפיים הקשורים DE. אסטרטגיית פיזור קדימה וצידית שימשה לאפיון ציטומטריית הזרימה המייצגת. מומלץ לבדוק ביטוי של יותר מסמן אחד, במיוחד במקרה של קווי iPSC חדשים/טרם מוסמכים במעבדה.
- כדי להעריך את המוכנות להתחיל בידול, בדוק את הקריטריונים הבאים.
- שלב 2: מידגוט/הינדגוט (MH)
- יום 3: יש לחמם רק את עוצמת MH הדרושה ליום 3 (0.5 מ"ל/באר) עד 15 - 25 מעלות צלזיוס. לשאוף DE בינוני מתאים ולהחליף עם 0.5 מ"ל של MH Medium. יש לדגור ב-37°C עם 5%CO2 ו-95% לחות למשך 24 שעות.
- ימים 4 - 9: לפני שינויי התווך היומיים, השתמש במיקרוסקופ בהגדלה פי 2 או 4 כדי להעריך היווצרות ספרואידים על ידי בדיקת מבנים תלת ממדיים גלויים (עשוי לקרות מהיום הרביעי); ספרואידים צפים בחופשיות (עשויים להתרחש מהיום החמישי).
- ברגע שהספרואידים מתחילים להתנתק, השתמש בפיפטור של 1 מ"ל כדי להעביר בעדינות את התווך מתאים לצינור חרוטי סטרילי של 15 מ"ל כדי להעריך את מספר הספרואידים המנותקים מהתאים.
הערה: הימנע מכל כוח גזירה שעלול לנתק מבנים תלת-ממדיים מהמונו-שכבה; ברגע שהם מוכנים, הספרואידים יתנתקו מעצמם. - אם פחות מ-50 ספרואידים מנותקים, צנטריפוגה ב-200 x גרם למשך 5 דקות, מוציאים את התווך הישן ומרחפים מחדש על 0.5 מ"ל/באר של תווך ומעבירים לבאר המתאימה עד שמספיק ספרואידים יבשילו.
הערה: משך החשיפה לתווך המעי האמצעי/אחורי ממלא תפקיד מכריע בקביעת הזהות האזורית של התפתחות אורגנואידים במעי הדק, כגון תריסריון (חשיפה קצרה יותר) או איליאום (חשיפה ארוכה יותר). כדי להשיג תרביות אחידות יותר עם אותה זהות, שאפו לאסוף ספרואידים שנחשפו לתווך המעי האמצעי/אחורי בו זמנית. - חזור על שלב 2.3.3 עד לניתוק מספיק ספרואידים כדי להטמיע וליזום תרבית אורגנואיד מעיים אנושי (hIO).
- לפני שממשיכים לשלב הבא, הפרידו דגימה של ספרואידים ובצעו אפיון ציטומטריית זרימה של סמנים ספציפיים הקשורים למידגוט/הינדגוט (MH). אסטרטגיית פיזור קדימה וצידית שימשה לאפיון ציטומטריית הזרימה המייצגת. עיין בטבלה 4 לקבלת רשימה של סמנים נפוצים. מומלץ לבדוק ביטוי של יותר מסמן אחד, במיוחד במקרה של קווי iPSC חדשים/טרם מוסמכים במעבדה.
- שלב 3: הטבעה ספרואידית
- הכינו את הדברים הבאים לפני תחילת ההליך.
- הפשירו אליציטוטים של מטריקס 1-ABO ומטריקס 3-ABO על קרח. שקול את מספר הספרואידים שנאספו כדי לקבוע את הכמות הכוללת של מטריצה הדרושה אם 30-40 מיקרוליטר של מטריצה יידרשו לכל כיפה.
- הכינו 25 מ"ל של HEPES קר מראש DMEM/F-12 המכיל 15 mM HEPES. ECMs בריכוז גבוה הם צמיגים וקשים לפיפטה. מניחים קופסה של קצוות פיפטה סטריליים של 100 μL בטמפרטורה של -20°C להכנת טיפים קרים שיכולים לעזור לתהליך. הכינו aliquots של Intestinal Organoid Growth Medium (OGM), אשר דורש 4 הזנות (0.5 מ"ל / באר לכל הזנה). ראו טבלה 5 להכנה.
- הפשיר aliquot של תוספת OGM על קרח. לאחר הפשרת aliquots, להשתמש בהם מיד. אין להקפיא מחדש. אחסן OGM מלא ב 2-8 ° C למשך עד שבועיים.
- הכינו OGM המכיל 3x של התוסף בהשוואה לנוסחה הסטנדרטית עבור (3x OGM). הוציאו את מטריקס 4-XFO1 חשב מטריקס 4-XFO4 מהמקרר ותנו להם להתחמם לטמפרטורת החדר (25°C).
- עבור המערכת שמקורה בבעלי חיים, בצע את השלבים המתוארים להלן.
- מניחים באינקובטור צלחת סטרילית של תרבית רקמה בת 24 בארות כדי להתחמם ל-37 מעלות צלזיוס בזמן הכנת הספרואידים והמטריצות. תן spheroids שנאספו לשקוע לתחתית של צינור חרוטי 15 מ"ל. בזהירות לשאוף ולהשליך את supernatant.
הערה: כדי לבצע השוואה מדויקת יותר של השפעת המטריצות, הקפד לשמור את הספרואידים שנאספו מה- hiPSC מובחנים על כל מטריצה בצינורות נפרדים. - הוסף 1 מ"ל של DMEM/F-12 עם HEPES של 15 mM לכדורואידים. צנטריפוגה ב 300 x גרם במשך 5 דקות בטמפרטורת החדר (15 - 25 ° C).
- בזהירות להסיר כמה שיותר supernatant. מומלץ להתחיל להסיר עם פיפטור 1 מ"ל ולעבור ל 100 μL ואפילו 10 μL פיפטות כדי להסיר ככל האפשר מבלי להפריע את כדור הספרואידים.
הערה: ככל שנפח המדיה גדול יותר, כך המטריצות יהיו מדוללות יותר. מטריצות מדוללות עלולות לגרום לבעיות ג'לינג או לכיפות רכות יותר. כיפות רכות יותר מובילות לסיכויים גבוהים יותר להתמוטטות עם מינימום הפרעות. - בעזרת פיפטור עם קצה פיפטה קר של 100 μL, הוסף 40 μL/50 ספרואידים קרים (2 - 8 ° C) Matrix 1-ABO או Matrix 3-ABO לצינור המתאים שלהם. מפזרים בעדינות ספרואידים לתוך המטריצה על ידי פיפטציה למעלה ולמטה ~ 5x. אין לרוקן לחלוטין את קצה פיפטה, אשר עלול להציג בועות.
- הביאו את הצלחת מהאינקובטור, ובעזרת קצה פיפטה קר העבירו בעדינות ספרואידים משובצים למרכז הצלחת בעקבות השלבים באיור 2. הימנעו מהפצת מטריקס 1-ABO ומטריקס 3-ABO מהר מדי לצלחת התרבית, מכיוון שזה ישטח את הכיפה.
- מעבירים בזהירות את הצלחת לאינקובטור של 37 מעלות צלזיוס ודגרים במשך 30 דקות כדי להבטיח ג'לציה של הכיפה. היזהרו במיוחד מכל טלטול או תנועה קשה במהלך ההובלה ובאינקובטור.
- בעת הדגירה על הכיפה לג'לינג, חם ב 37 ° C נפח מספיק של OGM מעיים (0.5 מ"ל / באר) למספר הבארות לשימוש.
הערה: יש לחמם רק את עוצמת הקול הדרושה. הימנעו ממחזורי חימום-קירור. ודא שהמדיה חמה לפני הוספתה לכיפה; מדיה קרה יכולה להוביל לקריסת הכיפה. - לאחר 30 דקות, בזהירות להוסיף 0.5 מ"ל של OGM המעי לצד הבאר כדי לא להפריע את הכיפה. יש לדגור ב-37°C עם 5%CO2 ו-95% לחות. בצע שינוי מלא-בינוני כל 3-4 ימים על ידי הסרת המדיום ולאחר מכן הוסף מדיום טרי.
- מניחים באינקובטור צלחת סטרילית של תרבית רקמה בת 24 בארות כדי להתחמם ל-37 מעלות צלזיוס בזמן הכנת הספרואידים והמטריצות. תן spheroids שנאספו לשקוע לתחתית של צינור חרוטי 15 מ"ל. בזהירות לשאוף ולהשליך את supernatant.
- עבור מערכות אורגנואיד Matrix 4-XF, בצע את השלבים המתוארים.
הערה: מערכת אורגנואיד Matrix 4-XF כוללת ארבע אפשרויות שונות (O1-O4); הנוסחה של כל סוג משתנה בליגנדות ביו-פונקציונליות, נוקשות ומתכלה. כתוצאה מכך, מומלץ לבצע ניסויים ראשוניים כדי לקבוע את הסוג האופטימלי עבור היישום הספציפי. פרוטוקול זה מתאר שימוש בארבע האפשרויות כדי למצוא נוסחה אופטימלית עבור אורגנואידי מעיים שמקורם ב-hiPSC. בנוסף, בעוד שישנם פרוטוקולי תרבית מרובים שניתן להשתמש בהם (למשל, אנקפסולציה תלת ממדית, אנקפסולציה של כיפה), פרוטוקול זה כולל שימוש בשיטת הכיפה כך שניתן להשוות ישירות עם השיטות הנפוצות המשמשות בעבודה עם מערכות קרום מרתף שמקורן בבעלי חיים.- הוסף 1 מ"ל/באר של מתקדם קר DMEM/F-12 המכיל 16 mM HEPES לכדורואידים הנוצרים במערכת Matrix 4-XFO4. צנטריפוגה ב 300 x גרם במשך 5 דקות בטמפרטורת החדר (15 - 25 ° C).
הערה: כדי למצוא את הנוסחה האופטימלית ליישום, הקפד לפזר ספרואידים ל -4 צינורות נפרדים לפני הצנטריפוגה. ספרואידים הנוצרים על מטריצות שמקורן בבעלי חיים יכולים גם להבשיל לאורגנואידים במעיים באמצעות מערכת זו. - באמצעות פיפטור 1 מ"ל, להסיר את supernatant מבלי להפריע spheroids. הוסף 50 μL של 3x OGM לגלולת הספרואידים (~ 100 ספרואידים). הוסף 100 μL של Matrix 4-XFO שנבחר למתלה הספרואידי 50 μL וערבב בעדינות 5x-10x פעמים. שמור על Matrix 4-XFO ל- 3x OGM ביחס ערבוב של 2:1 v/v כדי לקבל ריכוז סופי של 1x.
- הוסף 40 μL של תערובת הידרוג'ל-ספרואיד למרכז צלחת תרבית רקמות 24 באר. מעבירים בזהירות את הצלחות לאינקובטור של 37 מעלות צלזיוס ודגרים במשך 30 דקות.
הערה: Matrix 4-XFO אינו דורש דגירה של 37°C עבור ג'לציה; עם זאת, מומלץ לשמור על אורגנואידים חשופים לתנאים דומים בהשוואה למערכות מטריקס 1-ABO ומטריקס 3-ABO הדורשות 37 מעלות צלזיוס לג'לציה טובה יותר של הכיפות. - לאחר 30 דקות, בזהירות להוסיף 0.5 מ"ל של OGM המעי לצד הבאר כדי לא להפריע את הכיפה. יש לדגור ב-37°C עם 5%CO2 ו-95% לחות. בצע שינוי מלא-בינוני כל 3-4 ימים על ידי הסרת המדיום ולאחר מכן הוספת מדיום טרי.
- הוסף 1 מ"ל/באר של מתקדם קר DMEM/F-12 המכיל 16 mM HEPES לכדורואידים הנוצרים במערכת Matrix 4-XFO4. צנטריפוגה ב 300 x גרם במשך 5 דקות בטמפרטורת החדר (15 - 25 ° C).
- הכינו את הדברים הבאים לפני תחילת ההליך.
- hIO עובר והבשלה
- הכינו את אותם כימיקלים, תמיסות וריאגנטים כפי שנעשה בשלב 2.4.1.
- הוסף 1-2 מ"ל של תמיסת שטיפה נגד היצמדות לצינור חרוטי 15 מ"ל (1 לכל מצב) ומערבל כדי לצפות את הצינור.
- הסר את הפתרון נגד היצמדות ושטוף את הצינורות עם 5 מ"ל של D-PBS (ללא Ca++ ו- Mg++). מכסים את כל הצינורות המצופים ושומרים אותם בטמפרטורת החדר (15 - 25 מעלות צלזיוס) עד לצורך.
- שאפו את המדיום מהכיפות. באמצעות פיפטה של 1 מ"ל, הוסף 1 מ"ל של DMEM/F-12 קר לכיפה ישירות. המטרה היא לנתק את הכיפות מהצלחת.
- הוסף 1 מ"ל נוסף של DMEM/F-12 קר לבאר ופיפטה למעלה ולמטה כדי לקצור אורגנואידים שנותרו. מעבירים לצינורות החרוטי המצופים 15 מ"ל.
הערה: ודא את הקציר המוצלח של אורגנואידים על ידי בחינה חזותית של הבאר תחת מיקרוסקופ. אם נצפים שאריות אורגנואידים, חזור על שלב 2.5.5. - עם פיפטור 1 מ"ל, בצע פיפטינג מעלה ומטה של המתלה כדי לפרק אורגנואידים עד להשגת תרחיף שבר אחיד בגודל האורגנואיד הרצוי (למשל, 100 - 500 מיקרומטר).
הערה: השתמש בפיפטור של 200 μL כדי לוודא שהאורגנואידים תואמים לגודל המומלץ. שימוש בפיפטור של 200 מיקרוליטר מאפשר פיצול נוסף לפי הצורך, ומבטיח שהשברים יוכלו לעבור בצורה חלקה דרך קצה פיפטה של 200 מיקרוליטר.
אזהרה: הימנעו מפירוק מקטעים לתאים בודדים על ידי פיפטינג קשה או ממושך. - קבע את צפיפות האורגנואיד הרצויה על ידי ספירת מקטעים או שימוש ביחס הפיצול. הפרד aliquot ובצע ספירה באמצעות אותו הליך כמו בשלבים 1.4.6-1.4.9 עבור ספירת גושים.
הערה: צפיפות אורגנואידים אופטימלית צריכה להיות אופטימלית לכל שורה; באופן כללי, צפיפות של 40 - 80 אורגנואידי מעיים לכל כיפה מומלצת. - ודא שהצינור מונח על קרח במהלך תהליך ספירת האורגנואידים. לאחר כ-5 דקות, שברי אורגנואידים יתמקמו בתחתית הצינור עקב כוח הכבידה.
הערה: ככל שהנפח של תמיסת האורגנואידים גדול יותר, כך ייקח זמן רב יותר לשקוע לתחתית. - סלקו בעדינות כמה שיותר סופרנאטנט ואת השכבה העכורה שנוצרה על גבי האורגנואידים. במעברים המוקדמים כאשר אורגנואידים מבשילים, שלב עכור זה כולל מטריצה ותאים בודדים.
- הוסף 2 מ"ל של DMEM/F-12 קר על ידי פיפטציה ישירות על הכדור. צנטריפוגה ב 200 x גרם במשך 5 דקות בטמפרטורת החדר (15 - 25 ° C).
- עבור מערכת שמקורה בבעלי חיים, יש להסיר ולהשליך בזהירות סופרנאטנט בהתאם לאותם שלבים המתוארים בשלבים 2.4.2.4-2.4.2.9.
- עבור מערכת Matrix 4-XFO, הסר בזהירות והשלך את הסופרנאטנט בהתאם לאותם שלבים המתוארים בשלבים 2.4.3.2-2.4.3.4.
הערה: בעת עבודה עם מערכת Matrix 4-XFO, מומלץ להשתמש בתמיסת שחזור אורגנואיד הידרוג'ל ללא קסנו להסרה אופטימלית של שאריות הידרוג'ל. פתרון התאוששות זה מומלץ במיוחד בעת מעבר ממערכות הידרוג'ל מבוססות בעלי חיים למערכות הידרוג'ל נטולות קסנו, כדי להבטיח חיסול של כל חומר קסנוגני.
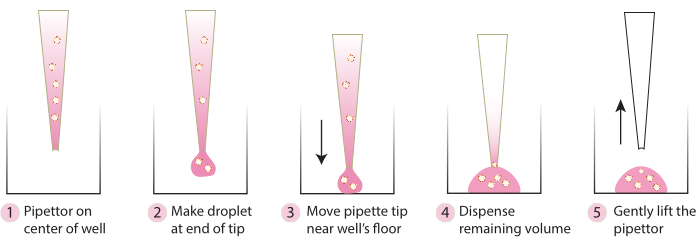
איור 2. סכמטי של טכניקה מומלצת ליצירת כיפה. הסכימה מתארת את התהליך שלב אחר שלב המומלץ ליצירת כיפה מוצלחת לכל המערכות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. אפיון גודל קלט/פלט
הערה: גודל האורגנואידים אופיין בתמונות שדה בהיר שצולמו ברזולוציה של 4x ו-10x. ניתוח עיבוד התמונה נעשה אוטומטי באמצעות MATLAB. השלבים הכוללים של התהליך מתוארים להלן, ודוגמה של הקוד כלולה בקובץ משלים 1.
- הגדר את הספרייה הכוללת את התמונות ופרט את כל קובצי התמונות בספרייה. אתחל את הטבלה כדי לאחסן את התוצאות. קרא את תמונות brightfield בקובץ.
- הגדר המרת פיקסל למיקרומטר והגדר את קנה המידה. אם התמונה אינה כוללת סרגל קנה מידה, בקשו מהמשתמש את מקדם ההמרה פיקסל למיקרומטר.
- המירו את התמונה לגווני אפור. החילו מסנן גאוס להפחתת הרעש בתמונה. סמן את התמונה המסוננת כדי להפריד אורגנואידים מהרקע.
- מלא חורים קטנים והסר עצמים קטנים כדי לנקות את התמונה הבינארית. בצע ניתוח רכיבים מחוברים כדי לזהות אורגנואידים בודדים ולחשב את תכונותיהם כגון שטח, צנטרויד, אורך ציר ראשי ואורך ציר משני.
- חשב את גודל האורגנואיד בהתבסס על אורכי הציר הראשי והשני. הצג את האורגנואידים המפולחים בתמונה המקורית ותייג אותם לפי גודלם. הדפס את גדלי האורגנואידים ואחסן תוצאות בקובץ cvs.
הערה: שתי התמונות הראשונות נותחו ידנית כדי לקבוע את הפרמטרים האופטימליים עבור סטיית התקן של מסנן גאוס ואת השטח לסף. הקוד בקובץ משלים 1 מספק דוגמה למסגרת הבסיסית לניתוח גודל אורגנואיד מתמונות שדה בהיר; עם זאת, יש צורך בחידוד נוסף כדי להתאים לדרישות הספציפיות עבור כל סוג תמונה ואיכות. אותו תהליך יכול להיעשות באמצעות תוכנת קוד פתוח כמו FIJI מתמונה J. - בצע את השלבים הבאים כדי להשתמש בתוכנת FIJI.
- הגדר המרת פיקסל למיקרומטר והגדר את קנה המידה. אם התמונה אינה כוללת סרגל קנה מידה, בקשו מהמשתמש את מקדם ההמרה פיקסל למיקרומטר בלחיצה על 'נתח' >'קבע קנה מידה'.
- המר את התמונה לגווני אפור על-ידי לחיצה על תמונה > הקלד > 8 סיביות. החילו מסנן גאוס כדי להפחית את הרעש בתמונה בלחיצה על 'מסנן תהליך' > > טשטוש גאוס > סיגמא (רדיוס) בשימוש: 2.
- סמן את התמונה המסוננת כדי להפריד אורגנואידים מהרקע על-ידי לחיצה על Image > Threshold > MaxEntropy > Apply.
- מלא חורים קטנים והסר עצמים קטנים כדי לנקות את התמונה הבינארית על-ידי לחיצה על עבד > רעש > הסר חריגים >- 20 פיקסלים.
- בצע ניתוח רכיבים מחוברים כדי לזהות אורגנואידים בודדים ולחשב את תכונותיהם, כגון שטח, צנטרויד, אורך ציר ראשי ואורך ציר משני על-ידי לחיצה על נתח > הגדר > מדידה ודא ששטח, היקף וקוטר כלולים > נתח > נתח חלקיקים > הצג קווי מתאר.
- ניתוח סטטיסטי
- הערך את התפלגות הנתונים לנורמליות באמצעות מבחן Saphiro-Wilk באמצעות תוכנת JMP (SAS). כדי לבחון הבדלים סטטיסטיים בין קבוצות, בצע ANOVA דו-כיווני, ובצע בדיקות פוסט-הוק באמצעות שיטת Wilcoxon הלא פרמטרית בתוכנת JMP(SAS). מובהקות נקבעה ברמת אלפא של p ≤ 0.05.
Access restricted. Please log in or start a trial to view this content.
תוצאות
בעקבות פרוטוקול זה, ממברנות מרתף זמינות מסחרית ומערכת הידרוג'ל נטולת קסנו נוצלו בהצלחה כדי לטפח תאי hiPSC ולהתמיין אותם ל- hIO. המטרה העיקרית של ניסויים אלה הייתה להעריך באופן שיטתי את השקילות של מטריצות ממקורות שונים עבור עבודת hiPSC ו- hIO. החלק הראשון של פרוטוקול זה התמקד בתחזוקה ואפיון של תרבית...
Access restricted. Please log in or start a trial to view this content.
Discussion
בחירת המיקרו-סביבה האופטימלית לעבודה של תאי גזע ואורגנואידים היא צעד מוקדם מכריע בעת שימוש בפלטפורמות אלה למגוון רחב של יישומים. התוצאות המייצגות שלנו מראות כי מטריקס 4-XFO3, בשילוב עם ריכוז גבוה יותר של גורמי גדילה, מוביל לאורגנואידים גדולים יותר, דבר המצביע על כך שניתן לרתום את התכונות הפי...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ד"ר ג'ון הואנג הוא מייסד ומנכ"ל TheWell Bioscience.
Acknowledgements
המחברים מודים על הדרכות קודמות והמלצות כלליות לגבי התחלת עבודת hiPSC ואורגנואידים מד"ר כריסטינה פאצ'אק, סילבלי סוסוקי-הטאנו וראסל ד'סוזה. הם מודים לד"ר צ'לסי סימונס על הדרכתה בשימוש במערכות הידרוג'ל לעבודת תרבית תאים במבחנה . כמו כן, המחברים רוצים להודות לד"ר כריסטין רודריגז וד"ר תומס אליסון מ-STEMCELL Technologies על הדרכתם בנושא תרבות hiPSC. המחברים מודים גם ל-TheWell Bioscience על כיסוי עלויות הפרסום.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 24-Well Plate (Culture treated, sterile) | Falcon | 353504 | |
| 37 °C water bath | VWR | ||
| 96-well plate | Fisher Scientific | FB012931 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| Anti-adherence Rinsing Solutio | STEMCELL Technologies | 7010 | |
| Biological safety cabinet (BSC) | Labconco | Logic | |
| Brightfield Microscope | Echo Rebel | REB-01-E2 | |
| BXS0116 | ATCC | ACS-1030 | |
| Centrifuge with temperature control (4 °C capabilities) | ThermoScientific | 75002441 | |
| Conical tubes, 15 mL, sterile | Thermo Fisher Scientific | 339650 | |
| Conical tubes, 50 mL, sterile | Thermo Fisher Scientific | 339652 | |
| Cultrex RGF BME, Type 2 | Bio-techne | 3533-005-02 | |
| Cultrex Stem Cell Qualified RGF BME | Bio-techne | 3434-010-02 | |
| D-PBS (Without Ca++ and Mg++) | Thermo Fisher Scientific | 14190144 | |
| GeltrexLDEV-Free, hESC-Qualified Reduce Growth Factor | Gibco | A14133-02 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Guava Muse Cell Analyzer or another flow cytometry equipment (optional) | Luminex | 0500-3115 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Heralcell Vios Cell culture incubator (37 °C, 5% CO2) | Thermo Scientific | 51033775 | |
| JMP Software | SAS Institute | JMP 16 | |
| MATLAB | MathWorks, Inc | R2022b | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix LDEV free | Corning | 356231 | |
| Matrigel Matrix High Concentration (HC), Growth Factor Reduced (GFR) LDEV-free | Corning | 354263 | |
| mTeSR Plus Medium | STEMCELL Technologies | 100-0276 | |
| Nunclon Delta surface treated 24-well plate | Thermo Scientific | 144530 | |
| PE Mouse Anti-human CD326 (EpCAM) | BD Pharmingen | 566841 | |
| PE Mouse Anti-human CDX2 | BD Pharmingen | 563428 | |
| PE Mouse Anti-human FOXA2 | BD Pharmingen | 561589 | |
| PerCP-Cy 5.5 Mouse Anti-human SSEA4 | BD Pharmingen | 561565 | |
| ReLeSR | STEMCELL | 5872 | |
| SCTi003-A | STEMCELL Technologies | 200-0510 | |
| Serological pipettes (10 mL) | Fisher Scientific | 13-678-11E | |
| Serological pipettes (5 mL) | Fisher Scientific | 13-678-11D | |
| STEMdiff Intestinal Organoid Growth Medium | STEMCELL Technologies | 5145 | |
| STEMdiff Intestinal Organoid Kit | STEMCELL Technologies | 5140 | |
| Vitrogel Hydrogel Matrix | TheWell Bioscience | VHM01 | |
| VitroGel ORGANOID Discovery Kit | TheWell Bioscience | VHM04-K |
References
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. J Cell Sci. 123, Pt 24 4195-4200 (2010).
- Hinz, B., Gabbiani, G. Fibrosis: Recent advances in myofibroblast biology and new therapeutic perspectives. F1000 Biol Rep. 2, 78(2010).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 15 (12), 1243-1253 (2014).
- Rozario, T., DeSimone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol. 341 (1), 126-140 (2010).
- Even-Ram, S., Artym, V., Yamada, K. M. Matrix control of stem cell fate. Cell. 126 (4), 645-647 (2006).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Tran, O. N., et al. Organ-specific extracellular matrix directs trans-differentiation of mesenchymal stem cells and formation of salivary gland-like organoids in vivo. Stem Cell Res Ther. 13 (1), 306(2022).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., et al. Tissue geometry drives deterministic organoid patterning. Science. 375 (6576), (2022).
- Heo, J. H., Kang, D., Seo, S. J., Jin, Y. Engineering the extracellular matrix for organoid culture. Int J Stem Cells. 15 (1), 60-69 (2022).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15 (10), 647-664 (2014).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Huch, M., et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494 (7436), 247-250 (2013).
- Greenlee, A. R., Kronenwetter-Koepel, T. A., Kaiser, S. J., Liu, K. Comparison of Matrigel and gelatin substrata for feeder-free culture of undifferentiated mouse embryonic stem cells for toxicity testing. Toxicol In Vitro. 19 (3), 389-397 (2005).
- Geltrex LDEV-Free, HESC-Qualified, Reduced Growth Factor Basement Membrane Matrix User Guide (Pub.No. MAN0007336 3.0. Fisher Scientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.cn/TFS-Assets%2FLSG%2Fmanuals%2FGeltrex_LDEV_Free_hESC_qualified_PI.pdf (2024).
- biotechne R&D Systems. Cultrex Stem Cell Qualified Reduced Growth Factor. biotechne R&D Systems. , (2024).
- VitroGel Organoid Protocol. TheWell Bioscience. , Available from: https://www.thewellbio.com/video-protocols (2024).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Henderson, J. K., et al. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 20 (4), 329-337 (2002).
- Haruna, N. F., Huang, J. Investigating the dynamic biophysical properties of a tunable hydrogel for 3D cell culture. J Cytol Tissue Biol. 7, 30(2020).
- Cherne, M. D., et al. A synthetic hydrogel, VitroGel ORGANOID-3, improves immune cell-epithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells. Front Pharmacol. 12, 707891(2021).
- Stewart, D. C., et al. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 13, e0200377(2018).
- Hernandez-Gordillo, V., et al. Fully synthetic matrices for in vitro culture of primary human intestinal enteroids and endometrial organoids. Biomaterials. 254, 120125(2020).
- Broguiere, N., et al. Growth of epithelial organoids in a defined hydrogel. Adv Mater. 30, 1801621(2018).
- Barthes, J., et al. Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: The recent advances. BioMed Res Int. 2014, 921905(2014).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nat Rev Mater. 5 (7), 539-551 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved