Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Сравнительное исследование матриц базальной мембраны для поддержания стволовых клеток человека и генерации кишечных органоидов
В этой статье
Резюме
Органоиды стали ценными инструментами для моделирования заболеваний. Внеклеточный матрикс (ВКМ) управляет судьбой клетки во время генерации органоидов, и использование системы, напоминающей нативную ткань, может повысить точность модели. В этом исследовании сравнивается генерация индуцированных плюрипотентных стволовых клеток, полученных из кишечных органоидов человека, в ВКМ животного происхождения и гидрогелях, не содержащих ксено.
Аннотация
Внеклеточный матрикс (ВКМ) играет решающую роль в поведении и развитии клеток. Органоиды, полученные из индуцированных плюрипотентных стволовых клеток человека (ИПСК), находятся в центре внимания многих областей исследований. Тем не менее, отсутствие физиологических сигналов в материалах классических клеточных культур препятствует эффективной дифференцировке iPSC. Включение коммерчески доступной ЭКМ в культуру стволовых клеток дает физические и химические сигналы, полезные для поддержания клеток. Коммерчески доступные продукты базальной мембраны животного происхождения состоят из белков ВКМ и факторов роста, которые поддерживают поддержание клеток. Поскольку ВКМ обладает тканеспецифичными свойствами, которые могут модулировать судьбу клеток, матрицы, свободные от ксеносов, используются для трансляции в клинические исследования. В то время как коммерчески доступные матрицы широко используются в работе с гиперПСК и органоидами, эквивалентность этих матриц еще не была оценена. Здесь было проведено сравнительное исследование поддержания hiPSC и генерации кишечных органоидов (hIO) человека в четырех различных матрицах: Matrigel (Matrix 1-AB), Geltrex (Matrix 2-AB), Cultrex (Matrix 3-AB) и VitroGel (Matrix 4-XF). Несмотря на то, что колонии не имели идеально круглой формы, спонтанная дифференцировка была минимальной, при этом более 85% клеток экспрессировали маркер стволовых клеток SSEA-4. Матрица 4-XF привела к образованию 3D круглых глыб. Кроме того, увеличение концентрации добавок и факторов роста в средах, используемых для изготовления раствора гидрогеля Matrix 4-XF, улучшило экспрессию SSEA-4 в 1,3 раза. Дифференциация ИПСК, поддерживаемого Matrix 2-AB, привела к меньшему количеству высвобождений сфероидов на средней/задней стадии кишечника по сравнению с другими базальными мембранами животного происхождения. По сравнению с другими, матрица органоидов, свободных от ксеносов (матрица 4-O3), приводит к увеличению размера и повышению зрелости гидрогелей, что позволяет предположить, что физические свойства гидрогелей, не содержащих ксено, могут быть использованы для оптимизации генерации органоидов. В целом, полученные результаты свидетельствуют о том, что вариации в составе различных матриц влияют на стадии дифференцировки IO. Это исследование повышает осведомленность о различиях в коммерчески доступных матрицах и предоставляет руководство по оптимизации матриц во время работы с iPSC и IO.
Введение
Внеклеточный матрикс (ВКМ) является динамичным и многофункциональным компонентом тканей, который играет центральную роль в регулировании поведения и развития клеток. Будучи сложной сетью, она обеспечивает структурную поддержку, клеточные адгезивные лиганды1 и хранение факторов роста и цитокинов, которые регулируют клеточную сигнализацию. Например, во время заживления ран ВКМ служит каркасом для мигрирующих клеток и резервуаром факторов роста, участвующих в восстановлении тканей2. Аналогичным образом, нарушение регуляции в ВКМ может привести к увеличению тяжести различных заболеваний, таких как фиброз и рак 3,4. Во время эмбрионального развития ВКМ руководит морфогенезом тканей. Например, в развитии сердца компоненты ЭКМ играют роль в создании правильной архитектуры и функционирования сердечной ткани5. Более десяти лет исследований показали, что жесткость микроокружениясама по себе может контролировать спецификацию линии стволовых клеток. Поэтому неудивительно, что во время дифференцировки клеток in vitro ВКМ влияет на судьбу стволовых клеток, предоставляя сигналы для дифференцировки.
Органоиды могут быть получены из индуцированных плюрипотентных стволовых клеток (ИПСК). Для успешной генерации органоидов необходимо начать с правильно охарактеризованной линии iPSC. Тем не менее, отсутствие физиологических сигналов в материалах классических клеточных культур препятствует эффективной дифференцировке иПСК и генерации органоидов. Кроме того, недавние исследования подчеркивают важность состава внеклеточного матрикса (ВКМ), взаимодействий между клетками и ВКМ8, а также механических и геометрических сигналов 9,10,11 в контексте органоидной экспансии и дифференцировки12. Развитие технологии органоидов за счет улучшения воспроизводимости будет включать в себя включение физических и химических сигналов, специфичных для тканей.
Органоиды нацелены на повторение нативной ткани в физиологически схожем микроокружении. Выбор системы ВКМ, которая точно имитирует ВКМ нативной ткани, имеет решающее значение для достижения физиологической значимости в отношении поведения, функции и реакции клеток настимулы. Выбор компонентов ВКМ может влиять на дифференцировку стволовых клеток в определенные типы клеток в пределах органоида. Различные белки ECM и их комбинации могут давать сигналы, определяющие судьбу клетки14. Например, исследования показали, что использование специфических компонентов ВКМ может способствовать дифференцировке кишечных стволовых клеток в зрелые типы кишечных клеток, что приводит к образованию физиологически значимых кишечных органоидов. В то время как органоиды являются ценным инструментом при моделировании заболеваний и тестировании лекарств, выбор подходящей системы ECM имеет решающее значение для этого приложения. Подходящая система ЭКМ может повысить точность моделирования заболевания за счет создания микроокружения, напоминающего пораженную ткань16. Кроме того, тканеспецифическая ВКМ может помочь в создании органоидов, которые лучше повторяют фенотипы, связанные с заболеванием, и реакцию на лекарства17. Оптимизация системы ECM, используемой для дифференцировки органоидов, имеет решающее значение для достижения желаемых результатов дифференцировки.
Коммерчески доступные системы базальных мембран, полученные из источников ECM животного происхождения (например, Matrigel, Cultrex) и гидрогеля, не содержащего ксеноса (например, VitroGel), широко используются в исследованиях iPSC и органоидов. Компании, которые коммерциализируют их, и исследователи, которые их используют, на протяжении многих лет излагают множество инструкций для своих конкретных продуктов и приложений. Многие из этих инструкций послужили руководством для создания этого протокола. Кроме того, преимущества и недостатки, связанные с их внутренними свойствами, были индивидуально отмечены многими 18,19,20,21. Тем не менее, не существует систематического рабочего процесса, который бы направлял выбор оптимальных систем для работы с iPSC и органоидами. Здесь предусмотрен рабочий процесс для систематической оценки эквивалентности систем ECM из различных источников для работы iPSC и органоидов. Это сравнительное исследование поддержания двух различных линий iPSC человека (hiPSC) и генерации кишечных органоидов человека (hIO) в четырех различных матрицах: Matrigel (Матрица 1-AB), Geltrex (Матрица 2-AB), Cultrex (Матрица 3-AB) и VitroGel (Матрица 4-XF). Для культивирования органоидов использовали четыре версии бесксено-свободной матрицы VitroGel, которые ранее были оптимизированы для культивирования органоидов: ORGANOID 1 (Матрица 4-O1), ORGANOID 2 (Матрица 4-O2), ORGANOID 3 (Матрица 4-O3), ORGANOID 4 (Матрица 4-O4). Также были использованы матрицы животного происхождения, оптимизированные для органоидов: Matrigel High Concentration (Matrix 1-ABO) и Cultrex Type 2 (Matrix 3-ABO). Использовали коммерчески доступные среды для культивирования стволовых клеток (mTeSR Plus) и набор для дифференцировки органоидов (STEMdiff intestinal organoid kit). Этот протокол сочетает в себе индивидуальные инструкции от производителей продуктов с лабораторным опытом, чтобы направить читателя к успешной оптимизации ECM для их конкретной работы с iPSC и органоидами. В целом, этот протокол и репрезентативные результаты подчеркивают важность выбора оптимального микроокружения для работы стволовых клеток и дифференцировки органоидов.
протокол
1. Обслуживание hiPSC
ВНИМАНИЕ: Все работы выполняются в шкафу биобезопасности (BSC) в соответствии со стандартными асептическими методами. Необходимо соблюдать стандарты безопасности OSHA для лабораторий, включая надлежащее использование средств индивидуальной защиты, таких как лабораторные халаты, перчатки и очки.
- Приготовление матриц, аликвот и клеточных культуральных сред
- Для коммерчески доступных базальных мембран животного происхождения (БМ; Матрица 1-АВ, Матрица 2-АВ, Матрица 3-АВ), подготавливают аликвоты рабочих объемов в соответствии с рекомендацией производителя, обобщенной в таблице 1 , и хранят их при температуре -20 °С или -80 °С для длительного хранения. Не допускайте образования пузырьков. Если образуются пузырьки, перед хранением центрифугируйте образцы при температуре 4 °C, при <200 x g, в течение ~1-2 минут, чтобы пузырь вышел на поверхность.
ПРИМЕЧАНИЕ: Изготовление одноразовых аликвот помогает избежать повторяющихся циклов замораживания-оттаивания, которые нарушают архитектуру ECM. Поскольку концентрация BM варьируется в зависимости от количества партии, обязательно следуйте рекомендациям производителя по приготовлению одноразовых аликвот и растворов для покрытий. Высококонцентрированные БМ вязкие и их трудно пипетировать; используйте холодные наконечники, которые ранее хранились при температуре -20 °C. - Питательную среду для стволовых клеток готовят в соответствии с рекомендациями производителя. Для приготовления специфической коммерчески доступной полной среды, используемой в данном протоколе, добавьте 100 мл 5-кратного коктейля к 400 мл базальной среды. Затем тщательно перемешайте эту среду и распределите по 40 мл объемов, храните при температуре 20 °C. Перед применением разморозьте каждую аликвоту готового носителя, немедленно используйте аликвотированную готовую среду или храните при температуре 2–8 °C до 2 недель. Не замораживайте его повторно.
- Приготовьте аликвоты полной среды стволовых клеток, содержащей в 3 раза большую концентрацию коктейля добавки, для приготовления гидрогеля Matrix 4-XE, т.е. разбавьте добавку в 5 раз до 3 раз.
- Для коммерчески доступных базальных мембран животного происхождения (БМ; Матрица 1-АВ, Матрица 2-АВ, Матрица 3-АВ), подготавливают аликвоты рабочих объемов в соответствии с рекомендацией производителя, обобщенной в таблице 1 , и хранят их при температуре -20 °С или -80 °С для длительного хранения. Не допускайте образования пузырьков. Если образуются пузырьки, перед хранением центрифугируйте образцы при температуре 4 °C, при <200 x g, в течение ~1-2 минут, чтобы пузырь вышел на поверхность.
- Покрытие пластика тканевых культур BM животного происхождения (Матрица 1-3AB)
- Перед началом работы подготовьте следующее: всегда держите матрицы во льду при размораживании и обработке, чтобы предотвратить их загустение. Используйте холодные среды для приготовления разведенных матриц. Подготовьте достаточное количество реплицируемых лунок для каждого условия для анализа клеток до начала и на каждой стадии процесса дифференцировки hiPSC и генерации органоидов hIO.
ПРИМЕЧАНИЕ: Здесь для этого исследования использовались 24-луночные планшеты. В таблице 2 приведены рекомендуемые объемы покрытия для пластин других размеров. - Для каждого типа матрицы приготовьте 25 мл холодного промежутка DMEM/F-12, содержащего 15 мМ HEPES, в конической пробирке объемом 50 мл. Держите их на льду.
- Добавьте размороженные матрицы в соответствующие холодные предварительные DMEM/F-12 и хорошо перемешайте. Держите носитель холодным во время процесса смешивания. Визуально проверьте однородное перемешивание, убедившись, что нет комочков.
- С помощью разбавленных растворов матриц сразу же покройте каждую выбранную для использования лунку (250 μл/лунка при использовании 24-луночных планшетов).
- Аккуратно наклоните посуду для культуры, чтобы раствор для покрытия равномерно распределился по поверхности. Перед использованием инкубировать при комнатной температуре (15 - 25 °C) не менее 1 часа.
ПРИМЕЧАНИЕ: Если пластина не будет использована сразу, ее можно хранить при температуре от 2 до 8 °C до 1 недели после нанесения покрытия, но она должна быть закрыта прозрачной пленкой для предотвращения испарения. При использовании хранящихся тарелок дайте им нагреться до комнатной температуры (15 - 25 °C) в течение 30 минут, прежде чем переходить к следующему этапу. - Аккуратно удалите излишки раствора с помощью серологической пипетки или методом аспирации. Следите за тем, чтобы поверхность с покрытием не была поцарапана.
- Немедленно добавьте теплую полную среду для стволовых клеток (50% от общего объема, необходимого для конкретной лунки, например, 250 мкл/лунка при использовании 24-луночного планшета).
- Перед началом работы подготовьте следующее: всегда держите матрицы во льду при размораживании и обработке, чтобы предотвратить их загустение. Используйте холодные среды для приготовления разведенных матриц. Подготовьте достаточное количество реплицируемых лунок для каждого условия для анализа клеток до начала и на каждой стадии процесса дифференцировки hiPSC и генерации органоидов hIO.
- Покрытие пластика тканевых культур гидрогелем Matrix 4-XE
- Перед началом работы подготовьте следующее: достаньте гидрогель Matrix 4-XE из холодильника и дайте ему нагреться до комнатной температуры (25 °C). Подготовьте достаточное количество реплицируемых лунок для каждого условия для анализа клеток до начала и на каждой стадии процесса дифференцировки hiPSC и генерации органоидов hIO.
ПРИМЕЧАНИЕ: Здесь для этого исследования использовались 24-луночные планшеты. Рекомендуемые объемы покрытия для пластин других размеров см. в таблице 3 . - Приготовьте полную питательную среду для стволовых клеток, содержащую концентрацию фактора роста в 3 раза по сравнению со стандартной формулой для культуры стволовых клеток (среда для стволовых клеток в 3 раза).
- Смешайте гидрогель Matrix 4-XE и среду для 3x стволовых клеток в соотношении 2:1 v/v и аккуратно пипеткой вверх и вниз 5x-10x для тщательного перемешивания.
- Переложите гидрогелевую смесь на лунную тарелку и осторожно наклоните посуду для культуры, чтобы смесь равномерно распределилась по поверхности. Используйте 250 μл/лунку при использовании 24-луночного планшета. Рекомендуемые объемы приведены в таблице 3 .
- Подождите 10-15 минут при комнатной температуре для образования мягкого геля. В процессе формирования гидрогеля не нарушайте работу гидрогеля, наклоняя или встряхивая пластину.
- Перед началом работы подготовьте следующее: достаньте гидрогель Matrix 4-XE из холодильника и дайте ему нагреться до комнатной температуры (25 °C). Подготовьте достаточное количество реплицируемых лунок для каждого условия для анализа клеток до начала и на каждой стадии процесса дифференцировки hiPSC и генерации органоидов hIO.
- Пассирование и посев комков без ферментов hiPSC
- Перед началом работы подготовьте следующее: не менее чем за 1 час до выгрузки обмажьте нужную пластиковую посуду матрицами. Аликвоту достаточно полноценных сред стволовых клеток и подогреть до комнатной температуры (15 - 25 °C). Избегайте многократных циклов нагрева для всей среды.
ПРИМЕЧАНИЕ: Следующие шаги описывают прохождение уже созданной и на >90% конфлюентной культуры ИПСК на 6-луночный планшет и посев их в 24-луночные планшеты для дифференцировки кишечных органоидов. - Промойте клетки 1 мл D-PBS (без Ca++ и Mg++) и аспирируйте. Добавьте 1 мл реагента для отбора плюрипотентных стволовых клеток человека, не содержащего ферментов, тщательно перемешайте для равномерного распределения и аспирируйте в течение 1 минуты. Колонии нужно только подвергать воздействию тонкой пленки жидкости.
- Инкубируйте при 37 °C до тех пор, пока колонии не начнут выглядеть менее уплотненными, что займет ~ 3-8 минут.
ПРИМЕЧАНИЕ: Оптимальное время инкубации может варьироваться в зависимости от используемой клеточной линии. Оптимальное время инкубации должно быть определено при первом прохождении каждой клеточной линии с реагентом селекции плюрипотентных стволовых клеток человека, не содержащим ферментов. - Добавьте 1 мл полной среды для стволовых клеток. Отделите колонии, осторожно постучав сильно по боковой стороне пластины. Обязательно держите тарелку другой рукой.
- С помощью пипетки объемом 1 мл или больше перенесите суспензию клеточных комков в коническую пробирку объемом 15 мл. Оцените размер скоплений с помощью светлопольного микроскопа и убедитесь, что размер скопления клеток составляет 50-200 мкм; Если они больше, аккуратно встряхните коническую трубку, чтобы разбить их.
- Нарисуйте сетку x-y на дне каждой лунки 96-луночной пластины с плоским дном, которая будет использоваться для подсчета комков, и добавьте 50 μL D-PBS в каждую из лунок. Рекомендуется усреднять куртины, отсчитываемые от 3 лунок.
- Обеспечьте равномерное распределение комков клеток, осторожно встряхивая пробирку, а затем перелейте 5 мкл суспензии комков в каждую из лунок 96-луночного планшета с плоским дном.
ПРИМЕЧАНИЕ: Не рекомендуется использовать автоматический счетчик ячеек для подсчета скоплений. Рекомендуется ручной подсчет. - Подсчитайте общее количество комков в каждой лунке диаметром 50 - 200 мкм. Если большинство скоплений клеток имеют диаметр > 200 мкм (см. рисунок 1), повторите шаги 1.4.5 - 1.4.7.
- Рассчитайте объем (в л) суспензии комков, необходимый для посева 6 000 комков, следующим образом:
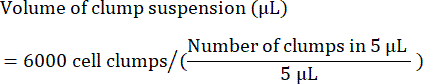
ПРИМЕЧАНИЕ: Оптимальная плотность посева должна быть оптимизирована для каждой клеточной линии. Чтобы определить оптимальную плотность посева, рекомендуется провести первоначальный посев в диапазоне плотностей комков (например, 4 000, 5 000 и 6 000 комков на лунку) и проверить через 24-48 ч после посева, достигнуто ли слияние 85%-90%. - В качестве контроля качества выделяют образец клеток для проточной цитометрии, исследования маркеров стволовых клеток. Список общих маркеров приведен в таблице 4 .
- Разделите необходимый объем суспензии комков iPSC на затравку на лунки, покрытые различными ECM, на отдельные пробирки по 15 мл.
- Центрифугируйте пробирку, содержащую комковатый раствор iPSC, при концентрации 200 x g в течение 5 мин для удаления среды, содержащей реагент отбора плюрипотентных стволовых клеток человека, не содержащий ферментов. В ожидании центрифугирования добавьте в каждую лунку 50% от желаемого объема на лунку, если это еще не было сделано.
- Перед началом работы подготовьте следующее: не менее чем за 1 час до выгрузки обмажьте нужную пластиковую посуду матрицами. Аликвоту достаточно полноценных сред стволовых клеток и подогреть до комнатной температуры (15 - 25 °C). Избегайте многократных циклов нагрева для всей среды.
- Культура iPSC в планшетах, содержащих матрицы животного происхождения
- Аккуратно ресуспендируйте скопления iPSCs в 50% расчетном объеме полной среды стволовых клеток для получения желаемой плотности и поместите смесь клеточных агрегатов на лунки с покрытием, содержащие 50% рассчитанной полной среды стволовых клеток.
ПРИМЕЧАНИЕ: Добавление ингибитора ROCK-1 может быть необходимо для некоторых клеточных линий или когда размер скоплений составляет 50 мкм или меньше. Рекомендуется добавить <10 мкм, чтобы избежать ранней гаструляции. - Осторожно добавьте среду с ячейками поверх матриц, 250 μл/лунку, если используется 24-луночный планшет. Рекомендуемый объем клеточной среды для луночных планшетов другого размера см. в таблице 2.
- Наклоните пластину несколькими короткими движениями вперед-назад и из стороны в сторону, чтобы равномерно распределить комки клеток.
ВНИМАНИЕ: Неравномерное распределение агрегатов приводит к повышенной спонтанной дифференцировке ИПСК человека. Круговое распределение суспензии комков приводит к скоплению комков на границе скважин и снижению плотности в центре. - Инкубируйте планшет при температуре 37 °C и выполняйте смену среды с использованием полной среды стволовых клеток ежедневно или через день. При выполнении смены среды визуально оценивайте культуры, чтобы контролировать рост и определить, требуют ли клетки времени для прохождения или готовы к дифференцировке. Чтобы пропустить два последовательных дня кормления, добавьте в 2 раза больше объема среды, чем необходимо для одного дня.
- Аккуратно ресуспендируйте скопления iPSCs в 50% расчетном объеме полной среды стволовых клеток для получения желаемой плотности и поместите смесь клеточных агрегатов на лунки с покрытием, содержащие 50% рассчитанной полной среды стволовых клеток.
- Культура iPSC в планшетах, содержащих Matrix 4-XE
- Мягко ресуспендируйте иПСК в общий расчетный объем в 3 раза больше полной среды стволовых клеток, чтобы получить желаемую плотность.
- Осторожно добавьте среду с ячейками поверх гидрогеля 250 μл/лунку, если вы используете 24-луночный планшет. Рекомендуемый объем клеточной среды для луночных планшетов другого размера см. в таблице 3.
ВНИМАНИЕ: Гидрогель будет набухать и занимать больший объем, чем свежеприготовленный. Колонии иПСК будут частично внедрены в гидрогель в нижней части пластины, поэтому рекомендуется менять 50-80% верхней среды, не нарушая гидрогель. - Перемещайте пластину несколькими быстрыми, короткими движениями вперед-назад и из стороны в сторону, чтобы равномерно распределить клеточные комки.
- Поместите планшет в инкубатор с температурой 37 °C и влажностью 5%CO2 и 95%. Измените клеточную среду с помощью полной среды для стволовых клеток. Выполняйте смену среды ежедневно или через день; Для последнего добавьте в 2 раза больше объема носителя.
- Визуально осматривайте культуры, чтобы отслеживать их рост по мере того, как они достигают стадии, подходящей для дифференциации.
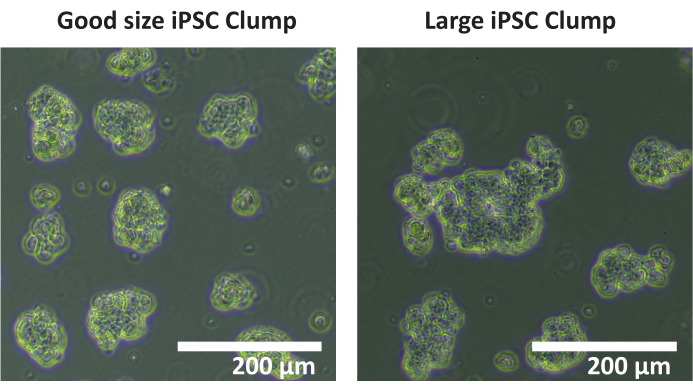
Рисунок 1: Оптимальный размер комка. Изображения скоплений клеточной линии iPSC SCTi003A, показывающие пример оптимального размера скопления. Масштабная линейка = 200 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Дифференцировка ИПСК и генерация кишечных органоидов
ВНИМАНИЕ: Все работы выполняются в шкафу биобезопасности (BSC) в соответствии со стандартными асептическими методами. Необходимо соблюдать стандарты безопасности OSHA для лабораторий, включая надлежащее использование средств индивидуальной защиты, таких как лабораторные халаты, перчатки и очки.
- Перед началом работы подготовьте следующие материалы: подготовьте аликвоты дифференцировочной среды, необходимой для каждой стадии. После размораживания аликвот используйте их сразу. Не замораживайте повторно. В таблице 5 приведено общее руководство по каждому типу и объему среды, необходимой для 24-луночного планшета.
Примечание: Оптимальное время на каждой стадии дифференцировки может варьироваться в зависимости от клеточной линии. Для повышения эффективности дифференцировки рекомендуется проверять экспрессию клеточного маркера каждой стадии. Периодическая оценка экспрессии генов в культурах iPSCS не была включена в данное исследование, поскольку мы использовали партии, сертифицированные поставщиком, на низких проходах, но она рекомендуется в качестве этапа контроля качества для новых/еще не квалифицированных линий iPSC на последующих этапах дифференцировки. - Стадия 1: Дефинитивная энтодерма (ДЭ)
- Чтобы оценить готовность к началу дифференциации, проверьте соответствие следующим критериям.
- С помощью микроскопа оцените слияние колоний стволовых клеток и степень спонтанной дифференцировки в культуре. Не стоит полагаться только на морфологическую оценку. Оптимальное слияние должно составлять от 85% до 90% (выше ~105 клеток/см2), а минимальная наблюдаемая спонтанная дифференцировка должна составлять <5% дифференцировки.
- Соберите клетки из жертвенной лунки для проточной цитометрии, характеризующей маркеры hiPSC, прежде чем приступать к следующему этапу. Для определения характеристик репрезентативной проточной цитометрии была использована стратегия прямого и бокового смещения. Если клетки соответствуют оптимальным критериям, приступают к дифференцировке. Критерием прохождения клеток является экспрессия >85% в идеале 3 маркеров (табл. 4), особенно в случае новых/еще не квалифицированных линий иПСК в лаборатории.
ПРИМЕЧАНИЕ: Культуры iPSC, выращенные на разных матрицах, подвергаются одному и тому же общему процессу, с выращиванием iPSC только на Matrix 4-XE, требуя более щадящей смены среды, чтобы не нарушить полувнедренные клетки. Ожидается значительная гибель клеток во время индукции дефинитивной энтодермы, так как клетки особенно чувствительны на этой стадии. Соблюдайте осторожность при смене среды, стремясь свести к минимуму продолжительность воздействия клеток за пределами инкубационной среды при температуре 37 °C.
- Начните дифференцировку клеточных колоний, как описано ниже.
- День 0: Прогрейте аликвоту среды DE до 37 °C. Чтобы избежать денатурации сред в циклах нагревания-охлаждения, убедитесь, что прогрев требуется только в объеме, необходимом для дня 0 (0,7 мл/лунка).
- Отсасывайте среду из ИПСК Осторожно добавьте 0,7 мл DE Medium на лунку вниз по стенке лунки. Избегайте резкого пипетирования, которое может отсоединить или повредить колонии. Инкубируйте планшет при температуре 37 °C с 5%CO2 и влажностью 95% в течение 24 часов.
- День 1: Нагрейте аликвоту среды ДЭ, содержащую только объем, необходимый для Дня 1 (0,5 мл/лунку) до 37 °С. Отсадите среду ДЭ из клеток и осторожно добавьте 0,5 мл среды ДЭ на лунку вниз по стенке лунки. Инкубировать при 37 °C с 5%CO2 и влажностью 95% в течение 24 часов.
- День 3: Клетки готовы к анализу на окончательное формирование энтодермы. Рекомендуемые маркеры приведены в таблице 4 . Прежде чем приступить к следующему этапу, пожертвуйте лунку для проведения проточной цитометрии, характеризующей специфические маркеры, связанные с ДЭ. Для определения характеристик репрезентативной проточной цитометрии была использована стратегия прямого и бокового смещения. Рекомендуется проверять экспрессию более 1 маркера, особенно в случае новых/еще не квалифицированных линий iPSC в лаборатории.
- Чтобы оценить готовность к началу дифференциации, проверьте соответствие следующим критериям.
- Стадия 2: Средняя кишка / задняя кишка (MH)
- День 3: Прогрейте только необходимый объем среды MH на 3-й день (0,5 мл/лунку) до 15 - 25 °C. Асасируйте среду ДЭ из клеток и замените на 0,5 мл среды MH. Инкубировать при 37 °C с 5%CO2 и влажностью 95% в течение 24 часов.
- Дни 4 - 9: Перед ежедневными изменениями среды используйте микроскоп с 2-кратным или 4-кратным увеличением для оценки образования сфероидов путем проверки видимых 3D-структур (может произойти с 4-го дня); свободно плавающие сфероиды (могут возникать с 5-го дня).
- Как только сфероиды начнут отделяться, используйте пипеттор объемом 1 мл, чтобы аккуратно перенести среду из клеток в стерильную коническую пробирку объемом 15 мл, чтобы оценить количество сфероидов, отделившихся от клеток.
ПРИМЕЧАНИЕ: Избегайте любых поперечных сил, которые могут отделить 3D-конструкции от монослоя; Когда все будет готово, сфероиды отсоединятся самостоятельно. - Если отделяется менее 50 сфероидов, центрифугируйте при 200 x g в течение 5 мин, удаляйте старую среду и повторно суспендируйте сфероиды на 0,5 мл/лунку среды и перекачивайте в соответствующую лунку до тех пор, пока не созреет достаточное количество сфероидов.
ПРИМЕЧАНИЕ: Продолжительность воздействия среды средней и задней кишки играет решающую роль в определении региональной идентичности развивающихся органоидов тонкого кишечника, таких как двенадцатиперстная кишка (более короткая экспозиция) или подвздошная кишка (более длительная экспозиция). Чтобы получить более однородные культуры с одинаковой идентичностью, стремитесь собирать сфероиды, подвергшиеся воздействию среды средней и задней кишки одновременно. - Повторяйте шаг 2.3.3 до тех пор, пока не будет отделено достаточное количество сфероидов для встраивания и начала культивирования органоидов кишечника человека (hIO).
- Прежде чем приступить к следующему этапу, отделите образец сфероидов и выполните проточную цитометрическую характеристику специфических маркеров, связанных со средней кишкой/задней кишкой (МН). Для определения характеристик репрезентативной проточной цитометрии была использована стратегия прямого и бокового смещения. Список часто используемых маркеров приведен в таблице 4 . Рекомендуется проверять экспрессию более 1 маркера, особенно в случае новых/еще не квалифицированных линий iPSC в лаборатории.
- Этап 3: Встраивание сфероида
- Перед началом процедуры подготовьте следующее.
- Разморозьте аликвоты Матрицы 1-НПА и Матрицы 3-НПА на льду. Учитывайте количество собранных сфероидов, чтобы определить общее количество необходимой матрицы, если потребуется 30-40 μл матрицы на купол.
- Приготовьте 25 мл холодного Advance DMEM/F-12, содержащего 15 мМ HEPES. Высококонцентрированные ЭКМ вязкие и их трудно пипетировать. Поместите коробку со стерильными наконечниками для пипеток объемом 100 л при температуре -20 °C для приготовления холодных наконечников, которые могут помочь процессу. Приготовьте аликвоты кишечной органоидной питательной среды (OGM), для которой требуется 4 кормления (0,5 мл/лунка на корм). Подготовка приведена в таблице 5 .
- Разморозьте аликвоту добавки OGM на льду. После размораживания аликвот используйте их сразу. Не замораживайте повторно. Хранить полный OGM при температуре 2-8 °C до 2 недель.
- Приготовьте OGM, содержащий в 3 раза больше добавки по сравнению со стандартной формулой для (3x OGM). Достаньте Matrix 4-XFO1 из холодильника и дайте им нагреться до комнатной температуры (25 °C).
- Для системы животного происхождения выполните описанные ниже действия.
- Поместите в инкубатор стерильную 24-луночную тарелку для культивирования тканей, чтобы она нагрелась до 37 °C во время подготовки сфероидов и матриц. Дайте собранным сфероидам осесть на дно конической пробирки объемом 15 мл. Осторожно аспирируйте и выбросьте надосадочную жидкость.
ПРИМЕЧАНИЕ: Чтобы сделать более точное сравнение влияния матриц, убедитесь, что сфероиды, собранные из ИПСК, дифференцированы на каждой матрице в отдельных пробирках. - Добавьте 1 мл DMEM/F-12 с 15 мМ HEPES к сфероидам. Центрифугируйте при 300 x g в течение 5 минут при комнатной температуре (15 - 25 °C).
- Аккуратно удалите как можно больше надосадочной жидкости. Рекомендуется начинать удаление с пипетки объемом 1 мл и переключаться на пипетки объемом 100 мкл и даже 10 мкл, чтобы удалить как можно больше, не нарушая гранулу сфероидов.
ПРИМЕЧАНИЕ: Чем больше оставшийся объем носителя, тем более разбавленными будут матрицы. Разбавленные матрицы могут привести к проблемам с гелеобразованием или более мягким куполам. Более мягкие купола повышают вероятность обрушения с минимальными нарушениями. - С помощью пипетки с холодным наконечником для дозатора объемом 100 мкл добавьте 40 мкл/50 сфероидов холодной (2–8 °C) матрицы 1-ABO или матрицы 3-ABO в соответствующую пробирку. Аккуратно распределите сфероиды в матрице пипетированием вверх и вниз ~5x. Не опорожняйте наконечник пипетки полностью, так как это может привести к образованию пузырьков.
- Достаньте планшет из инкубатора и с помощью холодного наконечника для пипетки аккуратно перенесите внедренные сфероиды в центр планшета, следуя инструкциям, показанным на рисунке 2. Избегайте слишком быстрого введения Matrix 1-ABO и Matrix 3-ABO в чашку для культивирования, так как это приведет к сплющиванию купола.
- Осторожно перенесите планшет в инкубатор с температурой 37 °C и инкубируйте в течение 30 минут, чтобы обеспечить гелеобразование купола. Будьте особенно осторожны с любой тряской или резким движением во время транспортировки и в инкубаторе.
- Во время инкубации купола для желирования подогрейте до 37 °C достаточный объем кишечного OGM (0,5 мл/лунку) для количества используемых лунок.
ПРИМЕЧАНИЕ: Нагревайте только необходимый объем. Избегайте циклов нагрева-охлаждения. Убедитесь, что носитель теплый, прежде чем добавлять его в купол; Холодные среды могут привести к обрушению купола. - Через 30 минут осторожно добавьте 0,5 мл кишечной ОГМ на стенку лунки, чтобы не нарушить купол. Инкубировать при 37 °C с 5%CO2 и влажностью 95%. Выполняйте полную смену среды каждые 3 - 4 дня, удаляя среду, а затем добавляйте свежую среду.
- Поместите в инкубатор стерильную 24-луночную тарелку для культивирования тканей, чтобы она нагрелась до 37 °C во время подготовки сфероидов и матриц. Дайте собранным сфероидам осесть на дно конической пробирки объемом 15 мл. Осторожно аспирируйте и выбросьте надосадочную жидкость.
- Для органоидных систем Matrix 4-XF выполните описанные действия.
ПРИМЕЧАНИЕ: Система органоидов Matrix 4-XF включает в себя четыре различных варианта (O1-O4); Рецептура каждого типа различается по биофункциональным лигандам, жесткости и разлагаемости. Следовательно, рекомендуется провести первоначальные эксперименты для определения оптимального типа для конкретного приложения. Этот протокол описывает использование четырех вариантов для поиска оптимальной формулы кишечных органоидов, полученных из ИПСХ. Кроме того, несмотря на то, что можно использовать несколько протоколов культивирования (например, 3D-инкапсуляция, купольная инкапсуляция), этот протокол включает использование купольного метода таким образом, что его можно напрямую сравнить с распространенными методами, используемыми при работе с системами базальных мембран животного происхождения.- Добавьте 1 мл/лунку холодного надвижного DMEM/F-12, содержащего 16 мМ HEPES, к сфероидам, полученным на системе Matrix 4-XFO4. Центрифугируйте при 300 x g в течение 5 минут при комнатной температуре (15 - 25 °C).
ПРИМЕЧАНИЕ: Чтобы найти оптимальную формулу для применения, перед центрифугированием обязательно распределите сфероиды по 4 отдельным пробиркам. Сфероиды, полученные на матрицах животного происхождения, также могут быть превращены в кишечные органоиды с помощью этой системы. - С помощью пипеттора объемом 1 мл удалите надосадочную жидкость, не потревожив сфероиды. Добавьте 50 мкл 3x OGM в гранулу сфероидов (~100 сфероидов). Добавьте 100 μL выбранного Matrix 4-XFO в 50 μL сфероидальной суспензии и аккуратно перемешайте 5-10x раз. Поддерживайте Matrix 4-XFO до 3x OGM в соотношении 2:1 об/в, чтобы конечная концентрация была 1x.
- Добавьте 40 мкл гидрогелево-сфероидной смеси в центр 24-луночного тканевого культурального планшета. Осторожно переложите планшеты в инкубатор с температурой 37 °C и инкубируйте в течение 30 минут.
ПРИМЕЧАНИЕ: Matrix 4-XFO не требует инкубации при температуре 37 °C для гелеобразования; тем не менее, рекомендуется подвергать органоиды воздействию аналогичных условий по сравнению с системами Matrix 1-ABO и Matrix 3-ABO, которым требуется 37 °C для лучшего гелеобразования куполов. - Через 30 минут осторожно добавьте 0,5 мл кишечной ОГМ на стенку лунки, чтобы не потревожить купол. Инкубировать при 37 °C с 5%CO2 и влажностью 95%. Выполняйте полную смену среды каждые 3 - 4 дня, удаляя среду и добавляя свежую среду.
- Добавьте 1 мл/лунку холодного надвижного DMEM/F-12, содержащего 16 мМ HEPES, к сфероидам, полученным на системе Matrix 4-XFO4. Центрифугируйте при 300 x g в течение 5 минут при комнатной температуре (15 - 25 °C).
- Перед началом процедуры подготовьте следующее.
- Пассирование и созревание hIO
- Приготовьте те же химические вещества, растворы и реагенты, что и на шаге 2.4.1.
- Добавьте 1-2 мл раствора для промывки, препятствующего прилипанию, в коническую пробирку объемом 15 мл (1 на условие) и взболтайте, чтобы покрыть пробирку.
- Удалите раствор, препятствующий прилипанию, и промойте пробирки 5 мл D-PBS (без Ca++ и Mg++). Закройте все пробирки с покрытием и держите их при комнатной температуре (15 - 25 °C) до тех пор, пока они не понадобятся.
- Отсасывайте среду из куполов. С помощью пипетки объемом 1 мл добавьте 1 мл холодного DMEM/F-12 непосредственно в купол. Цель состоит в том, чтобы отделить купола от плиты.
- Добавьте в лунку еще 1 мл холодного DMEM/F-12 и проводите пипеткой вверх и вниз, чтобы собрать оставшиеся органические вещества. Переложите в покрытые покрытием конические пробирки объемом 15 мл.
ПРИМЕЧАНИЕ: Убедитесь в успешном сборе органоидов путем визуального осмотра лунки под микроскопом. Если наблюдаются какие-либо остаточные органоиды, повторите шаг 2.5.5. - С помощью пипеттора объемом 1 мл выполняйте пипетирование суспензии вверх и вниз для распада органоидов до тех пор, пока не будет получена однородная фрагментная суспензия с желаемым размером органоида (например, 100 - 500 мкм).
ПРИМЕЧАНИЕ: Используйте пипетку объемом 200 μл, чтобы убедиться, что органоиды соответствуют рекомендуемому размеру. Использование пипетки объемом 200 мкл способствует дополнительному фрагментированию по мере необходимости, обеспечивая плавное прохождение фрагментов через наконечник пипетки объемом 200 мкл.
ВНИМАНИЕ: Избегайте разбиения фрагментов на отдельные клетки путем резкого или длительного пипетирования. - Установите желаемую плотность органоидов либо путем подсчета фрагментов, либо с помощью коэффициента расщепления. Отделите аликвоту и выполните подсчет, используя ту же процедуру, что и в шагах 1.4.6-1.4.9 для подсчета комков.
ПРИМЕЧАНИЕ: Оптимальная плотность органоидов должна быть оптимизирована для каждой линии; Как правило, рекомендуется плотность 40 - 80 кишечных органоидов на купол. - Убедитесь, что пробирка помещена на лед во время процесса подсчета органоидов. Примерно через 5 минут фрагменты органоидов осядут на дно пробирки под действием силы тяжести.
ПРИМЕЧАНИЕ: Чем больше объем раствора органоида, тем больше времени потребуется для его оседания на дно. - Аккуратно удалите как можно больше надосадочной жидкости и мутного слоя, образовавшегося поверх органоидов. На ранних стадиях, когда органоиды созревают, эта мутная фаза охватывает матрицу и отдельные клетки.
- Добавьте 2 мл холодного DMEM/F-12 путем пипетирования непосредственно на гранулу. Центрифуга при 200 x g в течение 5 мин при комнатной температуре (15 - 25 °C).
- В случае системы животного происхождения необходимо тщательно удалить и утилизировать надосадочную жидкость, выполнив те же действия, которые описаны в шагах 2.4.2.4-2.4.2.9.
- В случае системы Matrix 4-XFO осторожно удалите надосадочную жидкость, выполнив те же действия, что и шаги 2.4.3.2-2.4.3.4.
ПРИМЕЧАНИЕ: При работе с системой Matrix 4-XFO рекомендуется использовать раствор для восстановления гидрогелевых органоидов без ксеноса для оптимального удаления остатков гидрогеля. Это решение для восстановления особенно рекомендуется при переходе с гидрогелевых систем животного происхождения на безксеногенные для обеспечения удаления любого ксеногенного материала.
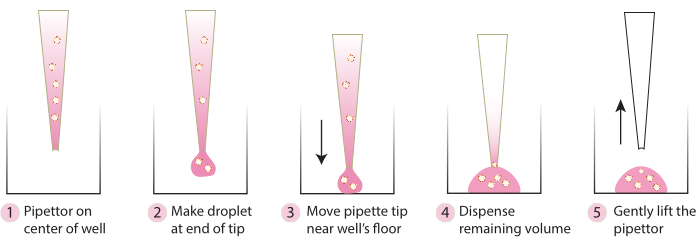
Рисунок 2. Схема методики, рекомендуемой для формирования купола. На схеме описан пошаговый процесс, рекомендуемый для успешного формирования купола для всех систем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Характеристика размеров ввода-вывода
ПРИМЕЧАНИЕ: Размер органоидов был охарактеризован светлыми изображениями, полученными с 4-кратным и 10-кратным увеличением. Анализ обработки изображений был автоматизирован с помощью MATLAB. Общие этапы процесса описаны ниже, а пример кода включен в Дополнительный файл 1.
- Определите каталог, содержащий изображения, и перечислите все файлы изображений в каталоге. Инициализируйте таблицу для сохранения результатов. Чтение изображений светлого поля в файле.
- Определите преобразование пикселей в μm и установите масштаб. Если изображение не содержит масштабной линейки, запросите у пользователя коэффициент преобразования пикселей в мкм.
- Преобразуйте изображение в оттенки серого. Примените фильтр Гаусса для уменьшения шума на изображении. Установите порог для отфильтрованного изображения, чтобы отделить органоиды от фона.
- Заполните небольшие отверстия и удалите мелкие объекты, чтобы очистить двоичное изображение. Выполняйте анализ связных компонентов для идентификации отдельных органоидов и расчета их свойств, таких как площадь, центроид, длина большой оси и длина малой оси.
- Рассчитайте размер органоида на основе длины большой и малой оси. Отобразите сегментированные органоиды на исходном изображении и пометьте их размером. Распечатайте размеры органоидов и сохраните результаты в файле .cvs.
ПРИМЕЧАНИЕ: Первая пара изображений была проанализирована вручную для определения оптимальных параметров стандартного отклонения фильтра Гаусса и площади до порогового значения. Код в дополнительном файле 1 представляет собой пример базовой структуры для анализа размеров органоидов по изображениям в светлом поле; Тем не менее, требуется дальнейшая доработка, чтобы соответствовать конкретным требованиям для каждого типа изображения и качества. Тот же процесс можно проделать с помощью программного обеспечения с открытым исходным кодом, такого как FIJI от Image J. - Выполните следующие действия, чтобы использовать программное обеспечение FIJI.
- Определите преобразование пикселей в μm и установите масштаб. Если изображение не содержит масштабной линейки, запросите у пользователя коэффициент преобразования пикселей в μm, нажав «Анализ» > «Установить масштаб».
- Преобразуйте изображение в оттенки серого, нажав кнопку Изображение > Тип > 8 бит. Примените фильтр Гаусса для уменьшения шума на изображении, щелкнув Обработка > Фильтр > Гауссова размытость > Сигма (радиус) используется: 2.
- Установите пороговое значение для отфильтрованного изображения, чтобы отделить органоиды от фона, щелкнув Изображение > Порог > MaxEntropy > Применить.
- Заполните небольшие отверстия и удалите мелкие объекты, чтобы очистить двоичное изображение, нажав «Обработать > шума» > «Удалить выбросы» > 20 пикселей.
- Выполните анализ соединенных компонентов для идентификации отдельных органоидов и вычисления их свойств, таких как площадь, центроид, длина большой оси и длина малой оси, щелкнув «Анализ» > «Задать измерение» > «Убедиться, что площадь, периметр и диаметр включены > «Анализ» > «Анализ частиц» > «Показать контуры».
- Статистический анализ
- Оцените нормальное распределение данных с помощью теста Сафиро-Уилка с использованием программного обеспечения JMP (SAS). Чтобы изучить статистические различия между группами, выполните двусторонний ANOVA и проведите апостериорное тестирование с использованием непараметрического метода Вилкоксона в программном обеспечении JMP(SAS). Значимость установлена на уровне альфа p ≤ 0,05.
Результаты
Следуя этому протоколу, коммерчески доступные базальные мембраны и гидрогелевая система, не содержащая ксено, были успешно использованы для культивирования клеток hiPSC и их дифференцировки в hIO. Основной целью этих экспериментов была систематическая оценка эквивалентности матриц из р?...
Обсуждение
Выбор оптимальной микросреды для работы со стволовыми клетками и органоидами является ключевым ранним шагом при использовании этих платформ для широкого спектра применений. Наши репрезентативные результаты показывают, что матрица 4-XFO3 в сочетании с более высокой концентрацией факто?...
Раскрытие информации
Доктор Джон Хуанг является основателем и генеральным директором компании TheWell Bioscience.
Благодарности
Авторы признают предыдущее обучение и общие рекомендации относительно начала работы с hiPSC и органоидами от докторов Кристины Пакак, Сильвели Сусуки-Хатано и Рассела Д'Соузы. Они благодарят доктора Челси Симмонс за ее руководство по использованию гидрогелевых систем для работы с клеточными культурами in vitro . Кроме того, авторы хотели бы поблагодарить докторов Кристин Родригес и Томаса Эллисона из STEMCELL Technologies за их рекомендации по культивированию ИПСК Авторы также благодарят компанию TheWell Bioscience за покрытие расходов на публикацию.
Материалы
| Name | Company | Catalog Number | Comments |
| 24-Well Plate (Culture treated, sterile) | Falcon | 353504 | |
| 37 °C water bath | VWR | ||
| 96-well plate | Fisher Scientific | FB012931 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| Anti-adherence Rinsing Solutio | STEMCELL Technologies | 7010 | |
| Biological safety cabinet (BSC) | Labconco | Logic | |
| Brightfield Microscope | Echo Rebel | REB-01-E2 | |
| BXS0116 | ATCC | ACS-1030 | |
| Centrifuge with temperature control (4 °C capabilities) | ThermoScientific | 75002441 | |
| Conical tubes, 15 mL, sterile | Thermo Fisher Scientific | 339650 | |
| Conical tubes, 50 mL, sterile | Thermo Fisher Scientific | 339652 | |
| Cultrex RGF BME, Type 2 | Bio-techne | 3533-005-02 | |
| Cultrex Stem Cell Qualified RGF BME | Bio-techne | 3434-010-02 | |
| D-PBS (Without Ca++ and Mg++) | Thermo Fisher Scientific | 14190144 | |
| GeltrexLDEV-Free, hESC-Qualified Reduce Growth Factor | Gibco | A14133-02 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Guava Muse Cell Analyzer or another flow cytometry equipment (optional) | Luminex | 0500-3115 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Heralcell Vios Cell culture incubator (37 °C, 5% CO2) | Thermo Scientific | 51033775 | |
| JMP Software | SAS Institute | JMP 16 | |
| MATLAB | MathWorks, Inc | R2022b | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix LDEV free | Corning | 356231 | |
| Matrigel Matrix High Concentration (HC), Growth Factor Reduced (GFR) LDEV-free | Corning | 354263 | |
| mTeSR Plus Medium | STEMCELL Technologies | 100-0276 | |
| Nunclon Delta surface treated 24-well plate | Thermo Scientific | 144530 | |
| PE Mouse Anti-human CD326 (EpCAM) | BD Pharmingen | 566841 | |
| PE Mouse Anti-human CDX2 | BD Pharmingen | 563428 | |
| PE Mouse Anti-human FOXA2 | BD Pharmingen | 561589 | |
| PerCP-Cy 5.5 Mouse Anti-human SSEA4 | BD Pharmingen | 561565 | |
| ReLeSR | STEMCELL | 5872 | |
| SCTi003-A | STEMCELL Technologies | 200-0510 | |
| Serological pipettes (10 mL) | Fisher Scientific | 13-678-11E | |
| Serological pipettes (5 mL) | Fisher Scientific | 13-678-11D | |
| STEMdiff Intestinal Organoid Growth Medium | STEMCELL Technologies | 5145 | |
| STEMdiff Intestinal Organoid Kit | STEMCELL Technologies | 5140 | |
| Vitrogel Hydrogel Matrix | TheWell Bioscience | VHM01 | |
| VitroGel ORGANOID Discovery Kit | TheWell Bioscience | VHM04-K |
Ссылки
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. J Cell Sci. 123, 4195-4200 (2010).
- Hinz, B., Gabbiani, G. Fibrosis: Recent advances in myofibroblast biology and new therapeutic perspectives. F1000 Biol Rep. 2, 78 (2010).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 15 (12), 1243-1253 (2014).
- Rozario, T., DeSimone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol. 341 (1), 126-140 (2010).
- Even-Ram, S., Artym, V., Yamada, K. M. Matrix control of stem cell fate. Cell. 126 (4), 645-647 (2006).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Tran, O. N., et al. Organ-specific extracellular matrix directs trans-differentiation of mesenchymal stem cells and formation of salivary gland-like organoids in vivo. Stem Cell Res Ther. 13 (1), 306 (2022).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., et al. Tissue geometry drives deterministic organoid patterning. Science. 375 (6576), (2022).
- Heo, J. H., Kang, D., Seo, S. J., Jin, Y. Engineering the extracellular matrix for organoid culture. Int J Stem Cells. 15 (1), 60-69 (2022).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15 (10), 647-664 (2014).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125 (2014).
- Huch, M., et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494 (7436), 247-250 (2013).
- Greenlee, A. R., Kronenwetter-Koepel, T. A., Kaiser, S. J., Liu, K. Comparison of Matrigel and gelatin substrata for feeder-free culture of undifferentiated mouse embryonic stem cells for toxicity testing. Toxicol In Vitro. 19 (3), 389-397 (2005).
- Geltrex LDEV-Free, HESC-Qualified, Reduced Growth Factor Basement Membrane Matrix User Guide (Pub.No. MAN0007336 3.0. Fisher Scientific Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.cn/TFS-Assets%2FLSG%2Fmanuals%2FGeltrex_LDEV_Free_hESC_qualified_PI.pdf (2024)
- biotechne R&D Systems. Cultrex Stem Cell Qualified Reduced Growth Factor. biotechne R&D Systems. , (2024).
- VitroGel Organoid Protocol. TheWell Bioscience Available from: https://www.thewellbio.com/video-protocols (2024)
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Henderson, J. K., et al. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 20 (4), 329-337 (2002).
- Haruna, N. F., Huang, J. Investigating the dynamic biophysical properties of a tunable hydrogel for 3D cell culture. J Cytol Tissue Biol. 7, 30 (2020).
- Cherne, M. D., et al. A synthetic hydrogel, VitroGel ORGANOID-3, improves immune cell-epithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells. Front Pharmacol. 12, 707891 (2021).
- Stewart, D. C., et al. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 13, e0200377 (2018).
- Hernandez-Gordillo, V., et al. Fully synthetic matrices for in vitro culture of primary human intestinal enteroids and endometrial organoids. Biomaterials. 254, 120125 (2020).
- Broguiere, N., et al. Growth of epithelial organoids in a defined hydrogel. Adv Mater. 30, 1801621 (2018).
- Barthes, J., et al. Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: The recent advances. BioMed Res Int. 2014, 921905 (2014).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nat Rev Mater. 5 (7), 539-551 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены