Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estudio comparativo de matrices de membrana basal para el mantenimiento de células madre humanas y la generación de organoides intestinales
En este artículo
Resumen
Los organoides se han convertido en herramientas valiosas para el modelado de enfermedades. La matriz extracelular (ECM) guía el destino de las células durante la generación de organoides, y el uso de un sistema que se asemeje al tejido nativo puede mejorar la precisión del modelo. Este estudio compara la generación de organoides intestinales humanos derivados de células madre pluripotentes inducidas en ECM de origen animal e hidrogeles libres de xeno.
Resumen
La matriz extracelular (MEC) desempeña un papel fundamental en el comportamiento y el desarrollo celular. Los organoides generados a partir de células madre pluripotentes inducidas humanas (hiPSC) están en el punto de mira de muchas áreas de investigación. Sin embargo, la falta de señales fisiológicas en los materiales de cultivo celular clásicos dificulta la diferenciación eficiente de iPSC. La incorporación de ECM disponible comercialmente en el cultivo de células madre proporciona señales físicas y químicas beneficiosas para el mantenimiento celular. Los productos de membrana basal de origen animal disponibles en el mercado están compuestos por proteínas ECM y factores de crecimiento que apoyan el mantenimiento celular. Dado que la MEC tiene propiedades específicas de los tejidos que pueden modular el destino de las células, se utilizan matrices libres de xeno para transmitir la traducción a los estudios clínicos. Si bien las matrices disponibles comercialmente se utilizan ampliamente en el trabajo de hiPSC y organoides, aún no se ha evaluado la equivalencia de estas matrices. En este trabajo se realizó un estudio comparativo del mantenimiento de hiPSC y la generación de organoides intestinales humanos (hIO) en cuatro matrices diferentes: Matrigel (Matriz 1-AB), Geltrex (Matriz 2-AB), Cultrex (Matriz 3-AB) y VitroGel (Matriz 4-XF). Aunque las colonias carecían de una forma perfectamente redonda, hubo una diferenciación espontánea mínima, con más del 85% de las células expresando el marcador de células madre SSEA-4. Matrix 4-XF condujo a la formación de grupos redondos en 3D. Además, el aumento de la concentración de suplementos y factores de crecimiento en los medios utilizados para fabricar la solución de hidrogel Matrix 4-XF mejoró la expresión de hiPSC de SSEA-4 en 1,3 veces. La diferenciación de la hiPSC mantenida por Matrix 2-AB condujo a menos liberaciones de esferoides durante la etapa del intestino medio/posterior en comparación con las otras membranas basales derivadas de animales. En comparación con otros, la matriz de organoides libres de xeno (Matriz 4-O3) conduce a hIO más grande y maduro, lo que sugiere que las propiedades físicas de los hidrogeles libres de xeno se pueden aprovechar para optimizar la generación de organoides. En conjunto, los resultados sugieren que las variaciones en la composición de diferentes matrices afectan a las etapas de diferenciación de la IO. Este estudio crea conciencia sobre las diferencias en las matrices disponibles comercialmente y proporciona una guía para la optimización de matrices durante el trabajo de iPSC e IO.
Introducción
La matriz extracelular (MEC) es un componente dinámico y multifuncional de los tejidos que desempeña un papel central en la regulación del comportamiento y el desarrollo celular. Como una red compleja, proporciona soporte estructural, ligandos adhesivos celulares1 y almacenamiento de factores de crecimiento y citocinas que regulan la señalización celular. Por ejemplo, durante la cicatrización de heridas, la MEC sirve como andamio para las células migratorias y como reservorio de factores de crecimiento implicados enla reparación de los tejidos. Del mismo modo, la desregulación en la MEC puede conducir a un aumento de la gravedad de diversas enfermedades como la fibrosis y el cáncer 3,4. Durante el desarrollo embrionario, la MEC guía la morfogénesis de los tejidos. Por ejemplo, en el desarrollo del corazón, los componentes de la MEC desempeñan un papel en la creación de la arquitectura y la función correctas del tejido cardíaco5. Más de una década de investigación ha demostrado que la rigidez del microambiente por sí sola 6,7 puede controlar la especificación del linaje de células madre. Por lo tanto, no es sorprendente que durante la diferenciación celular in vitro, la MEC influya en el destino de las células madre al proporcionar señales para la diferenciación.
Los organoides se pueden generar a partir de células madre pluripotentes inducidas (iPSC). Es necesario comenzar con una línea de iPSC debidamente caracterizada para generar organoides con éxito. Sin embargo, la falta de señales fisiológicas en los materiales de cultivo celular clásicos dificulta la diferenciación eficiente de iPSC y la generación de organoides. Además, investigaciones recientes han enfatizado la importancia de la composición de la matriz extracelular (MEC), las interacciones entre las células y la MEC8, así como las señales mecánicas y geométricas 9,10,11 en el contexto de la expansión y diferenciación de organoides12. El avance de la tecnología de organoides mediante la mejora de la reproducibilidad implicará la incorporación de señales físicas y químicas específicas de los tejidos.
Los organoides tienen como objetivo recapitular el tejido nativo dentro de un microambiente fisiológicamente similar. La elección de un sistema de MEC que imite de cerca la MEC del tejido nativo es crucial para lograr la relevancia fisiológica con respecto al comportamiento, la función y la respuesta de las células a los estímulos13. La elección de los componentes de la MEC puede influir en la diferenciación de las células madre en tipos celulares específicos dentro del organoide. Diferentes proteínas de la MEC y sus combinaciones pueden proporcionar pistas que guíanel destino de las células. Por ejemplo, los estudios han demostrado que el uso de componentes específicos de la MEC puede promover la diferenciación de las células madre intestinales en tipos de células intestinales maduras, lo que da como resultado organoides intestinales fisiológicamente relevantes15. Si bien los organoides son una herramienta valiosa durante el modelado de enfermedades y las pruebas de fármacos, la selección de un sistema ECM adecuado es fundamental para esta aplicación. Un sistema de ECM adecuado puede mejorar la precisión del modelado de la enfermedad mediante la creación de un microambiente que se asemeja al tejido afectado16. Además, la MEC específica de tejido puede ayudar a generar organoides que recapitulan mejor los fenotipos asociados a la enfermedad y las respuestas a los fármacos17. La optimización del sistema ECM utilizado en la diferenciación de organoides es fundamental para lograr los resultados de diferenciación deseados.
Los sistemas de membranas basales disponibles en el mercado derivados de fuentes animales de ECM (por ejemplo, Matrigel, Cultrex) y el hidrogel libre de xeno (por ejemplo, VitroGel) se utilizan ampliamente en la investigación de iPSC y organoides. Las empresas que los comercializan y los investigadores que los utilizan han establecido muchas instrucciones para sus productos y aplicaciones específicas a lo largo de los años. Muchas de estas instrucciones sirvieron de guía para la generación de este protocolo. Además, los beneficios y contratiempos asociados con sus propiedades intrínsecas han sido señalados individualmente por muchos 18,19,20,21. Sin embargo, no existe un flujo de trabajo sistemático que guíe la selección de sistemas óptimos para el trabajo con iPSC y organoides. Aquí, se proporciona un flujo de trabajo para evaluar sistemáticamente la equivalencia de los sistemas ECM de varias fuentes para el trabajo con iPSC y organoides. Se trata de un estudio comparativo del mantenimiento de dos líneas diferentes de iPSC humanas (hiPSC) y de la generación de organoides intestinales humanos (hIO) en cuatro matrices diferentes: Matrigel (Matriz 1-AB), Geltrex (Matriz 2-AB), Cultrex (Matriz 3-AB) y VitroGel (Matriz 4-XF). Para el cultivo de organoides, se utilizaron cuatro versiones de la matriz libre de xeno VitroGel que previamente estaban optimizadas para el cultivo de organoides: ORGANOIDE 1 (Matriz 4-O1), ORGANOIDE 2 (Matriz 4-O2), ORGANOIDE 3 (Matriz 4-O3), ORGANOIDE 4 (Matriz 4-O4). Además, se utilizaron matrices de origen animal optimizadas para organoides: Matrigel Alta Concentración (Matriz 1-ABO) y Cultrex Tipo 2 (Matriz 3-ABO). Se utilizaron medios de cultivo de células madre disponibles en el mercado (mTeSR Plus) y un kit de diferenciación de organoides (kit de organoides intestinales STEMdiff). Este protocolo combina las instrucciones individuales de los fabricantes de los productos con las experiencias de laboratorio para guiar al lector hacia una optimización exitosa de ECM para su trabajo específico de iPSC y organoides. En conjunto, este protocolo y los resultados representativos enfatizan la importancia de seleccionar el microambiente óptimo para el trabajo con células madre y la diferenciación de organoides.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Mantenimiento de hiPSC
PRECAUCIÓN: Todos los trabajos se realizan en una cabina de bioseguridad (BSC) siguiendo las técnicas asépticas estándar. Debe seguir las normas de seguridad de OSHA para laboratorios, incluido el uso adecuado de equipo de protección personal como batas de laboratorio, guantes y gafas.
- Preparación de matrices, alícuotas y medios de cultivo celular
- En el caso de las membranas basales de origen animal disponibles en el mercado; Matriz 1-AB, Matriz 2-AB, Matriz 3-AB), prepare alícuotas de los volúmenes de trabajo siguiendo la recomendación del fabricante resumida en la Tabla 1 y almacene a -20 °C o -80 °C para su almacenamiento a largo plazo. Evita la formación de burbujas. Si se forman algunas burbujas, antes de almacenar, centrifugar las muestras a 4 °C, a <200 x g, durante ~ 1-2 minutos para forzar que la burbuja salga a la superficie.
NOTA: La fabricación de alícuotas de un solo uso ayuda a evitar repetidos ciclos de congelación y descongelación que interrumpen la arquitectura de ECM. Debido a que la concentración de BM varía con el número de lote, asegúrese de seguir la recomendación del fabricante de preparar alícuotas de un solo uso y hacer soluciones de recubrimiento. Los BM altamente concentrados son viscosos y difíciles de pipetear; utilice puntas frías previamente almacenadas a -20 °C. - Prepare el medio de cultivo de células madre siguiendo las recomendaciones del fabricante. Para preparar el medio completo específico disponible en el mercado utilizado en este protocolo, agregue 100 mL de cóctel de suplemento 5x a 400 mL de medio basal. A continuación, mezcle bien este medio y la alícuota en volúmenes de 40 ml, almacenados a 20 °C. Para su uso, descongele cada alícuota de medio completo, use el medio completo alícuota inmediatamente o almacene a 2 - 8 °C durante un máximo de 2 semanas. No lo vuelvas a congelar.
- Prepare alícuotas del medio completo de células madre que contenga 3 veces la concentración del cóctel de suplementos para preparar el hidrogel Matrix 4-XE, es decir, diluya 5 veces el suplemento a 3 veces.
- En el caso de las membranas basales de origen animal disponibles en el mercado; Matriz 1-AB, Matriz 2-AB, Matriz 3-AB), prepare alícuotas de los volúmenes de trabajo siguiendo la recomendación del fabricante resumida en la Tabla 1 y almacene a -20 °C o -80 °C para su almacenamiento a largo plazo. Evita la formación de burbujas. Si se forman algunas burbujas, antes de almacenar, centrifugar las muestras a 4 °C, a <200 x g, durante ~ 1-2 minutos para forzar que la burbuja salga a la superficie.
- Recubrimiento de plástico de cultivo de tejidos con BM de origen animal (Matrix 1-3AB)
- Prepare lo siguiente antes de comenzar: mantenga siempre las matrices en hielo al descongelarlas y manipularlas para evitar que se gelifiquen. Utilice medios fríos para preparar las matrices diluidas. Prepare suficientes pocillos replicados por condición para analizar las células antes de comenzar y en cada etapa del proceso de diferenciación de hiPSC y la generación de organoides hIO.
NOTA: Aquí, se utilizaron placas de 24 pocillos para este estudio. Consulte la Tabla 2 para conocer los volúmenes de recubrimiento recomendados para otros tamaños de placa. - Para cada tipo de matriz, prepare 25 mL de avance frío DMEM/F-12 que contenga 15 mM HEPES en un tubo cónico de 50 mL. Manténgalos en hielo.
- Añadir las matrices descongeladas a sus respectivos avance en frío DMEM/F-12 y mezclar bien. Mantenga el medio frío durante el proceso de mezcla. Compruebe visualmente si la mezcla es homogénea asegurándose de que no haya grumos.
- Utilice inmediatamente las soluciones de matrices diluidas para recubrir cada pocillo seleccionado para su uso (250 μL/ pocillo si se utilizan placas de 24 pocillos).
- Incline suavemente la vajilla de cultivo para distribuir la solución de recubrimiento de manera uniforme por la superficie. Incubar a temperatura ambiente (15 - 25 °C) durante al menos 1 h antes de usar.
NOTA: Si no se usa inmediatamente, la placa se puede almacenar a 2 - 8 °C hasta 1 semana después del recubrimiento, pero debe sellarse con una película transparente para evitar la evaporación. Cuando utilice placas almacenadas, deje que alcancen la temperatura ambiente (15 - 25 °C) durante 30 minutos antes de continuar con el siguiente paso. - Retire suavemente el exceso de solución con una pipeta serológica o por aspiración. Asegúrese de que la superficie recubierta no esté rayada.
- Agregue medio tibio de células madre completas inmediatamente (50% del volumen total necesario para un pocillo específico, por ejemplo, 250 μL/pocillo si se usa una placa de 24 pocillos).
- Prepare lo siguiente antes de comenzar: mantenga siempre las matrices en hielo al descongelarlas y manipularlas para evitar que se gelifiquen. Utilice medios fríos para preparar las matrices diluidas. Prepare suficientes pocillos replicados por condición para analizar las células antes de comenzar y en cada etapa del proceso de diferenciación de hiPSC y la generación de organoides hIO.
- Recubrimiento de plástico de cultivo de tejidos con hidrogel Matrix 4-XE
- Prepare lo siguiente antes de comenzar: saque el hidrogel Matrix 4-XE del refrigerador y déjelo calentar a temperatura ambiente (25 °C). Prepare suficientes pocillos replicados por condición para analizar las células antes de comenzar y en cada etapa del proceso de diferenciación de hiPSC y la generación de organoides hIO.
NOTA: Aquí, se utilizaron placas de 24 pocillos para este estudio. Consulte la Tabla 3 para conocer los volúmenes de recubrimiento recomendados para otros tamaños de placa. - Prepare un medio completo de cultivo de células madre que contenga una concentración de factor de crecimiento 3x en comparación con la formulación estándar para el cultivo de células madre (medio de células madre 3x).
- Mezcle el hidrogel Matrix 4-XE y el medio de células madre 3x en una proporción de mezcla de 2:1 v/v y pipetee suavemente hacia arriba y hacia abajo 5x-10x para mezclar bien.
- Transfiera la mezcla de hidrogel a una placa de pocillo e incline con cuidado la vajilla de cultivo para esparcir la mezcla de manera uniforme por la superficie. Use 250 μL/pocillo si usa una placa de 24 pocillos. Consulte la Tabla 3 para conocer los volúmenes recomendados.
- Espere de 10 a 15 minutos a temperatura ambiente para que se forme una cápsula blanda. Durante el proceso de formación de hidrogel, no interrumpa el hidrogel inclinando o agitando la placa.
- Prepare lo siguiente antes de comenzar: saque el hidrogel Matrix 4-XE del refrigerador y déjelo calentar a temperatura ambiente (25 °C). Prepare suficientes pocillos replicados por condición para analizar las células antes de comenzar y en cada etapa del proceso de diferenciación de hiPSC y la generación de organoides hIO.
- Paso y siembra de matas sin enzimas hiPSC
- Prepare lo siguiente antes de comenzar: al menos 1 h antes de pasar, cubra los utensilios de plástico deseados con matrices. Alícuota suficiente medio completo de células madre y calentar a temperatura ambiente (15 - 25 °C). Evite varios ciclos de calentamiento para todo el medio.
NOTA: Los pasos a continuación describen el paso de un cultivo ya establecido y confluente del >90% de iPSC en una placa de 6 pocillos y su siembra en placas de 24 pocillos para la diferenciación de organoides intestinales. - Enjuague las células con 1 mL de D-PBS (sin Ca++ y Mg++) y aspire. Agregue 1 ml de reactivo de selección de células madre pluripotentes humanas sin enzimas, agite con cuidado para que se extienda uniformemente y aspire dentro de 1 minuto. Las colonias solo necesitan ser expuestas a una película delgada de líquido.
- Incubar a 37 °C hasta que las colonias comiencen a verse menos compactas, lo que tomará ~ 3-8 min.
NOTA: El tiempo óptimo de incubación puede variar en función de la línea celular utilizada. El tiempo óptimo de incubación debe determinarse al pasar cada línea celular con el reactivo de selección de células madre pluripotentes humanas libres de enzimas por primera vez. - Agregue 1 mL de medio completo de células madre. Separe las colonias golpeando con cuidado firmemente el costado del plato. Asegúrate de sostener el plato con la otra mano.
- Con una pipeta de 1 mL o más grande, transfiera la suspensión de los grumos celulares a un tubo cónico de 15 mL. Evalúe el tamaño de los grupos utilizando un microscopio de campo claro y asegúrese de que el tamaño del grupo de células esté entre 50 y 200 μm; Si son más grandes, agite suavemente el tubo cónico para descomponerlos.
- Dibuje una cuadrícula x-y en el fondo de cada pocillo de una placa de fondo plano de 96 pocillos que se utilizará para el conteo de grupos y agregue 50 μL de D-PBS a cada uno de los pocillos. Se recomienda promediar los grupos contados desde 3 pozos.
- Asegúrese de que los grupos de células se distribuyan uniformemente agitando suavemente el tubo y luego transfiera 5 μL de suspensión de grupo a cada uno de los pocillos de la placa de fondo plano de 96 pocillos.
NOTA: No se recomienda utilizar un contador automático de celdas para contar grupos. Se recomienda un conteo manual. - Cuente el número total de grupos en cada pocillo que tienen entre 50 y 200 μm de diámetro. Si la mayoría de los grupos de células tienen > de 200 μm de diámetro (véase la figura 1), repita los pasos 1.4.5 a 1.4.7.
- Calcule el volumen (en μL) de suspensión de grupo necesario para sembrar 6.000 grumos de la siguiente manera:
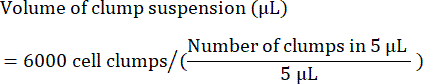
NOTA: La densidad óptima de siembra debe optimizarse con cada línea celular. Para determinar la densidad óptima de siembra, se recomienda realizar una siembra inicial en un rango de densidades de grupo (por ejemplo, 4,000, 5,000 y 6,000 grupos por pozo) y verificar 24-48 h después de la siembra si se alcanza una confluencia del 85%-90%. - Como control de calidad, separar una muestra de células para el examen de citometría de flujo de marcadores de células madre. Consulte la Tabla 4 para obtener una lista de marcadores comunes.
- Separe el volumen requerido de suspensión de grupo de iPSC para sembrar en los pocillos recubiertos con diferentes ECM en tubos separados de 15 mL.
- Centrifugar el tubo que contiene la solución de grupo iPSC a 200 x g durante 5 min para eliminar el medio que contiene reactivo de selección de células madre pluripotentes humanas libres de enzimas. Mientras espera la centrifugación, agregue el 50% del volumen deseado por pocillo a cada pocillo si aún no se ha hecho.
- Prepare lo siguiente antes de comenzar: al menos 1 h antes de pasar, cubra los utensilios de plástico deseados con matrices. Alícuota suficiente medio completo de células madre y calentar a temperatura ambiente (15 - 25 °C). Evite varios ciclos de calentamiento para todo el medio.
- Cultivo de iPSC en placas que contienen matrices de origen animal
- Vuelva a suspender suavemente los grupos de iPSC en el 50% del volumen calculado de medios de células madre completos para obtener la densidad deseada y coloque la mezcla de agregados celulares en pocillos recubiertos que contengan el 50% de los medios de células madre completos calculados.
NOTA: La adición de un inhibidor de ROCK-1 puede ser necesaria para algunas líneas celulares o cuando los grupos son de 50 μm o menos. Se recomienda añadir <10 μm para evitar la gastrulación precoz. - Agregue con cuidado el medio con celdas en la parte superior de las matrices, 250 μL / pocillo si usa una placa de 24 pocillos. Para conocer el volumen recomendado de medio celular para placas de pocillos de otros tamaños, consulte la Tabla 2.
- Incline la placa en varios movimientos cortos hacia adelante y hacia atrás y de lado a lado para distribuir los grupos de celdas de manera uniforme.
PRECAUCIÓN: La distribución desigual de los agregados da lugar a una mayor diferenciación espontánea de las iPSC humanas. La propagación circular de la suspensión de los grupos da como resultado grupos que se aglomeran en el borde de los pozos y una menor densidad en el centro. - Incubar la placa a 37 °C y realizar cambios de medio utilizando medios completos de células madre diariamente o cada dos días. Al realizar cambios en el medio, evalúe visualmente los cultivos para monitorear el crecimiento y determinar si las células requieren tiempo de paso o están listas para la diferenciación. Para saltarse dos días consecutivos de alimentación, agregue 2 veces el volumen del medio necesario para un solo día.
- Vuelva a suspender suavemente los grupos de iPSC en el 50% del volumen calculado de medios de células madre completos para obtener la densidad deseada y coloque la mezcla de agregados celulares en pocillos recubiertos que contengan el 50% de los medios de células madre completos calculados.
- Cultivo de iPSC en placas que contienen Matrix 4-XE
- Vuelva a suspender suavemente las iPSC en el volumen total calculado de 3 veces los medios de células madre completos para obtener la densidad deseada.
- Agregue con cuidado el medio con celdas en la parte superior del hidrogel 250 μL / pocillo si usa una placa de 24 pocillos. Para conocer el volumen recomendado de medio celular para placas de pocillos de otros tamaños, consulte la Tabla 3.
PRECAUCIÓN: El hidrogel se hinchará y ocupará un volumen mayor que el recién hecho. Las colonias de iPSC estarán parcialmente incrustadas en el hidrogel en la parte inferior de la placa, por lo que se recomienda cambiar el 50%-80% del medio superior sin alterar el hidrogel. - Mueva la placa en varios movimientos rápidos, cortos, de adelante hacia atrás y de lado a lado para distribuir los grupos de celdas de manera uniforme.
- Coloque la placa en una incubadora a 37 °C con 5% de CO2 y 95% de humedad. Cambie el medio celular utilizando medios completos de células madre. Realizar cambios de medio diariamente o cada dos días; Para este último, agregue 2 veces el volumen del medio.
- Inspeccione visualmente los cultivos para realizar un seguimiento de su crecimiento a medida que alcanzan la etapa adecuada para la diferenciación.
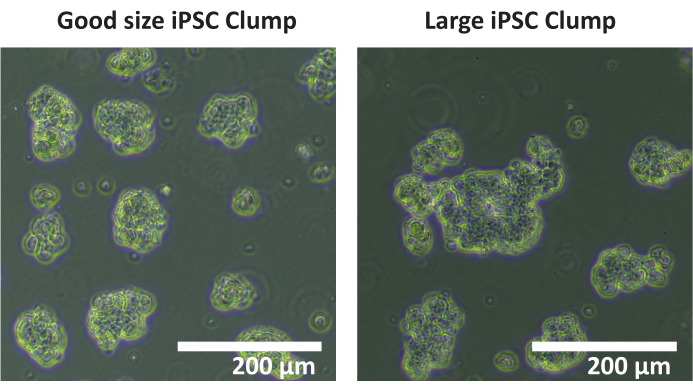
Figura 1: Tamaño óptimo del grupo. Imágenes de grupos de la línea celular iPSC SCTi003A que muestran un ejemplo de tamaño óptimo de grupo. Barra de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
2. Diferenciación de hiPSC y generación de organoides intestinales
PRECAUCIÓN: Todos los trabajos se realizan en una cabina de bioseguridad (BSC) siguiendo las técnicas asépticas estándar. Debe seguir las normas de seguridad de OSHA para laboratorios, incluido el uso adecuado de equipo de protección personal como batas de laboratorio, guantes y gafas.
- Prepare lo siguiente antes de comenzar: prepare las alícuotas del medio de diferenciación requerido para cada etapa. Después de descongelar las alícuotas, úselas inmediatamente. No vuelva a congelar. Siga la Tabla 5 para obtener una guía general de cada tipo de medio de etapa y los volúmenes necesarios para una placa de 24 pocillos.
NOTA: El tiempo óptimo en cada etapa de diferenciación puede variar según la línea celular. Se recomienda comprobar la expresión de cada estadio del marcador celular para mejorar la eficacia de la diferenciación. La evaluación periódica de la expresión génica en los cultivos de iPSCS no se incluyó en esta investigación, ya que aprovechamos los lotes calificados por el proveedor en pasos bajos, pero se recomienda como un paso de control de calidad para líneas de iPSC nuevas o aún no calificadas durante los pasos de diferenciación posteriores. - Etapa 1: Endodermo definitivo (DE)
- Para evaluar la preparación para iniciar la diferenciación, compruebe los siguientes criterios.
- Usando un microscopio, evalúe la confluencia de las colonias de células madre y la cantidad de diferenciación espontánea en el cultivo. No confíe solo en la evaluación morfológica. La confluencia óptima debe estar entre el 85% y el 90% (por encima de ~105 células/cm2), y la diferenciación espontánea mínima observada debe ser de <5% de diferenciación.
- Recoja células de un pozo de sacrificio para la caracterización por citometría de flujo de marcadores hiPSC antes de continuar con el siguiente paso. Se utilizó una estrategia de compuerta de dispersión frontal y lateral para la caracterización representativa de la citometría de flujo. Si las células cumplen con los criterios óptimos, comienza la diferenciación. El criterio de paso celular es >85% de expresión de idealmente 3 marcadores (Tabla 4), especialmente en el caso de líneas de iPSC nuevas/aún no calificadas en el laboratorio.
NOTA: Los cultivos de iPSC cultivados en diferentes matrices se someten al mismo proceso general con solo crecimiento de iPSC en Matrix 4-XE, lo que requiere cambios de medio más suaves para no perturbar las células semiincrustadas. Se espera una muerte celular significativa durante la inducción del endodermo definitivo, ya que las células son particularmente sensibles en esta etapa. Tenga cuidado durante los cambios de medio, con el objetivo de minimizar el tiempo que las células están expuestas fuera del entorno de incubación a 37 °C tanto como sea posible.
- Inicie la diferenciación de las colonias celulares como se describe a continuación.
- Día 0: Calentar una alícuota de DE medio a 37 °C. Para evitar la desnaturalización de los medios por los ciclos de calentamiento-enfriamiento, asegúrese de calentar solo el volumen requerido para el día 0 (0,7 mL/pocillo).
- Aspire los medios de las hiPSC. Agregue con cuidado 0.7 mL de DE Medium por pocillo por el costado del pozo. Evite el pipeteo brusco que pueda desprenderse o dañar las colonias. Incubar la placa a 37 °C con 5% de CO2 y 95% de humedad durante 24 h.
- Día 1: Calentar una alícuota de medio DE que contenga solo el volumen necesario para el día 1 (0,5 mL/pocillo) a 37 °C. Aspire el medio DE de las células y agregue con cuidado 0.5 mL de medio DE por pocillo por el costado del pocillo. Incubar a 37 °C con 5% de CO2 y 95% de humedad durante 24 h.
- Día 3: Las células están listas para ser analizadas para la formación definitiva del endodermo. Consulte la Tabla 4 para conocer los marcadores recomendados. Antes de continuar con la siguiente fase, sacrifique un pocillo para realizar una caracterización por citometría de flujo de marcadores específicos asociados con DE. Se utilizó una estrategia de compuerta de dispersión frontal y lateral para la caracterización representativa de la citometría de flujo. Se recomienda comprobar la expresión de más de 1 marcador, especialmente en el caso de líneas iPSC nuevas/aún no cualificadas en el laboratorio.
- Para evaluar la preparación para iniciar la diferenciación, compruebe los siguientes criterios.
- Etapa 2: Intestino medio/intestino posterior (MH)
- Día 3: Calentar solo el volumen de medio MH necesario para el día 3 (0,5 mL/pocillo) a 15 - 25 °C. Aspire el medio DE de las células y reemplácelo con 0,5 mL de medio MH. Incubar a 37 °C con 5% de CO2 y 95% de humedad durante 24 h.
- Días 4 - 9: Antes de los cambios diarios de medio, utilice el microscopio con un aumento de 2x o 4x para evaluar la formación de esferoides mediante la comprobación de estructuras 3D visibles (puede ocurrir a partir del día 4); Esferoides que flotan libremente (pueden ocurrir a partir del día 5).
- Una vez que los esferoides comiencen a desprenderse, use una pipeta de 1 mL para transferir suavemente el medio de las células a un tubo cónico estéril de 15 mL para evaluar el número de esferoides desprendidos de las células.
NOTA: Evite cualquier fuerza de cizallamiento que pueda separar las estructuras 3D de la monocapa; Una vez listos, los esferoides se desprenderán por sí solos. - Si se desprenden menos de 50 esferoides, centrifugar a 200 x g durante 5 min, eliminar el medio viejo y volver a suspender los esferoides en 0,5 mL/pocillo de medio y transferirlos al pocillo respectivo hasta que hayan madurado suficientes esferoides.
NOTA: La duración de la exposición al medio del intestino medio/intestino posterior desempeña un papel crucial en la determinación de la identidad regional de los organoides del intestino delgado en desarrollo, como el duodeno (exposición más corta) o el íleon (exposición más prolongada). Para lograr cultivos más uniformes con la misma identidad, trate de recolectar esferoides expuestos al medio del intestino medio y posterior simultáneamente. - Repita el paso 2.3.3 hasta que se desprendan suficientes esferoides para incrustar e iniciar el cultivo de organoides intestinales humanos (hIO).
- Antes de continuar con la siguiente fase, separe una muestra de esferoides y realice una caracterización por citometría de flujo de marcadores específicos asociados con el intestino medio/intestino posterior (MH). Se utilizó una estrategia de compuerta de dispersión frontal y lateral para la caracterización representativa de la citometría de flujo. Consulte la Tabla 4 para obtener una lista de los marcadores más utilizados. Se recomienda comprobar la expresión de más de 1 marcador, especialmente en el caso de líneas iPSC nuevas/aún no cualificadas en el laboratorio.
- Etapa 3: Incrustación de esferoides
- Prepare lo siguiente antes de comenzar el procedimiento.
- Descongele las alícuotas de la Matriz 1-ABO y la Matriz 3-ABO en hielo. Considere el número de esferoides recolectados para determinar la cantidad total de matriz necesaria si se requerirán 30-40 μL de matriz por domo.
- Prepare 25 mL de Advance DMEM/F-12 frío que contenga 15 mM de HEPES. Los ECM de alta concentración son viscosos y difíciles de pipetear. Coloque una caja de puntas de pipeta estériles de 100 μL a -20 °C para preparar puntas frías que puedan ayudar al proceso. Prepare alícuotas de Medio de Crecimiento de Organoides Intestinales (OGM), que requiere 4 tomas (0,5 mL/pocillo por toma). Consulte la Tabla 5 para la preparación.
- Descongele una alícuota del suplemento OGM en hielo. Después de descongelar las alícuotas, úselas inmediatamente. No vuelva a congelar. Almacene OGM completo a 2-8 °C durante un máximo de 2 semanas.
- Prepare OGM que contenga 3 veces el suplemento en comparación con la formulación estándar para (3 veces OGM). Saca la Matrix 4-XFO1 thought Matrix 4-XFO4 del frigorífico y déjala calentar a temperatura ambiente (25 °C).
- Para el sistema derivado de animales, realice los pasos que se describen a continuación.
- Coloque una placa estéril de cultivo de tejidos de 24 pocillos en la incubadora para calentarla a 37 °C mientras prepara los esferoides y las matrices. Deje que los esferoides recolectados se depositen en el fondo de un tubo cónico de 15 ml. Aspire con cuidado y deseche el sobrenadante.
NOTA: Para hacer una comparación más precisa del efecto de las matrices, asegúrese de mantener los esferoides recolectados de la hiPSC diferenciados en cada matriz en tubos separados. - Agregue 1 mL de DMEM/F-12 con 15 mM HEPES a los esferoides. Centrifugar a 300 x g durante 5 min a temperatura ambiente (15 - 25 °C).
- Retire con cuidado la mayor cantidad posible del sobrenadante. Se recomienda comenzar a extraer con una pipeta de 1 mL y cambiar a pipetas de 100 μL e incluso de 10 μL para eliminar la mayor cantidad posible sin alterar el pellet de esferoides.
NOTA: Cuanto mayor sea el volumen de medios restante, más diluidas estarán las matrices. Las matrices diluidas pueden provocar problemas de gelificación o cúpulas más blandas. Las cúpulas más blandas conducen a mayores posibilidades de colapsar con perturbaciones mínimas. - Utilizando una pipeta con una punta de pipeta fría de 100 μL, añada 40 μL/50 esferoides de Matrix 1-ABO o Matrix 3-ABO en frío (2 - 8 °C) a su tubo correspondiente. Distribuya suavemente los esferoides en la matriz pipeteando hacia arriba y hacia abajo ~ 5 veces. No vacíe completamente la punta de la pipeta, ya que puede introducir burbujas.
- Traiga la placa de la incubadora y, con una punta de pipeta fría, transfiera suavemente los esferoides incrustados al centro de la placa siguiendo los pasos de la Figura 2. Evite dispensar Matrix 1-ABO y Matrix 3-ABO demasiado rápido en la placa de cultivo, ya que esto aplanará la cúpula.
- Transfiera con cuidado la placa a una incubadora a 37 °C e incube durante 30 minutos para asegurar la gelificación de la cúpula. Tenga especial cuidado con cualquier sacudida o movimiento brusco durante el transporte y en la incubadora.
- Durante la incubación de la cúpula para la gelificación, calentar a 37 °C un volumen suficiente de OGM intestinal (0,5 mL/pocillo) para el número de pocillos a utilizar.
NOTA: Caliente solo el volumen necesario. Evite los ciclos de calentamiento-enfriamiento. Asegúrese de que el medio esté caliente antes de agregarlo a la cúpula; Los medios fríos pueden provocar el colapso de la cúpula. - Después de 30 minutos, agregue con cuidado 0,5 mL de OGM intestinal al costado del pozo para no perturbar la cúpula. Incubar a 37 °C con 5% de CO2 y 95% de humedad. Realice un cambio de medio completo cada 3 a 4 días eliminando el medio y luego agregue medio nuevo.
- Coloque una placa estéril de cultivo de tejidos de 24 pocillos en la incubadora para calentarla a 37 °C mientras prepara los esferoides y las matrices. Deje que los esferoides recolectados se depositen en el fondo de un tubo cónico de 15 ml. Aspire con cuidado y deseche el sobrenadante.
- Para los sistemas de organoides Matrix 4-XF, siga los pasos descritos.
NOTA: El sistema de organoides Matrix 4-XF incluye cuatro opciones diferentes (O1-O4); La formulación de cada tipo varía en ligandos biofuncionales, rigidez y degradabilidad. En consecuencia, se recomienda realizar experimentos iniciales para determinar el tipo óptimo para la aplicación específica. Este protocolo describe el uso de las cuatro opciones para encontrar una formulación óptima para los organoides intestinales derivados de hiPSC. Además, si bien existen múltiples protocolos de cultivo que se pueden usar (por ejemplo, encapsulación 3D, encapsulación en cúpula), este protocolo implica el uso del método de cúpula de modo que es posible comparar directamente con los métodos comunes utilizados cuando se trabaja con sistemas de membrana basal derivados de animales.- Añada 1 mL/pocillo de avance en frío DMEM/F-12 que contenga 16 mM HEPES a los esferoides generados en el sistema Matrix 4-XFO4. Centrifugar a 300 x g durante 5 min a temperatura ambiente (15 - 25 °C).
NOTA: Para encontrar la formulación óptima para la aplicación, asegúrese de distribuir los esferoides en 4 tubos separados antes de la centrifugación. Los esferoides generados en matrices de origen animal también pueden madurar en organoides intestinales utilizando este sistema. - Con una pipeta de 1 mL, retire el sobrenadante sin alterar los esferoides. Agregue 50 μL de 3x OGM al pellet de esferoides (~100 esferoides). Añada 100 μL de la Matrix 4-XFO seleccionada a la suspensión esferoide de 50 μL y mezcle suavemente de 5 a 10 veces. Mantenga la Matrix 4-XFO a 3x OGM en una proporción de mezcla de 2:1 v/v para tener una concentración final de 1x.
- Agregue 40 μL de la mezcla de hidrogel y esferoide al centro de una placa de cultivo de tejidos de 24 pocillos. Transfiera con cuidado las placas a una incubadora a 37 °C e incube durante 30 minutos.
NOTA: La matriz 4-XFO no requiere incubación a 37 °C para la gelificación; sin embargo, se recomienda mantener los organoides expuestos a condiciones similares en comparación con los sistemas Matrix 1-ABO y Matrix 3-ABO que requieren 37 °C para una mejor gelificación de los domos. - Después de 30 minutos, agregue con cuidado 0,5 mL de OGM intestinal al costado del pozo para no perturbar la cúpula. Incubar a 37 °C con 5% de CO2 y 95% de humedad. Realice un cambio de medio completo cada 3 a 4 días eliminando el medio y luego agregando medio nuevo.
- Añada 1 mL/pocillo de avance en frío DMEM/F-12 que contenga 16 mM HEPES a los esferoides generados en el sistema Matrix 4-XFO4. Centrifugar a 300 x g durante 5 min a temperatura ambiente (15 - 25 °C).
- Prepare lo siguiente antes de comenzar el procedimiento.
- Paso y maduración de hIO
- Prepare los mismos productos químicos, soluciones y reactivos que se hicieron en el paso 2.4.1.
- Agregue 1-2 mL de solución de enjuague antiadherente a un tubo cónico de 15 mL (1 por condición) y agite para cubrir el tubo.
- Retire la solución antiadherente y enjuague los tubos con 5 mL de D-PBS (sin Ca++ y Mg++). Tape todos los tubos recubiertos y manténgalos a temperatura ambiente (15 - 25 °C) hasta que los necesite.
- Aspire el medio desde las cúpulas. Con una pipeta de 1 mL, añada 1 mL de DMEM/F-12 frío directamente a la cúpula. El objetivo es separar las cúpulas de la placa.
- Agregue 1 mL adicional de DMEM/F-12 frío al pocillo y pipetee hacia arriba y hacia abajo para cosechar los organoides restantes. Transfiera a los tubos cónicos recubiertos de 15 mL.
NOTA: Verifique la cosecha exitosa de organoides examinando visualmente el pozo bajo un microscopio. Si se observan organoides residuales, repita el paso 2.5.5. - Con una pipeta de 1 mL, realice el pipeteo ascendente y descendente de la suspensión para desintegrar los organoides hasta lograr una suspensión de fragmentos uniforme con el tamaño de organoide deseado (por ejemplo, 100 - 500 μm).
NOTA: Utilice una pipeta de 200 μL para verificar que los organoides se ajusten al tamaño recomendado. El empleo de la pipeta de 200 μL facilita la fragmentación adicional según sea necesario, lo que garantiza que los fragmentos puedan pasar sin problemas a través de una punta de pipeta de 200 μL.
PRECAUCIÓN: Evite romper los fragmentos en células individuales mediante un pipeteo brusco o prolongado. - Establezca la densidad de organoides deseada contando fragmentos o empleando la relación de división. Separe una alícuota y realice el recuento utilizando el mismo procedimiento que en los pasos 1.4.6-1.4.9 para el recuento de grupos.
NOTA: La densidad óptima de organoides debe optimizarse por línea; Generalmente, se recomienda una densidad de 40 a 80 organoides intestinales por cúpula. - Asegúrese de que el tubo se coloque en hielo durante el proceso de recuento de organoides. Después de aproximadamente 5 minutos, los fragmentos de organoides se habrán asentado en el fondo del tubo debido a la gravedad.
NOTA: Cuanto mayor sea el volumen de la solución de organoide, más tiempo tardará en asentarse en el fondo. - Elimine suavemente la mayor cantidad de sobrenadante y la capa turbia formada en la parte superior de los organoides. En los primeros pasajes, cuando los organoides están madurando, esta fase turbia abarca una matriz y células individuales.
- Añadir 2 mL de DMEM/F-12 frío pipeteando directamente sobre el pellet. Centrifugar a 200 x g durante 5 min a temperatura ambiente (15 - 25 °C).
- En el caso de los sistemas derivados de animales, retire y deseche cuidadosamente el sobrenadante siguiendo los mismos pasos descritos en los pasos 2.4.2.4-2.4.2.9.
- Para el sistema Matrix 4-XFO, retire y deseche cuidadosamente el sobrenadante siguiendo los mismos pasos descritos en los pasos 2.4.3.2-2.4.3.4.
NOTA: Cuando se trabaja con el sistema Matrix 4-XFO, se recomienda utilizar una solución de recuperación de organoides de hidrogel libre de xeno para una eliminación óptima del residuo de hidrogel. Esta solución de recuperación está especialmente recomendada cuando se cambia de sistemas de hidrogel de origen animal a sistemas de hidrogel sin xeno para garantizar la eliminación de cualquier material xenogénico.
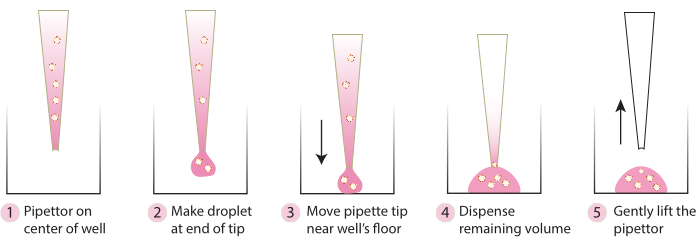
Figura 2. Esquema de la técnica recomendada para la formación de cúpulas. El esquema describe el proceso paso a paso recomendado para la formación exitosa de cúpulas para todos los sistemas. Haga clic aquí para ver una versión más grande de esta figura.
3. Caracterización del tamaño de E/S
NOTA: El tamaño de los organoides se caracterizó por imágenes de campo claro tomadas a 4x y 10x. El análisis del procesamiento de imágenes se automatizó con MATLAB. Los pasos generales del proceso se describen a continuación, y se incluye una muestra del código en el Archivo Complementario 1.
- Defina el directorio que contiene las imágenes y enumere todos los archivos de imagen en el directorio. Inicialice la tabla para almacenar los resultados. Leer las imágenes de campo claro de un archivo.
- Defina la conversión de píxeles a μm y establezca la escala. Si la imagen no contiene una barra de escala, solicite al usuario el factor de conversión de píxel a μm.
- Convierte la imagen a escala de grises. Aplique un filtro gaussiano para reducir el ruido en la imagen. Umbral de la imagen filtrada para separar los organoides del fondo.
- Rellene los agujeros pequeños y retire los objetos pequeños para limpiar la imagen binaria. Realice análisis de componentes conectados para identificar organoides individuales y calcular sus propiedades, como el área, el centroide, la longitud del eje mayor y la longitud del eje menor.
- Calcule el tamaño del organoide en función de las longitudes de los ejes mayor y menor. Muestre los organoides segmentados en la imagen original y etiquételos con su tamaño. Imprima los tamaños de los organoides y almacene los resultados en un archivo .cvs.
NOTA: Las primeras dos imágenes se analizaron manualmente para determinar los parámetros óptimos para la desviación estándar del filtro gaussiano y el área hasta el umbral. El código del Archivo Suplementario 1 proporciona un ejemplo del marco básico para el análisis del tamaño de organoides a partir de imágenes de campo claro; Sin embargo, es necesario un mayor refinamiento para adaptarse a los requisitos específicos de cada tipo y calidad de imagen. El mismo proceso se puede realizar utilizando software de código abierto como FIJI de Image J. - Siga los pasos que se indican a continuación para utilizar el software FIJI.
- Defina la conversión de píxeles a μm y establezca la escala. Si la imagen no contiene una barra de escala, solicite al usuario el factor de conversión de píxel a μm haciendo clic en Analizar > Establecer escala.
- Convierta la imagen a escala de grises haciendo clic en Imagen > Escriba > 8 bits. Aplique un filtro gaussiano para reducir el ruido en la imagen haciendo clic en Procesar filtro > > Propaganda gaussiana > Sigma (radio) utilizado: 2.
- Umbral de la imagen filtrada para separar los organoides del fondo haciendo clic en Imagen > Umbral > MaxEntropy > Aplicar.
- Rellene los agujeros pequeños y elimine los objetos pequeños para limpiar la imagen binaria haciendo clic en Procesar > ruido > Eliminar valores atípicos > 20 píxeles.
- Realice análisis de componentes conectados para identificar organoides individuales y calcular sus propiedades, como el área, el centroide, la longitud del eje mayor y la longitud del eje menor, haciendo clic en Analizar > Establecer > de medición Asegúrese de que el área, el perímetro y el diámetro estén incluidos > Analizar > Analizar partículas > Mostrar contornos.
- Análisis estadístico
- Evalúe la normalidad de la distribución de datos a través de la prueba de Saphiro-Wilk utilizando el software JMP (SAS). Para examinar las diferencias estadísticas entre los grupos, se realizó un ANOVA de dos factores y se realizaron pruebas post-hoc utilizando el método no paramétrico de Wilcoxon en el software JMP(SAS). La significación se estableció a un nivel alfa de p ≤ 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
Siguiendo este protocolo, se utilizaron con éxito membranas basales disponibles en el mercado y un sistema de hidrogel libre de xeno para cultivar células hiPSC y diferenciarlas en hIO. El objetivo principal de estos experimentos fue evaluar sistemáticamente la equivalencia de matrices de diversas fuentes para el trabajo de hiPSC y hIO. La primera sección de este protocolo se centró en el mantenimiento y caracterización de un cultivo de iPSC saludable que produce una generación eficiente de organoides intestinales...
Access restricted. Please log in or start a trial to view this content.
Discusión
La selección del microentorno óptimo para el trabajo con células madre y organoides es un primer paso fundamental cuando se utilizan estas plataformas para una amplia gama de aplicaciones. Nuestros resultados representativos muestran que la matriz 4-XFO3, en combinación con una mayor concentración de factores de crecimiento, conduce a organoides más grandes, lo que sugiere que las propiedades físicas de los hidrogeles libres de xeno se pueden aprovechar para optimizar la generación de organoides utilizando estos ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
El Dr. John Huang es fundador y CEO de TheWell Bioscience.
Agradecimientos
Los autores reconocen la capacitación previa y las recomendaciones generales sobre el inicio del trabajo con hiPSC y organoides de los doctores Christina Pacak, Silveli Susuki-Hatano y Russell D'Souza. Agradecen a la Dra. Chelsey Simmons por su orientación en el uso de sistemas de hidrogel para el trabajo de cultivo celular in vitro . Además, los autores desean agradecer a los doctores Christine Rodriguez y Thomas Allison de STEMCELL Technologies por su orientación sobre el cultivo de hiPSC. Los autores también agradecen a TheWell Bioscience por cubrir los costos de publicación.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 24-Well Plate (Culture treated, sterile) | Falcon | 353504 | |
| 37 °C water bath | VWR | ||
| 96-well plate | Fisher Scientific | FB012931 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| Anti-adherence Rinsing Solutio | STEMCELL Technologies | 7010 | |
| Biological safety cabinet (BSC) | Labconco | Logic | |
| Brightfield Microscope | Echo Rebel | REB-01-E2 | |
| BXS0116 | ATCC | ACS-1030 | |
| Centrifuge with temperature control (4 °C capabilities) | ThermoScientific | 75002441 | |
| Conical tubes, 15 mL, sterile | Thermo Fisher Scientific | 339650 | |
| Conical tubes, 50 mL, sterile | Thermo Fisher Scientific | 339652 | |
| Cultrex RGF BME, Type 2 | Bio-techne | 3533-005-02 | |
| Cultrex Stem Cell Qualified RGF BME | Bio-techne | 3434-010-02 | |
| D-PBS (Without Ca++ and Mg++) | Thermo Fisher Scientific | 14190144 | |
| GeltrexLDEV-Free, hESC-Qualified Reduce Growth Factor | Gibco | A14133-02 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Guava Muse Cell Analyzer or another flow cytometry equipment (optional) | Luminex | 0500-3115 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Heralcell Vios Cell culture incubator (37 °C, 5% CO2) | Thermo Scientific | 51033775 | |
| JMP Software | SAS Institute | JMP 16 | |
| MATLAB | MathWorks, Inc | R2022b | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix LDEV free | Corning | 356231 | |
| Matrigel Matrix High Concentration (HC), Growth Factor Reduced (GFR) LDEV-free | Corning | 354263 | |
| mTeSR Plus Medium | STEMCELL Technologies | 100-0276 | |
| Nunclon Delta surface treated 24-well plate | Thermo Scientific | 144530 | |
| PE Mouse Anti-human CD326 (EpCAM) | BD Pharmingen | 566841 | |
| PE Mouse Anti-human CDX2 | BD Pharmingen | 563428 | |
| PE Mouse Anti-human FOXA2 | BD Pharmingen | 561589 | |
| PerCP-Cy 5.5 Mouse Anti-human SSEA4 | BD Pharmingen | 561565 | |
| ReLeSR | STEMCELL | 5872 | |
| SCTi003-A | STEMCELL Technologies | 200-0510 | |
| Serological pipettes (10 mL) | Fisher Scientific | 13-678-11E | |
| Serological pipettes (5 mL) | Fisher Scientific | 13-678-11D | |
| STEMdiff Intestinal Organoid Growth Medium | STEMCELL Technologies | 5145 | |
| STEMdiff Intestinal Organoid Kit | STEMCELL Technologies | 5140 | |
| Vitrogel Hydrogel Matrix | TheWell Bioscience | VHM01 | |
| VitroGel ORGANOID Discovery Kit | TheWell Bioscience | VHM04-K |
Referencias
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. J Cell Sci. 123, Pt 24 4195-4200 (2010).
- Hinz, B., Gabbiani, G. Fibrosis: Recent advances in myofibroblast biology and new therapeutic perspectives. F1000 Biol Rep. 2, 78(2010).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 15 (12), 1243-1253 (2014).
- Rozario, T., DeSimone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol. 341 (1), 126-140 (2010).
- Even-Ram, S., Artym, V., Yamada, K. M. Matrix control of stem cell fate. Cell. 126 (4), 645-647 (2006).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Tran, O. N., et al. Organ-specific extracellular matrix directs trans-differentiation of mesenchymal stem cells and formation of salivary gland-like organoids in vivo. Stem Cell Res Ther. 13 (1), 306(2022).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., et al. Tissue geometry drives deterministic organoid patterning. Science. 375 (6576), (2022).
- Heo, J. H., Kang, D., Seo, S. J., Jin, Y. Engineering the extracellular matrix for organoid culture. Int J Stem Cells. 15 (1), 60-69 (2022).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15 (10), 647-664 (2014).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Huch, M., et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494 (7436), 247-250 (2013).
- Greenlee, A. R., Kronenwetter-Koepel, T. A., Kaiser, S. J., Liu, K. Comparison of Matrigel and gelatin substrata for feeder-free culture of undifferentiated mouse embryonic stem cells for toxicity testing. Toxicol In Vitro. 19 (3), 389-397 (2005).
- Geltrex LDEV-Free, HESC-Qualified, Reduced Growth Factor Basement Membrane Matrix User Guide (Pub.No. MAN0007336 3.0. Fisher Scientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.cn/TFS-Assets%2FLSG%2Fmanuals%2FGeltrex_LDEV_Free_hESC_qualified_PI.pdf (2024).
- biotechne R&D Systems. Cultrex Stem Cell Qualified Reduced Growth Factor. biotechne R&D Systems. , (2024).
- VitroGel Organoid Protocol. TheWell Bioscience. , Available from: https://www.thewellbio.com/video-protocols (2024).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Henderson, J. K., et al. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 20 (4), 329-337 (2002).
- Haruna, N. F., Huang, J. Investigating the dynamic biophysical properties of a tunable hydrogel for 3D cell culture. J Cytol Tissue Biol. 7, 30(2020).
- Cherne, M. D., et al. A synthetic hydrogel, VitroGel ORGANOID-3, improves immune cell-epithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells. Front Pharmacol. 12, 707891(2021).
- Stewart, D. C., et al. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 13, e0200377(2018).
- Hernandez-Gordillo, V., et al. Fully synthetic matrices for in vitro culture of primary human intestinal enteroids and endometrial organoids. Biomaterials. 254, 120125(2020).
- Broguiere, N., et al. Growth of epithelial organoids in a defined hydrogel. Adv Mater. 30, 1801621(2018).
- Barthes, J., et al. Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: The recent advances. BioMed Res Int. 2014, 921905(2014).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nat Rev Mater. 5 (7), 539-551 (2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados