需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基底膜基质用于人类干细胞维持和肠道类器官生成的比较研究
摘要
类器官已成为疾病建模的宝贵工具。细胞外基质 (ECM) 在类器官生成过程中指导细胞命运,使用类似于天然组织的系统可以提高模型的准确性。这项研究比较了动物源性 ECM 和无异种水凝胶中诱导多能干细胞衍生的人肠道类器官的产生。
摘要
细胞外基质(ECM)在细胞行为和发育中起着关键作用。由人类诱导多能干细胞 (hiPSC) 产生的类器官是许多研究领域的焦点。然而,经典细胞培养材料中缺乏生理线索阻碍了有效的iPSC分化。将市售的ECM掺入干细胞培养中,可提供有益于细胞维持的物理和化学线索。动物源性市售基底膜产品由支持细胞维持的 ECM 蛋白和生长因子组成。由于 ECM 具有可以调节细胞命运的组织特异性,因此无异种基质用于将翻译上级到临床研究。虽然市售基质广泛用于 hiPSC 和类器官工作,但这些基质的等效性尚未得到评估。在这里,进行了四种不同基质中hiPSC维持和人肠道类器官(hIO)生成的比较研究:Matrigel(Matrix 1-AB)、Geltrex(Matrix 2-AB)、Cultrex(Matrix 3-AB)和VitroGel(Matrix 4-XF)。尽管这些菌落缺乏完美的圆形形状,但自发分化极小,超过85%的细胞表达干细胞标记物SSEA-4。基质 4-XF 导致 3D 圆形团块的形成。此外,在用于制备 Matrix 4-XF 水凝胶溶液的培养基中增加补充剂和生长因子的浓度可将 SSEA-4 的 hiPSC 表达提高 1.3 倍。与其他动物源性基底膜相比,基质 2-AB 维持的 hiPSC 的分化导致中/后肠阶段的球状体释放减少。与其他基质相比,无异种有机体基质(基质 4-O3)导致更大、更成熟的 hIO,这表明可以利用无异种水凝胶的物理特性来优化类器官的生成。总而言之,结果表明,不同基质组成的变化会影响IO分化的阶段。这项研究提高了人们对商用基质差异的认识,并为 iPSC 和 IO 工作期间的基质优化提供了指导。
引言
细胞外基质 (ECM) 是组织的动态和多功能组成部分,在调节细胞行为和发育方面发挥着核心作用。作为一个复杂的网络,它提供结构支持、细胞粘附配体1 以及调节细胞信号传导的生长因子和细胞因子的储存。例如,在伤口愈合过程中,ECM 充当迁移细胞的支架和参与组织修复的生长因子的储存库2。同样,ECM 中的失调会导致各种疾病(如纤维化和癌症)的严重程度增加 3,4。在胚胎发育过程中,ECM指导组织形态发生。例如,在心脏的发育中,ECM 组件在创建心脏组织的正确结构和功能方面发挥作用5.十多年的研究表明,仅微环境的硬度6,7就可以控制干细胞谱系规格。因此,在体外细胞分化过程中,ECM通过提供分化信号来影响干细胞的命运也就不足为奇了。
类器官可以由诱导多能干细胞 (iPSC) 产生。从正确表征的 iPSC 系开始,需要成功生成类器官。然而,经典细胞培养材料中缺乏生理线索阻碍了有效的 iPSC 分化和类器官生成。此外,最近的研究强调了细胞外基质 (ECM) 组成、细胞与 ECM8 之间的相互作用以及类器官扩增和分化背景下的机械和几何线索 9,10,11 的重要性12。通过提高可重复性来推进类器官技术将涉及结合组织特异性的物理和化学线索。
类器官旨在在生理上相似的微环境中概括天然组织。选择与天然组织 ECM 非常相似的 ECM 系统对于实现有关细胞行为、功能和对刺激的反应的生理相关性至关重要13。ECM成分的选择会影响干细胞在类器官内分化为特定细胞类型。不同的 ECM 蛋白及其组合可以提供指导细胞命运的线索14。例如,研究表明,使用特定的 ECM 成分可以促进肠道干细胞分化为成熟的肠道细胞类型,从而产生生理相关的肠道类器官15。虽然类器官是疾病建模和药物测试过程中的宝贵工具,但选择合适的 ECM 系统对于此应用至关重要。适当的 ECM 系统可以通过创建类似于受影响组织的微环境来提高疾病建模的准确性16。此外,组织特异性 ECM 可以帮助生成类器官,更好地概括疾病相关的表型和药物反应17。优化用于类器官分化的 ECM 系统对于实现预期的分化结果至关重要。
源自动物 ECM 来源(例如 Matrigel、Cultrex)和无异种成分水凝胶(例如 VitroGel)的市售基底膜系统广泛用于 iPSC 和类器官研究。多年来,将它们商业化的公司和使用它们的研究人员已经为其特定产品和应用制定了许多说明。其中许多指令作为生成该协议的指南。此外,与其内在属性相关的好处和挫折已被许多人单独指出 18,19,20,21。然而,没有系统的工作流程来指导选择用于 iPSC 和类器官工作的最佳系统。本文提供了一个工作流程,用于系统地评估来自不同来源的 ECM 系统对 iPSC 和类器官工作的等效性。这是一项在四种不同基质中维持两种不同人 iPSC 系 (hiPSC) 和人肠道类器官 (hIO) 生成的比较研究:Matrigel(基质 1-AB)、Geltrex(基质 2-AB)、Cultrex(基质 3-AB)和 VitroGel(基质 4-XF)。对于类器官培养,使用了先前针对类器官培养进行优化的四种无异种基质 VitroGel:类器官 1(基质 4-O1)、类器官 2(基质 4-O2)、类器官 3(基质 4-O3)、类器官 4(基质 4-O4)。此外,还使用了针对类器官优化的动物源性基质:Matrigel High Concentration(Matrix 1-ABO)和 Cultrex Type 2(Matrix 3-ABO)。使用市售干细胞培养基(mTeSR Plus)和类器官分化试剂盒(STEMdiff肠道类器官试剂盒)。该协议将产品制造商的单独说明与实验室经验相结合,以指导读者成功优化其特定 iPSC 和类器官工作的 ECM。总而言之,该协议和代表性结果强调了选择干细胞工作和类器官分化最佳微环境的重要性。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. hiPSC维持
注意:所有工作均在生物安全柜 (BSC) 中按照标准无菌技术完成。必须遵守 OSHA 实验室安全标准,包括正确使用实验室外套、手套和护目镜等个人防护设备。
- 基质、等分试样和细胞培养基的制备
- 用于市售的动物源性基底膜(BMs;基质 1-AB、基质 2-AB、基质 3-AB),按照 表 1 中总结的制造商建议制备工作体积的等分试样,并将它们储存在 -20 °C 或 -80 °C 下以进行长期储存。避免气泡的形成。如果形成一些气泡,在储存之前,将样品在4°C,<200×g离心 ~ 1-2分钟,以迫使气泡到达表面。
注意:制作一次性等分试样有助于避免破坏 ECM 架构的重复冻融循环。由于 BM 浓度随批号而变化,因此请务必遵循制造商的建议制备一次性等分试样并制备包衣溶液。高浓度的 BM 是粘稠的,难以移液;使用先前储存在-20°C的冷头。 - 按照制造商的建议制备干细胞培养基。为了制备本协议中使用的特定市售完全培养基,将 100 mL 5x 补充剂混合物加入 400 mL 基础培养基中。然后,将该培养基彻底混合并分装成40mL体积,储存在20°C下。 使用时,解冻每个等分试样的完全培养基,立即使用等分的完全培养基,或在2-8°C下储存长达2周。请勿重新冷冻。
- 制备含有 3 倍浓度的补充混合物的干细胞完全培养基的等分试样,以制备 Matrix 4-XE 水凝胶,即将 5 倍补充剂稀释至 3x。
- 用于市售的动物源性基底膜(BMs;基质 1-AB、基质 2-AB、基质 3-AB),按照 表 1 中总结的制造商建议制备工作体积的等分试样,并将它们储存在 -20 °C 或 -80 °C 下以进行长期储存。避免气泡的形成。如果形成一些气泡,在储存之前,将样品在4°C,<200×g离心 ~ 1-2分钟,以迫使气泡到达表面。
- 用动物源性 BMs(基质 1-3AB)包被组织培养塑料
- 在开始之前准备以下内容:解冻和处理时,始终将基质保持在冰中,以防止它们凝胶化。使用冷培养基制备稀释的基质。根据条件准备足够的复制孔,以便在开始之前以及 hiPSC 分化过程和 hIO 类器官生成的每个阶段检测细胞。
注:本研究使用 24 孔板。请参阅 表 2 了解其他板尺寸的推荐涂层体积。 - 对于每种类型的基质,在 50 mL 锥形管中制备含有 15 mM HEPES 的 25 mL 冷提前 DMEM/F-12。把它们放在冰上。
- 将解冻的基质加入各自的冷推进 DMEM/F-12 中,并充分混合。在混合过程中保持介质低温。目视检查混合是否均匀,确保没有结块。
- 立即使用稀释的基质溶液包被选用于的每个孔(如果使用 24 孔板,则为 250 μL/孔)。
- 轻轻倾斜培养器皿,使涂层溶液均匀地铺在表面上。使用前在室温(15 - 25°C)下孵育至少1小时。
注意:如果不立即使用,板可以在包被后在 2 - 8 °C 下储存长达 1 周,但必须用透明薄膜密封以防止蒸发。使用储存的板时,让它们达到室温(15-25°C)30分钟,然后再进行下一步。 - 使用血清移液管或抽吸轻轻去除多余的溶液。确保涂层表面没有被划伤。
- 立即加入温热的完全干细胞培养基(特定孔所需总体积的 50%,例如,如果使用 24 孔板,则为 250 μL/孔)。
- 在开始之前准备以下内容:解冻和处理时,始终将基质保持在冰中,以防止它们凝胶化。使用冷培养基制备稀释的基质。根据条件准备足够的复制孔,以便在开始之前以及 hiPSC 分化过程和 hIO 类器官生成的每个阶段检测细胞。
- 用 Matrix 4-XE 水凝胶包被组织培养塑料
- 开始前准备以下内容:将 Matrix 4-XE 水凝胶从冰箱中取出,使其加热至室温 (25 °C)。根据条件准备足够的复制孔,以便在开始之前以及 hiPSC 分化过程和 hIO 类器官生成的每个阶段检测细胞。
注:本研究使用 24 孔板。请参阅 表 3 了解其他板尺寸的推荐涂层体积。 - 与用于干细胞培养的标准配方(3x 干细胞培养基)相比,制备含有 3 倍生长因子浓度的完整干细胞培养基。
- 以 2:1 v/v 混合比混合 Matrix 4-XE 水凝胶和 3x 干细胞培养基,轻轻上下移液 5x-10x 以充分混合。
- 将水凝胶混合物转移到孔板中,并小心地倾斜培养器皿,使混合物均匀地分布在表面上。如果使用 24 孔板,则使用 250 μL/孔。有关推荐的卷,请参阅 表 3 。
- 在室温下等待 10-15 分钟以形成软凝胶。在水凝胶形成过程中,请勿通过倾斜或摇晃板来破坏水凝胶。
- 开始前准备以下内容:将 Matrix 4-XE 水凝胶从冰箱中取出,使其加热至室温 (25 °C)。根据条件准备足够的复制孔,以便在开始之前以及 hiPSC 分化过程和 hIO 类器官生成的每个阶段检测细胞。
- hiPSC 无酶团块传代和接种
- 开始前准备以下内容:在传代前至少 1 小时,用基质涂覆所需的塑料器皿。分装足够的完全干细胞培养基,并加热至室温(15-25°C)。避免对整个介质进行多次加热循环。
注:以下步骤描述了在 6 孔板上传代已经建立且 >90% 汇合的 iPSC 培养物,并将它们接种在 24 孔板中以分化肠道类器官。 - 用 1 mL D-PBS(不含 Ca++ 和 Mg++)冲洗细胞并吸出。加入 1 mL 无酶人多能干细胞选择试剂,小心旋转均匀扩散,并在 1 分钟内吸出。菌落只需要暴露在一层薄薄的液体膜中。
- 在37°C下孵育,直到菌落开始看起来不那么紧凑,这将需要~3-8分钟。
注:最佳孵育时间可能因所用细胞系而异。在首次使用无酶人多能干细胞选择试剂对每个细胞系进行传代时,必须确定最佳孵育时间。 - 加入 1 mL 完全干细胞培养基。小心地用力敲击板的一侧,分离菌落。确保用另一只手握住盘子。
- 使用 1 mL 或更大的移液管,将细胞团块悬浮液转移到 15 mL 锥形管中。使用明场显微镜评估团块的大小,并确保细胞团块的大小在50-200μm之间;如果它们较大,轻轻摇晃锥形管以将它们分解。
- 在平底 96 孔板的每个孔的底部绘制一个 x-y 网格,该网格将用于团块计数,并向每个孔中加入 50 μL D-PBS。建议对 3 个孔计数的团块进行平均。
- 轻轻摇晃试管,确保细胞团块均匀分布,然后将 5 μL 团块悬浮液转移到平底 96 孔板的每个孔中。
注意:不建议使用自动细胞计数仪来计数团块。建议进行手动计数。 - 计算每个孔中直径为50-200μm的团块总数。如果大多数细胞团块的直径>200μm(见 图1),则重复步骤1.4.5-1.4.7。
- 计算接种 6,000 个团块所需的团块悬浮液体积(以 μL 为单位),如下所示:
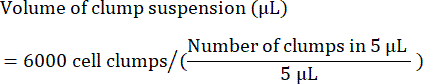
注意:必须对每种细胞系优化最佳接种密度。为了确定最佳接种密度,建议在一定的团块密度范围内进行初始接种(例如,每孔 4,000、5,000 和 6,000 个团),并在接种后 24-48 小时检查是否达到 85%-90% 汇合度。 - 作为质量控制,分离细胞样本进行干细胞标志物的流式细胞术检查。有关常见标记的列表,请参阅 表 4 。
- 将所需体积的 iPSC 团块悬浮液分离到涂有不同 ECM 的孔中,以接种到单独的 15 mL 管中。
- 将含有iPSC团块溶液的试管以200× g 离心5分钟,以除去含有无酶人多能干细胞选择试剂的培养基。在等待离心时,如果尚未离心,则向每个孔中添加每孔所需体积的 50%。
- 开始前准备以下内容:在传代前至少 1 小时,用基质涂覆所需的塑料器皿。分装足够的完全干细胞培养基,并加热至室温(15-25°C)。避免对整个介质进行多次加热循环。
- 在含有动物源性基质的平板中培养 iPSC
- 轻轻地将 iPSCs 团块重悬于 50% 计算体积的完全干细胞培养基中,以获得所需的密度,并将细胞聚集体混合物铺板到含有 50% 计算完全干细胞培养基的包被孔中。
注意:对于某些细胞系或当团块为 50 μm 或更小时,可能需要添加 ROCK-1 抑制剂。建议添加<10μm,以避免早期原肠胚形成。 - 小心地添加基质顶部含有细胞的培养基,如果使用 24 孔板,则为 250 μL/孔。有关其他尺寸孔板的推荐细胞培养基体积,请查看 表 2。
- 以几次短的来回和左右运动倾斜板,以均匀分布细胞团块。
注意:聚集体分布不均匀导致人类 iPSC 的自发分化增加。团块悬浮液的圆形扩散导致团块在孔的边界上聚集,而在中心处的密度较低。 - 将板在37°C下孵育,并每天或每隔一天使用完全干细胞培养基进行培养基更换。在进行培养基更换时,目视评估培养物以监测生长并确定细胞是否需要传代时间或是否准备好分化。要跳过连续两天的饲喂,请添加一天所需培养基体积的 2 倍。
- 轻轻地将 iPSCs 团块重悬于 50% 计算体积的完全干细胞培养基中,以获得所需的密度,并将细胞聚集体混合物铺板到含有 50% 计算完全干细胞培养基的包被孔中。
- 在含有基质 4-XE 的平板中培养 iPSC
- 轻轻地将 iPSCs 重悬到计算出的 3 倍完全干细胞培养基的总计算体积中,以获得所需的密度。
- 如果使用 24 孔板,则小心地将细胞放在水凝胶顶部 250 μL/孔。有关其他尺寸孔板的推荐细胞培养基体积,请查看 表 3。
注意:水凝胶会膨胀并占据比新鲜制成的更大的体积。iPSC菌落将部分嵌入板底部的水凝胶中,因此建议在不干扰水凝胶的情况下更换50%-80%的顶部培养基。 - 以几次快速、短时间、来回和左右运动移动板,以均匀分布细胞团块。
- 将板置于37°C培养箱中,具有5%CO2 和95%湿度。使用完全干细胞培养基更换细胞培养基。每天或每隔一天进行培养基更换;对于后者,添加培养基体积的 2 倍。
- 目视检查培养物,以跟踪其生长,因为它们达到适合分化的阶段。
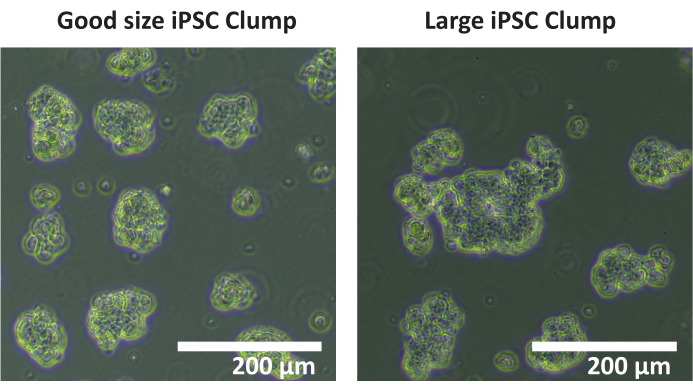
图 1:最佳团块尺寸。 iPSC细胞系SCTi003A的团块图像描绘了最佳团块大小的示例。比例尺 = 200 μm. 请点击这里查看此图的较大版本.
2. hiPSC分化和肠道类器官生成
注意:所有工作均在生物安全柜 (BSC) 中按照标准无菌技术完成。必须遵守 OSHA 实验室安全标准,包括正确使用实验室外套、手套和护目镜等个人防护设备。
- 在开始之前准备以下内容:准备每个阶段所需的分化培养基的等分试样。解冻等分试样后,请立即使用。不要重新冷冻。按照 表 5 了解 24 孔板所需的每个阶段培养基类型和体积的一般指南。
注:每个分化阶段的最佳时间可能因细胞系而异。建议检查每个阶段细胞标志物的表达,以提高分化效率。本研究未包括对 iPSCS 培养物上基因表达的定期评估,因为我们在低传代中使用了供应商合格的批次,但建议将其作为后续分化步骤中新的/尚未合格的 iPSC 系的质量控制步骤。 - 第 1 阶段:确定性内胚层 (DE)
- 要评估开始区分的准备情况,请检查以下条件。
- 使用显微镜,评估干细胞集落的汇合度和培养物中自发分化的量。不要仅仅依赖形态学评估。最佳汇合度应在 85%-90% 之间(高于 ~105 个细胞/cm2),观察到的最小自发分化应为 <5% 分化。
- 从牺牲孔中收集细胞,用于流式细胞术表征hiPSC标记物,然后再进行下一步。前向和侧向散射门控策略用于代表性的流式细胞术表征。如果细胞满足最佳标准,则开始分化。细胞通过标准是理想情况下 3 个标记物的 >85% 表达(表 4),尤其是在实验室中出现新的/尚未合格的 iPSC 系的情况下。
注:在不同基质上生长的 iPSC 培养物经历相同的整个过程,仅在基质 4-XE 上 iPSC 生长,需要更温和的培养基更换以不干扰半包埋细胞。在诱导确定性内胚层期间,预计会出现显着的细胞死亡,因为细胞在此阶段特别敏感。在更换培养基时要谨慎,旨在尽可能减少细胞暴露在37°C孵育环境之外的持续时间。
- 如下所述开始细胞集落的分化。
- 第 0 天:将等分试样的 DE 培养基加热至 37 °C。 为避免培养基因加热-冷却循环而变性,请确保仅加热第 0 天所需的体积(0.7 mL/孔)。
- 从hiPSC中吸出培养基。小心地将 0.7 mL DE 培养基添加到孔的一侧。避免使用可能使菌落分离或损坏的苛刻移液。将板在37°C,5%CO2 和95%湿度下孵育24小时。
- 第 1 天:将仅包含第 1 天所需体积(0.5 mL/孔)的 DE 培养基等分试样加热至 37 °C。 从细胞中吸出 DE 培养基,并小心地在孔的一侧每孔加入 0.5 mL DE 培养基。在37°C,5%CO2 和95%湿度下孵育24小时。
- 第 3 天:细胞已准备好进行检测,以确定内胚层的形成。请参阅 表 4 了解推荐的标记。在进行下一阶段之前,牺牲一个孔来对与 DE 相关的特定标记物进行流式细胞术表征。前向和侧向散射门控策略用于代表性的流式细胞术表征。建议检查 1 个以上标记物的表达,尤其是在实验室中出现新的/尚未合格的 iPSC 系的情况下。
- 要评估开始区分的准备情况,请检查以下条件。
- 第 2 阶段:中肠/后肠 (MH)
- 第 3 天:仅将第 3 天所需的 MH 培养基体积(0.5 mL/孔)加热至 15 - 25 °C。 从细胞中吸出 DE 培养基,并用 0.5 mL MH 培养基替换。在37°C,5%CO2 和95%湿度下孵育24小时。
- 第 4 - 9 天:在每日培养基更换之前,使用 2 倍或 4 倍放大倍率的显微镜通过检查可见的 3D 结构来评估球体的形成(可能从第 4 天开始发生);自由漂浮的球状体(可能从第 5 天开始发生)。
- 一旦球状体开始分离,使用 1 mL 移液器将培养基轻轻地从细胞转移到无菌的 15 mL 锥形管中,以评估从细胞中分离的球状体数量。
注意:避免任何可能将 3D 结构从单层中分离的剪切力;一旦准备好,球体将自行分离。 - 如果分离的球体少于 50 个,则以 200 x g 离心 5 分钟,除去旧培养基,并将球状体重悬于 0.5 mL/孔培养基上,并转移到相应的孔中,直到足够的球体成熟。
注意:暴露于中肠/后肠培养基的持续时间在确定发育中的小肠类器官的区域同一性方面起着至关重要的作用,例如十二指肠(较短的暴露)或回肠(较长的暴露)。为了获得具有相同特性的更均匀的培养物,旨在同时收集暴露于中肠/后肠培养基的球状体。 - 重复步骤 2.3.3,直到分离出足够的球状体以嵌入并启动人肠道类器官 (hIO) 培养。
- 在进行下一阶段之前,分离球状体样本,并对与中肠/后肠 (MH) 相关的特定标记物进行流式细胞术表征。前向和侧向散射门控策略用于代表性的流式细胞术表征。有关常用标记的列表,请参阅 表 4 。建议检查 1 个以上标记物的表达,尤其是在实验室中出现新的/尚未合格的 iPSC 系的情况下。
- 第 3 阶段:球状体嵌入
- 在开始该过程之前,请准备以下内容。
- 在冰上解冻基质 1-ABO 和基质 3-ABO 的等分试样。如果每个圆顶需要 30-40 μL 基质,请考虑收集的球状体数量,以确定所需的基质总量。
- 制备含有 15 mM HEPES 的 25 mL 冷 Advance DMEM/F-12。高浓度 ECM 是粘稠的,难以移液。将一盒无菌100μL移液器吸头置于-20°C,用于制备有助于该过程的冷吸头。准备肠道类器官生长培养基 (OGM) 的等分试样,需要 4 次补料(每次补料 0.5 mL/孔)。准备工作见 表5 。
- 在冰上解冻 OGM 补充剂的等分试样。解冻等分试样后,请立即使用。不要重新冷冻。将完整的OGM在2-8°C下储存长达2周。
- 制备含有3倍补充剂的OGM与标准制剂(3x OGM)相比。将 Matrix 4-XFO1 认为 Matrix 4-XFO4 从冰箱中取出,让它们加热至室温 (25 °C)。
- 对于动物源性系统,请执行下述步骤。
- 将无菌24孔组织培养板置于培养箱中,加热至37°C,同时制备球状体和基质。让收集的球体沉降到 15 mL 锥形管的底部。小心地吸出并弃去上清液。
注意:为了更准确地比较基质的影响,请确保在单独的试管中保持从hiPSC收集的球体在每个基质上区分。 - 向球状体中加入 1 mL DMEM/F-12 和 15 mM HEPES。在室温(15-25°C)下以300× g 离心5分钟。
- 小心地去除尽可能多的上清液。建议使用 1 mL 移液器开始移除,然后切换到 100 μL 甚至 10 μL 移液器,以尽可能去除,而不会干扰球状体颗粒。
注意:剩余的介质体积越大,基质的稀释程度就越高。稀释的基质会导致胶凝问题或更柔软的圆顶。较软的穹顶导致更高的坍塌机会,而干扰最小。 - 使用带有冷 100 μL 移液器吸头的移液器,将 40 μL/50 个冷 (2 - 8 °C) 基质 1-ABO 或基质 3-ABO 球体添加到各自的试管中。通过上下移液 ~5 次,将球状体轻轻地分配到基质中。请勿完全清空移液器吸头,否则可能会产生气泡。
- 从培养箱中取出板,并使用冷移液器吸头,按照 图 2 中的步骤将嵌入的球状体轻轻地转移到板的中心。避免将基质 1-ABO 和基质 3-ABO 过快地分配到培养皿中,因为这会使圆顶变平。
- 小心地将板转移到37°C培养箱中,孵育30分钟以确保圆顶凝胶化。在运输过程中和在培养箱中,要特别小心任何摇晃或剧烈移动。
- 在孵育圆顶进行胶凝时,在37°C下加热足够体积的肠道OGM(0.5mL /孔)以用于要使用的孔数。
注意: 仅加热所需的体积。避免加热-冷却循环。在将介质添加到圆顶之前,请确保介质是温暖的;冷介质会导致圆顶坍塌。 - 30 分钟后,小心地将 0.5 mL 肠道 OGM 添加到孔的一侧,以免干扰圆顶。在37°C,5%CO2 和95%湿度下孵育。每 3 - 4 天更换一次全培养基,去除培养基,然后添加新鲜培养基。
- 将无菌24孔组织培养板置于培养箱中,加热至37°C,同时制备球状体和基质。让收集的球体沉降到 15 mL 锥形管的底部。小心地吸出并弃去上清液。
- 对于 Matrix 4-XF 类器官系统,请按照所述步骤操作。
注:基质 4-XF 类器官系统包括四种不同的选项 (O1-O4);每种类型的配方在生物功能配体、刚度和降解性方面都有所不同。因此,建议进行初始实验以确定特定应用的最佳类型。该协议描述了使用四个选项来找到 hiPSC 衍生的肠道类器官的最佳制剂。此外,虽然可以使用多种培养方案(例如,3D封装、圆顶封装),但该协议涉及使用圆顶方法,以便可以直接与处理动物源性基底膜系统时使用的常用方法进行比较。- 将 1 mL/孔含有 16 mM HEPES 的冷推进 DMEM/F-12 添加到基质 4-XFO4 系统上生成的球状体中。在室温(15-25°C)下以300× g 离心5分钟。
注意:要找到应用的最佳配方,请确保在离心前将球状体分配到 4 个单独的管中。在动物源性基质上生成的球状体也可以使用该系统成熟为肠道类器官。 - 使用 1 mL 移液器,在不干扰球状体的情况下去除上清液。向球状体沉淀(~100 个球状体)中加入 50 μL 3x OGM。将 100 μL 选定的基质 4-XFO 加入 50 μL 球状体悬浮液中,轻轻混合 5x-10x 次。将基质 4-XFO 保持在 3x OGM 的混合比下,混合比为 2:1 v/v,最终浓度为 1x。
- 将 40 μL 水凝胶-球状体混合物加入 24 孔组织培养板的中心。小心地将板转移到37°C培养箱中并孵育30分钟。
注意:基质 4-XFO 不需要 37 °C 孵育即可凝胶化;然而,与需要 37 °C 以获得更好的圆顶凝胶化的基质 1-ABO 和基质 3-ABO 系统相比,建议将类器官暴露在类似的条件下。 - 30 分钟后,小心地将 0.5 mL 肠道 OGM 添加到孔的一侧,以免干扰圆顶。在37°C,5%CO2 和95%湿度下孵育。每 3 - 4 天更换一次全培养基,去除培养基,然后添加新鲜培养基。
- 将 1 mL/孔含有 16 mM HEPES 的冷推进 DMEM/F-12 添加到基质 4-XFO4 系统上生成的球状体中。在室温(15-25°C)下以300× g 离心5分钟。
- 在开始该过程之前,请准备以下内容。
- hIO传代和成熟
- 制备与步骤 2.4.1 中相同的化学品、溶液和试剂。
- 将 1-2 mL 抗粘附冲洗液加入 15 mL 锥形管中(每种条件 1 个),并涡旋以涂覆管。
- 取出抗粘附溶液,用 5 mL D-PBS(不含 Ca++ 和 Mg++)冲洗试管。盖上所有涂层管的盖子,并将它们保持在室温(15-25°C)下,直到需要。
- 从圆顶中吸出培养基。使用 1 mL 移液管,将 1 mL 冷 DMEM/F-12 直接加入圆顶。目标是将圆顶从板上分离下来。
- 向孔中再加入 1 mL 冷 DMEM/F-12,并上下移液以收获任何剩余的类器官。转移到包被的 15 mL 锥形管中。
注意:通过在显微镜下目视检查孔来验证类器官的成功收获。如果观察到任何残留的类器官,请重复步骤 2.5.5。 - 使用 1 mL 移液器,对悬浮液进行上下移液以崩解类器官,直到获得具有所需类器官大小(例如,100 - 500 μm)的均匀片段悬浮液。
注:使用 200 μL 移液器验证类器官是否符合推荐大小。使用 200 μL 移液器可根据需要进行额外的碎片分析,确保碎片可以顺利通过 200 μL 移液器吸头。
注意:避免通过苛刻或长时间的移液将片段分解成单细胞。 - 通过计数片段或采用分裂率来确定所需的类器官密度。分离等分试样,并使用与步骤 1.4.6-1.4.9 中相同的步骤进行计数,以进行团块计数。
注意:最佳类器官密度应针对每行进行优化;通常,建议每个圆顶的密度为 40 - 80 个肠道类器官。 - 确保在类器官计数过程中将试管放在冰上。大约 5 分钟后,由于重力,类器官片段将沉降到管的底部。
注意:类器官溶液的体积越大,沉降到底部所需的时间就越长。 - 轻轻地去除尽可能多的上清液和在类器官顶部形成的浑浊层。在类器官成熟的早期传代中,这种混浊阶段包含基质和单个细胞。
- 通过直接移液到沉淀上加入 2 mL 冷 DMEM/F-12。在室温(15-25°C)下以200× g 离心5分钟。
- 对于动物源性系统,请按照步骤 2.4.2.4-2.4.2.9 中描述的相同步骤小心地去除并丢弃上清液。
- 对于 Matrix 4-XFO 系统,请按照步骤 2.4.3.2-2.4.3.4 中描述的相同步骤小心地去除并丢弃上清液。
注:使用 Matrix 4-XFO 系统时,建议使用无异种成分的水凝胶类器官回收溶液,以最佳方式去除水凝胶残留物。当从动物基水凝胶系统切换到无异种物质时,特别推荐使用这种回收溶液,以确保消除任何异种物质。
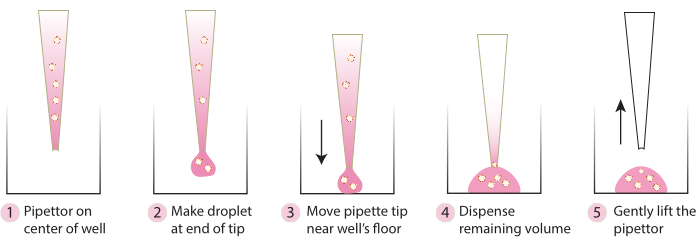
图2.推荐用于圆顶形成的技术示意图。 该原理图描述了为成功形成所有系统而推荐的分步过程。 请点击这里查看此图的较大版本.
3. IO尺寸表征
注:类器官的大小通过以 4 倍和 10 倍拍摄的明场图像进行表征。图像处理分析使用MATLAB实现自动化。下面介绍了该过程的整体步骤, 补充文件 1 中包含了代码示例。
- 定义包含图像的目录,并列出目录中的所有图像文件。初始化表以存储结果。读取文件中的明场图像。
- 定义像素到微米的转换并设置刻度。如果图像不包含比例尺,请向用户请求像素到 μm 的转换因子。
- 将图像转换为灰度。应用高斯滤波器以减少图像中的噪声。对过滤后的图像设置阈值,以将类器官与背景分离。
- 填充小孔并移除小物体以清理二进制图像。执行连接成分分析以识别单个类器官并计算其属性,例如面积、质心、长轴长度和短轴长度。
- 根据长轴和短轴长度计算类器官大小。在原始图像上显示分割的类器官,并用它们的大小标记它们。打印类器官大小并将结果存储在 .cvs 文件中。
注意:前几张图像是手动分析的,以确定高斯滤波器标准差和到阈值的面积的最佳参数。 补充文件 1 中的代码提供了从明场图像中分析类器官大小的基本框架示例;但是,需要进一步改进,以适应每种图像类型和质量的特定要求。可以使用开源软件(例如Image J中的FIJI)来完成相同的过程。 - 请按照以下步骤使用FIJI软件。
- 定义像素到微米的转换并设置刻度。如果图像不包含比例尺,则通过单击“ 分析”>“设置比例”向用户请求像素到 μm 的转换因子。
- 通过单击 “图像”>键入 8 位>将图像转换为灰度。应用高斯滤波器以减少图像中的噪声,方法是单击“ 处理>滤镜”>高斯简介>使用的西格玛(半径):2。
- 通过单击“ 图像>阈值> MaxEntropy > 应用,对过滤后的图像进行阈值,以将类器官与背景分离。
- 通过单击“ 处理>噪点”>“删除 20 像素>的异常值”来填充小孔并删除小对象以清理二进制图像。
- 执行连接分量分析以识别单个类器官并计算其属性,例如面积、质心、长轴长度和短轴长度,方法是单击“ 分析”>“设置测量>确保”分析“、”周长“和”直径“包含在”分析“>”分析粒子“>”显示轮廓“>。
- 统计分析
- 使用 JMP (SAS) 软件通过 Saphiro-Wilk 检验评估数据的正态性分布。为了检查组间的统计差异,执行双向方差分析,并使用JMP(SAS)软件中的非参数Wilcoxon方法进行事后检验。显著性是在 p ≤ 0.05 的 alpha 水平上建立的。
Access restricted. Please log in or start a trial to view this content.
结果
按照该方案,成功地利用市售的基底膜和无异种水凝胶系统来培养hiPSC细胞并将它们分化为hIO。这些实验的主要目的是系统地评估来自各种来源的基质对hiPSC和hIO工作的等效性。该协议的第一部分侧重于维持和表征健康的 iPSC 培养物,该培养物可产生有效的肠道类器官。描述了用动物源性基质基质 Matrix 1-AB、Matrix 2-AB 和 Matrix 3-AB 包被培养皿的过程,并与无异种水凝胶系统 Matrix 4-XF 进行了比较。
...Access restricted. Please log in or start a trial to view this content.
讨论
在将这些平台用于广泛的应用时,为干细胞和类器官工作选择最佳微环境是关键的早期步骤。我们的代表性结果表明,基质 4-XFO3 与更高浓度的生长因子相结合,可产生更大的类器官,这表明可以利用无异种水凝胶的物理特性来优化使用这些系统的类器官生成。先前已经表明,细胞外基质 (ECM) 的独特特性与器官12 内细胞的身份密切相关。由于细胞通过整合素和其他受体感知外...
Access restricted. Please log in or start a trial to view this content.
披露声明
John Huang博士是TheWell Bioscience的创始人兼首席执行官。
致谢
作者感谢 Christina Pacak、Silveli Susuki-Hatano 和 Russell D'Souza 博士之前关于开始 hiPSC 和类器官工作的培训和一般建议。他们感谢 Chelsey Simmons 博士在使用水凝胶系统进行 体外 细胞培养工作方面的指导。此外,作者还要感谢 STEMCELL Technologies 的 Christine Rodriguez 博士和 Thomas Allison 博士对 hiPSC 培养的指导。作者还感谢TheWell Bioscience支付了出版费用。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 24-Well Plate (Culture treated, sterile) | Falcon | 353504 | |
| 37 °C water bath | VWR | ||
| 96-well plate | Fisher Scientific | FB012931 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| Anti-adherence Rinsing Solutio | STEMCELL Technologies | 7010 | |
| Biological safety cabinet (BSC) | Labconco | Logic | |
| Brightfield Microscope | Echo Rebel | REB-01-E2 | |
| BXS0116 | ATCC | ACS-1030 | |
| Centrifuge with temperature control (4 °C capabilities) | ThermoScientific | 75002441 | |
| Conical tubes, 15 mL, sterile | Thermo Fisher Scientific | 339650 | |
| Conical tubes, 50 mL, sterile | Thermo Fisher Scientific | 339652 | |
| Cultrex RGF BME, Type 2 | Bio-techne | 3533-005-02 | |
| Cultrex Stem Cell Qualified RGF BME | Bio-techne | 3434-010-02 | |
| D-PBS (Without Ca++ and Mg++) | Thermo Fisher Scientific | 14190144 | |
| GeltrexLDEV-Free, hESC-Qualified Reduce Growth Factor | Gibco | A14133-02 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Guava Muse Cell Analyzer or another flow cytometry equipment (optional) | Luminex | 0500-3115 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Heralcell Vios Cell culture incubator (37 °C, 5% CO2) | Thermo Scientific | 51033775 | |
| JMP Software | SAS Institute | JMP 16 | |
| MATLAB | MathWorks, Inc | R2022b | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix LDEV free | Corning | 356231 | |
| Matrigel Matrix High Concentration (HC), Growth Factor Reduced (GFR) LDEV-free | Corning | 354263 | |
| mTeSR Plus Medium | STEMCELL Technologies | 100-0276 | |
| Nunclon Delta surface treated 24-well plate | Thermo Scientific | 144530 | |
| PE Mouse Anti-human CD326 (EpCAM) | BD Pharmingen | 566841 | |
| PE Mouse Anti-human CDX2 | BD Pharmingen | 563428 | |
| PE Mouse Anti-human FOXA2 | BD Pharmingen | 561589 | |
| PerCP-Cy 5.5 Mouse Anti-human SSEA4 | BD Pharmingen | 561565 | |
| ReLeSR | STEMCELL | 5872 | |
| SCTi003-A | STEMCELL Technologies | 200-0510 | |
| Serological pipettes (10 mL) | Fisher Scientific | 13-678-11E | |
| Serological pipettes (5 mL) | Fisher Scientific | 13-678-11D | |
| STEMdiff Intestinal Organoid Growth Medium | STEMCELL Technologies | 5145 | |
| STEMdiff Intestinal Organoid Kit | STEMCELL Technologies | 5140 | |
| Vitrogel Hydrogel Matrix | TheWell Bioscience | VHM01 | |
| VitroGel ORGANOID Discovery Kit | TheWell Bioscience | VHM04-K |
参考文献
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. J Cell Sci. 123, Pt 24 4195-4200 (2010).
- Hinz, B., Gabbiani, G. Fibrosis: Recent advances in myofibroblast biology and new therapeutic perspectives. F1000 Biol Rep. 2, 78(2010).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 15 (12), 1243-1253 (2014).
- Rozario, T., DeSimone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol. 341 (1), 126-140 (2010).
- Even-Ram, S., Artym, V., Yamada, K. M. Matrix control of stem cell fate. Cell. 126 (4), 645-647 (2006).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Tran, O. N., et al. Organ-specific extracellular matrix directs trans-differentiation of mesenchymal stem cells and formation of salivary gland-like organoids in vivo. Stem Cell Res Ther. 13 (1), 306(2022).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., et al. Tissue geometry drives deterministic organoid patterning. Science. 375 (6576), (2022).
- Heo, J. H., Kang, D., Seo, S. J., Jin, Y. Engineering the extracellular matrix for organoid culture. Int J Stem Cells. 15 (1), 60-69 (2022).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15 (10), 647-664 (2014).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Huch, M., et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494 (7436), 247-250 (2013).
- Greenlee, A. R., Kronenwetter-Koepel, T. A., Kaiser, S. J., Liu, K. Comparison of Matrigel and gelatin substrata for feeder-free culture of undifferentiated mouse embryonic stem cells for toxicity testing. Toxicol In Vitro. 19 (3), 389-397 (2005).
- Geltrex LDEV-Free, HESC-Qualified, Reduced Growth Factor Basement Membrane Matrix User Guide (Pub.No. MAN0007336 3.0. Fisher Scientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.cn/TFS-Assets%2FLSG%2Fmanuals%2FGeltrex_LDEV_Free_hESC_qualified_PI.pdf (2024).
- biotechne R&D Systems. Cultrex Stem Cell Qualified Reduced Growth Factor. biotechne R&D Systems. , (2024).
- VitroGel Organoid Protocol. TheWell Bioscience. , Available from: https://www.thewellbio.com/video-protocols (2024).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Henderson, J. K., et al. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 20 (4), 329-337 (2002).
- Haruna, N. F., Huang, J. Investigating the dynamic biophysical properties of a tunable hydrogel for 3D cell culture. J Cytol Tissue Biol. 7, 30(2020).
- Cherne, M. D., et al. A synthetic hydrogel, VitroGel ORGANOID-3, improves immune cell-epithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells. Front Pharmacol. 12, 707891(2021).
- Stewart, D. C., et al. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 13, e0200377(2018).
- Hernandez-Gordillo, V., et al. Fully synthetic matrices for in vitro culture of primary human intestinal enteroids and endometrial organoids. Biomaterials. 254, 120125(2020).
- Broguiere, N., et al. Growth of epithelial organoids in a defined hydrogel. Adv Mater. 30, 1801621(2018).
- Barthes, J., et al. Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: The recent advances. BioMed Res Int. 2014, 921905(2014).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nat Rev Mater. 5 (7), 539-551 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。