JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 줄기세포 유지와 장 오가노이드 생성을 위한 기저막 매트릭스의 비교 연구
요약
오가노이드는 질병 모델링을 위한 유용한 도구가 되었습니다. 세포외 기질(ECM)은 오가노이드 생성 중 세포의 운명을 안내하며, 자연 조직과 유사한 시스템을 사용하면 모델 정확도를 향상시킬 수 있습니다. 이 연구는 동물 유래 ECM과 무이종 하이드로겔에서 유도만능줄기세포 유래 인간 장 오가노이드의 생성을 비교합니다.
초록
세포외 기질(ECM)은 세포의 행동과 발달에 중요한 역할을 합니다. 인간 유도 만능 줄기 세포(hiPSC)에서 생성된 오가노이드는 많은 연구 분야에서 주목을 받고 있습니다. 그러나 기존 세포 배양 물질에는 생리학적 단서가 부족하여 효율적인 iPSC 분화를 방해합니다. 상업적으로 이용 가능한 ECM을 줄기 세포 배양에 통합하면 세포 유지 관리에 유용한 물리적, 화학적 단서를 얻을 수 있습니다. 동물 유래 상업적으로 이용 가능한 기저막 제품은 세포 유지를 지원하는 ECM 단백질과 성장 인자로 구성되어 있습니다. ECM은 세포의 운명을 조절할 수 있는 조직 특이적 특성을 가지고 있기 때문에 이종이 없는 매트릭스는 임상 연구로의 번역을 스트리밍하는 데 사용됩니다. 상업적으로 이용 가능한 매트릭스는 hiPSC 및 오가노이드 작업에 널리 사용되지만 이러한 매트릭스의 동등성은 아직 평가되지 않았습니다. 여기에서는 Matrigel(Matrix 1-AB), Geltrex(Matrix 2-AB), Cultrex(Matrix 3-AB) 및 VitroGel(Matrix 4-XF)의 4가지 매트릭스에서 hiPSC 유지 및 인간 장 오가노이드(hIO) 생성에 대한 비교 연구를 수행했습니다. 콜로니는 완벽하게 둥근 모양은 아니었지만 세포의 85% 이상이 줄기세포 마커 SSEA-4를 발현하는 등 자발적 분화가 최소화되었습니다. 매트릭스 4-XF는 3D 원형 덩어리를 형성했습니다. 또한, Matrix 4-XF 하이드로겔 용액을 만드는 데 사용된 배지에서 보충제 및 성장 인자의 농도를 증가시킴으로써 SSEA-4의 hiPSC 발현이 1.3배 개선되었습니다. Matrix 2-AB 유지 hiPSC의 분화는 다른 동물 유래 기저막에 비해 중기/후장 단계에서 스페로이드 방출이 더 적었습니다. 다른 것과 비교하여 무이물질 오가노이드 매트릭스(매트릭스 4-O3)는 더 크고 성숙한 hIO로 이어지며, 이는 무이물질 하이드로겔의 물리적 특성을 활용하여 오가노이드 생성을 최적화할 수 있음을 시사합니다. 전체적으로, 결과는 서로 다른 매트릭스의 구성 변화가 IO 분화 단계에 영향을 미친다는 것을 시사합니다. 이 연구는 상업적으로 이용 가능한 매트릭스의 차이점에 대한 인식을 높이고 iPSC 및 IO 작업 중 매트릭스 최적화를 위한 가이드를 제공합니다.
서문
세포외 기질(ECM)은 세포의 행동과 발달을 조절하는 데 중심적인 역할을 하는 조직의 역동적이고 다기능적인 구성 요소입니다. 복잡한 네트워크로서 구조적 지지, 세포 접착 리간드(cell adhesive ligands)1, 세포 신호 전달을 조절하는 성장 인자(growth factor) 및 사이토카인(cytokine)의 저장을 제공합니다. 예를 들어, 상처 치유 중에 ECM은 세포의 이동을 위한 골격체이자 조직 복구에 관여하는 성장 인자의 저장소 역할을 한다2. 마찬가지로, ECM의 조절 장애는 섬유증 및 암과 같은 다양한 질병의 중증도를 증가시킬 수 있습니다 3,4. 배아 발달 동안 ECM은 조직 형태 형성을 안내합니다. 예를 들어, 심장의 발달에서 ECM 구성 요소는 심장 조직의 올바른 구조와 기능을 만드는 데 중요한 역할을 한다5. 10년 이상의 연구에 따르면 미세환경의 강성만으로도 줄기세포 계통 사양을 제어할 수 있습니다 6,7. 따라서 in vitro cell differentiation에서 ECM이 분화를 위한 신호를 제공하여 줄기세포의 운명에 영향을 미치는 것은 놀라운 일이 아닙니다.
오가노이드는 유도만능줄기세포(iPSC)에서 생성할 수 있습니다. 오가노이드를 성공적으로 생성하려면 적절하게 특성화된 iPSC 라인으로 시작해야 합니다. 그러나 기존 세포 배양 물질에는 생리학적 단서가 없기 때문에 효율적인 iPSC 분화와 오가노이드 생성을 방해합니다. 더욱이, 최근의 연구는 세포외 기질(ECM)의 구성, 세포와 ECM사이의 상호 작용8, 오가노이드 확장 및 분화의 맥락에서 기계적 및 기하학적 단서(9,10,11)의 중요성을 강조하고 있다12. 재현성을 개선하여 오가노이드 기술을 발전시키려면 조직 특이적인 물리적, 화학적 단서를 통합해야 합니다.
오가노이드는 생리학적으로 유사한 미세환경 내에서 네이티브 조직을 재현하는 것을 목표로 합니다. 본래 조직 ECM을 밀접하게 모방하는 ECM 시스템을 선택하는 것은 세포의 행동, 기능 및 자극에 대한 반응에 관한 생리학적 타당성을 달성하는 데 매우 중요하다13. ECM 구성 요소의 선택은 줄기 세포가 오가노이드 내의 특정 세포 유형으로 분화하는 데 영향을 미칠 수 있습니다. 다양한 ECM 단백질과 그 조합은 세포의 운명을 안내하는 단서를 제공할 수 있다14. 예를 들어, 연구에 따르면 특정 ECM 구성 요소를 사용하면 장 줄기 세포가 성숙한 장 세포 유형으로 분화하는 것을 촉진하여 생리학적으로 관련된 장 오가노이드를 생성할 수 있습니다15. 오가노이드는 질병 모델링 및 약물 테스트 중에 유용한 도구이지만, 적절한 ECM 시스템을 선택하는 것이 이 응용 분야에서 매우 중요합니다. 적절한 ECM 시스템은 영향을 받은 조직(16)과 유사한 미세환경을 생성함으로써 질병 모델링의 정확도를 향상시킬 수 있다. 또한 조직 특이적 ECM은 질병 관련 표현형 및 약물 반응을 더 잘 요약하는 오가노이드를 생성하는 데 도움이 될 수 있습니다17. 오가노이드 분화에 사용되는 ECM 시스템을 최적화하는 것은 원하는 분화 결과를 달성하는 데 매우 중요합니다.
동물 ECM 소스(예: Matrigel, Cultrex) 및 무이종 하이드로겔(예: VitroGel)에서 파생된 상업적으로 이용 가능한 기저막 시스템은 iPSC 및 오가노이드 연구에 널리 사용됩니다. 이를 상용화하는 회사와 이를 사용하는 연구자들은 수년에 걸쳐 특정 제품과 응용 분야에 대한 많은 지침을 제시했습니다. 이러한 지침의 대부분은 이 프로토콜의 생성을 위한 가이드 역할을 했습니다. 더욱이, 그들의 내재적 특성과 관련된 이점과 단점은 많은 사람들에 의해 개별적으로 언급되어 왔다 18,19,20,21. 그러나 iPSC 및 오가노이드 작업을 위한 최적의 시스템 선택을 안내하는 체계적인 워크플로우는 없습니다. 여기에서는 iPSC 및 오가노이드 작업을 위해 다양한 소스의 ECM 시스템 동등성을 체계적으로 평가할 수 있는 워크플로우를 제공합니다. 이것은 Matrigel(Matrix 1-AB), Geltrex(Matrix 2-AB), Cultrex(Matrix 3-AB) 및 VitroGel(Matrix 4-XF)의 네 가지 다른 매트릭스에서 두 가지 다른 인간 iPSC 라인(hiPSC) 및 인간 장 오가노이드(hIO) 생성의 유지에 대한 비교 연구입니다. 오가노이드 배양의 경우 이전에 오가노이드 배양에 최적화된 이종이 없는 matrix VitroGel의 4가지 버전인 ORGANOID 1(매트릭스 4-O1), ORGANOID 2(매트릭스 4-O2), ORGANOID 3(매트릭스 4-O3), ORGANOID 4(매트릭스 4-O4)가 사용되었습니다. 또한 오가노이드에 최적화된 동물 유래 매트릭스인 Matrigel High Concentration(Matrix 1-ABO) 및 Cultrex Type 2(Matrix 3-ABO)가 사용되었습니다. 시판되는 줄기세포 배양 배지(mTeSR Plus)와 오가노이드 분화 키트(STEMdiff intestinal organoid kit)를 사용하였다. 이 프로토콜은 제품 제조업체의 개별 지침과 실험실 경험을 결합하여 판독기가 특정 iPSC 및 오가노이드 작업을 위해 ECM을 성공적으로 최적화할 수 있도록 안내합니다. 이 프로토콜과 대표적인 결과는 줄기세포 작업과 오가노이드 분화를 위한 최적의 미세환경 선택의 중요성을 강조합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. hiPSC 유지 보수
주의 : 모든 작업은 표준 무균 기술에 따라 생물 안전 캐비닛 (BSC)에서 수행됩니다. 실험실 가운, 장갑 및 고글과 같은 개인 보호 장비의 적절한 사용을 포함하여 실험실에 대한 OSHA 안전 표준을 따라야 합니다.
- 매트릭스, 부분 표본 및 세포 배양 배지의 준비
- 상업적으로 이용 가능한 동물 유래 기저막(BM; 매트릭스 1-AB, 매트릭스 2-AB, 매트릭스 3-AB), 표 1 에 요약된 제조업체의 권장 사항에 따라 작업 볼륨의 부분 표본을 준비하고 장기 보관을 위해 -20°C 또는 -80°C에서 보관합니다. 거품이 형성되지 않도록 하십시오. 일부 기포가 형성된 경우 보관하기 전에 샘플을 4°C, <200 x g 에서 ~1-2분 동안 원심분리하여 기포가 표면으로 나오도록 합니다.
참고: 일회용 부분 표본을 만들면 ECM 아키텍처를 방해하는 반복적인 동결-해동 주기를 방지하는 데 도움이 됩니다. BM 농도는 로트 번호에 따라 다르기 때문에 제조업체의 권장 사항에 따라 일회용 부분 표본을 준비하고 코팅 용액을 만들어야 합니다. 고농축 BM은 점성이 있고 피펫팅이 어렵습니다. 이전에 -20 °C에서 보관했던 콜드 팁을 사용하십시오. - 제조업체의 권장 사항에 따라 줄기 세포 배양 배지를 준비합니다. 이 프로토콜에 사용되는 상업적으로 이용 가능한 특정 완전한 배지를 준비하려면 400mL의 기초 배지에 5x 보충제 칵테일 100mL를 추가합니다. 그런 다음 이 배지를 철저히 혼합하고 20°C에서 보관된 40mL 용량으로 분취합니다. 사용을 위해는, 완전 배지의 각 부분 표본을 해동하거나, 분취된 완전 배지를 즉시 사용하거나, 2 - 8 °C에서 최대 2주 동안 보관하십시오. 다시 얼리지 마십시오.
- 보충제 칵테일 농도의 3배를 함유한 줄기세포 완전 배지의 부분 표본을 준비하여 Matrix 4-XE 하이드로겔을 제조합니다. 즉, 5배 보충제를 3배로 희석합니다.
- 상업적으로 이용 가능한 동물 유래 기저막(BM; 매트릭스 1-AB, 매트릭스 2-AB, 매트릭스 3-AB), 표 1 에 요약된 제조업체의 권장 사항에 따라 작업 볼륨의 부분 표본을 준비하고 장기 보관을 위해 -20°C 또는 -80°C에서 보관합니다. 거품이 형성되지 않도록 하십시오. 일부 기포가 형성된 경우 보관하기 전에 샘플을 4°C, <200 x g 에서 ~1-2분 동안 원심분리하여 기포가 표면으로 나오도록 합니다.
- 동물 유래 BM으로 조직 배양 플라스틱 코팅(매트릭스 1-3AB)
- 시작하기 전에 다음을 준비하십시오: 해동 및 취급 시 매트릭스가 겔화되는 것을 방지하기 위해 항상 얼음 속에 보관하십시오. 차가운 매체를 사용하여 희석된 매트릭스를 준비합니다. hiPSC 분화 과정 및 hIO 오가노이드 생성을 시작하기 전과 모든 단계에서 세포를 분석할 수 있도록 조건별로 충분한 복제 웰을 준비합니다.
참고: 여기에서는 이 연구에 24웰 플레이트가 사용되었습니다. 다른 플레이트 크기에 대한 권장 코팅량에 대해서는 표 2 를 참조하십시오. - 각 유형의 매트릭스에 대해 50mL 원뿔형 튜브에 15mM HEPES를 포함하는 25mL의 콜드 어드밴스 DMEM/F-12를 준비합니다. 이것을 얼음 위에 보관하십시오.
- 해동된 매트릭스를 각각의 Cold Advance DMEM/F-12에 추가하고 잘 섞습니다. 혼합 과정에서 매체를 차갑게 유지하십시오. 덩어리가 없는지 확인하여 균일한 혼합을 육안으로 확인합니다.
- 즉시 희석된 매트릭스 용액을 사용하여 사용하기 위해 선택한 각 웰을 코팅합니다(24개의 웰 플레이트를 사용하는 경우 250μL/웰).
- 코팅 용액이 표면 전체에 고르게 펴지도록 배양기를 부드럽게 기울입니다. 사용하기 전에 실온 (15 - 25 °C)에서 최소 1 시간 동안 배양하십시오.
참고: 즉시 사용하지 않을 경우 코팅 후 최대 1주일 동안 2 - 8 °C에서 보관할 수 있지만 증발을 방지하기 위해 투명 필름으로 밀봉해야 합니다. 보관된 플레이트를 사용할 때는 다음 단계로 진행하기 전에 30분 동안 실온(15 - 25 °C)에 도달하도록 하십시오. - 혈청학적 피펫을 사용하거나 흡인으로 여분의 용액을 부드럽게 제거합니다. 코팅된 표면이 긁히지 않았는지 확인하십시오.
- 따뜻하고 완전한 줄기 세포 배지를 즉시 추가합니다(특정 웰에 필요한 총 부피의 50%, 예: 24웰 플레이트를 사용하는 경우 250μL/웰).
- 시작하기 전에 다음을 준비하십시오: 해동 및 취급 시 매트릭스가 겔화되는 것을 방지하기 위해 항상 얼음 속에 보관하십시오. 차가운 매체를 사용하여 희석된 매트릭스를 준비합니다. hiPSC 분화 과정 및 hIO 오가노이드 생성을 시작하기 전과 모든 단계에서 세포를 분석할 수 있도록 조건별로 충분한 복제 웰을 준비합니다.
- Matrix 4-XE 하이드로겔로 조직 배양 플라스틱 코팅
- 시작하기 전에 다음을 준비하십시오: Matrix 4-XE 하이드로겔을 냉장고에서 꺼내 실온(25°C)으로 데우십시오. hiPSC 분화 과정 및 hIO 오가노이드 생성을 시작하기 전과 모든 단계에서 세포를 분석할 수 있도록 조건별로 충분한 복제 웰을 준비합니다.
참고: 여기에서는 이 연구에 24웰 플레이트가 사용되었습니다. 다른 플레이트 크기에 대한 권장 코팅량에 대해서는 표 3 을 참조하십시오. - 줄기 세포 배양을 위한 표준 제형(3x 줄기 세포 배지)과 비교하여 3x 성장 인자 농도를 포함하는 완전한 줄기 세포 배양 배지를 준비합니다.
- 매트릭스 4-XE 하이드로겔과 3x 줄기 세포 배지를 2:1 v/v 혼합 비율로 혼합하고 5x-10x 위아래로 부드럽게 피펫팅하여 완전히 혼합합니다.
- 하이드로겔 혼합물을 웰 플레이트로 옮기고 배양 용기를 조심스럽게 기울여 혼합물이 표면 전체에 고르게 펴지도록 합니다. 24웰 플레이트를 사용하는 경우 250μL/웰을 사용하십시오. 권장 볼륨은 표 3 을 참조하십시오.
- 소프트 젤이 형성될 때까지 실온에서 10-15분 동안 기다립니다. 하이드로겔 형성 과정에서 플레이트를 기울이거나 흔들어 하이드로겔을 방해하지 마십시오.
- 시작하기 전에 다음을 준비하십시오: Matrix 4-XE 하이드로겔을 냉장고에서 꺼내 실온(25°C)으로 데우십시오. hiPSC 분화 과정 및 hIO 오가노이드 생성을 시작하기 전과 모든 단계에서 세포를 분석할 수 있도록 조건별로 충분한 복제 웰을 준비합니다.
- hiPSC enzyme-free clump passaging and seeding
- 시작하기 전에 다음을 준비하십시오 : 통과하기 최소 1 시간 전에 원하는 플라스틱 용기를 매트릭스로 코팅하십시오. 충분한 완전한 줄기 세포 배지를 분취하고 실온 (15 - 25 ° C)에서 따뜻하게 합니다. 전체 매체에 대해 여러 번의 가열 주기를 피하십시오.
참고: 아래 단계는 6-웰 플레이트에서 이미 확립된 >90% 융합 배양액을 6-웰 플레이트에 전달하고 장 오가노이드의 분화를 위해 24-웰 플레이트에 파종하는 방법을 설명합니다. - 1mL의 D-PBS(Ca++ 및 Mg++ 제외)로 세포를 헹구고 흡인합니다. 효소가 없는 인간 만능 줄기세포 선택 시약 1mL를 넣고 조심스럽게 휘저어 고르게 펴지도록 한 후 1분 이내에 흡인합니다. 콜로니는 얇은 액체 막에만 노출되면 됩니다.
- 콜로니가 덜 압축된 것처럼 보이기 시작할 때까지 37°C에서 배양하며 3-8분이 소요됩니다.
참고: 최적의 배양 시간은 사용하는 세포주에 따라 다를 수 있습니다. 효소가 없는 인간 만능 줄기세포 선택 시약으로 각 세포주를 처음으로 passage할 때 최적의 배양 시간을 결정해야 합니다. - 완전한 줄기 세포 배지 1mL를 추가합니다. 플레이트 측면을 조심스럽게 두드려 콜로니를 분리합니다. 다른 손으로 접시를 잡으십시오.
- 1mL 이상의 피펫을 사용하여 세포 덩어리 현탁액을 15mL 코니컬 튜브로 옮깁니다. 명시야 현미경을 사용하여 세포 덩어리의 크기를 평가하고 세포 덩어리의 크기가 50-200 μm 사이인지 확인합니다. 더 크면 원뿔형 튜브를 부드럽게 흔들어 분해합니다.
- 덩어리 계수에 사용할 평평한 바닥 96웰 플레이트의 각 웰 바닥에 x-y 그리드를 그리고 각 웰에 50μL의 D-PBS를 추가합니다. 3개의 웰에서 계산된 덩어리의 평균을 내는 것이 좋습니다.
- 튜브를 부드럽게 흔들어 세포 덩어리가 고르게 분포되도록 한 다음 5μL의 덩어리 현탁액을 평평한 바닥 96웰 플레이트의 각 웰로 옮깁니다.
참고: 자동 셀 카운터를 사용하여 덩어리를 계산하는 것은 권장되지 않습니다. 수동 계산이 권장됩니다. - 각 웰에서 직경이 50 - 200 μm인 덩어리의 총 수를 셉니다. 대부분의 세포 덩어리의 직경이 200μm >인 경우( 그림 1 참조) 1.4.5 - 1.4.7단계를 반복합니다.
- 다음과 같이 6,000개의 덩어리를 파종하는 데 필요한 덩어리 현탁액의 부피(μL)를 계산합니다.
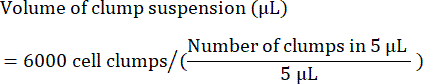
참고: 최적의 파종 밀도는 모든 세포주에서 최적화되어야 합니다. 최적의 파종 밀도를 결정하려면 덩어리 밀도 범위(예: 웰당 4,000, 5,000 및 6,000 덩어리)에서 초기 파종을 수행하고 파종 후 24-48시간 후에 85%-90% 밀도에 도달하는지 확인하는 것이 좋습니다. - 품질 관리를 위해 줄기 세포 마커의 유세포 분석을 위해 세포 샘플을 분리합니다. 공통 마커 목록은 표 4 를 참조하십시오.
- 다른 ECM으로 코팅된 웰에 파종하기 위해 필요한 부피의 iPSC 덩어리 현탁액을 별도의 15mL 튜브로 분리합니다.
- iPSC 덩어리 용액이 들어 있는 튜브를 200 x g 에서 5분 동안 원심분리하여 효소가 없는 인간 만능 줄기 세포 선택 시약이 포함된 배지를 제거합니다. 원심분리를 기다리는 동안 웰당 원하는 부피의 50%를 각 웰에 추가합니다(아직 수행하지 않은 경우).
- 시작하기 전에 다음을 준비하십시오 : 통과하기 최소 1 시간 전에 원하는 플라스틱 용기를 매트릭스로 코팅하십시오. 충분한 완전한 줄기 세포 배지를 분취하고 실온 (15 - 25 ° C)에서 따뜻하게 합니다. 전체 매체에 대해 여러 번의 가열 주기를 피하십시오.
- 동물 유래 매트릭스를 포함하는 플레이트의 iPSC 배양
- 계산된 50% 부피의 완전 줄기 세포 배지에서 iPSC 덩어리를 부드럽게 재현탁하여 원하는 밀도를 얻고 세포 응집체 혼합물을 계산된 완전 줄기 세포 배지의 50%가 포함된 코팅된 웰에 플레이트합니다.
참고: 일부 세포주나 덩어리가 50μm 이하인 경우 ROCK-1 억제제를 추가해야 할 수 있습니다. 조기 위축을 피하기 위해 <10μm를 추가하는 것이 좋습니다. - 매트릭스 위에 셀이 있는 배지를 조심스럽게 추가합니다(24웰 플레이트를 사용하는 경우 250μL/웰). 다른 크기의 웰 플레이트에 대한 셀 매체의 권장 부피는 표 2를 확인하십시오.
- 세포 덩어리를 고르게 분배하기 위해 플레이트를 앞뒤로 여러 번 짧게 기울입니다.
주의: 응집체의 불균일한 분포는 인간 iPSC의 자발적 분화를 증가시킵니다. 덩어리의 현탁액이 원형으로 퍼지면 우물 경계에 덩어리가 응집되고 중앙의 밀도가 낮아집니다. - 37 °C에서 플레이트를 배양하고 매일 또는 격일로 완전한 줄기 세포 배지를 사용하여 배지 변화를 수행합니다. 배지 변화를 수행할 때 배양을 육안으로 평가하여 성장을 모니터링하고 세포에 통과 시간이 필요한지 또는 분화할 준비가 되었는지 여부를 확인합니다. 이틀 연속 수유를 건너뛰려면 하루 동안 필요한 배지 부피의 2배를 추가하십시오.
- 계산된 50% 부피의 완전 줄기 세포 배지에서 iPSC 덩어리를 부드럽게 재현탁하여 원하는 밀도를 얻고 세포 응집체 혼합물을 계산된 완전 줄기 세포 배지의 50%가 포함된 코팅된 웰에 플레이트합니다.
- Matrix 4-XE를 함유한 플레이트의 iPSC 배양
- 원하는 밀도를 얻기 위해 3x 완전한 줄기 세포 배지의 총 계산된 부피에 iPSC 덩어리를 부드럽게 재현탁시킵니다.
- 24웰 플레이트를 사용하는 경우 하이드로겔 250μL/웰 위에 셀이 있는 배지를 조심스럽게 추가합니다. 다른 크기의 웰 플레이트에 대한 셀 매체의 권장 부피는 표 3을 확인하십시오.
주의: 하이드로겔은 부풀어 올라 갓 만든 것보다 더 많은 부피를 차지합니다. iPSC 콜로니는 플레이트 하단의 하이드로겔에 부분적으로 내장되므로 하이드로겔을 방해하지 않고 상단 매체의 50%-80%를 변경하는 것이 좋습니다. - 플레이트를 빠르고, 짧고, 앞뒤로 여러 번 움직여 세포 덩어리를 고르게 분포시킵니다.
- 37% CO5 및 2 % 습도가 있는 95°C 인큐베이터에 플레이트를 놓습니다. 완전한 줄기 세포 배지를 사용하여 세포 배지를 변경합니다. 매일 또는 격일로 매체 변경을 수행하십시오. 후자의 경우 매체 부피의 2배를 추가합니다.
- 배양액을 육안으로 검사하여 분화에 적합한 단계에 도달함에 따라 배양액의 성장을 추적합니다.
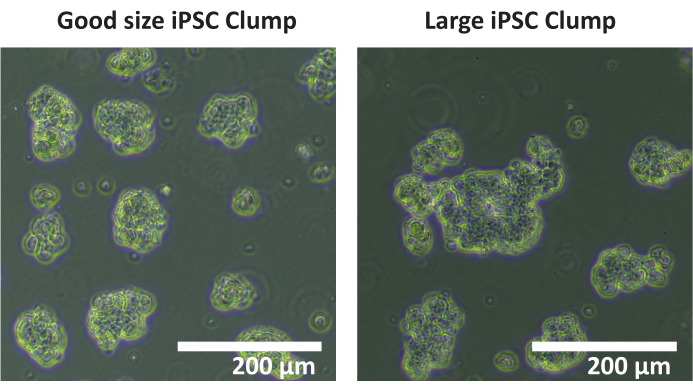
그림 1: 최적의 덩어리 크기. 최적의 응집 크기의 예를 보여주는 iPSC 세포주 SCTi003A의 덩어리 이미지. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. hiPSC 분화 및 장 오가노이드 생성
주의 : 모든 작업은 표준 무균 기술에 따라 생물 안전 캐비닛 (BSC)에서 수행됩니다. 실험실 가운, 장갑 및 고글과 같은 개인 보호 장비의 적절한 사용을 포함하여 실험실에 대한 OSHA 안전 표준을 따라야 합니다.
- 시작하기 전에 다음을 준비하십시오: 각 단계에 필요한 분화 배지의 부분 표본을 준비합니다. 부분 표본을 해동한 후에는 즉시 사용하십시오. 다시 얼리지 마십시오. 표 5 를 따라 24-well plate에 필요한 각 스테이지 매체 유형 및 부피에 대한 일반적인 지침을 확인하십시오.
참고: 각 분화 단계에서 최적의 시간은 세포주마다 다를 수 있습니다. 분화 효능을 향상시키기 위해 각 stage cell marker의 발현을 확인하는 것이 권장됩니다. 낮은 통로에서 공급업체가 인증한 배치를 활용했기 때문에 iPSCS 배양에 대한 유전자 발현의 주기적 평가는 이 연구에 포함되지 않았지만, 후속 분화 단계에서 새로운/아직 자격이 없는 iPSC 라인에 대한 품질 관리 단계로 권장됩니다. - 1단계: 확정 내배엽(DE)
- 차별화를 시작하기 위한 준비 상태를 평가하려면 다음 기준을 확인합니다.
- 현미경을 사용하여 줄기 세포 콜로니의 밀도와 배양에서 자발적 분화의 양을 평가합니다. 형태학적 평가에만 의존하지 마십시오. 최적의 밀도는 85%-90%(~105 cells/cm2 이상)여야 하며, 관찰된 최소 자발적 분화는 <5% 분화여야 합니다.
- 다음 단계를 진행하기 전에 hiPSC 마커의 유세포 분석 특성 분석을 위해 희생 웰에서 세포를 수집합니다. 전방 및 측면 산란 게이팅(forward and side scatter gating) 전략은 대표적인 유세포 분석 특성 분석을 위해 사용되었습니다. 세포가 최적 기준을 충족하면 분화를 시작합니다. 세포 통과 기준은 이상적으로 3개의 마커를 >85% 발현하는 것이며(표 4), 특히 실험실에서 새로운/아직 검증되지 않은 iPSC 라인의 경우.
참고: 서로 다른 매트릭스에서 성장한 iPSC 배양물은 매트릭스 4-XE에서 iPSC 성장만 있는 동일한 전체 과정을 거치므로 반포입 세포를 방해하지 않도록 보다 부드러운 배지 변경이 필요합니다. 결정적인 내배엽 유도 중에는 상당한 세포 사멸이 예상되는데, 이는 이 단계에서 세포가 특히 민감하기 때문입니다. 세포가 37°C 배양 환경 외부에 노출되는 시간을 가능한 한 최소화하는 것을 목표로 배지 변경 중에는 주의를 기울이십시오.
- 아래 설명된 대로 세포 콜로니의 분화를 시작합니다.
- 0일차: DE 매체의 부분 표본을 37°C로 데웁니다. 워밍-쿨링 사이클에서 매체의 변성을 방지하려면 Day 0(0.7mL/웰)에 필요한 부피만 워밍업해야 합니다.
- hiPSC에서 매체를 흡인합니다. 웰당 0.7mL의 DE 배지를 웰 측면에 조심스럽게 추가합니다. 콜로니를 분리하거나 손상시킬 수 있는 거친 피펫팅을 피하십시오. 37 ° C에서 5 % CO2 및 95 % 습도로 24 시간 동안 플레이트를 배양합니다.
- 1일차: 1일차에 필요한 부피(0.5mL/웰)만 포함된 DE 배지의 부분 표본을 37°C로 예열합니다. 세포에서 DE 배지를 흡입하고 웰당 0.5mL의 DE 배지를 웰 측면에 조심스럽게 추가합니다. 37 ° C에서 5 % CO2 및 95 % 습도로 24 시간 동안 배양합니다.
- 3일차: 명확한 내배엽 형성을 위해 세포를 분석할 준비가 되었습니다. 권장 마커에 대해서는 표 4 를 참조하십시오. 다음 단계를 진행하기 전에 DE와 관련된 특정 마커의 유세포 분석 특성 분석을 수행하기 위해 웰을 희생합니다. 전방 및 측면 산란 게이팅(forward and side scatter gating) 전략은 대표적인 유세포 분석 특성 분석을 위해 사용되었습니다. 1개 이상의 마커의 발현을 확인하는 것이 권장되며, 특히 실험실에서 새로운/아직 검증되지 않은 iPSC 라인의 경우 더욱 그렇습니다.
- 차별화를 시작하기 위한 준비 상태를 평가하려면 다음 기준을 확인합니다.
- 2단계: 중장/후창자(MH)
- 3일차: 3일차에 필요한 MH 배지의 부피(0.5mL/웰)만 15 - 25°C로 데웁니다. 세포에서 DE 배지를 흡입하고 0.5mL의 MH 배지로 교체합니다. 37 ° C에서 5 % CO2 및 95 % 습도로 24 시간 동안 배양합니다.
- 4 - 9일차: 매일 배지를 교체하기 전에 2배 또는 4배 배율로 현미경을 사용하여 눈에 보이는 3D 구조를 확인하여 스페로이드 형성을 평가합니다(4일째부터 발생할 수 있음). 자유 부유 스페로이드(5일째부터 발생할 수 있음).
- 스페로이드가 분리되기 시작하면 1mL 피펫터를 사용하여 배지를 세포에서 멸균된 15mL 원뿔형 튜브로 부드럽게 옮겨 세포에서 분리된 스페로이드의 수를 평가합니다.
참고: 단층에서 3D 구조를 분리할 수 있는 전단력을 피하십시오. 준비가 되면 스페로이드가 저절로 분리됩니다. - 50개 미만의 스페로이드가 분리된 경우 200 x g 에서 5분 동안 원심분리한 후 기존 배지를 제거하고 스페로이드를 0.5mL/웰의 배지에 재현탁시키고 충분한 스페로이드가 성숙할 때까지 각각의 웰로 옮깁니다.
참고: midgut/hindgut 배지에 대한 노출 시간은 십이지장(짧은 노출) 또는 회장(장시간 노출)과 같은 발달하는 소장 오가노이드의 지역적 정체성을 결정하는 데 중요한 역할을 합니다. 동일한 정체성을 가진 보다 균일한 배양을 달성하려면 중장/후장 배지에 동시에 노출된 스페로이드를 수집하는 것을 목표로 합니다. - 인간 장 오가노이드(hIO) 배양을 삽입하고 시작할 수 있을 만큼 충분한 스페로이드가 분리될 때까지 2.3.3단계를 반복합니다.
- 다음 단계를 진행하기 전에 스페로이드 샘플을 분리하고 Midgut/Hindgut(MH)와 관련된 특정 마커의 유세포 분석 특성 분석을 수행합니다. 전방 및 측면 산란 게이팅(forward and side scatter gating) 전략은 대표적인 유세포 분석 특성 분석을 위해 사용되었습니다. 일반적으로 사용되는 마커 목록은 표 4 를 참조하십시오. 1개 이상의 마커의 발현을 확인하는 것이 권장되며, 특히 실험실에서 새로운/아직 검증되지 않은 iPSC 라인의 경우 더욱 그렇습니다.
- 3단계: 스페로이드 임베딩
- 절차를 시작하기 전에 다음을 준비하십시오.
- 매트릭스 1-ABO 및 매트릭스 3-ABO의 부분 표본을 얼음에서 해동합니다. 돔당 30-40 μL의 매트릭스가 필요한 경우 필요한 매트릭스의 총 양을 결정하기 위해 수집된 스페로이드의 수를 고려하십시오.
- 15mM HEPES를 포함하는 25mL의 콜드 Advance DMEM/F-12를 준비합니다. 고농축 ECM은 점성이 있어 피펫팅이 어렵습니다. 멸균 100μL 피펫 팁 상자를 -20°C에 놓고 공정에 도움이 될 수 있는 차가운 팁을 준비합니다. 4회 피드(피드당 0.5mL/웰)가 필요한 장내 오가노이드 성장 배지(OGM)의 부분 표본을 준비합니다. 준비는 표 5 를 참조하십시오.
- OGM 보충제의 부분 표본을 얼음에 해동합니다. 부분 표본을 해동한 후에는 즉시 사용하십시오. 다시 얼리지 마십시오. 전체 OGM을 2-8 °C에서 최대 2주 동안 보관하십시오.
- (3x OGM)에 대한 표준 제형과 비교하여 보충제의 3배를 함유하는 OGM을 제조합니다. Matrix 4-XFO1 thought Matrix 4-XFO4를 냉장고에서 꺼내 실온(25°C)으로 데웁니다.
- 동물 유래 시스템의 경우 아래 설명된 단계를 수행합니다.
- 멸균 24웰 조직 배양 플레이트를 인큐베이터에 넣어 스페로이드와 매트릭스를 준비하는 동안 37°C로 예열합니다. 수집된 스페로이드를 15mL 원뿔형 튜브의 바닥에 가라앉힙니다. 상층액을 조심스럽게 흡입하고 버립니다.
참고: 매트릭스의 효과를 보다 정확하게 비교하려면 hiPSC에서 수집된 스페로이드를 별도의 튜브의 각 매트릭스에서 분화되도록 유지해야 합니다. - 스페로이드에 15mM HEPES와 함께 1mL의 DMEM/F-12를 추가합니다. 실온(15 - 25 °C)에서 300 x g 으로 5분 동안 원심분리합니다.
- 가능한 한 많은 상층액을 조심스럽게 제거하십시오. 1mL 피펫으로 제거를 시작하고 100μL 및 10μL 피펫으로 전환하여 스페로이드 펠릿을 방해하지 않고 가능한 한 많이 제거하는 것이 좋습니다.
참고: 남은 미디어 볼륨이 클수록 매트릭스가 더 많이 희석됩니다. 희석된 매트릭스는 겔화 문제 또는 더 부드러운 돔으로 이어질 수 있습니다. 더 부드러운 돔은 최소한의 방해로 붕괴 가능성이 높아집니다. - 차가운 100 μL 피펫 팁이 있는 피펫터를 사용하여 40 μL/50 스페로이드의 저온(2 - 8 °C) Matrix 1-ABO 또는 Matrix 3-ABO를 해당 튜브에 추가합니다. 스페로이드를 위아래로 ~5배 피펫팅하여 매트릭스에 부드럽게 분포시킵니다. 기포가 발생할 수 있는 피펫 팁을 완전히 비우지 마십시오.
- 인큐베이터에서 플레이트를 가져오고 차가운 피펫 팁을 사용하여 그림 2의 단계에 따라 내장된 스페로이드를 플레이트 중앙으로 부드럽게 옮깁니다. Matrix 1-ABO 및 Matrix 3-ABO를 배양 접시에 너무 빨리 분주하면 돔이 평평해집니다.
- 플레이트를 37°C 인큐베이터로 조심스럽게 옮기고 돔 겔화를 보장하기 위해 30분 동안 배양합니다. 운송 중 및 인큐베이터에서 흔들리거나 거친 움직임에 특히 주의하십시오.
- 겔화를 위해 돔을 배양하는 동안 사용할 웰 수에 충분한 양의 장 OGM(0.5mL/웰)을 37°C에서 데웁니다.
알림: 필요한 볼륨만 따뜻하게 합니다. 예열-냉각 주기를 피하십시오. 매체를 돔에 추가하기 전에 매체가 따뜻한지 확인하십시오. 차가운 매체는 돔이 무너질 수 있습니다. - 30분 후 돔을 방해하지 않도록 웰 측면에 0.5mL의 장 OGM을 조심스럽게 추가합니다. 37 °C에서 5 % CO2 및 95 % 습도로 배양합니다. 매체를 제거한 다음 새 매체를 추가하여 3-4일마다 전체 매체 교체를 수행합니다.
- 멸균 24웰 조직 배양 플레이트를 인큐베이터에 넣어 스페로이드와 매트릭스를 준비하는 동안 37°C로 예열합니다. 수집된 스페로이드를 15mL 원뿔형 튜브의 바닥에 가라앉힙니다. 상층액을 조심스럽게 흡입하고 버립니다.
- Matrix 4-XF 오가노이드 시스템의 경우 설명된 단계를 따릅니다.
참고: Matrix 4-XF 오가노이드 시스템에는 4가지 옵션(O1-O4)이 포함되어 있습니다. 각 유형의 제형은 생체 기능 리간드, 강성 및 분해성이 다릅니다. 따라서 특정 응용 분야에 대한 최적의 유형을 결정하기 위해 초기 실험을 수행하는 것이 좋습니다. 이 프로토콜은 hiPSC 유래 장 오가노이드에 대한 최적의 제형을 찾기 위해 4가지 옵션을 사용하는 방법을 설명합니다. 또한 사용할 수 있는 여러 배양 프로토콜(예: 3D 캡슐화, 돔 캡슐화)이 있지만, 이 프로토콜은 동물 유래 기저막 시스템으로 작업할 때 사용되는 일반적인 방법과 직접 비교할 수 있도록 돔 방법을 사용하는 것을 포함합니다.- 16mM HEPES를 함유한 콜드 어드밴스 DMEM/F-12 1웰을 Matrix 4-XFO4 시스템에서 생성된 스페로이드에 추가합니다. 실온(15 - 25 °C)에서 300 x g 으로 5분 동안 원심분리합니다.
참고: 응용 분야에 대한 최적의 제형을 찾으려면 원심분리 전에 스페로이드를 4개의 개별 튜브에 분배해야 합니다. 동물 유래 매트릭스에서 생성된 스페로이드도 이 시스템을 사용하여 장내 오가노이드로 성숙시킬 수 있습니다. - 1mL 피펫터를 사용하여 스페로이드를 방해하지 않고 상층액을 제거합니다. 스페로이드 펠릿(~100 스페로이드)에 50μL의 3x OGM을 추가합니다. 선택한 Matrix 4-XFO 100μL를 50μL 스페로이드 현탁액에 넣고 5x-10x 번 부드럽게 혼합합니다. 매트릭스 4-XFO와 3x OGM을 2:1 v/v 혼합 비율로 유지하여 최종 농도가 1x가 되도록 합니다.
- 40μL의 하이드로겔-스페로이드 혼합물을 24웰 조직 배양 플레이트의 중앙에 추가합니다. 플레이트를 37°C 인큐베이터로 조심스럽게 옮기고 30분 동안 배양합니다.
참고: Matrix 4-XFO는 겔화를 위해 37°C 배양이 필요하지 않습니다. 그러나 돔의 더 나은 겔화를 위해 37°C가 필요한 Matrix 1-ABO 및 Matrix 3-ABO 시스템과 비교할 때 오가노이드를 유사한 조건에 노출시키는 것이 좋습니다. - 30분 후 돔을 방해하지 않도록 웰 측면에 장 OGM 0.5mL를 조심스럽게 추가합니다. 37 °C에서 5 % CO2 및 95 % 습도로 배양합니다. 배지를 제거한 다음 새 배지를 추가하여 3-4일마다 전체 매체 교체를 수행합니다.
- 16mM HEPES를 함유한 콜드 어드밴스 DMEM/F-12 1웰을 Matrix 4-XFO4 시스템에서 생성된 스페로이드에 추가합니다. 실온(15 - 25 °C)에서 300 x g 으로 5분 동안 원심분리합니다.
- 절차를 시작하기 전에 다음을 준비하십시오.
- hIO passaging 및 성숙
- 2.4.1단계에서 수행한 것과 동일한 화학 물질, 용액 및 시약을 준비합니다.
- 15mL 코니컬 튜브(조건당 1개)에 1-2mL의 접착 방지 헹굼 용액을 추가하고 소용돌이쳐 튜브를 코팅합니다.
- 부착 방지 용액을 제거하고 5mL의 D-PBS(Ca++ 및 Mg++ 제외)로 튜브를 헹굽니다. 코팅된 모든 튜브의 뚜껑을 닫고 필요할 때까지 실온(15 - 25 °C)에서 보관하십시오.
- 돔에서 매체를 흡입합니다. 1mL 피펫을 사용하여 1mL의 차가운 DMEM/F-12를 돔에 직접 추가합니다. 목표는 플레이트에서 돔을 분리하는 것입니다.
- 웰에 Cold DMEM/F-12 1mL를 추가하고 위아래로 피펫팅하여 남은 오가노이드를 채취합니다. 코팅된 15mL 코니컬 튜브로 옮깁니다.
NOTE: 현미경으로 웰을 육안으로 검사하여 오가노이드의 성공적인 수확을 확인하십시오. 잔류 오가노이드가 관찰되면 2.5.5단계를 반복합니다. - 1 mL 피펫터를 사용하여 원하는 오가노이드 크기(예: 100 - 500 μm)로 균일한 단편 현탁액이 얻어질 때까지 현탁액의 상하 피펫팅을 수행하여 오가노이드를 분해합니다.
참고: 200μL 피펫터를 사용하여 오가노이드가 권장 크기를 준수하는지 확인합니다. 200 μL 피펫터를 사용하면 필요에 따라 추가적인 단편화가 용이하여 단편이 200 μL 피펫 팁을 원활하게 통과할 수 있습니다.
주의: 가혹하거나 장시간의 피펫팅으로 단편을 단일 셀로 분해하지 마십시오. - 단편을 계수하거나 분할 비율을 사용하여 원하는 오가노이드 밀도를 설정합니다. 부분 표본을 분리하고 덩어리 계수를 위한 1.4.6-1.4.9 단계와 동일한 절차를 사용하여 계수를 수행합니다.
참고: 최적의 오가노이드 밀도는 라인별로 최적화되어야 합니다. 일반적으로 돔당 40 - 80개의 장 오가노이드 밀도가 권장됩니다. - 오가노이드 계수 과정에서 튜브가 얼음 위에 놓였는지 확인하십시오. 약 5분 후, 오가노이드 조각은 중력으로 인해 튜브 바닥에 가라앉습니다.
알림: 오가노이드 용액의 부피가 클수록 바닥에 가라앉는 데 더 오래 걸립니다. - 오가노이드 위에 형성된 상층액과 탁한 층을 부드럽게 제거합니다. 오가노이드가 성숙하는 초기 단계에서 이 흐린 단계는 매트릭스와 개별 세포를 포함합니다.
- 펠릿에 직접 피펫팅하여 2mL의 차가운 DMEM/F-12를 추가합니다. 실온(15 - 25 °C)에서 200 x g 으로 5분 동안 원심분리합니다.
- 동물 유래 시스템의 경우 2.4.2.4-2.4.2.9 단계에서 설명한 것과 동일한 단계에 따라 상층액을 조심스럽게 제거하고 폐기하십시오.
- Matrix 4-XFO 시스템의 경우 2.4.3.2-2.4.3.4단계에 설명된 것과 동일한 단계에 따라 상층액을 조심스럽게 제거하고 폐기합니다.
참고: Matrix 4-XFO 시스템으로 작업할 때 하이드로겔 잔류물의 최적 제거를 위해 무이종 하이드로겔 오가노이드 회수 용액을 사용하는 것이 좋습니다. 이 회수 솔루션은 이종 물질의 제거를 보장하기 위해 동물 기반에서 무이종 하이드로겔 시스템으로 전환할 때 특히 권장됩니다.
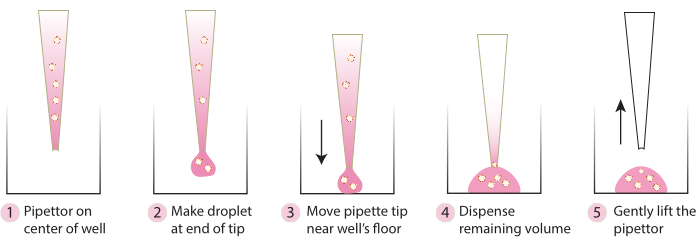
그림 2. 돔 형성에 권장되는 기술 개략도. 회로도는 모든 시스템에서 성공적인 돔 형성을 위해 권장되는 단계별 프로세스를 설명합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. IO 크기 특성화
참고: 오가노이드의 크기는 4x 및 10x에서 촬영한 명시야 이미지로 특징지어졌습니다. 이미지 처리 분석은 MATLAB을 사용하여 자동화되었습니다. 프로세스의 전체 단계는 아래에 설명되어 있으며 코드 샘플은 보충 파일 1에 포함되어 있습니다.
- 이미지가 포함된 디렉터리를 정의하고 디렉터리의 모든 이미지 파일을 나열합니다. 테이블을 초기화하여 결과를 저장합니다. 파일의 명시야 이미지를 읽어 들입니다.
- 픽셀에서 μm로의 변환을 정의하고 스케일을 설정합니다. 이미지에 축척 막대가 포함되어 있지 않으면 사용자에게 픽셀에서 μm로의 변환 계수를 요청합니다.
- 이미지를 회색조로 변환합니다. 가우스 필터를 적용하여 이미지의 노이즈를 줄입니다. 필터링된 이미지의 임계값을 설정하여 배경에서 오가노이드를 분리합니다.
- 작은 구멍을 채우고 작은 물체를 제거하여 이진 영상을 정리합니다. 연결된 구성 요소 분석을 수행하여 개별 오가노이드를 식별하고 면적, 중심, 장축 길이 및 단축 길이와 같은 속성을 계산합니다.
- 장축과 단축 길이를 기준으로 오가노이드 크기를 계산합니다. 원본 이미지에 분할된 오가노이드를 표시하고 크기로 레이블을 지정합니다. 오가노이드 크기를 인쇄하고 결과를 .cvs 파일에 저장합니다.
참고: 처음 몇 개의 이미지는 수동으로 분석하여 가우시안 필터 표준 편차와 임계값까지의 면적에 대한 최적의 매개변수를 결정했습니다. 보충 파일 1 의 코드는 명시야 이미지에서 오가노이드 크기 분석을 위한 기본 프레임워크의 예를 제공합니다. 그러나 각 이미지 유형 및 품질에 대한 특정 요구 사항에 맞게 추가 개선이 필요합니다. Image J의 FIJI와 같은 오픈 소스 소프트웨어를 사용하여 동일한 프로세스를 수행할 수 있습니다. - FIJI 소프트웨어를 사용하려면 아래 단계를 따르십시오.
- 픽셀에서 μm로의 변환을 정의하고 스케일을 설정합니다. 이미지에 축척 막대가 포함되어 있지 않으면 분석 > 축척 설정을 클릭하여 사용자에게 픽셀에서 μm로의 변환 계수를 요청합니다.
- 이미지 > 유형 > 8bit를 클릭하여 이미지를 회색조로 변환합니다. 가우스 필터를 적용하여 이미지의 노이즈를 줄입니다. 프로세스 > 필터 > 사용된 시그마(반경) > 가우스 광고 문구: 2.
- Image > Threshold > MaxEntropy > Apply를 클릭하여 필터링된 이미지를 임계값으로 설정하여 배경에서 오가노이드를 분리합니다.
- Process > Noise(노이즈 처리) > Remove Outliers > 20 pixels(이상값 제거)를 클릭하여 작은 구멍을 채우고 작은 객체를 제거하여 이진 영상을 정리합니다.
- Analyze > Set measurement > Make sure Area, Perimeter, and Diameter are are included are included > Analyze > Analyze Particles > Show Outlines를 클릭하여 개별 오가노이드를 식별하고 면적, 중심, 장축 길이, 단축 길이와 같은 속성을 계산합니다.
- 통계 분석
- JMP(SAS) 소프트웨어를 사용하여 Saphiro-Wilk 검정을 통해 데이터 분포의 정규성을 평가합니다. 그룹 간의 통계적 차이를 조사하려면 이원 분산 분석을 수행하고 JMP(SAS) 소프트웨어에서 비모수 Wilcoxon 방법을 사용하여 사후 검정을 수행합니다. 유의성은 p ≤ 0.05의 알파 수준에서 설정되었습니다.
Access restricted. Please log in or start a trial to view this content.
결과
이 프로토콜에 따라 상업적으로 이용 가능한 기저막과 무이종 하이드로겔 시스템을 사용하여 hiPSC 세포를 배양하고 hIO로 분화시키는 데 성공했습니다. 이 실험의 주요 목적은 hiPSC 및 hIO 작업을 위해 다양한 소스의 매트릭스 동등성을 체계적으로 평가하는 것이었습니다. 이 프로토콜의 첫 번째 섹션에서는 효율적인 장 오가노이드 생성을 생성하는 건강한 iPSC 배양의 유지 및 특성 분석에 초점을 ?...
Access restricted. Please log in or start a trial to view this content.
토론
줄기 세포 및 오가노이드 작업을 위한 최적의 미세환경을 선택하는 것은 광범위한 응용 분야에서 이러한 플랫폼을 사용할 때 중요한 초기 단계입니다. 당사의 대표적인 결과는 Matrix 4-XFO3가 더 높은 농도의 성장 인자와 결합하여 더 큰 오가노이드로 이어진다는 것을 보여주며, 이는 무계 하이드로겔의 물리적 특성을 활용하여 이러한 시스템을 사용하여 오가노이드 생성을 최적화할 수 있음을 시?...
Access restricted. Please log in or start a trial to view this content.
공개
John Huang 박사는 TheWell Bioscience의 설립자 겸 CEO입니다.
감사의 말
저자는 Christina Pacak, Silveli Susuki-Hatano 및 Russell D'Souza 박사로부터 hiPSC 및 오가노이드 작업 시작에 대한 이전 교육 및 일반적인 권장 사항을 인정합니다. 그들은 체외 세포 배양 작업을 위해 하이드로겔 시스템을 사용하는 방법에 대한 Chelsey Simmons 박사의 지도에 감사드립니다. 또한 저자들은 hiPSC 배양에 대한 지도를 해준 STEMCELL Technologies의 Christine Rodriguez와 Thomas Allison 박사에게 감사의 뜻을 전합니다. 저자들은 또한 출판 비용을 부담해 준 TheWell Bioscience에 감사를 표합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 24-Well Plate (Culture treated, sterile) | Falcon | 353504 | |
| 37 °C water bath | VWR | ||
| 96-well plate | Fisher Scientific | FB012931 | |
| Advanced DMEM/F12 | Life Technologies | 12634 | |
| Anti-adherence Rinsing Solutio | STEMCELL Technologies | 7010 | |
| Biological safety cabinet (BSC) | Labconco | Logic | |
| Brightfield Microscope | Echo Rebel | REB-01-E2 | |
| BXS0116 | ATCC | ACS-1030 | |
| Centrifuge with temperature control (4 °C capabilities) | ThermoScientific | 75002441 | |
| Conical tubes, 15 mL, sterile | Thermo Fisher Scientific | 339650 | |
| Conical tubes, 50 mL, sterile | Thermo Fisher Scientific | 339652 | |
| Cultrex RGF BME, Type 2 | Bio-techne | 3533-005-02 | |
| Cultrex Stem Cell Qualified RGF BME | Bio-techne | 3434-010-02 | |
| D-PBS (Without Ca++ and Mg++) | Thermo Fisher Scientific | 14190144 | |
| GeltrexLDEV-Free, hESC-Qualified Reduce Growth Factor | Gibco | A14133-02 | |
| GlutaMAX Supplement | Thermo Fischer Scientific | 35050-061 | |
| Guava Muse Cell Analyzer or another flow cytometry equipment (optional) | Luminex | 0500-3115 | |
| HEPES buffer solution | Thermo Fischer Scientific | 15630-056 | |
| Heralcell Vios Cell culture incubator (37 °C, 5% CO2) | Thermo Scientific | 51033775 | |
| JMP Software | SAS Institute | JMP 16 | |
| MATLAB | MathWorks, Inc | R2022b | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix LDEV free | Corning | 356231 | |
| Matrigel Matrix High Concentration (HC), Growth Factor Reduced (GFR) LDEV-free | Corning | 354263 | |
| mTeSR Plus Medium | STEMCELL Technologies | 100-0276 | |
| Nunclon Delta surface treated 24-well plate | Thermo Scientific | 144530 | |
| PE Mouse Anti-human CD326 (EpCAM) | BD Pharmingen | 566841 | |
| PE Mouse Anti-human CDX2 | BD Pharmingen | 563428 | |
| PE Mouse Anti-human FOXA2 | BD Pharmingen | 561589 | |
| PerCP-Cy 5.5 Mouse Anti-human SSEA4 | BD Pharmingen | 561565 | |
| ReLeSR | STEMCELL | 5872 | |
| SCTi003-A | STEMCELL Technologies | 200-0510 | |
| Serological pipettes (10 mL) | Fisher Scientific | 13-678-11E | |
| Serological pipettes (5 mL) | Fisher Scientific | 13-678-11D | |
| STEMdiff Intestinal Organoid Growth Medium | STEMCELL Technologies | 5145 | |
| STEMdiff Intestinal Organoid Kit | STEMCELL Technologies | 5140 | |
| Vitrogel Hydrogel Matrix | TheWell Bioscience | VHM01 | |
| VitroGel ORGANOID Discovery Kit | TheWell Bioscience | VHM04-K |
참고문헌
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. J Cell Sci. 123, Pt 24 4195-4200 (2010).
- Hinz, B., Gabbiani, G. Fibrosis: Recent advances in myofibroblast biology and new therapeutic perspectives. F1000 Biol Rep. 2, 78(2010).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Rep. 15 (12), 1243-1253 (2014).
- Rozario, T., DeSimone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol. 341 (1), 126-140 (2010).
- Even-Ram, S., Artym, V., Yamada, K. M. Matrix control of stem cell fate. Cell. 126 (4), 645-647 (2006).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Tran, O. N., et al. Organ-specific extracellular matrix directs trans-differentiation of mesenchymal stem cells and formation of salivary gland-like organoids in vivo. Stem Cell Res Ther. 13 (1), 306(2022).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., et al. Tissue geometry drives deterministic organoid patterning. Science. 375 (6576), (2022).
- Heo, J. H., Kang, D., Seo, S. J., Jin, Y. Engineering the extracellular matrix for organoid culture. Int J Stem Cells. 15 (1), 60-69 (2022).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15 (10), 647-664 (2014).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Jung, P., et al. Isolation and in vitro expansion of human colonic stem cells. Nat Med. 17 (10), 1225-1227 (2011).
- Lancaster, M. A., Knoblich, J. A. Organogenesis in a dish: Modeling development and disease using organoid technologies. Science. 345 (6194), 1247125(2014).
- Huch, M., et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 494 (7436), 247-250 (2013).
- Greenlee, A. R., Kronenwetter-Koepel, T. A., Kaiser, S. J., Liu, K. Comparison of Matrigel and gelatin substrata for feeder-free culture of undifferentiated mouse embryonic stem cells for toxicity testing. Toxicol In Vitro. 19 (3), 389-397 (2005).
- Geltrex LDEV-Free, HESC-Qualified, Reduced Growth Factor Basement Membrane Matrix User Guide (Pub.No. MAN0007336 3.0. Fisher Scientific. , Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.cn/TFS-Assets%2FLSG%2Fmanuals%2FGeltrex_LDEV_Free_hESC_qualified_PI.pdf (2024).
- biotechne R&D Systems. Cultrex Stem Cell Qualified Reduced Growth Factor. biotechne R&D Systems. , (2024).
- VitroGel Organoid Protocol. TheWell Bioscience. , Available from: https://www.thewellbio.com/video-protocols (2024).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Henderson, J. K., et al. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 20 (4), 329-337 (2002).
- Haruna, N. F., Huang, J. Investigating the dynamic biophysical properties of a tunable hydrogel for 3D cell culture. J Cytol Tissue Biol. 7, 30(2020).
- Cherne, M. D., et al. A synthetic hydrogel, VitroGel ORGANOID-3, improves immune cell-epithelial interactions in a tissue chip co-culture model of human gastric organoids and dendritic cells. Front Pharmacol. 12, 707891(2021).
- Stewart, D. C., et al. Quantitative assessment of intestinal stiffness and associations with fibrosis in human inflammatory bowel disease. PLoS One. 13, e0200377(2018).
- Hernandez-Gordillo, V., et al. Fully synthetic matrices for in vitro culture of primary human intestinal enteroids and endometrial organoids. Biomaterials. 254, 120125(2020).
- Broguiere, N., et al. Growth of epithelial organoids in a defined hydrogel. Adv Mater. 30, 1801621(2018).
- Barthes, J., et al. Cell microenvironment engineering and monitoring for tissue engineering and regenerative medicine: The recent advances. BioMed Res Int. 2014, 921905(2014).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nat Rev Mater. 5 (7), 539-551 (2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유