A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس التغيرات الديناميكية في درجة الحموضة الجليكوزومية في المثقبيات الحية بروسي
* These authors contributed equally
In This Article
Summary
وصفنا طريقة لدراسة كيفية استجابة الأس الهيدروجيني للإشارات البيئية في جليكوسومات مجرى الدم من المثقبيات الأفريقية. يتضمن هذا النهج مستشعر بروتين وراثي حساس لدرجة الحموضة مع قياس التدفق الخلوي لقياس ديناميكيات الأس الهيدروجيني ، سواء كفحص زمني أو في شكل شاشة عالية الإنتاجية.
Abstract
استقلاب الجلوكوز أمر بالغ الأهمية للمثقبيات الأفريقية ، المثقبية البروسية ، كعملية أيضية أساسية ومنظم لتطور الطفيليات. لا يعرف سوى القليل عن الاستجابات الخلوية المتولدة عندما تتغير مستويات الجلوكوز البيئية. في كل من مجرى الدم والطفيليات ذات الشكل الحلقي (مرحلة الحشرات) ، تحتوي الجليكوسومات على معظم تحلل السكر. يتم تحمض هذه العضيات بسرعة استجابة للحرمان من الجلوكوز ، مما يؤدي على الأرجح إلى التنظيم الخيفي للإنزيمات المحللة للسكر مثل هيكسوكيناز. في العمل السابق ، كان توطين المسبار الكيميائي المستخدم لإجراء قياسات الأس الهيدروجيني أمرا صعبا ، مما حد من فائدته في التطبيقات الأخرى.
تصف هذه الورقة تطور واستخدام الطفيليات التي تعبر عن pHluorin2 الموضعي جليكوسومي ، وهو مستشعر حيوي للبروتين يمكن توريثه. pHluorin2 هو متغير pHluorin نسبي يعرض انخفاضا يعتمد على الأس الهيدروجيني (الحمض) في الإثارة عند 395 نانومتر بينما ينتج عنه في نفس الوقت زيادة في الإثارة عند 475 نانومتر. تم إنشاء الطفيليات المعدلة وراثيا عن طريق استنساخ إطار القراءة المفتوح pHluorin2 في ناقل تعبير المثقبيات pLEW100v5 ، مما يتيح التعبير البروتيني المستحث في أي من مرحلتي دورة الحياة. تم استخدام التألق المناعي لتأكيد توطين الجليكوزوم للمستشعر الحيوي pHluorin2 ، ومقارنة توطين المستشعر الحيوي بالبروتين المقيم الجليكوزومي الألدولاز. تمت معايرة استجابة المستشعر عند مستويات مختلفة من الأس الهيدروجيني عن طريق احتضان الخلايا في سلسلة من المخازن المؤقتة التي تراوحت في الأس الهيدروجيني من 4 إلى 8 ، وهو نهج استخدمناه سابقا لمعايرة مستشعر الأس الهيدروجيني القائم على الفلوريسين. ثم قمنا بقياس مضان pHluorin2 عند 405 نانومتر و 488 نانومتر باستخدام قياس التدفق الخلوي لتحديد الرقم الهيدروجيني للجليكوزوم. لقد تحققنا من أداء الطفيليات الحية المعدلة وراثيا التي تعبر عن pHluorin2 ، ومراقبة درجة الحموضة بمرور الوقت استجابة للحرمان من الجلوكوز ، وهو محفز معروف لتحمض الجليكوزومات في طفيليات PF. تحتوي هذه الأداة على مجموعة من التطبيقات المحتملة ، بما في ذلك إمكانية استخدامها في فحص الأدوية عالي الإنتاجية. بالإضافة إلى درجة الحموضة الجليكوزومية ، يمكن تكييف المستشعر مع عضيات أخرى أو استخدامه في المثقبيات الأخرى لفهم ديناميكيات الأس الهيدروجيني في إعداد الخلية الحية.
Introduction
تعتمد الأراستيدات الحركية الطفيلية ، مثل معظم الكائنات الحية ، على الجلوكوز كمكون أساسي في استقلاب الكربون المركزي. تشمل هذه المجموعة الكائنات الحية المهمة طبيا ، مثل المثقبيات الأفريقية ، المثقبية البروسي. المثقبيات الأمريكية ، T. cruzi ؛ والطفيليات من جنس الليشمانيا. استقلاب الجلوكوز أمر بالغ الأهمية لنمو الطفيليات في مراحل دورة الحياة المسببة للأمراض. على سبيل المثال ، عند الحرمان من الجلوكوز ، يموت شكل مجرى الدم (BSF) من المثقبيات الأفريقية بسرعة. والجدير بالذكر أن تحلل السكر يعمل كمصدر وحيد ل ATP خلال هذه المرحلة من العدوى1. تعتمد طفيليات الليشمانيا أيضا على الجلوكوز في المضيف البشري ، مع مرحلة دورة حياة amastigote الموجودة في الضامة المضيفة التي تعتمد على مصدر الكربون هذا للنمو2.
في حين أن هذه الطفيليات لها أنماط حياة متميزة تتضمن ناقلات حشرات مختلفة ، إلا أنها تشترك في العديد من القواسم المشتركة في كيفية استجابتها للجلوكوز واستهلاكه. على سبيل المثال ، تقوم هذه الطفيليات بتوطين معظم إنزيمات تحلل السكر في بيروكسيسومات معدلة تسمى الجليكوسومات. ترتبط هذه العضية الخاصة بالأرومة الحركية ببيروكسيسومات الثدييات بناء على آليات التخليق الحيوي المحفوظة والتشكل3،4،5،6.
يوفر تجزئة معظم إنزيمات مسار تحلل السكر في الجليكوسوم وسائل خاصة بالطفيليات لتنظيم المسار. باستخدام مسبار الأس الهيدروجيني الكيميائي ، أثبتنا أن الحرمان من المغذيات يؤدي إلى تحمض سريع لجليكوسومات طفيلية الشكل الحلقية (PF) التي تؤدي إلى تغيير نشاط إنزيم حال للسكر من خلال التعرض لموقع ربط منظم خيفي على إنزيم هيكسيوكيناز تحلل السكر الرئيسي 7,8. في عملنا السابق ، تطلب المسبار الكيميائي تسليما ثابتا للاستخدام ، مما حد من فائدته في التطبيقات الأخرى. بالإضافة إلى ذلك ، حدت التحديات التي تم الحفاظ على توزيع المسبار في الجليكوسوم في BSF من فائدة النهج للتحقيق في درجة الحموضة الجليكوزومية في تلك المرحلة من الحياة.
في هذه الدراسة ، استخدمنا المستشعر الحيوي للبروتين الفلوري pHluorin2 لمراقبة تغير درجة الحموضة الجليكوزومية في BSF T. brucei استجابة للإشارات البيئية بما في ذلك تجويع الجلوكوز9 (الشكل 1). تشير نتائج هذا العمل إلى أن BSF T. brucei يحمض الجليكوسومات بسرعة استجابة للمجاعة بطريقة عكسية ، على غرار الاستجابات التي لاحظناها في طفيليات PF. نتوقع أن يحسن هذا المستشعر الحيوي فهمنا لتنظيم تحلل السكر في T. brucei والطفيليات ذات الصلة.
Protocol
يتطلب استخدام T. brucei brucei 90-13 BSF trypanosomes ، وهو خط طفيلي أحادي الشكل ، النظر في السلامة لأنها تعتبر كائنات من مجموعة المخاطر 2 التي يجب التعامل معها في مرافق السلامة الأحيائية من المستوى 2.
1. ثقافة المثقبيات ونقلها
- ثقافة T. brucei brucei 90-13 BSF المثقبيات في وسط HMI-9 مكمل ب 10٪ FBS معطل حراريا و 10٪ Nu-Serum عند 37 درجة مئوية في 5٪ CO210.
ملاحظة: للحفاظ على صحة المزرعة ، حافظ على كثافة الخلايا بين 2 × 104 و 5 × 106 خلايا / مل. - استنساخ pHluorin2-PTS1 إلى pLEW100v5
- توليف إطار القراءة المفتوح pHluorin2 تجاريا لإنتاج الجين بامتداد 3 بوصات يشفر رابطين جليكاين متبوعا بثلاثي الببتيد AKL ، علامة توطين PTS1.
- استنساخ هذا البناء في ناقل تعبير المثقبيات المستحث pLEW100v5 عن طريق هضم التقييد. هضم مزدوج لكل من ناقل الاستنساخ الذي يحتوي على pHluorin2-PTS1 و pLEW100v5 باستخدام HindIII و BamHI11. قم بإجراء خطوة تنظيف ، ويفضل أن يكون ذلك عن طريق تنقية هلام الأغاروز ، لإزالة إنزيمات التقييد ، والعمود الفقري لناقل الاستنساخ غير المرغوب فيه ، والجزء المحتوي على جين لوسيفيراز المستأصل.
- أدخل الحامل pHluorin2 في pLEW100v5 المهضوم باستخدام T4 DNA Ligase12. (انظر الشكل التكميلي S1 للاطلاع على مخطط للاستنساخ).
- تسلسل البلازميد عن طريق الجيل التالي من تسلسل البلازميد الكامل للتحقق من ربط الإدخال والناقل بشكل صحيح وأنه لا يتم إدخال أي طفرات داخل جين pHluorin2-PTS1 أثناء عملية الاستنساخ.
ملاحظة: تم إرسال تسلسل البلازميد الكامل إلى Addgene.org وتم تعيينه # 83680. - خطي 20 ميكروغرام من البلازميد عن طريق الهضم مع 40 وحدة من NotI ؛ بعد ذلك ، انتقل إلى طفيليات BSF 90-13 عبر النواة باستخدام مجموعة الخلايا التائية البشرية المشار إليها (انظر جدول المواد). حدد للتكامل المستقر كما هو موضح بواسطة Burkard et al.13.
2. التموضع المناعي المشترك لل pHlourin2-PTS1
- تحضير الشرائح المجهرية عن طريق معالجتها باستخدام poly-L-lysine 0.1٪ (w / v) في H2O لمدة 10 دقائق. بعد إزالة محلول poly-L-lysine ، اغسل الشريحة مرة واحدة باستخدام PBS.
- للحث على تعبير pHluorin2-PTS1 ، عالج الخلايا عند 2 × 105 خلايا / مل باستخدام التتراسيكلين أو الدوكسيسيكلين (1 ميكروغرام / مل) قبل 24 ساعة من الحصاد. بيليه 2 × 106 طفيليات pLEWpHluorin2-PTS1 (pHL) الأبوية والمستحثة عن طريق الطرد المركزي (درجة حرارة الغرفة [RT] ، 10 دقائق ، 1000 × جم) وتغسل مرة واحدة مع برنامج تلفزيوني.
- أعد تعليق الخلايا في 200 ميكرولتر من بارافورمالدهايد 2٪ طازجة في PBS مصنوعة من محلول درجة EM 16٪ الموردة تجاريا. ضع الخلايا الموجودة في المثبت على الشريحة واترك الخلايا تستقر لمدة 30 دقيقة. اغسل الخلايا الملتصقة 2x بمحلول الغسيل (0.1٪ مصل الماعز الطبيعي في PBS).
- ضع محلول النفاذية (0.5٪ Triton X-100 في PBS) على الخلايا واحتضانها لمدة 30 دقيقة بالضبط. قم بإزالة محلول النفاذية واغسله مرة واحدة بكميات كبيرة من محلول الغسيل.
- ضع محلول الكتلة (10٪ مصل الماعز الطبيعي و 0.1٪ Triton X-100 في PBS) واحتضانه لمدة 30 دقيقة.
- تمييع الأمصال المضادة التي أثيرت ضد T. brucei aldolase 1: 500 في محلول كتلة وتطبيقه على الخلايا14. احتضان لمدة 1 ساعة في RT. اغسل الشرائح لمدة 5 مرات لمدة 3-5 دقائق بمحلول الغسيل.
- تمييع الماعز المضادة للأرانب اليكسا فلور 568 1: 1000 في محلول كتلة وتطبيقها على الخلايا. احتضان لمدة 1 ساعة في RT. اغسل الشرائح لمدة 5 مرات لمدة 3-5 دقائق بمحلول الغسيل.
- ضع وسيط التثبيت وأغلق غطاء على الشريحة.
- قم بتصوير الخلايا بهدف 100x (NA 1.4-0.7) وقم بتحليل الصور باستخدام ImageJ. قم بإجراء تحليل التوطين المشترك ل Pearson باستخدام المكون الإضافي "Coloc 2" ل ImageJ. انظر الشكل التكميلي S2 لحقل الخلايا التمثيلية. )
- لإكمال ذلك ، أضف ملف الصورة إلى فيجي وحدد الصور.
- اضبط السطوع والتباين لكل قناة إلى نقطة لا تظهر فيها الخلفية.
- قم بتغيير الصور من 16 بت إلى 8 بت ، ودمج الصور ، ثم اقتصاصها إلى خلية واحدة مع قنوات مقسمة.
- ضمن التحليل والتوطين المشترك، حدد المكون الإضافي Coloc2. حدد aldolase ( القناة الحمراء) كقناة 1 و pHL ( القناة الخضراء) كقناة 2 وانقر فوق موافق لبدء حساب ارتباط بيرسون.
3. إعداد عينة لقياس التدفق الخلوي
- تحفيز خلايا pHL إما بالتتراسيكلين أو الدوكسيسيكلين (1 ميكروغرام / مل) بين عشية وضحاها.
- بيليه الخلايا (~ 4 × 107 pHL و ~ 1 × 106 الوالدين) عن طريق الطرد المركزي (RT ، 10 دقائق ، 1000 × جم). قم بإزالة المادة الطافية وإعادة تعليق الخلايا في 1 مل من PBS إما مع أو بدون 10 mM الجلوكوز اعتمادا على ما إذا كانت العينة جائعة أو غير جوعية. بالنسبة لمقايسات الدورة الزمنية ، أعد التعليق في برنامج تلفزيوني مكمل بجلوكوز 10 مللي مول لمنع الخلايا من الجوع حتى تكتمل عمليات الغسيل. بالنسبة لفحص الشاشة عالية الإنتاجية (HTS) ، أعد التعليق في PBS بدون جلوكوز لتقليل ترحيل الجلوكوز ؛ كرر الغسل مرتين أخريين.
- قم بطرد الخلايا للمرة الرابعة ، وإزالة المادة الطافية ، وإعادة تعليق حبيبات الخلية إما في PBS أو PBS بالإضافة إلى 5 mM glucose أو PBS بالإضافة إلى 10 mM glucose اعتمادا على العلاج. استكمل العينات إما ب 1 ميكروغرام / مل من يوديد البروبيديوم (PI) أو 100 نانومتر ثيازول أحمر (TR) لتحديد الأحياء / الأموات. انقل كل عينة إلى أنابيب سعة 5 مل متوافقة مع مقياس التدفق الخلوي.
4. قياس التدفق الخلوي
ملاحظة: قم بإعداد التجربة على مقياس التدفق الخلوي الذي يحتوي على أشعة الليزر التالية: 405 نانومتر (بنفسجي) و 488 نانومتر (أزرق) و 561 نانومتر (أصفر) أو 638 نانومتر (أحمر). انظر الجدول التكميلي S1 للاطلاع على الأسماء الشائعة للقنوات التي تمت مناقشتها أدناه.
- لقياس مضان pHL ، استخدم القنوات KO525 (VL2-H ، الإثارة 405 نانومتر ، الانبعاث 542/27 نانومتر) و FITC (BL1-H ، الإثارة 488 نانومتر ، الانبعاثات 530/30 نانومتر). للتمييز بين الخلايا الحية والخلايا الميتة ، استخدم إما PI أو TR ؛ قياس PI على قناة YL2-H (إثارة 561 نانومتر ، انبعاث 620/25 نانومتر). قم بقياس TR على قناة RL1-H (إثارة 638 نانومتر ، 660/10 BP).
- لإعداد التجربة على برنامج مقياس التدفق الخلوي ، قم بإنشاء المخططات التالية: 1) الرسم البياني لقناة YL2-H (في حالة استخدام PI) أو الرسم البياني لقناة RL1-H (في حالة استخدام TR) ، 2) مخطط نقطة FSC-A مقابل SSC-A ، 3) مخطط نقطة FSC-A مقابل FSC-H ، و 4) مخطط نقطة قناة BL1-H مقابل VL2-H.
- ضع عنصر التحكم WT (خط الخلية الأبوية) غير الملوث على منفذ حقن العينة (SIP) أولا وارفع المرحلة إلى موضعها. ابدأ في الحصول على بيانات على مقياس الخلايا بأقل معدل تدفق لإعطاء الوقت لإجراء التعديلات اللازمة. لتجنب تسجيل الحطام الزائف والخلايا الميتة ، ابدأ في تسجيل الأحداث بعد 5 ثوان من بدء الحصول على العينة.
- اضبط جهد YL2 أو RL1 بحيث تكون الذروة الرئيسية في حدود 103-10 4 وحدات شدة مضان نسبية (RFI). اضبط الفولتية FSC و SSC بحيث تتلاءم >90٪ من الأحداث مع الرسم النقطي. اضبط عتبة FSC لاستبعاد مجموعة الحطام ولكن ليس الخلايا المحتملة.
- اضبط قنوات VL2 و BL1 بحيث تكون الذروة الأساسية في حدود 103-10 4 وحدات RFI للتحكم في WT غير الملوث.
- ضع العينة الأولى التي تحتوي على pHL المستحث الملطخ إما ب PI أو TR على SIP وارفع المرحلة إلى موضعها. ابدأ في الحصول على البيانات بأقل معدل تدفق وراقب الأحداث بعناية في كل مؤامرة. تأكد من أن >90٪ من الأحداث موجودة داخل كل قطعة أرض وأنه لا توجد أحداث تشبع قنوات VL2-H و BL1-H.
- تابع تشغيل العينات. تأكد من تسجيل ما لا يقل عن 10000 حدث لكل عينة.
- احفظ البيانات من العينات بتنسيق ملف .fcs وقم بتصديرها للتحليل.
5. تحليل بيانات نتائج قياس التدفق الخلوي
ملاحظة: يستخدم سير عمل تحليل البيانات هذا برنامج FlowJo. إذا تم استخدام برامج أخرى لتحليل التدفق الخلوي ، فاستمر في اتباع الخطوات الرئيسية الموضحة أدناه ، باستخدام أدوات مناسبة للبرامج. لتصور المؤامرات والبوابات ، انظر الشكل التكميلي S3 والشكل التكميلي S4.
- افتح تخطيطا جديدا وافتح ملفات .fcs التي تم الحصول عليها في الخطوة 4.3. اسحب ملفات .fcs وأفلتها في نافذة التخطيط.
- بوابة للخلايا الحية.
- انقر نقرا مزدوجا فوق عنصر تحكم WT غير ملوث لفتح نافذة لهذا النموذج.
- اعرض البيانات كمدرج تكراري على قناة YL2-H (في حالة استخدام PI) أو RL2-H (في حالة استخدام TR). قم بالتبديل بين هذا والعينات الملطخة بصبغة الصلاحية لتحديد السكان الأحياء والأموات.
ملاحظة: يجب أن تكون جميع الأحداث غير ملوثة حيث لم تتم إضافة صبغة صلاحية إلى هذه العينة. - إنشاء بوابة ثنائية المنصف تقسم السكان الأحياء والأموات ؛ اسم البوابة اليسرى لايف والبوابة اليمنى ميت. قم بتطبيق هذه البوابة على جميع العينات ثم قم بالتبديل بين العينات لضمان رسم هذه البوابة بشكل مناسب لجميع العينات. اضبط البوابة حسب الحاجة.
- بوابة للخلايا.
- في عنصر تحكم WT غير الملوث ، انقر نقرا مزدوجا فوق البوابة المباشرة لعرض الأحداث في تلك البوابة. قم بتغيير المحور السيني للرسم النقطي إلى FSC-A والمحور y إلى SSC-A.
- استخدم أداة بوابة المضلع لرسم بوابة حول محتوى الخلية وتسميتها خلايا. احرص على استبعاد خلايا الحطام/الموت (عادة في أقصى يسار وأسفل الرسم النقطي) والتجمعات (أقصى يمين وأعلى المخطط النقطي).
- قم بتطبيق هذه البوابة تحت البوابة الحية لجميع العينات. قم بالتبديل بين العينات للتأكد من أن البوابة تشمل عدد الخلايا المحتمل لجميع العينات وإجراء التعديلات اللازمة. تأكد من إعادة تطبيق البوابة على جميع العينات بعد تغييرها.
ملاحظة: يتغير توزيع عدد الخلايا بشكل ملحوظ بين الظروف الجائعة وغير الجائعة على FSC مقابل SSC ؛ تأكد من أن بوابة الخلية تشمل سكان الخلايا في جميع الظروف.
- بوابة للخلايا المفردة لزيادة جودة قياسات الأس الهيدروجيني.
- في عنصر تحكم WT غير الملوث ، انقر نقرا مزدوجا فوق بوابة الخلية لعرض الأحداث في تلك البوابة. قم بتغيير المحور x لرسم النقاط إلى FSC-A والمحور y إلى FSC-H.
- ابحث عن توزيع قطري للخلايا المفردة على هذا المخطط النقطي مع مضاعفة تشكل مجموعة سكانية ثانوية إلى أسفل يمين السكان المفردين (انظر الشكل التكميلي S1 الرسم الثالث). باستخدام أداة البوابة المضلعة، ارسم بوابة حول أحداث المفردة باستثناء المحتوى المزدوج. اسم هذه البوابة المفردات.
- قم بتطبيق بوابة Singlets أسفل بوابة الخلية لجميع العينات. مرة أخرى ، قم بالتبديل بين العينات للتأكد من أن البوابة تستبعد بشكل صحيح السكان المزدوجين مع تضمين السكان الفرديين. اضبط حسب الحاجة.
- بوابة لخلايا HL الفلورية.
- في عينة التحكم WT غير الملوثة ، انقر نقرا مزدوجا فوق بوابة Singlets لفتح مخطط نقطي لتلك المجموعة. قم بتغيير المحور السيني إلى BL1-H والمحور ص إلى VL2-H.
- مستشعر الأس الهيدروجيني pHluorin2 هو الفلورسنت في كل من VL2 و BL1. استخدم أداة البوابة المضلعة لرسم بوابة قطرية الشكل تمتد إلى الأعلى وبعيدا عن مجموعة الفلورسنت الذاتي في أسفل يسار الرسم النقطي. قم بتسمية هذه البوابة pHL +.
- قم بتطبيق بوابة pHL + أسفل بوابة Singlets لجميع العينات. قم بالتبديل إلى عينة pHL واضبط البوابة لتضمين الأحداث ذات كثافة مضان أكبر في كل من VL2-H و BL1-H من عنصر تحكم WT. تأكد من أن هذه البوابة تشمل هذه المجموعة الفلورية لجميع العينات لأن موضع هذه المجموعة سيتغير مع تغير الرقم الهيدروجيني للجليكوزوم.
ملاحظة: يرجع هذا التحول الصغير ولكن المرئي في عدد الأشخاص + إلى التغيرات المعتمدة على الأس الهيدروجيني في طيف الإثارة في الفلوروفور.
- تصدير الإحصاءات.
- انقر فوق محرر الجدول | شريط التحرير | إضافة عمود لإضافة إحصائيات جديدة للتصدير.
ملاحظة: لكل إحصائية للتصدير، اختر الإحصائية المعنية والسكان الذين سيتم تصديرها منها. تأكد من اختيار المعلمة المناسبة للإحصاءات القابلة للتطبيق مثل الوسيط. اترك العينة دون تغيير. - أضف أعمدة تحتوي على الإحصائيات التالية: إجمالي العدد (غير المؤرخ) ، عدد pHL + ، التكرار المباشر من الإجمالي (النسبة المئوية بناء على إجمالي الأحداث) ، pHL + Freq. للأصل (النسبة المئوية بناء على البوابة الرئيسية) ، pHL + الوسيط VL2-H ، و pHL + الوسيط BL1-H.
- انقر فوق محرر الجدول وقم بتغيير إعدادات التصدير التالية: عرض إلى ملف ونص إلى CSV ثم اختر وجهة الملف واسمه. انقر فوق إنشاء جدول.
- انقر فوق محرر الجدول | شريط التحرير | إضافة عمود لإضافة إحصائيات جديدة للتصدير.
- احسب نسبة التألق.
- احفظ ملف .csv الذي تم تصديره كملف جدول بيانات.
- قم بإجراء تحليل مراقبة الجودة من خلال مقارنة ما يلي عبر جميع العينات في التجربة: عدد الأحداث لكل عينة ، والنسبة المئوية للأحداث الحية ، والنسبة المئوية لأحداث pHL +. قارن هذه بصريا في مخططات شريطية أو مبعثرة حسب التجربة.
- قم بتسمية عمود جديد ك pHL + Median VL2 / BL1. لكل عينة ، قسم متوسط قيمة VL2-H على متوسط قيمة BL1-H كما هو موضح في المعادلة (1).
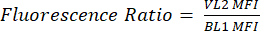 (1)
(1)
- استخدم برنامج التحليل الإحصائي لإجراء التحليل الإحصائي باستخدام نسبة التألق.
6. معايرة المستشعر الحيوي لدرجة الحموضة
ملاحظة: لتحويل نسب التألق المقاسة إلى وحدات الأس الهيدروجيني ، قم بمعايرة الخلايا المعبرة عن pHL باستخدام النيجيريسين والفالينوميسين. النيجريسين هو مضاد K + / H + ، وهو أيونوفور يمكنه موازنة الأس الهيدروجيني عبر الأغشية عندما يكون هناك ما يكفي من K + في المخزن المؤقت15. يستخدم النيجريسين بشكل شائع لمعايرة pHluorin وأجهزة استشعار الأس الهيدروجيني الأخرى16,17. نظرا لأن pHluorin الموضعي البيروكسيسومولي تمت معايرته سابقا باستخدام 10 ميكرومتر نيجيريسين18 ، فقد اخترنا العلاج بهذا التركيز. Valinomycin هو أيونوفور البوتاسيوم وقد استخدم (عند 4 μM) لموازنة الأس الهيدروجيني عبر أغشية الميتوكوندريا19. استخدمنا 10 ميكرومتر فالينوميسين للمساعدة في نشاط توازن الأس الهيدروجيني للنيجيريسين من خلال ضمان توازن أيونات K + عبر الأغشية. بينما استخدمنا تركيبة نيجيريسين وفالينوميسين ، قد يكون النيجيريسين كافيا لموازنة درجة الحموضة العضوية.
- قم بإعداد ثمانية حلول للمخزن المؤقت للمعايرة العالمية (UCB ؛ 15 mM MES ، 15 mM HEPES ، و 130 mM KCl) لكل منها عند درجة حموضة مختلفة تتراوح من 5 إلى 8.5.
- أجهزة الطرد المركزي (RT ، 10 دقائق ، 800-1000 × جم) ثمانية أنابيب منفصلة من 2 مل من ثقافة BSF المعبرة عن pHL (~ 4 × 106 خلايا لكل منهما).
- قم بإزالة المادة الطافية ثم أعد تعليق كل حبيبة خلية في UCB بقيم أس هيدروجيني مختلفة.
- إدخال النيجيريسين والفالينوميسين ، كل منهما إلى 10 ميكرومتر. ارتفاع في PI إلى 1 ميكروغرام / مل.
- احتضان الخلايا في كل محلول لمدة 15 دقيقة.
- قم بتشغيل كل عينة على مقياس التدفق الخلوي لقياس نسبة التألق كما هو موضح في الخطوات 4-5.
- كرر هذه التجربة مرتين أخريين للحصول على ثلاث نسخ بيولوجية لكل قيمة أس هيدروجيني. تصدير البيانات بتنسيق .fcs.
- تحليل ملفات .fcs كما هو موضح في الخطوات من 5.1 إلى 5.8. استخدم نسبة التألق المقاسة لكل أس هيدروجيني لاستيفاء الأس الهيدروجيني الجليكوزومي في التجارب المستقبلية باستخدام المعادلة (2).
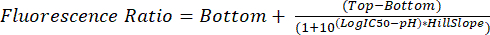 (2)
(2)
ملاحظة: يوضح الشكل التكميلي S3 مخططات النقاط ومخطط البوابات. يمكن العثور على النتائج في الجدول التكميلي S2. فيما يلي وصف لكيفية استيفاء الأس الهيدروجيني من نسبة التألق باستخدام GraphPad Prism. إذا كنت تستخدم برنامجا إحصائيا آخر ، فاتبع نفس الخطوات الرئيسية.- افتح منشور لوحة الرسم البياني وقم بإنشاء جدول XY بثلاث نسخ متماثلة y. الصق قيم الأس الهيدروجيني في العمود x وقيم نسبة التألق المرتبطة بها في أعمدة y-replicate.
- انقر على الرسم البياني المرتبط بالجدول. عند عرض الرسم البياني ، انقر فوق تحليل أسفل شريط التحليل | استيفاء منحنى قياسي تحت تحليلات XY.
- اختر Sigmoidal ، 4PL ، X هو log (تركيز) لأن وحدات الأس الهيدروجيني على مقياس لوغاريتمي. المعلمات العلوية والسفلية هي الهضاب العلوية والسفلية المقدرة. اختر لا معالجة خاصة للقيم المتطرفة.
ملاحظة: سيسعى البرنامج إلى ملاءمة البيانات مع النموذج الموضح في المعادلة (2) والخطوة 6.9.3. ابحث عن دليل على عدم الملاءمة في جدول النتائج والمنحنى على الرسم البياني. - لاستيفاء الأس الهيدروجيني من نسب التألق في تجارب أخرى ، انتقل إلى الجدول الذي يحتوي على بيانات معايرة pHL. الصق قيم نسبة التألق أسفل بيانات المعايرة في العمود (الأعمدة) y. امنح كل قيمة y عنوانا ولكن اترك قيمة x (الرقم الهيدروجيني) فارغة لأنها غير معروفة.
- في معرض النتائج ، انقر فوق تحليل الاستيفاء ثم انتقل إلى علامة التبويب النسخ المتماثلة X المقحمة . ابحث عن قيم الأس الهيدروجيني المقحمة التي سيتم سردها جنبا إلى جنب مع قيم نسبة التألق المدخلة.
ملاحظة: يستخدم البرنامج قيم النموذج والمعلمات الأكثر ملاءمة الموجودة من بيانات المعايرة لاستيفاء الأس الهيدروجيني من نسب التألق للتجارب التي يكون فيها الرقم الهيدروجيني غير معروف.
7. تجويع الجلوكوز ودورات وقت الإضافة
- تحفيز 15 مل من طفيليات BSF pHL طوال الليل مع 1 ميكروغرام / مل دوكسيسيكلين محتضن عند 37 درجة مئوية كما هو موضح في الخطوة 1.1.
- اغسل 15 مل من ثقافة الأس الهيدروجيني المستحثة في برنامج تلفزيوني مكمل بجلوكوز 10 ملليمتر. كرر هذه الخطوة 3x.
- في الوقت نفسه ، اغسل 3 مل من ثقافة WT في PBS 3x كما هو موضح في الخطوة 3.2.
- بعد الغسيل الأول عند إعادة تعليق عينة pHL في 1 مل من PBS ، قم بإزالة 0.1 مل من حصة معلق خلية pHL للاحتفاظ بها في 10 mM الجلوكوز كعنصر تحكم غير جوع.
- بعد الغسيل النهائي ، أعد تعليق عينة pHL في PBS المكملة ب 1 ميكروغرام / مل PI.
- الحصول على بيانات قياس التدفق الخلوي
- ابدأ في مراقبة الرقم الهيدروجيني للجليكوزوم لكل من العينات الجائعة وغير الجائعة عن طريق قياس كل عينة على مقياس التدفق الخلوي كل 5 أو 10 أو 30 أو 90 دقيقة ، اعتمادا على التجربة والعينة. الحصول على بيانات قياس التدفق الخلوي كما هو موضح في الخطوات من 4.1 إلى 4.3 ، مما يضمن إعداد الفولتية والمؤامرات مسبقا.
- قم بتشغيل عنصر التحكم WT غير الملوث أولا في 0 دقيقة.
- قم بتشغيل عينة التحكم غير الجائعة على مقياس الخلايا كل 90 دقيقة بدءا من 0 دقيقة. بالنسبة لفحص الدورة الزمنية للتجويع ، قم بتشغيل العينة الجائعة كل 10 دقائق بدءا من 0 دقيقة. بالنسبة لمقايسة الجلوكوز Addback ، قم بتشغيل العينة الجائعة في 0 و 5 و 10 و 20 و 30 و 60 و 90 دقيقة ؛ ثم كرر بعد إدخال الجلوكوز.
- احتضان العينات في درجة حرارة الغرفة خلال دورة وقت الجوع لمدة 90 دقيقة ودورة وقت إضافة الجلوكوز لمدة 180 دقيقة.
- تحليل ملفات .fcs كما هو موضح في الخطوات من 5.1 إلى 5.8.
ملاحظة: يوضح الشكل التكميلي S4 كيفية تنفيذ البوابات وكيف يجب أن تبدو المخططات النقطية. يوضح الجدول التكميلي S3 والجدول التكميلي S4 نتائج فحص دورة وقت تجويع الجلوكوز ومقايسة دورة وقت إضافة الجلوكوز ، على التوالي.
8. تحسين الفحص لفحص المخدرات
- اغسل ما يقرب من 32 مل من طفيليات BSF المعبرة عن pHL و 3 مل من خلايا WT ، كلاهما في حوالي 2 × 106 خلايا / مل ، 2x في PBS كما هو موضح سابقا.
ملاحظة: يجب تسجيل أكثر من 10000 حدث لكل بئر لتقليل تباين نسب التألق المقاسة وقياس إحصائية عامل Z بدقة. الحد الأدنى من الثقافة اللازمة لتحقيق ذلك هو حوالي 26 مل ، لكننا نوصي ب 32 مل لسهولة التعامل.- بعد الغسيل الأول ، افصل عينة pHL بالتساوي إلى أنبوبي طرد مركزي دقيقين.
- بعد الغسيل ، أعد تعليق عينة pHL واحدة في 18 مل من PBS تحتوي على 5 mM الجلوكوز ، 0.1٪ DMSO ، و TR. أعد تعليق عينة pHL الأخرى في 18 مل من PBS بالإضافة إلى 0.1٪ DMSO و TR.
ملاحظة: يتم استخدام DMSO لتقليد تكوين المخزن المؤقت في شاشة الدواء حيث يتم إذابة المركبات عادة في DMSO. - انقل هذين المحلولين الخلويين إلى خزان مكون من 12 بئرا ، 9 مل لكل بئر.
- استخدم روبوت سحب الماصات لسحب محاليل الخلايا إلى نصفين منفصلين من صفيحة 384 بئرا ، 80 ميكرولتر لكل بئر.
- احتضان اللوحة في درجة حرارة الغرفة لمدة 1.5 ساعة ، ورجها برفق ولفها بورق الألمنيوم لحماية الفلوروفورات من الضوء.
- قم بتشغيل اللوحة على مقياس تدفق خلوي قادر على تشغيل 384 لوحة بئر.
ملاحظة: يتم تكييف سير العمل التالي مع Attune NxT مع Cytkick Max Auto Sampler. إذا تم استخدام مقياس تدفق خلوي آخر ، فاستمر في اتباع الخطوات الرئيسية.- بالنسبة للوحة، قم بتشغيلها بأسرع معدل تدفق (1000 ميكرولتر/دقيقة) وقم بتمكين وضع التعزيز. الحصول على 20 ميكرولتر / بئر. قم بتضمين دورة خلط واحدة ودورة شطف واحدة بين كل بئر.
- إنشاء قطع الأراضي كما هو موضح في الخطوة 4.1.3.
- قم بتشغيل التحكم في أنبوب WT غير الملوث وتحسين الفولتية كما هو موضح في الخطوتين 4.1.3 و 4.1.4. قم بتشغيل عينة أنبوب pHL المتعطشة وتحسين الفولتية VL2 و BL1 كما هو موضح في الخطوة 4.1.
- البدء في الحصول على لوحة على مقياس التدفق الخلوي. قم بتشغيل اللوحة أفقيا حتى لا يكون هناك فرق كبير في وقت الاستحواذ بين آبار العينات الجائعة وغير الجائعة. تأكد من الانتهاء من الحصول على اللوحة في ~ 1.5 ساعة.
- تصدير ملفات .fcs وتحليل البيانات كما هو موضح في الخطوات من 5.1 إلى 5.8. أوجد المتوسط (AVG) والانحراف المعياري (SD) لنسب التألق للعينات المعالجة إما بالجلوكوز (Glc) أو بدون جلوكوز (جائع).
ملاحظة: يمكن العثور على البيانات من تجارب عامل Z الخاصة بنا في الجدول التكميلي S5. - احسب إحصائية العاملZ 20 باستخدام المعادلة (3).
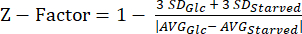 (3)
(3)
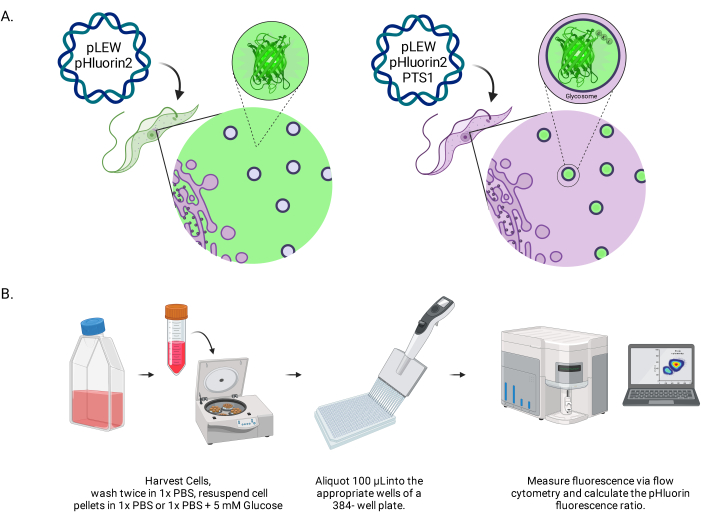
الشكل 1: شكل لطريقة تسجيل الأس الهيدروجيني للجليكوزوم في المثقبيات الحية BSF. (أ) تصوير خطوط الخلايا التي تعبر عن مستشعر pHluorin2 الموجود جليكوزوميا. يوفر تضمين تسلسل استهداف بيروكسيسومال التحكم في التوطين. ملاحظة: نتوقع أن يؤدي التخلص من PTS-1 إلى توطين الخلايا الخلوية ، مما يسمح بتحليل الأس الهيدروجيني في المستقبل في تلك الحجرة تحت الخلوية. (ب) تصوير مقايسة التحقق من صحة المستشعر. اختصار: BSF = شكل مجرى الدم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: يتم استخدام إحصائية عامل Z لتحديد مدى ملاءمة الفحص ل HTS. تعني القيم بين 0.5 و 1.0 عموما أن جودة الفحص مقبولة ل HTS.
النتائج
توطين pHLuorin2-PTS1 إلى الجليكوسومات في BSF T. brucei
لتقييم التوطين تحت الخلوي لل pHluorin2-PTS1 ، تعرضت الطفيليات لمقايسات التألق المناعي. إشارة من جين التحوير المتزامن مع الأمصال المضادة التي أثيرت ضد بروتين مقيم في الجليكوزوم ، ألدولاز (TbAldolase) (الشكل 2 أ). كان متوسط معامل ?...
Discussion
إن آليات الإدراك والاستجابة البيئية في المثقبيات الأفريقية غير مفهومة بشكل جيد. من المعروف أن التغييرات في توافر المغذيات تؤدي إلى استجابات متنوعة في الطفيلي ، بما في ذلك تحمض الجليكوزومات. لقد وصفنا هنا طريقة لدراسة استجابة الأس الهيدروجيني الجليكوزومي للاضطرابات البيئية في الخلايا ال...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم استنساخ pHluorin2-PTS1 إلى pLEW100v5 بواسطة Twist Bioscience الذي قدم البناء في ناقل استنساخ عالي النسخ. كان pLEW100v5 هدية من الدكتور جورج كروس. يتوفر المصل المضاد الذي أثير ضد T. brucei aldolase من الدكتورة ميريديث تي موريس ، جامعة كليمسون ، عند الطلب. تم دعم العمل من مختبرات JCM و KAC جزئيا بجائزة من المعاهد الوطنية للصحة (R01AI156382). تم دعم SSP بواسطة NIH 3R01AI156382.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mL Tissue Culture Flasks (Non-treated, sterile) | VWR | 10861-572 | |
| 75 cm2 Tissue Culture Flask (Non-Treated, sterile) | Corning | 431464U | |
| 80 µL flat-bottom 384-well plate | BrandTech | 781620 | |
| Amaxa Human T Cell Nucleofector Kit | Lonza | VPA-1002 | |
| Attune NxT Flow Cytometer | invitrogen by Thermo Fisher Scientific | A24858 | FlowJo software |
| BRANDplates 96-Well, flat bottom plate | Millipore Sigma | BR781662 | |
| Coloc 2 plugin of ImageJ | https://imagej.net/plugins/coloc-2 | ||
| CytKick Max Auto Sampler | invitrogen by Thermo Fisher Scientific | A42973 | |
| CytoFLEX Flow Cytometer | Beckman-Coulter | ||
| Electron Microscopy Sciences 16% Paraformaldehyde Aqueous Solution, EM Grade, 10 mL Ampoule | Fisher Scientific | 50-980-487 | |
| GraphPad Prism | statistical software | ||
| Nigericin (sodium salt) | Cayman Chemical | 11437 | |
| Nucleofector 2b | Lonza | Discontinued Product | |
| OP2 Liquid Handler | opentrons | OP2 | |
| poly-L-lysine, 0.1% (w/v) in H2O | Sigma Life Science | CAS:25988-63-0 | Pipetting robot for HTS assay |
| Thiazole Red (TO-PRO-3) | biotium | #40087 | We machined a custom acrylic plate stand so this brand of plate could be detected and used on our CytKick Max Auto Sampler |
| valinomycin | Cayman Chemical | 10009152 | Pipetting robot for HTS assay |
| For pH calibration | |||
| For pH calibration |
References
- Coley, A. F., Dodson, H. C., Morris, M. T., Morris, J. C. Glycolysis in the African trypanosome: Targeting enzymes and their subcellular compartments for therapeutic development. Molecular Biology International. 2011, 123702 (2011).
- Mcconville, M. J., Saunders, E. C., Kloehn, J., Dagley, M. J. Leishmania carbon metabolism in the macrophage phagolysosome- feast or famine. F1000Res. 4, 938 (2015).
- Parsons, M. Glycosomes: Parasites and the divergence of peroxisomal purpose. Molecular Microbiology. 53 (3), 717-724 (2004).
- Parsons, M., Furuya, T., Pal, S., Kessler, P. Biogenesis and function of peroxisomes and glycosomes. Molecular and Biochemical Parasitology. 115 (1), 19-28 (2001).
- Haanstra, J. R., Gonzalez-Marcano, E. B., Gualdron-Lopez, M., Michels, P. A. Biogenesis, maintenance and dynamics of glycosomes in trypanosomatid parasites. Biochimica et Biophysica Acta. 1863 (5), 1038-1048 (2016).
- Allmann, S., Bringaud, F. Glycosomes: A comprehensive view of their metabolic roles in t. Brucei. International Journal of Biochemistry and Cell Biology. 85, 85-90 (2017).
- Dodson, H. C., Morris, M. T., Morris, J. C. Glycerol 3-phosphate alters Trypanosoma brucei hexokinase activity in response to environmental change. The Journal of Biological Chemistry. 286 (38), 33150-33157 (2011).
- Lin, S., Morris, M. T., Ackroyd, P. C., Morris, J. C., Christensen, K. A. Peptide targeted delivery of pH sensor for quantitative measurements of intraglycosomal pH in live Trypanosoma brucei. Biochemistry. 52 (21), 3629-3637 (2013).
- Mahon, M. J. Phluorin2: An enhanced, ratiometric, pH-sensitive green florescent protein. Advances in Bioscience and Biotechnology. 2 (3), 132-137 (2011).
- Wirtz, E., Leal, S., Ochatt, C., Cross, G. A. A tightly regulated inducible expression system for conditional gene knock-outs and dominant-negative genetics in Trypanosoma brucei. Molecular and Biochemical Parasitology. 99 (1), 89-101 (1999).
- . Restriction digest v.2 Available from: https://www.protocols.io/view/restriction-digest-nkqdg33pg25z/v2 (2018)
- . Ligation protocol with t4 DNA ligaase (m0202) v.3 Available from: https://www.protocols.io/view/ligation-protocol-with-t4-dna-ligase-m0202-95qpvorzv4o1/v3 (2021)
- Burkard, G., Fragoso, C. M., Roditi, I. Highly efficient stable transformation of bloodstream forms of Trypanosoma brucei. Molecular and Biochemical Parasitology. 153 (2), 220-223 (2007).
- Crowe, L. P., Wilkinson, C. L., Nicholson, K. R., Morris, M. T. Trypanosoma brucei pex13.2 is an accessory peroxin that functions in the import of peroxisome targeting sequence type 2 proteins and localizes to subdomains of the glycosome. mSphere. 5 (1), e00744 (2020).
- Kucejova, B., Kucej, M., Petrezselyova, S., Abelovska, L., Tomaska, L. A screen for nigericin-resistant yeast mutants revealed genes controlling mitochondrial volume and mitochondrial cation homeostasis. Genetics. 171 (2), 517-526 (2005).
- Huynh, M. H., Carruthers, V. B. Toxoplasma gondii excretion of glycolytic products is associated with acidification of the parasitophorous vacuole during parasite egress. PLoS Pathogens. 18 (5), e1010139 (2022).
- Lehoux, S., Abe, J., Florian, J. A., Berk, B. C. 14-3-3 binding to Na+/H+ exchanger isoform-1 is associated with serum-dependent activation of Na+/H+ exchange. TheJournal of Biological Chemistry. 276 (19), 15794-15800 (2001).
- Jankowski, A., et al. In situ measurements of the ph of mammalian peroxisomes using the fluorescent protein phluorin. The Journal of Biological Chemistry. 276 (52), 48748-48753 (2001).
- Jankowski, A., Grinstein, S. A. A noninvasive fluorimetric procedure for measurement of membrane potential. Quantification of the NADPH oxidase-induced depolarization in activated neutrophils. The Journal of Biological Chemistry. 274 (37), 26098-26104 (1999).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Lin, S., et al. Ph regulation in glycosomes of procyclic form Trypanosoma brucei. The Journal of Biological Chemistry. 292 (19), 7795-7805 (2017).
- Ha, D. S., Schwarz, J. K., Turco, S. J., Beverley, S. M. Use of the green fluorescent protein as a marker in transfected Leishmania. Molecular and Biochemical Parasitology. 77 (1), 57-64 (1996).
- Kelly, J. M., Ward, H. M., Miles, M. A., Kendall, G. A shuttle vector which facilitates the expression of transfected genes in Trypanosoma cruzi and Leishmania. Nucleic Acids Research. 20 (15), 3963-3969 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved