Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure des changements dynamiques du pH glycosomal chez Trypanosoma brucei vivant
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous décrivons une méthode pour étudier comment le pH répond aux signaux environnementaux dans les glycosomes de la forme sanguine des trypanosomes africains. Cette approche implique une sonde de protéine héréditaire sensible au pH en combinaison avec la cytométrie en flux pour mesurer la dynamique du pH, à la fois en tant que test temporel et dans un format de criblage à haut débit.
Résumé
Le métabolisme du glucose est essentiel pour le trypanosome africain, Trypanosoma brucei, en tant que processus métabolique essentiel et régulateur du développement du parasite. On sait peu de choses sur les réponses cellulaires générées lorsque les niveaux de glucose environnementaux changent. Dans les parasites de la circulation sanguine et de la forme procyclique (stade d’insecte), les glycosomes abritent la majeure partie de la glycolyse. Ces organites sont rapidement acidifiés en réponse à la privation de glucose, ce qui entraîne probablement la régulation allostérique des enzymes glycolytiques telles que l’hexokinase. Dans les travaux précédents, la localisation de la sonde chimique utilisée pour effectuer les mesures de pH était difficile, ce qui limitait son utilité dans d’autres applications.
Cet article décrit le développement et l’utilisation de parasites qui expriment pHluorin2 localisée glycosomiquement, un biocapteur de pH protéique héréditaire. pHluorin2 est une variante ratiométrique de la pHluorin qui présente une diminution de l’excitation dépendante du pH (acide) à 395 nm tout en produisant simultanément une augmentation de l’excitation à 475 nm. Les parasites transgéniques ont été générés en clonant le cadre de lecture ouvert de pHluorin2 dans le vecteur d’expression du trypanosome pLEW100v5, permettant l’expression inductible de protéines à l’une ou l’autre étape du cycle de vie. L’immunofluorescence a été utilisée pour confirmer la localisation glycosomale du biocapteur pHluorin2, en comparant la localisation du biocapteur à la protéine résidente glycosomale aldolase. La réactivité de la sonde a été calibrée à différents niveaux de pH en incubant des cellules dans une série de tampons dont le pH variait de 4 à 8, une approche que nous avons déjà utilisée pour étalonner une sonde de pH à base de fluorescéine. Nous avons ensuite mesuré la fluorescence de pHluorin2 à 405 nm et 488 nm en utilisant la cytométrie en flux pour déterminer le pH glycosomal. Nous avons validé les performances des parasites transgéniques vivants exprimant pHluorin2, en surveillant le pH dans le temps en réponse à la privation de glucose, un déclencheur connu de l’acidification glycosomale chez les parasites PF. Cet outil a une gamme d’applications potentielles, y compris potentiellement utilisé dans le criblage de médicaments à haut débit. Au-delà du pH glycosomal, la sonde pourrait être adaptée à d’autres organites ou utilisée dans d’autres trypanosomatidés pour comprendre la dynamique du pH dans le cadre de cellules vivantes.
Introduction
Les kinétoplastides parasites, comme la plupart des organismes vivants, dépendent du glucose comme composant fondamental du métabolisme central du carbone. Ce groupe comprend des organismes médicalement importants, tels que le trypanosome africain, Trypanosoma brucei ; le trypanosome américain, T. cruzi ; et les parasites du genre Leishmania. Le métabolisme du glucose est essentiel à la croissance du parasite dans les stades du cycle de vie pathogène. Par exemple, lorsqu’il est privé de glucose, la forme sanguine (BSF) du trypanosome africain meurt rapidement. Notamment, la glycolyse est la seule source d’ATP à ce stade de l’infection1. Les parasites Leishmania dépendent également du glucose de l’hôte humain, le stade du cycle de vie de l’amastigote qui réside dans les macrophages de l’hôte dépendant de cette source de carbone pour sa croissance2.
Bien que ces parasites aient des modes de vie distincts impliquant différents insectes vecteurs, ils partagent de nombreux points communs dans la façon dont ils réagissent et consomment le glucose. Par exemple, ces parasites localisent la plupart des enzymes glycolytiques dans des peroxysomes modifiés appelés glycosomes. Cet organite spécifique au kinétoplastide est apparenté aux peroxysomes de mammifères sur la base de mécanismes de biosynthèse conservés et de morphologie 3,4,5,6.
La compartimentation de la plupart des enzymes de la voie glycolytique dans le glycosome offre des moyens spécifiques au parasite de réguler la voie. À l’aide d’une sonde de pH chimique, nous avons établi que la privation de nutriments déclenche une acidification rapide des glycosomes parasitaires de forme procyclique (PF) qui entraîne une altération de l’activité enzymatique glycolytique par exposition d’un site de liaison régulateur allostérique sur l’enzyme glycolytique clé hexokinase 7,8. Dans nos travaux précédents, la sonde chimique nécessitait une livraison constante pour être utilisée, ce qui limitait son utilité dans d’autres applications. De plus, les difficultés à maintenir la distribution de la sonde dans le glycosome dans le BSF ont limité l’utilité de l’approche pour étudier le pH glycosomal à ce stade de vie.
Dans cette étude, nous avons utilisé le biocapteur de protéines fluorescentes pHluorin2 pour surveiller le changement de pH glycosomal chez BSF T. brucei en réponse à des signaux environnementaux, y compris la privation de glucose9 (Figure 1). Les résultats de ce travail suggèrent que le FPS T. brucei acidifie rapidement les glycosomes en réponse à la famine de manière réversible, comme nous l’avons observé chez les parasites PF. Nous espérons que ce biocapteur améliorera notre compréhension de la régulation glycolytique chez T. brucei et les parasites apparentés.
Protocole
L’utilisation de trypanosomes 90-13 BSF de T. brucei brucei , une lignée parasitaire monomorphe, nécessite une prise en compte de l’innocuité, car ils sont considérés comme des organismes du groupe de risque 2 qui doivent être manipulés dans des installations de niveau de biosécurité 2.
1. Culture et transfection de trypanosomes
- Culture de trypanosomes T . brucei brucei 90-13 BSF en milieu HMI-9 complété par 10 % de FBS inactivé par la chaleur et 10 % de Nu-Serum à 37 °C dans 5 % de CO210.
REMARQUE : Pour garder la culture en bonne santé, maintenez la densité cellulaire entre 2 × 104 et 5 × 106 cellules/mL. - Clonage de pHluorin2-PTS1 dans pLEW100v5
- Synthétiser commercialement le cadre de lecture ouvert pHluorin2 pour produire le gène avec une extension 3' codant pour un linker à deux glycines suivi du tripeptide AKL, une étiquette de localisation PTS1.
- Clonez cette construction dans le vecteur d’expression inductible du trypanosome pLEW100v5 par digestion de restriction. Double digestion du vecteur de clonage contenant pHluorin2-PTS1 et pLEW100v5 à l’aide de HindIII et BamHI11. Effectuez une étape de nettoyage, de préférence par purification en gel d’agarose, pour éliminer les enzymes de restriction, le squelette du vecteur de clonage indésirable et le fragment excisé contenant le gène de la luciférase.
- Comparez l’insert contenant pHluorin2 dans pLEW100v5 digéré avec de l’ADN ligaseT4 12. (voir la figure supplémentaire S1 pour un schéma de clonage).
- Séquencer le plasmide par séquençage du plasmide entier de nouvelle génération pour vérifier que l’insert et le vecteur sont correctement ligaturés et qu’aucune mutation n’est introduite dans le gène pHluorin2-PTS1 pendant le processus de clonage.
REMARQUE : La séquence complète du plasmide a été soumise à Addgene.org et a reçu le #83680. - Linéariser 20 μg du plasmide en digérant avec 40 unités de NotI ; ensuite, transfecter en parasites BSF 90-13 par nucléofection à l’aide du kit de cellules T humaines référencées (voir Tableau des matériaux). Sélectionner pour une intégration stable telle que décrite par Burkard et al.13.
2. Colocalisation par immunofluorescence de pHlourin2-PTS1
- Préparez les lames de microscopie en les traitant avec de la poly-L-lysine à 0,1 % (p/v) dans H2O pendant 10 min. Après avoir retiré la solution de poly-L-lysine, laver la lame une fois avec du PBS.
- Pour induire l’expression de pHluorin2-PTS1, traiter les cellules à 2 × 105 cellules/mL avec de la tétracycline ou de la doxycycline (1 μg/mL) 24 h avant la récolte. Granuler 2 × 106 parasites parentaux et induits pLEWpHluorin2-PTS1 (pHL) par centrifugation (température ambiante [RT], 10 min, 1 000 × g) et laver une fois avec du PBS.
- Remettre les cellules en suspension dans 200 μL de paraformaldéhyde à 2 % fraîchement préparé dans du PBS fabriqué à partir d’une solution de qualité EM à 16 % fournie dans le commerce. Appliquez les cellules du fixateur sur la lame et laissez les cellules se déposer pendant 30 minutes. Laver les cellules adhérentes 2 fois avec une solution de lavage (0,1 % de sérum de chèvre normal dans du PBS).
- Appliquer la solution de perméabilisation (0,5% de Triton X-100 dans du PBS) sur les cellules et incuber pendant exactement 30 min. Retirez la solution de perméabilisation et lavez une fois avec de grandes quantités de solution de lavage.
- Appliquer la solution en bloc (10 % de sérum de chèvre normal et 0,1 % de Triton X-100 dans du PBS) et incuber pendant 30 min.
- Diluer l’antisérum contre T. brucei aldolase 1:500 dans une solution en bloc et l’appliquer sur les cellules14. Incuber pendant 1 h à RT. Laver les lames 5x pendant 3-5 min min avec une solution de lavage.
- Diluer l’anti-lapin Alexa fluor 568 1:1 000 dans une solution en bloc et appliquer sur les cellules. Incuber pendant 1 h à RT. Lavez les lames 5x pendant 3-5 min avec une solution de lavage.
- Appliquez le milieu de montage et scellez une lamelle sur la lame.
- Imagez les cellules avec un objectif 100x (NA 1,4-0,7) et analysez les images à l’aide d’ImageJ. Effectuez l’analyse de colocalisation de Pearson à l’aide du plug-in « Coloc 2 » pour ImageJ. Voir la figure supplémentaire S2 pour un champ de cellules représentatives. )
- Pour ce faire, ajoutez le fichier image aux Fidji et sélectionnez Images.
- Ajustez la luminosité et le contraste de chaque canal à un point où aucun arrière-plan n’est visible.
- Modifiez les images de 16 bits à 8 bits, fusionnez les images, puis recadrez en une seule cellule avec des canaux partagés.
- Sous Analyser et colocaliser, sélectionnez le plug-in Coloc2. Sélectionnez aldolase (le canal rouge) comme canal 1 et pHL (le canal vert) comme canal 2 et cliquez sur OK pour lancer le calcul de la corrélation de Pearson.
3. Préparation des échantillons pour la cytométrie en flux
- Induire les cellules pHL avec de la tétracycline ou de la doxycycline (1 μg/mL) pendant la nuit.
- Granuler les cellules (~4 × 107 pHL et ~1 × 106 parental) par centrifugation (RT, 10 min, 1 000 × g). Retirer le surnageant et remettre les cellules en suspension dans 1 mL de PBS avec ou sans 10 mM de glucose selon que l’échantillon est affamé ou non. Pour les essais sur le temps, remettre en suspension dans du PBS complété par 10 mM de glucose pour éviter que les cellules ne meurent de faim jusqu’à ce que les lavages soient terminés. Pour le test de criblage à haut débit (HTS), remettre en suspension dans le PBS sans glucose pour minimiser le transfert de glucose ; Répétez les lavages deux fois de plus.
- Centrifuger les cellules une quatrième fois, retirer le surnageant et remettre la pastille cellulaire en suspension dans du PBS, du PBS plus 5 mM de glucose ou du PBS plus 10 mM de glucose selon le traitement. Compléter les échantillons avec 1 μg/mL d’iodure de propidium (PI) ou 100 nM de rouge de thiazole (TR) pour la détermination de la présence ou de la mort. Transférer chaque échantillon dans des tubes de 5 mL compatibles avec le cytomètre en flux.
4. Cytométrie en flux
REMARQUE : Préparez l’expérience sur un cytomètre en flux contenant les lasers suivants : 405 nm (violet), 488 nm (bleu) et 561 nm (jaune) ou 638 nm (rouge). Voir le tableau supplémentaire S1 pour les noms usuels des canaux discutés ci-dessous.
- Pour mesurer la fluorescence pHL, utilisez les canaux KO525 (VL2-H, excitation 405 nm, émission 542/27 nm) et FITC (BL1-H, excitation 488 nm, émission 530/30 nm). Pour différencier les cellules vivantes des cellules mortes, utilisez soit PI, soit TR ; mesurer PI sur le canal YL2-H (excitation 561 nm, émission 620/25 nm). Mesurez TR sur le canal RL1-H (excitation 638 nm, 660/10 BP).
- Pour configurer l’expérience sur le logiciel de cytomètre en flux, créez les graphiques suivants : 1) histogramme de canal YL2-H (si vous utilisez PI) ou histogramme de canal RL1-H (si vous utilisez TR), 2) diagramme de points FSC-A vs SSC-A, 3) diagramme de points FSC-A vs FSC-H et 4) diagramme de points de canal BL1-H vs VL2-H.
- Placez d’abord la commande WT (lignée cellulaire parentale) non colorée sur l’orifice d’injection d’échantillon (SIP) et soulevez la platine en position. Commencez à acquérir des données sur le cytomètre au débit le plus bas pour avoir le temps de faire les ajustements nécessaires. Pour éviter de noter les faux débris et les cellules mortes, commencez à enregistrer les événements 5 s après le début de l’acquisition de l’échantillon.
- Ajustez la tension YL2 ou RL1 de sorte que le pic principal se situe à moins de 103-10 4 unités d’intensité de fluorescence relative (RFI). Ajustez les tensions FSC et SSC de sorte que >90 % des événements tiennent sur le diagramme à points. Ajustez le seuil FSC pour exclure la population de débris, mais pas les cellules probables.
- Ajustez les canaux VL2 et BL1 de sorte que le pic primaire se situe à moins de 10,3-10,4 unités RFI pour le contrôle WT non coloré.
- Placez le premier échantillon contenant du pHL induit coloré avec PI ou TR sur le SIP et soulevez la platine en position. Commencez à acquérir des données au débit le plus bas et observez attentivement les événements dans chaque parcelle. Assurez-vous >90 % des événements se trouvent dans chaque parcelle et qu’aucun événement ne sature les canaux VL2-H et BL1-H.
- Procédez à l’exécution des échantillons. Assurez-vous d’enregistrer au moins 10 000 événements par échantillon.
- Enregistrez les données des échantillons au format de fichier .fcs et exportez-les pour analyse.
5. Analyse des données des résultats de cytométrie en flux
REMARQUE : Ce flux de travail d’analyse de données utilise le logiciel FlowJo. Si vous utilisez un autre logiciel d’analyse par cytométrie en flux, continuez à suivre les étapes clés décrites ci-dessous, en utilisant des outils appropriés au logiciel. Pour visualiser les tracés et les portes, voir la figure supplémentaire S3 et la figure supplémentaire S4.
- Ouvrez une nouvelle mise en page et ouvrez les fichiers .fcs acquis à l’étape 4.3. Faites glisser et déposez les fichiers .fcs dans la fenêtre de mise en page.
- Porte pour cellules vivantes.
- Double-cliquez sur la commande WT non colorée pour ouvrir une fenêtre pour cet échantillon.
- Affichez les données sous forme d’histogramme sur le canal YL2-H (si vous utilisez PI) ou RL2-H (si vous utilisez TR). Basculez entre cela et les échantillons colorés avec le colorant de viabilité pour identifier les populations vivantes et mortes.
REMARQUE : Tous les événements ne doivent pas être colorés car aucun colorant de viabilité n’a été ajouté à cet échantillon. - Créer une porte bissectrice divisant les populations vivantes et mortes ; nommez la porte de gauche Vivre et la porte de droite Mort. Appliquez cette porte à tous les échantillons, puis passez d’un échantillon à l’autre pour vous assurer que cette porte est dessinée correctement pour tous les échantillons. Ajustez la barrière au besoin.
- Porte pour les cellules.
- Sur la commande WT non tachée, double-cliquez sur le portail en direct pour afficher les événements de ce portail. Remplacez l’axe des x par FSC-A et l’axe des y par SSC-A.
- Utilisez l’outil Porte polygonale pour dessiner une porte autour de la population de cellules et nommez-la Cellules. Veillez à exclure les débris/cellules mourantes (généralement à l’extrême gauche et en bas du diagramme à points) et les agrégats (à l’extrême droite et en haut du diagramme à points).
- Appliquez cette porte sous la porte Live pour tous les échantillons. Basculez entre les échantillons pour vous assurer que la porte englobe la population cellulaire probable pour tous les échantillons et effectuez les ajustements nécessaires. Assurez-vous de réappliquer la porte sur tous les échantillons après l’avoir modifiée.
REMARQUE : La distribution de la population cellulaire change sensiblement entre les conditions de famine et de non-famine sur FSC et SSC ; s’assurer que la porte cellulaire englobe la population cellulaire dans toutes les conditions.
- Porte pour cellules individuelles pour augmenter la qualité des mesures de pH.
- Sur le contrôle WT non taché, double-cliquez sur la porte de cellule pour afficher les événements de cette porte. Remplacez l’axe des x du diagramme à points par FSC-A et l’axe des y par FSC-H.
- Recherchez une distribution diagonale de cellules simples sur ce graphique à points, avec des doublets formant une population secondaire en bas à droite de la population singulet (voir le troisième graphique de la figure supplémentaire S1 ). À l’aide de l’outil Porte polygonale, tracez une porte autour des événements singulet excluant la population doublet. Nommez cette porte Singlets.
- Appliquez la porte Singlets sous la porte Cellule pour tous les échantillons. Encore une fois, basculez entre les échantillons pour vous assurer que la porte exclut correctement la population du doublet tout en incluant la population du singulet. Ajustez au besoin.
- Porte pour cellules pHL fluorescentes.
- Sur l’échantillon témoin WT non coloré, double-cliquez sur la porte Singlets pour ouvrir un diagramme à points pour cette population. Changez l’axe des x en BL1-H et l’axe des y en VL2-H.
- La sonde de pH pHluorin2 est fluorescente à la fois dans VL2 et BL1. Utilisez l’outil Porte polygonale pour dessiner une porte en forme de diagonale s’étendant vers le haut et à droite de la population autofluorescente en bas à gauche du diagramme à points. Nommez cette porte pHL+.
- Appliquez la porte pHL+ sous la porte Singlets pour tous les échantillons. Basculez vers un échantillon pHL et ajustez la porte pour inclure les événements avec une intensité de fluorescence plus grande dans VL2-H et BL1-H que le contrôle WT. Assurez-vous que cette porte englobe cette population fluorescente pour tous les échantillons, car la position de cette population changera à mesure que le pH glycosomal change.
REMARQUE : Ce changement faible mais visible dans la population pHL+ est dû à des changements dépendants du pH dans le spectre d’excitation du fluorophore.
- Exportez les statistiques.
- Cliquez sur Éditeur de tableau | Barre d’édition | Ajouter une colonne pour ajouter de nouvelles statistiques à exporter.
REMARQUE : Pour chaque statistique à exporter, choisissez la statistique correspondante et la population à partir de laquelle l’exporter. Assurez-vous de choisir le paramètre approprié pour les statistiques applicables, telles que Médiane. Laissez l’échantillon inchangé. - Ajoutez des colonnes avec les statistiques suivantes : Nombre total (non traité), Nombre pHL+, Fréquence réelle du total (pourcentage basé sur le nombre total d’événements), Fréquence pHL+ du parent (pourcentage basé sur la porte parent), VL2-H médian pHL+ et BL1-H médian pHL+.
- Cliquez sur l’éditeur de tableau et modifiez les paramètres d’exportation suivants : Afficher sur Vers un fichier et Texte sur CSV, puis choisissez la destination et le nom du fichier. Cliquez sur Créer une table.
- Cliquez sur Éditeur de tableau | Barre d’édition | Ajouter une colonne pour ajouter de nouvelles statistiques à exporter.
- Calculez le rapport de fluorescence.
- Enregistrez le fichier .csv exporté en tant que fichier de feuille de calcul.
- Effectuez une analyse de contrôle de la qualité en comparant les éléments suivants sur tous les échantillons de l’expérience : nombre d’événements par échantillon, pourcentage d’événements en direct et pourcentage d’événements pHL+. Comparez-les visuellement dans des diagrammes à barres ou en nuages de points en fonction de l’expérience.
- Étiquetez une nouvelle colonne comme pHL+ Médiane VL2/BL1. Pour chaque échantillon, divisez la valeur médiane de VL2-H par la valeur médiane de BL1-H, comme indiqué dans l’équation (1).
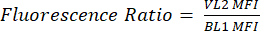 (1)
(1)
- Utilisez un logiciel d’analyse statistique pour effectuer une analyse statistique à l’aide du rapport de fluorescence.
6. Étalonnage des biocapteurs de pH
REMARQUE : Pour convertir les rapports de fluorescence mesurés en unités de pH, étalonnez les cellules exprimant le pHL à l’aide de la nigéricine et de la valinomycine. La nigéricine est un antiporteur K+/H+, un ionophore qui peut équilibrer le pH à travers les membranes lorsqu’il y a suffisamment de K+ dans le tampon15. La nigéricine a été couramment utilisée pour calibrer la pHluorin et d’autres sondes de pH16,17. Comme la pHluorine localisée dans les peroxysomes a été précédemment calibrée à l’aide de 10 μM de nigéricine18, nous avons choisi de traiter avec cette concentration. La valinomycine est un ionophore de potassium et a été utilisée (à 4 μM) pour équilibrer le pH à travers les membranes mitochondriales19. Nous avons utilisé de la valinomycine 10 μM pour aider à l’activité d’équilibrage du pH de la nigéricine en veillant à ce que les ions K+ soient équilibrés à travers les membranes. Bien que nous ayons utilisé une combinaison nigéricine-valinomycine, la nigéricine peut être suffisante pour équilibrer le pH organellar.
- Préparez huit solutions de tampon d’étalonnage universel (UCB ; 15 mM MES, 15 mM HEPES et 130 mM KCl) chacune à un pH différent allant de 5 à 8,5.
- Centrifugeuse (RT, 10 min, 800-1 000 × g) huit tubes séparés de 2 mL de culture de fBS exprimant pHL (~4 × 106 cellules chacun).
- Retirez le surnageant, puis remettez en suspension chaque pastille cellulaire dans UCB à différentes valeurs de pH.
- Introduire la nigéricine et la valinomycine, chacune à 10 μM. Augmenter le pic en IP à 1 μg/mL.
- Incuber les cellules dans chaque solution pendant 15 min.
- Analysez chaque échantillon sur un cytomètre en flux pour mesurer le rapport de fluorescence comme décrit aux étapes 4 et 5.
- Répétez cette expérience deux fois de plus pour obtenir trois répétitions biologiques pour chaque valeur de pH. Exportez les données au format .fcs.
- Analysez les fichiers .fcs comme décrit aux étapes 5.1 à 5.8. Utiliser le rapport de fluorescence mesuré pour chaque pH pour interpoler le pH glycosomal dans les expériences futures à l’aide de l’équation (2).
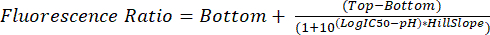 (2)
(2)
REMARQUE : La figure supplémentaire S3 montre les diagrammes à points et le schéma de contrôle. Les résultats se trouvent dans le tableau supplémentaire S2. Ce qui suit décrit comment interpoler le pH à partir du rapport de fluorescence à l’aide de GraphPad Prism. Si vous utilisez un autre logiciel statistique, suivez les mêmes étapes clés.- Ouvrez GraphPad Prism et créez un tableau XY avec trois réplicats y. Collez les valeurs de pH dans la colonne x et leurs valeurs de rapport de fluorescence associées dans les colonnes de répétition y.
- Cliquez sur le graphique associé au tableau. Lors de l’affichage du graphique, cliquez sur Analyser sous le ruban Analyse | Interpoler une courbe standard dans le cadre d’analyses XY.
- Choisissez Sigmoïdal, 4PL, X est log(concentration) puisque les unités de pH sont sur une échelle logarithmique. Les paramètres Haut et Bas sont les plateaux supérieur et inférieur estimés. Choisissez Aucune gestion spéciale des valeurs aberrantes.
NOTA : Le logiciel cherchera à ajuster les données au modèle décrit dans l’équation (2) et à l’étape 6.9.3. Recherchez des preuves de manque d’ajustement dans le tableau des résultats et la courbe sur le graphique. - Pour interpoler le pH à partir des rapports de fluorescence dans d’autres expériences, consultez le tableau contenant les données d’étalonnage du pHL. Collez les valeurs du rapport de fluorescence sous les données d’étalonnage dans la ou les colonnes y. Donnez un titre à chaque valeur y, mais laissez la valeur x (pH) vide car elle est inconnue.
- Dans la galerie Résultats, cliquez sur l’analyse d’interpolation , puis accédez à l’onglet Réplications X interpolées . Recherchez les valeurs de pH interpolées qui seront répertoriées à côté des valeurs de rapport de fluorescence saisies.
REMARQUE : Le logiciel utilise le modèle et les valeurs des paramètres les mieux adaptés trouvées à partir des données d’étalonnage pour interpoler le pH à partir des rapports de fluorescence pour les expériences où le pH est inconnu.
7. Manque de glucose et temps d’ajout
- Induire 15 mL de parasites pHL BSF pendant la nuit avec 1 μg/mL de doxycycline incubée à 37 °C comme décrit à l’étape 1.1.
- Laver 15 mL de culture pHL induite dans du PBS supplémenté en 10 mM de glucose. Répétez cette étape 3 fois.
- En même temps, laver 3 mL de culture WT dans du PBS 3x comme décrit à l’étape 3.2.
- Après le premier lavage, lorsque l’échantillon de pHL est remis en suspension dans 1 mL de PBS, prélever une aliquote de 0,1 mL de suspension cellulaire pHL pour conserver 10 mM de glucose comme témoin non affamé.
- Après le lavage final, remettre en suspension l’échantillon de pHL dans du PBS complété par 1 μg/mL d’IP.
- Acquisition de données de cytométrie en flux
- Commencez à surveiller le pH glycosomal pour les échantillons affamés et non affamés en mesurant chaque échantillon sur un cytomètre en flux toutes les 5, 10, 30 ou 90 minutes, selon l’expérience et l’échantillon. Acquérir les données de cytométrie en flux comme décrit aux étapes 4.1 à 4.3, en veillant à ce que les tensions et les tracés soient préparés à l’avance.
- Exécutez d’abord la commande WT non tachée à 0 min.
- Analysez l’échantillon témoin non affamé sur le cytomètre toutes les 90 minutes à partir de 0 minute. Pour le test de l’évolution temporelle de la famine, analysez l’échantillon affamé toutes les 10 minutes à partir de 0 minute. Pour le test Glucose Addback, analysez l’échantillon affamé à 0, 5, 10, 20, 30, 60 et 90 min ; Ensuite, répétez après avoir introduit du glucose.
- Incuber les échantillons à température ambiante pendant le traitement de 90 minutes de famine et le traitement de 180 minutes de temps d’ajout de glucose.
- Analysez les fichiers .fcs comme décrit aux étapes 5.1 à 5.8.
REMARQUE : La figure supplémentaire S4 montre comment effectuer le gating et à quoi devraient ressembler les diagrammes à points. Le tableau supplémentaire S3 et le tableau supplémentaire S4 montrent les résultats du test de l’évolution temporelle de la privation de glucose et de l’essai de l’évolution temporelle de l’ajout du glucose, respectivement.
8. Optimisation du test pour le dépistage des drogues
- Laver environ 32 mL de parasites BSF exprimant pHL et 3 mL de cellules WT, tous deux à environ 2 × 106 cellules/mL, 2x dans le PBS comme décrit précédemment.
REMARQUE : Plus de 10 000 événements doivent être enregistrés par puits pour minimiser la variabilité des rapports de fluorescence mesurés et mesurer avec précision la statistique du facteur Z. La culture minimale nécessaire pour y parvenir est d’environ 26 ml, mais nous recommandons 32 ml pour faciliter la manipulation.- Après le premier lavage, séparez également l’échantillon pHL dans deux microtubes à centrifuger.
- Après les lavages, remettre en suspension un échantillon de pHL dans 18 mL de PBS contenant 5 mM de glucose, 0,1 % de DMSO et TR. Remettre en suspension l’autre échantillon de pHL dans 18 mL de PBS plus 0,1 % de DMSO et de TR.
REMARQUE : Le DMSO est utilisé pour imiter la composition du tampon dans un criblage de drogues, car les composés sont généralement dissous dans le DMSO. - Transvasez ces deux solutions cellulaires dans un réservoir de 12 puits, 9 mL par puits.
- Utilisez un robot de pipetage pour pipeter les solutions cellulaires dans des moitiés séparées d’une plaque de 384 puits, 80 μL par puits.
- Incuber la plaque à température ambiante pendant 1,5 h, en secouant doucement et en l’enveloppant dans du papier d’aluminium pour protéger les fluorophores de la lumière.
- Faites fonctionner la plaque sur un cytomètre en flux capable de faire fonctionner des plaques de 384 puits.
REMARQUE : Le flux de travail suivant est adapté à un Attune NxT avec Cytkick Max Auto Sampler. Si un autre cytomètre en flux est utilisé, continuez à suivre les étapes clés.- Pour la plaque, fonctionner au débit le plus rapide (1 000 uL/min) et activer le mode boost. Acquérir 20 μL/puits. Inclure un cycle de mélange et un cycle de rinçage entre chaque puits.
- Créez des tracés comme décrit à l’étape 4.1.3.
- Exécutez une commande de tube WT non colorée et optimisez les tensions comme décrit aux étapes 4.1.3 et 4.1.4. Analysez un échantillon de tube pHL affamé et optimisez les tensions VL2 et BL1 comme décrit à l’étape 4.1.
- Commencez à acquérir la plaque sur le cytomètre en flux. Faites passer la plaque horizontalement afin qu’il n’y ait pas de différence significative entre le temps d’acquisition entre les puits d’échantillon affamés et non affamés. Assurez-vous que l’acquisition de la plaque est terminée en ~1,5 h.
- Exportez les fichiers .fcs et analysez les données comme décrit dans les étapes 5.1 à 5.8. Trouvez la moyenne (AVG) et l’écart-type (ET) des rapports de fluorescence pour les échantillons traités avec du glucose (Glc) ou sans glucose (Starved).
REMARQUE : Les données de nos expériences sur le facteur Z se trouvent dans le tableau supplémentaire S5. - Calculer la statistique du facteur Z20 à l’aide de l’équation (3).
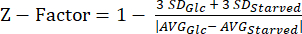 (3)
(3)
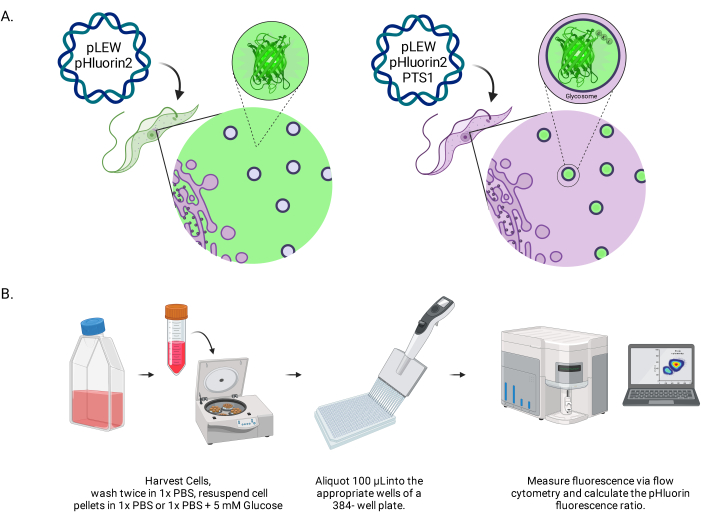
Figure 1 : Schéma de la méthode de notation du pH glycosomal dans les trypanosomes BSF vivants. (A) Représentation de lignées cellulaires exprimant le capteur pHluorin2 situé dans un glycosom. L’inclusion d’une séquence de ciblage peroxysomale permet de contrôler la localisation. NOTE : Nous prévoyons que l’élimination du PTS-1 conduirait à une localisation cytosolique, permettant une analyse future du pH dans ce compartiment subcellulaire. (B) Représentation de l’essai de validation des capteurs. Abréviation : BSF = forme de la circulation sanguine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
REMARQUE : La statistique du facteur Z est utilisée pour déterminer dans quelle mesure un test est adapté au HTS. Des valeurs comprises entre 0,5 et 1,0 signifient généralement que la qualité du test est acceptable pour le HTS.
Résultats
Localisation de pHLuorin2-PTS1 dans les glycosomes chez BSF T. brucei
Pour évaluer la localisation subcellulaire de la pHluorin2-PTS1, les parasites ont été soumis à des tests d’immunofluorescence. Signal du transgène colocalisé avec des antisérums élevés contre une protéine résidente des glycosomes, l’aldolase (TbAldolase) (Figure 2A). Le coefficient de corrélation moyen de Pearson de colocalisation entre l’anti-TbAldolase et la pHluorin2-PTS1 ...
Discussion
La perception environnementale et les mécanismes de réponse du trypanosome africain sont mal compris. Les changements dans la disponibilité des nutriments sont connus pour déclencher diverses réponses chez le parasite, y compris l’acidification des glycosomes. Ici, nous avons décrit une méthode pour étudier la réponse du pH glycosomal aux perturbations environnementales dans les cellules vivantes à l’aide d’un capteur de protéines héréditaires, pHluorin2, et de la cytométrie en flux.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
pHluorin2-PTS1 a été cloné en pLEW100v5 par Twist Bioscience qui a fourni la construction dans un vecteur de clonage à haute copie ; pLEW100v5 était un cadeau du Dr George Cross. L’antisérum contre T. brucei aldolase est disponible sur demande auprès du Dr Meredith T. Morris, de l’Université de Clemson. Les travaux des laboratoires JCM et KAC ont été partiellement soutenus par un prix des National Institutes of Health (R01AI156382). Le SSP a été soutenu par le NIH 3R01AI156382.
matériels
| Name | Company | Catalog Number | Comments |
| 50 mL Tissue Culture Flasks (Non-treated, sterile) | VWR | 10861-572 | |
| 75 cm2 Tissue Culture Flask (Non-Treated, sterile) | Corning | 431464U | |
| 80 µL flat-bottom 384-well plate | BrandTech | 781620 | |
| Amaxa Human T Cell Nucleofector Kit | Lonza | VPA-1002 | |
| Attune NxT Flow Cytometer | invitrogen by Thermo Fisher Scientific | A24858 | FlowJo software |
| BRANDplates 96-Well, flat bottom plate | Millipore Sigma | BR781662 | |
| Coloc 2 plugin of ImageJ | https://imagej.net/plugins/coloc-2 | ||
| CytKick Max Auto Sampler | invitrogen by Thermo Fisher Scientific | A42973 | |
| CytoFLEX Flow Cytometer | Beckman-Coulter | ||
| Electron Microscopy Sciences 16% Paraformaldehyde Aqueous Solution, EM Grade, 10 mL Ampoule | Fisher Scientific | 50-980-487 | |
| GraphPad Prism | statistical software | ||
| Nigericin (sodium salt) | Cayman Chemical | 11437 | |
| Nucleofector 2b | Lonza | Discontinued Product | |
| OP2 Liquid Handler | opentrons | OP2 | |
| poly-L-lysine, 0.1% (w/v) in H2O | Sigma Life Science | CAS:25988-63-0 | Pipetting robot for HTS assay |
| Thiazole Red (TO-PRO-3) | biotium | #40087 | We machined a custom acrylic plate stand so this brand of plate could be detected and used on our CytKick Max Auto Sampler |
| valinomycin | Cayman Chemical | 10009152 | Pipetting robot for HTS assay |
| For pH calibration | |||
| For pH calibration |
Références
- Coley, A. F., Dodson, H. C., Morris, M. T., Morris, J. C. Glycolysis in the African trypanosome: Targeting enzymes and their subcellular compartments for therapeutic development. Molecular Biology International. 2011, 123702 (2011).
- Mcconville, M. J., Saunders, E. C., Kloehn, J., Dagley, M. J. Leishmania carbon metabolism in the macrophage phagolysosome- feast or famine. F1000Res. 4, 938 (2015).
- Parsons, M. Glycosomes: Parasites and the divergence of peroxisomal purpose. Molecular Microbiology. 53 (3), 717-724 (2004).
- Parsons, M., Furuya, T., Pal, S., Kessler, P. Biogenesis and function of peroxisomes and glycosomes. Molecular and Biochemical Parasitology. 115 (1), 19-28 (2001).
- Haanstra, J. R., Gonzalez-Marcano, E. B., Gualdron-Lopez, M., Michels, P. A. Biogenesis, maintenance and dynamics of glycosomes in trypanosomatid parasites. Biochimica et Biophysica Acta. 1863 (5), 1038-1048 (2016).
- Allmann, S., Bringaud, F. Glycosomes: A comprehensive view of their metabolic roles in t. Brucei. International Journal of Biochemistry and Cell Biology. 85, 85-90 (2017).
- Dodson, H. C., Morris, M. T., Morris, J. C. Glycerol 3-phosphate alters Trypanosoma brucei hexokinase activity in response to environmental change. The Journal of Biological Chemistry. 286 (38), 33150-33157 (2011).
- Lin, S., Morris, M. T., Ackroyd, P. C., Morris, J. C., Christensen, K. A. Peptide targeted delivery of pH sensor for quantitative measurements of intraglycosomal pH in live Trypanosoma brucei. Biochemistry. 52 (21), 3629-3637 (2013).
- Mahon, M. J. Phluorin2: An enhanced, ratiometric, pH-sensitive green florescent protein. Advances in Bioscience and Biotechnology. 2 (3), 132-137 (2011).
- Wirtz, E., Leal, S., Ochatt, C., Cross, G. A. A tightly regulated inducible expression system for conditional gene knock-outs and dominant-negative genetics in Trypanosoma brucei. Molecular and Biochemical Parasitology. 99 (1), 89-101 (1999).
- . Restriction digest v.2 Available from: https://www.protocols.io/view/restriction-digest-nkqdg33pg25z/v2 (2018)
- . Ligation protocol with t4 DNA ligaase (m0202) v.3 Available from: https://www.protocols.io/view/ligation-protocol-with-t4-dna-ligase-m0202-95qpvorzv4o1/v3 (2021)
- Burkard, G., Fragoso, C. M., Roditi, I. Highly efficient stable transformation of bloodstream forms of Trypanosoma brucei. Molecular and Biochemical Parasitology. 153 (2), 220-223 (2007).
- Crowe, L. P., Wilkinson, C. L., Nicholson, K. R., Morris, M. T. Trypanosoma brucei pex13.2 is an accessory peroxin that functions in the import of peroxisome targeting sequence type 2 proteins and localizes to subdomains of the glycosome. mSphere. 5 (1), e00744 (2020).
- Kucejova, B., Kucej, M., Petrezselyova, S., Abelovska, L., Tomaska, L. A screen for nigericin-resistant yeast mutants revealed genes controlling mitochondrial volume and mitochondrial cation homeostasis. Genetics. 171 (2), 517-526 (2005).
- Huynh, M. H., Carruthers, V. B. Toxoplasma gondii excretion of glycolytic products is associated with acidification of the parasitophorous vacuole during parasite egress. PLoS Pathogens. 18 (5), e1010139 (2022).
- Lehoux, S., Abe, J., Florian, J. A., Berk, B. C. 14-3-3 binding to Na+/H+ exchanger isoform-1 is associated with serum-dependent activation of Na+/H+ exchange. TheJournal of Biological Chemistry. 276 (19), 15794-15800 (2001).
- Jankowski, A., et al. In situ measurements of the ph of mammalian peroxisomes using the fluorescent protein phluorin. The Journal of Biological Chemistry. 276 (52), 48748-48753 (2001).
- Jankowski, A., Grinstein, S. A. A noninvasive fluorimetric procedure for measurement of membrane potential. Quantification of the NADPH oxidase-induced depolarization in activated neutrophils. The Journal of Biological Chemistry. 274 (37), 26098-26104 (1999).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Lin, S., et al. Ph regulation in glycosomes of procyclic form Trypanosoma brucei. The Journal of Biological Chemistry. 292 (19), 7795-7805 (2017).
- Ha, D. S., Schwarz, J. K., Turco, S. J., Beverley, S. M. Use of the green fluorescent protein as a marker in transfected Leishmania. Molecular and Biochemical Parasitology. 77 (1), 57-64 (1996).
- Kelly, J. M., Ward, H. M., Miles, M. A., Kendall, G. A shuttle vector which facilitates the expression of transfected genes in Trypanosoma cruzi and Leishmania. Nucleic Acids Research. 20 (15), 3963-3969 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon