Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение динамических изменений рН гликосом у живой Trypanosoma brucei
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описан метод изучения того, как рН реагирует на сигналы окружающей среды в гликосомах кровавой формы африканских трипаносом. Этот подход включает в себя чувствительный к рН наследственный белковый сенсор в сочетании с проточной цитометрией для измерения динамики рН, как в виде анализа по времени, так и в формате высокопроизводительного скрининга.
Аннотация
Метаболизм глюкозы имеет решающее значение для африканской трипаносомы, Trypanosoma brucei, как важнейший метаболический процесс и регулятор развития паразитов. Мало что известно о клеточных реакциях, возникающих при изменении уровня глюкозы в окружающей среде. Как у кровотоковых, так и у проциклических (стадия насекомого) паразитов гликосома содержит большую часть гликолиза. Эти органеллы быстро подкисляются в ответ на недостаток глюкозы, что, вероятно, приводит к аллостерической регуляции гликолитических ферментов, таких как гексокиназа. В предыдущей работе локализация химического зонда, используемого для измерения pH, была сложной задачей, что ограничивало его полезность в других приложениях.
В данной работе описывается разработка и использование паразитов, экспрессирующих гликозомно локализованный pHluorin2, наследуемый белковый биосенсор рН. pHluorin2 представляет собой ратиометрический вариант pHluorin, который демонстрирует pH-зависимое (кислотно-зависимое) снижение возбуждения на длине волны 395 нм с одновременным увеличением возбуждения на длине волны 475 нм. Трансгенные паразиты были получены путем клонирования открытой рамки считывания pHluorin2 в вектор экспрессии трипаносом pLEW100v5, что позволило индуцировать экспрессию белка на любой стадии жизненного цикла. Иммунофлуоресценцию использовали для подтверждения гликосомной локализации биосенсора pHluorin2, сравнивая локализацию биосенсора с гликосомным резидентным белком альдолазой. Чувствительность датчика была откалибрована при различных уровнях pH путем инкубации клеток в серии буферов с диапазоном pH от 4 до 8, подход, который мы ранее использовали для калибровки датчика pH на основе флуоресцеина. Затем мы измерили флуоресценцию pHluorin2 на длинах волны 405 нм и 488 нм с помощью проточной цитометрии для определения гликосомального рН. Мы валидировали эффективность живых трансгенных паразитов, экспрессирующих pHluorin2, отслеживая рН с течением времени в ответ на депривацию глюкозы, известный триггер гликозомального закисления у паразитов ЛП. Этот инструмент имеет ряд потенциальных применений, в том числе потенциально может быть использован для высокопроизводительного скрининга наркотиков. Помимо гликозомального рН, сенсор может быть адаптирован к другим органеллам или использован в других трипаносоматидах для понимания динамики рН в условиях живой клетки.
Введение
Паразитические кинетопластиды, как и большинство живых организмов, полагаются на глюкозу как на фундаментальный компонент центрального метаболизма углерода. В эту группу входят важные с медицинской точки зрения организмы, такие как африканская трипаносома, Trypanosoma brucei; американская трипаносома T. cruzi; и паразиты рода Leishmania. Метаболизм глюкозы имеет решающее значение для роста паразитов на стадиях патогенного жизненного цикла. Например, при лишении глюкозы форма кровотока (BSF) африканской трипаносомы быстро погибает. Примечательно, что гликолиз служит единственным источником АТФ на этой стадии инфекции1. Паразиты Leishmania также зависят от глюкозы в организме человека-хозяина, при этом стадия жизненного цикла амастигот, которая находится в макрофагах хозяина, зависит от этого источника углеродадля роста.
Несмотря на то, что эти паразиты ведут различный образ жизни, связанный с различными насекомыми-переносчиками, у них много общего в том, как они реагируют на глюкозу и потребляют ее. Например, эти паразиты локализуют большинство гликолитических ферментов в модифицированные пероксисомы, называемые гликосомами. Эта кинетопластидно-специфическая органелла связана с пероксисомами млекопитающих на основе консервативных механизмов биосинтеза и морфологии 3,4,5,6.
Компартментализация большинства ферментов гликолитического пути в гликосоме предлагает паразитоспецифичные средства регуляции этого пути. С помощью химического датчика рН мы установили, что недостаток питательных веществ вызывает быстрое закисление гликосом паразита проциклической формы (ПФ), что приводит к изменению активности гликолитического фермента за счет воздействия сайта связывания аллостерического регулятора на ключевой гликолитический фермент гексокиназу 7,8. В нашей предыдущей работе химический зонд требовал постоянной доставки для использования, что ограничивало его полезность в других приложениях. Кроме того, проблемы с сохранением распределения зондов в гликосоме в BSF ограничивали полезность подхода для исследования гликосомального рН на этой стадии жизни.
В этом исследовании мы использовали флуоресцентный белковый биосенсор pHluorin2 для мониторинга изменения гликосомального рН у BSF T. brucei в ответ на сигналы окружающей среды, включая глюкозное голодание9 (рис. 1). Результаты этой работы свидетельствуют о том, что BSF T. brucei быстро подкисляет гликозомы в ответ на голодание обратимым образом, подобно реакциям, которые мы наблюдали у паразитов PF. Мы ожидаем, что этот биосенсор улучшит наше понимание гликолитической регуляции у T. brucei и родственных паразитов.
протокол
Использование трипаносом T. brucei brucei 90-13 BSF, мономорфной линии паразитов, требует рассмотрения вопросов безопасности, поскольку они считаются организмами 2-й группы риска, с которыми следует обращаться на объектах 2-го уровня биобезопасности.
1. Культивирование и трансфекция трипаносом
- Культура трипаносом T. brucei brucei 90-13 BSF в среде HMI-9 дополнена 10% термоинактивированным FBS и 10% Nu-Serum при 37 °C в 5% CO210.
ПРИМЕЧАНИЕ: Чтобы сохранить культуру здоровой, поддерживайте плотность клеток в пределах 2 × 104 и 5 × 106 клеток/мл. - Клонирование pHluorin2-PTS1 в pLEW100v5
- Синтезируйте открытую рамку считывания pHluorin2 в коммерческих целях, чтобы получить ген с 3'-расширением, кодирующим линкер с двумя глицинами, за которым следует трипептид AKL, метка локализации PTS1.
- Клонируйте эту конструкцию в индуцируемый вектор экспрессии трипаносом pLEW100v5 с помощью дайджеста рестрикции. Двойной переваривание вектора клонирования, содержащего pHluorin2-PTS1 и pLEW100v5, с использованием HindIII и BamHI11. Выполните этап очистки, предпочтительно путем очистки агарозным гелем, чтобы удалить ферменты рестрикции, нежелательный костяк вектора клонирования и вырезанный фрагмент, содержащий ген люциферазы.
- Лигировать pHluorin2-содержащую вставку в расщепленный pLEW100v5 с помощью ДНК-лигазыT4 12. (см. дополнительный рисунок S1 для схемы клонирования).
- Секвенирование плазмиды с помощью секвенирования целой плазмиды нового поколения, чтобы убедиться, что вставка и вектор лигированы правильно, а также в том, что в процессе клонирования в гене pHluorin2-PTS1 не вводятся мутации.
ПРИМЕЧАНИЕ: Полная последовательность плазмид была отправлена в Addgene.org и ей было присвоено #83680. - Линеаризуют 20 мкг плазмиды путем расщепления с 40 единицами NotI; затем трансфицируют в паразитов BSF 90-13 с помощью нуклеофекции с использованием эталонного набора Т-клеток человека (см. таблицу материалов). Выберите стабильную интеграцию, как описано Burkard et al.13.
2. Иммунофлуоресцентная колокализация pHlourin2-PTS1
- Подготовьте предметные стекла для микроскопии, обработав их поли-L-лизином 0,1% (w/v) вH2Oв течение 10 мин. После удаления раствора поли-L-лизина промойте предметное стекло один раз PBS.
- Чтобы индуцировать экспрессию pHluorin2-PTS1, обработайте клетки в дозе 2 ×10 5 клеток/мл тетрациклином или доксициклином (1 мкг/мл) за 24 ч до сбора урожая. Гранулы 2 × 106 родительских и индуцированных pLEWpHluorin2-PTS1 (pHL) паразитов центрифугированием (комнатная температура [RT], 10 мин, 1,000 × г) и однократной промывкой PBS.
- Ресуспендируйте клетки в 200 мкл свежеприготовленного 2%-ного параформальдегида в PBS, изготовленном из коммерчески поставляемого 16%-ного раствора ЭМ. Приложите клетки в фиксаторе к предметному стеклу и дайте клеткам отстояться в течение 30 минут. Слипшиеся клетки промыть 2 раза промывным раствором (0,1% обычной козьей сыворотки в PBS).
- Нанесите раствор пермеабилизации (0,5% Triton X-100 в PBS) на клетки и инкубируйте ровно 30 мин. Удалите раствор пермеабилизации и промойте один раз достаточным количеством промывочного раствора.
- Наносят блочный раствор (10% обычной козьей сыворотки и 0,1% Triton X-100 в PBS) и инкубируют в течение 30 мин.
- Разбавляют антисыворотки, выращенные против T. brucei aldolase 1:500, в блочном растворе и наносят его на клетки14. Инкубировать в течение 1 ч при RT. Промыть предметные стекла 5 раз в течение 3-5 мин промывочным раствором.
- Разведите козий антикроличий препарат Alexa fluor 568 1:1,000 в блочном растворе и нанесите на клетки. Инкубировать в течение 1 ч при RT. Промыть предметные стекла 5 раз в течение 3-5 мин промывным раствором.
- Нанесите монтажный материал и прикрепите покровный стекло к направляющему.
- Визуализируйте ячейки с помощью 100-кратного объектива (NA 1.4-0.7) и проанализируйте изображения с помощью ImageJ. Выполните анализ колокализации Pearson с помощью плагина Coloc 2 для ImageJ. На дополнительном рисунке S2 показано поле репрезентативных ячеек. )
- Для этого добавьте файл изображения на Фиджи и выберите Изображения.
- Отрегулируйте яркость и контрастность для каждого канала до точки, в которой фон не виден.
- Измените изображения с 16-битных на 8-битные, объедините изображения, а затем обрежьте их до одной ячейки с разделением каналов.
- В разделе Analyze and Colocalization (Анализ и колокализация) выберите подключаемый модуль Coloc2. Выберите альдолазу ( красный канал) в качестве канала 1 и pHL ( зеленый канал) в качестве канала 2 и нажмите кнопку ОК , чтобы начать расчет корреляции Пирсона.
3. Подготовка образцов для проточной цитометрии
- Индуцируйте клетки pHL тетрациклином или доксициклином (1 мкг/мл) в течение ночи.
- Гранулирование клеток (~4 × 107 pHL и ~1 × 106 родительских) центрифугированием (RT, 10 мин, 1000 × г). Удалите надосадочную жидкость и повторно суспендируйте клетки в 1 мл PBS с глюкозой 10 мМ или без нее, в зависимости от того, голодает или не голодает образец. Для анализа с течением времени ресуспендируйте в PBS с добавлением глюкозы 10 мМ, чтобы предотвратить голодную промывку клеток до завершения промывки. Для высокопроизводительного скринингового анализа (HTS) ресуспендирование в PBS без глюкозы, чтобы свести к минимуму перенос глюкозы; Повторите стирки еще два раза.
- Центрифугируют клетки в четвертый раз, удаляют надосадочную жидкость и повторно суспендируют клеточную гранулу в PBS, PBS плюс 5 мМ глюкозы или PBS плюс 10 мМ глюкозы в зависимости от лечения. Добавьте в образцы 1 мкг/мл йодида пропидия (PI) или 100 нМ тиазола красного (TR) для определения живого/мертвого вещества. Переложите каждый образец в пробирки объемом 5 мл, совместимые с проточным цитометром.
4. Проточная цитометрия
ПРИМЕЧАНИЕ: Подготовьте эксперимент на проточном цитометре, содержащем следующие лазеры: 405 нм (фиолетовый), 488 нм (синий) и 561 нм (желтый) или 638 нм (красный). Общие имена каналов, обсуждаемые ниже, см. в Дополнительной таблице S1 .
- Для измерения флуоресценции pHL используют каналы KO525 (VL2-H, возбуждение 405 нм, излучение 542/27 нм) и FITC (BL1-H, возбуждение 488 нм, излучение 530/30 нм). Чтобы отличить живые клетки от мертвых, используйте PI или TR; измерение ПИ на канале YL2-H (возбуждение 561 нм, излучение 620/25 нм). Измерение TR на канале RL1-H (возбуждение 638 нм, 660/10.н.).
- Чтобы настроить эксперимент в программном обеспечении проточного цитометра, создайте следующие графики: 1) гистограмма канала YL2-H (при использовании PI) или гистограмма канала RL1-H (при использовании TR), 2) точечная диаграмма FSC-A и SSC-A, 3) точечная диаграмма FSC-A в зависимости от FSC-H и 4) точечная диаграмма канала BL1-H и VL2-H.
- Сначала поместите неокрашенный регулятор WT (родительская клеточная линия) на порт для впрыска образца (SIP) и установите столик на место. Начинайте получать данные с цитометра при самом низком расходе, чтобы дать время для внесения необходимых корректировок. Чтобы избежать появления ложных обломков и мертвых клеток, начинайте запись событий через 5 секунд после начала отбора пробы.
- Отрегулируйте напряжение YL2 или RL1 так, чтобы основной пик находился в пределах 103-10 4 единиц относительной интенсивности флуоресценции (RFI). Отрегулируйте напряжения FSC и SSC так, чтобы >90% событий умещались на точечной диаграмме. Отрегулируйте пороговое значение FSC, чтобы исключить скопление мусора, но не вероятные клетки.
- Отрегулируйте каналы VL2 и BL1 так, чтобы первичный пик находился в пределах 10 3-104 единиц RFI для контроля WT без пятен.
- Поместите первый образец, содержащий индуцированный pHL, окрашенный PI или TR, на SIP и поднимите предметный столик в нужное положение. Начинайте сбор данных с наименьшей скорости потока и внимательно наблюдайте за событиями на каждом участке. Убедитесь, что >90 % событий находятся на каждом графике и что никакие события не перегружают каналы VL2-H и BL1-H.
- Приступайте к запуску примеров. Обязательно запишите не менее 10 000 событий на выборку.
- Сохраните данные из образцов в формате .fcs и экспортируйте для анализа.
5. Анализ данных результатов проточной цитометрии
ПРИМЕЧАНИЕ: В этом рабочем процессе анализа данных используется программное обеспечение FlowJo. Если используется другое программное обеспечение для анализа проточной цитометрии, продолжайте выполнять ключевые шаги, описанные ниже, используя соответствующие программные инструменты. Чтобы визуализировать графики и стробирование, см. Дополнительный рисунок S3 и Дополнительный рисунок S4.
- Откройте новый макет и откройте файлы .fcs, полученные на шаге 4.3. Перетащите файлы .fcs в окно макета.
- Ворота для живых клеток.
- Дважды щелкните элемент управления WT без пятен, чтобы открыть окно для этого образца.
- Просмотрите данные в виде гистограммы на канале YL2-H (при использовании PI) или RL2-H (при использовании TR). Переключайтесь между ним и образцами, окрашенными красителем жизнеспособности, чтобы идентифицировать живые и мертвые популяции.
ПРИМЕЧАНИЕ: Все мероприятия должны быть неокрашенными, так как в этот образец не был добавлен краситель жизнеспособности. - Создать биссектрисные ворота, разделяющие живое и мертвое население; Назовите левые ворота Живыми , а правые — Мертвыми. Примените этот элемент ко всем образцам, а затем переключайтесь между образцами, чтобы убедиться, что этот элемент нарисован правильно для всех образцов. При необходимости отрегулируйте ворота.
- Ворота для клеток.
- В незапятнанном элементе управления WT дважды щелкните Live gate , чтобы просмотреть события в этом элементе управления. Измените ось X точечной диаграммы на FSC-A , а ось Y на SSC-A.
- Используйте инструмент Полигональные ворота , чтобы нарисовать ворота вокруг популяции ячеек и назовите их Ячейки. Позаботьтесь о том, чтобы исключить обломки/умирающие клетки (обычно в крайнем левом и нижнем углу точечной диаграммы) и агрегаты (крайние справа и вверху точечной диаграммы).
- Примените этот гейт под динамическим стробом для всех сэмплов. Переключайтесь между образцами, чтобы убедиться, что вентиль охватывает вероятную популяцию клеток для всех образцов, и внесите необходимые корректировки. Обязательно повторно примените затвор ко всем образцам после его изменения.
ПРИМЕЧАНИЕ: Распределение клеточной популяции заметно меняется между голодающими и неголодающими состояниями по сравнению с КФС и КСК; убедитесь, что ворота ячейки охватывают популяцию клеток в любых условиях.
- Затвор для одиночных ячеек для повышения качества измерений pH.
- В элементе управления WT без пятен дважды щелкните по гейту ячейки , чтобы просмотреть события в этом элементе. Измените ось X точечной диаграммы на FSC-A , а ось Y на FSC-H.
- Найдите диагональное распределение одиночных клеток на этой точечной диаграмме с дублетами, образующими вторичную популяцию в правом нижнем углу синглетной популяции (см. дополнительный рисунок S1 , третий график). Используя инструмент полигональные ворота, нарисуйте вентиль вокруг синглетных событий, исключая популяцию дублетов. Назовите эти ворота синглетами.
- Примените гейт синглетов под вентилем ячейки для всех образцов. Опять же, переключайтесь между выборками, чтобы убедиться, что вентиль правильно исключает дублетную популяцию, включая синглетную популяцию. При необходимости отрегулируйте.
- Затвор для флуоресцентных pHL-клеток.
- На неокрашенной контрольной выборке WT дважды щелкните на стробе синглетов, чтобы открыть точечную диаграмму для этой популяции. Измените ось X на BL1-H, а ось Y на VL2-H.
- Датчик pHh pHluorin2 флуоресцентный как в VL2, так и в BL1. Используйте инструмент Многоугольный гейт , чтобы нарисовать диагональный вентиль, простирающийся вверх и вправо от автофлуоресцентной популяции в левом нижнем углу точечной диаграммы. Назовите этот вентиль pHL+.
- Примените затвор pHL+ под затвором синглетов для всех образцов. Переключитесь на образец pHL и отрегулируйте вентиль, чтобы включить события с большей интенсивностью флуоресценции как в VL2-H, так и в BL1-H, чем в контроле WT. Убедитесь, что эти ворота охватывают эту флуоресцентную популяцию для всех образцов, так как положение этой популяции будет меняться по мере изменения гликосомального рН.
ПРИМЕЧАНИЕ: Этот небольшой, но заметный сдвиг в популяции pHL+ обусловлен pH-зависимыми изменениями в спектре возбуждения флуорофора.
- Экспортируйте статистику.
- Нажмите на Редактор таблиц | Панель редактирования | Добавить столбец , чтобы добавить новую статистику для экспорта.
ПРИМЕЧАНИЕ: Для каждой статистики для экспорта выберите соответствующую статистику и генеральную совокупность для ее экспорта. Убедитесь, что выбран соответствующий параметр для применимой статистики, например Медиана. Оставьте образец без изменений. - Добавьте столбцы со следующей статистикой: Общее (необработанное) количество, Количество pHL+, Текущая частота от общего числа (процент от общего количества событий), pHL+ Частота родительского элемента (процент на основе родительского элемента), pHL+ Медиана VL2-H и pHL+ Медиана BL1-H.
- Нажмите на редактор таблиц и измените следующие параметры экспорта: «Отображение» на «В файл» и «Текст в CSV», а затем выберите место назначения и имя файла. Нажмите «Создать таблицу».
- Нажмите на Редактор таблиц | Панель редактирования | Добавить столбец , чтобы добавить новую статистику для экспорта.
- Рассчитайте коэффициент флуоресценции.
- Сохраните экспортированный .csv файл в виде файла электронной таблицы.
- Выполните анализ контроля качества, сравнив следующие данные во всех образцах эксперимента: количество событий в выборке, процент активных событий и процент событий pHL+. Сравните их визуально с помощью линейчатых или точечных диаграмм в зависимости от эксперимента.
- Обозначьте новый столбец как pHL+ Median VL2/BL1. Для каждого образца разделите медианное значение VL2-H на медианное значение BL1-H, как показано в уравнении (1).
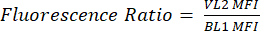 (1)
(1)
- Используйте программное обеспечение для статистического анализа для выполнения статистического анализа с использованием коэффициента флуоресценции.
6. Калибровка биосенсора pH
ПРИМЕЧАНИЕ: Чтобы перевести измеренные коэффициенты флуоресценции в единицы pH, откалибруйте pHL-экспрессирующие клетки с помощью нигерицина и валиномицина. Нигерицин является антипортером K+/H+, ионофором, который может уравновешивать pH через мембраны, когда в буфере15 достаточно K+. Нигерицин обычно используется для калибровки pHluorin и других датчиков pH16,17. Поскольку пероксисомально локализованный pHluorin ранее был откалиброван с использованием 10 мкМ нигерицина18, мы решили проводить лечение в этой концентрации. Валиномицин представляет собой ионофор калия и используется (при концентрации 4 мкМ) для уравновешивания рН через митохондриальные мембраны19. Мы использовали валиномицин размером 10 мкМ для поддержания рН-балансировки нигерицина, обеспечивая равновесие ионов К+ через мембраны. Несмотря на то, что мы использовали комбинацию нигерицина и валиномицина, нигерицина может быть достаточно для уравновешивания органеллярного рН.
- Приготовьте восемь растворов универсального калибровочного буфера (UCB; 15 мМ MES, 15 мМ HEPES и 130 мМ KCl) каждый с различным рН в диапазоне от 5 до 8,5.
- Центрифуга (RT, 10 мин, 800-1000 × г) восемь отдельных пробирок по 2 мл культуры BSF, экспрессирующей pHL (~4 × 106 клеток каждая).
- Удалите надосадочную жидкость, а затем повторно суспендируйте каждую клеточную гранулу в UCB при различных значениях pH.
- Вводят нигерицин и валиномицин по 10 мкМ. Всплеск ПИ до 1 мкг/мл.
- Инкубируют клетки в каждом растворе в течение 15 мин.
- Запустите каждый образец на проточном цитометре, чтобы измерить коэффициент флуоресценции, как описано в шагах 4–5.
- Повторите этот эксперимент еще дважды, чтобы получить три биологических репликата для каждого значения pH. Экспорт данных в формате .fcs.
- Проанализируйте FCS-файлы, как описано в шагах 5.1–5.8. Используйте измеренный коэффициент флуоресценции для каждого рН для интерполяции гликосомального рН в будущих экспериментах с использованием уравнения (2).
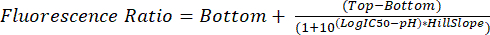 (2)
(2)
ПРИМЕЧАНИЕ: На дополнительном рисунке S3 показаны точечные графики и схема стробирования. Результаты можно найти в Дополнительной таблице S2. Ниже описано, как интерполировать pH из коэффициента флуоресценции с помощью GraphPad Prism. Если вы используете другое статистическое программное обеспечение, выполните те же ключевые шаги.- Откройте GraphPad Prism и создайте таблицу XY с тремя y-репликами. Вставьте значения pH в столбец x и связанные с ними значения коэффициента флуоресценции в столбцы y-репликации.
- Нажмите на график, связанный с таблицей. При просмотре графика нажмите «Анализ» на ленте «Анализ | Интерполируйте стандартную кривую при анализе XY.
- Выберите Sigmoidal, 4PL, X - логарифм (концентрация), так как единицы pH находятся по логарифмической шкале. Параметры Top и Bottom - это предполагаемые верхнее и нижнее плато. Выберите Без специальной обработки выбросов.
ПРИМЕЧАНИЕ: Программное обеспечение будет стремиться подогнать данные под модель, описанную в уравнении (2) и шаге 6.9.3. Ищите доказательства отсутствия подгонки в таблице результатов и кривой на графике. - Чтобы интерполировать рН по коэффициентам флуоресценции в других экспериментах, перейдите к таблице с данными калибровки pHL. Вставьте значения коэффициента флуоресценции под данными калибровки в столбец (столбцы) по оси Y. Присвойте каждому y-значению заголовок, но оставьте значение x (pH) пустым, так как оно неизвестно.
- В галерее результатов щелкните по интерполяционному анализу, а затем перейдите на вкладку Интерполированные реплики X. Найдите интерполированные значения pH, которые будут перечислены рядом с введенными значениями коэффициента флуоресценции.
ПРИМЕЧАНИЕ: Программное обеспечение использует значения параметров модели и наилучшего соответствия, полученные из данных калибровки, для интерполяции pH из коэффициентов флуоресценции для экспериментов, где pH неизвестен.
7. Глюкозное голодание и прибавление времени
- Индуцируйте 15 мл паразитов BSF pHL в течение ночи с помощью 1 мкг/мл доксициклина, инкубированного при 37 °C, как описано в шаге 1.1.
- Промыть 15 мл индуцированной культуры pHL в PBS с добавлением 10 мМ глюкозы. Повторите этот шаг 3 раза.
- Одновременно промойте 3 мл культуры WT в PBS 3x, как описано в шаге 3.2.
- После первой промывки, когда образец pHL ресуспендируют в 1 мл PBS, удаляют 0,1 мл аликвоты клеточной суспензии pHL для хранения в 10 мМ глюкозы в качестве контрольной группы.
- После окончательной промывки повторно суспендируйте образец pHL в PBS с добавлением 1 мкг/мл PI.
- Получение данных проточной цитометрии
- Начните мониторинг гликозомального рН как для голодающих, так и для неголодающих образцов, измеряя каждый образец на проточном цитометре каждые 5, 10, 30 или 90 минут, в зависимости от эксперимента и образца. Получите данные проточной цитометрии, как описано в шагах 4.1–4.3, предварительно подготовив напряжения и графики.
- Запустите контроль WT без пятен сначала на 0 минут.
- Запускайте контрольный образец на цитометре каждые 90 мин, начиная с 0 мин. Для анализа с временным ходом голодания запускайте голодный образец каждые 10 минут, начиная с 0 минут. Для анализа Glucose Addback прогоните голодный образец через 0, 5, 10, 20, 30, 60 и 90 минут; Затем, после введения глюкозы, повторите процедуру.
- Инкубируйте образцы при комнатной температуре в течение 90-минутного курса голодания и 180-минутного курса добавления глюкозы.
- Проанализируйте FCS-файлы, как описано в шагах 5.1–5.8.
ПРИМЕЧАНИЕ: Дополнительный рисунок S4 показывает, как выполнить стробирование и как должны выглядеть точечные диаграммы. В Дополнительной таблице S3 и Дополнительной таблице S4 показаны результаты анализа времени прохождения голодания глюкозы и анализа времени добавления глюкозы, соответственно.
8. Оптимизация анализа для скрининга лекарственных препаратов
- Промыть примерно 32 мл pHL-экспрессирующих BSF-паразитов и 3 мл WT-клеток, оба примерно в 2 × 106 клеток/мл, 2 раза в PBS, как описано выше.
ПРИМЕЧАНИЕ: Для минимизации изменчивости измеренных коэффициентов флуоресценции и точного измерения статистики Z-фактора необходимо зарегистрировать более 10 000 событий на скважину. Минимальная культура, необходимая для этого, составляет примерно 26 мл, но мы рекомендуем 32 мл для удобства использования.- После первой промывки разделите образец pHL поровну на две пробирки для микроцентрифуги.
- После промывки ресуспендируйте один образец pHL в 18 мл PBS, содержащего 5 мМ глюкозы, 0,1% ДМСО и TR. Другой образец pHL ресуспендируйте в 18 мл PBS плюс 0,1% ДМСО и TR.
ПРИМЕЧАНИЕ: ДМСО используется для имитации буферного состава в скрининге лекарственного препарата, поскольку соединения обычно растворяются в ДМСО. - Перелейте эти два клеточных раствора в 12-луночный резервуар по 9 мл на лунку.
- Используйте робота-пипетчика для пипетирования клеточных растворов в отдельные половинки 384-луночной пластины, по 80 мкл на лунку.
- Выдерживают планшет при комнатной температуре в течение 1,5 ч, аккуратно встряхивая и заворачивая в алюминиевую фольгу, чтобы защитить флуорофоры от света.
- Запустите планшет на проточный цитометр, способный работать с 384-луночными планшетами.
ПРИМЕЧАНИЕ: Следующий рабочий процесс адаптирован к Attune NxT с автоматическим сэмплером Cytkick Max. Если используется другой проточный цитометр, продолжайте выполнять основные действия.- Для пластины работайте с максимальной скоростью потока (1 000 мкл/мин) и включите режим наддува. Возьмите 20 мкл/лунка. Включите один цикл смешивания и один цикл промывки между каждой лункой.
- Создайте графики, как описано в шаге 4.1.3.
- Запустите управление неокрашенной трубкой WT и оптимизируйте напряжение, как описано в шагах 4.1.3 и 4.1.4. Запустите образец пробирки pHL и оптимизируйте напряжения VL2 и BL1, как описано в шаге 4.1.
- Начните приобретать пластину на проточном цитометре. Проводите планшет горизонтально, чтобы не было существенной разницы во времени сбора между лунками для образцов с голодным и неголодным образцами. Убедитесь, что получение пластины завершено через ~1,5 часа.
- Экспортируйте файлы .fcs и проанализируйте данные, как описано в шагах 5.1–5.8. Найдите среднее значение (AVG) и стандартное отклонение (SD) коэффициентов флуоресценции для образцов, обработанных глюкозой (Glc) или без глюкозы (Starved).
ПРИМЕЧАНИЕ: Данные наших экспериментов с Z-фактором можно найти в Дополнительной таблице S5. - Вычислите статистику Z-фактора20 , используя уравнение (3).
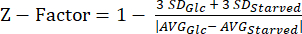 (3) См.
(3) См.
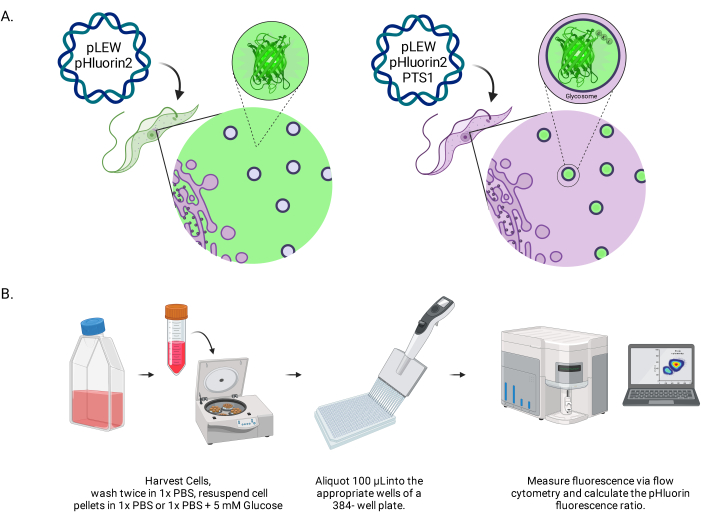
Рисунок 1: Диаграмма метода оценки гликосомального рН в живых трипаносомах BSF. (A) Изображение клеточных линий, экспрессирующих гликосомно расположенный сенсор pHluorin2. Включение последовательности пероксисомального таргетирования обеспечивает контроль над локализацией. Примечание: Мы ожидаем, что элиминация PTS-1 приведет к цитозольной локализации, что позволит в будущем проанализировать pH в этом субклеточном компартменте. (B) Изображение валидационного анализа датчика. Аббревиатура: BSF = форма кровотока. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Статистика Z-фактора используется для определения того, насколько анализ подходит для HTS. Значения от 0,5 до 1,0 обычно означают, что качество анализа приемлемо для HTS.
Результаты
Локализация pHLuorin2-PTS1 в гликосомах у BSF T. brucei
Для оценки субклеточной локализации pHluorin2-PTS1 паразитов подвергали иммунофлюоресцентным анализам. Сигнал от трансгена, локализованного с антисыворотками, повышенными против гликозомно-резидентного белка альдолазы (TbAldolase) (
Обсуждение
Восприятие окружающей среды и механизмы реагирования африканской трипаносомы плохо изучены. Известно, что изменения в доступности питательных веществ вызывают различные реакции у паразита, включая закисление гликосом. В данной работе мы описали метод изучения реакции гликосомного р...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
pHluorin2-PTS1 был клонирован в pLEW100v5 компанией Twist Bioscience, которая предоставила конструкцию в векторе клонирования с высокой степенью копии; pLEW100v5 был подарком от доктора Джорджа Кросса. Антисыворотка, выращенная против T. brucei aldolase, можно получить у доктора Мередит Т. Моррис из Университета Клемсона по запросу. Работа лабораторий JCM и KAC была частично поддержана премией Национальных институтов здравоохранения (R01AI156382). SSP был поддержан NIH 3R01AI156382.
Материалы
| Name | Company | Catalog Number | Comments |
| 50 mL Tissue Culture Flasks (Non-treated, sterile) | VWR | 10861-572 | |
| 75 cm2 Tissue Culture Flask (Non-Treated, sterile) | Corning | 431464U | |
| 80 µL flat-bottom 384-well plate | BrandTech | 781620 | |
| Amaxa Human T Cell Nucleofector Kit | Lonza | VPA-1002 | |
| Attune NxT Flow Cytometer | invitrogen by Thermo Fisher Scientific | A24858 | FlowJo software |
| BRANDplates 96-Well, flat bottom plate | Millipore Sigma | BR781662 | |
| Coloc 2 plugin of ImageJ | https://imagej.net/plugins/coloc-2 | ||
| CytKick Max Auto Sampler | invitrogen by Thermo Fisher Scientific | A42973 | |
| CytoFLEX Flow Cytometer | Beckman-Coulter | ||
| Electron Microscopy Sciences 16% Paraformaldehyde Aqueous Solution, EM Grade, 10 mL Ampoule | Fisher Scientific | 50-980-487 | |
| GraphPad Prism | statistical software | ||
| Nigericin (sodium salt) | Cayman Chemical | 11437 | |
| Nucleofector 2b | Lonza | Discontinued Product | |
| OP2 Liquid Handler | opentrons | OP2 | |
| poly-L-lysine, 0.1% (w/v) in H2O | Sigma Life Science | CAS:25988-63-0 | Pipetting robot for HTS assay |
| Thiazole Red (TO-PRO-3) | biotium | #40087 | We machined a custom acrylic plate stand so this brand of plate could be detected and used on our CytKick Max Auto Sampler |
| valinomycin | Cayman Chemical | 10009152 | Pipetting robot for HTS assay |
| For pH calibration | |||
| For pH calibration |
Ссылки
- Coley, A. F., Dodson, H. C., Morris, M. T., Morris, J. C. Glycolysis in the African trypanosome: Targeting enzymes and their subcellular compartments for therapeutic development. Molecular Biology International. 2011, 123702 (2011).
- Mcconville, M. J., Saunders, E. C., Kloehn, J., Dagley, M. J. Leishmania carbon metabolism in the macrophage phagolysosome- feast or famine. F1000Res. 4, 938 (2015).
- Parsons, M. Glycosomes: Parasites and the divergence of peroxisomal purpose. Molecular Microbiology. 53 (3), 717-724 (2004).
- Parsons, M., Furuya, T., Pal, S., Kessler, P. Biogenesis and function of peroxisomes and glycosomes. Molecular and Biochemical Parasitology. 115 (1), 19-28 (2001).
- Haanstra, J. R., Gonzalez-Marcano, E. B., Gualdron-Lopez, M., Michels, P. A. Biogenesis, maintenance and dynamics of glycosomes in trypanosomatid parasites. Biochimica et Biophysica Acta. 1863 (5), 1038-1048 (2016).
- Allmann, S., Bringaud, F. Glycosomes: A comprehensive view of their metabolic roles in t. Brucei. International Journal of Biochemistry and Cell Biology. 85, 85-90 (2017).
- Dodson, H. C., Morris, M. T., Morris, J. C. Glycerol 3-phosphate alters Trypanosoma brucei hexokinase activity in response to environmental change. The Journal of Biological Chemistry. 286 (38), 33150-33157 (2011).
- Lin, S., Morris, M. T., Ackroyd, P. C., Morris, J. C., Christensen, K. A. Peptide targeted delivery of pH sensor for quantitative measurements of intraglycosomal pH in live Trypanosoma brucei. Biochemistry. 52 (21), 3629-3637 (2013).
- Mahon, M. J. Phluorin2: An enhanced, ratiometric, pH-sensitive green florescent protein. Advances in Bioscience and Biotechnology. 2 (3), 132-137 (2011).
- Wirtz, E., Leal, S., Ochatt, C., Cross, G. A. A tightly regulated inducible expression system for conditional gene knock-outs and dominant-negative genetics in Trypanosoma brucei. Molecular and Biochemical Parasitology. 99 (1), 89-101 (1999).
- . Restriction digest v.2 Available from: https://www.protocols.io/view/restriction-digest-nkqdg33pg25z/v2 (2018)
- . Ligation protocol with t4 DNA ligaase (m0202) v.3 Available from: https://www.protocols.io/view/ligation-protocol-with-t4-dna-ligase-m0202-95qpvorzv4o1/v3 (2021)
- Burkard, G., Fragoso, C. M., Roditi, I. Highly efficient stable transformation of bloodstream forms of Trypanosoma brucei. Molecular and Biochemical Parasitology. 153 (2), 220-223 (2007).
- Crowe, L. P., Wilkinson, C. L., Nicholson, K. R., Morris, M. T. Trypanosoma brucei pex13.2 is an accessory peroxin that functions in the import of peroxisome targeting sequence type 2 proteins and localizes to subdomains of the glycosome. mSphere. 5 (1), e00744 (2020).
- Kucejova, B., Kucej, M., Petrezselyova, S., Abelovska, L., Tomaska, L. A screen for nigericin-resistant yeast mutants revealed genes controlling mitochondrial volume and mitochondrial cation homeostasis. Genetics. 171 (2), 517-526 (2005).
- Huynh, M. H., Carruthers, V. B. Toxoplasma gondii excretion of glycolytic products is associated with acidification of the parasitophorous vacuole during parasite egress. PLoS Pathogens. 18 (5), e1010139 (2022).
- Lehoux, S., Abe, J., Florian, J. A., Berk, B. C. 14-3-3 binding to Na+/H+ exchanger isoform-1 is associated with serum-dependent activation of Na+/H+ exchange. TheJournal of Biological Chemistry. 276 (19), 15794-15800 (2001).
- Jankowski, A., et al. In situ measurements of the ph of mammalian peroxisomes using the fluorescent protein phluorin. The Journal of Biological Chemistry. 276 (52), 48748-48753 (2001).
- Jankowski, A., Grinstein, S. A. A noninvasive fluorimetric procedure for measurement of membrane potential. Quantification of the NADPH oxidase-induced depolarization in activated neutrophils. The Journal of Biological Chemistry. 274 (37), 26098-26104 (1999).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Lin, S., et al. Ph regulation in glycosomes of procyclic form Trypanosoma brucei. The Journal of Biological Chemistry. 292 (19), 7795-7805 (2017).
- Ha, D. S., Schwarz, J. K., Turco, S. J., Beverley, S. M. Use of the green fluorescent protein as a marker in transfected Leishmania. Molecular and Biochemical Parasitology. 77 (1), 57-64 (1996).
- Kelly, J. M., Ward, H. M., Miles, M. A., Kendall, G. A shuttle vector which facilitates the expression of transfected genes in Trypanosoma cruzi and Leishmania. Nucleic Acids Research. 20 (15), 3963-3969 (1992).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены