Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Canlı Trypanosoma brucei'de Dinamik Glikozomal pH Değişikliklerinin Ölçülmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
PH'ın, Afrika tripanozomlarının kan dolaşımı formunun glikozomlarındaki çevresel ipuçlarına nasıl tepki verdiğini incelemek için bir yöntem açıklıyoruz. Bu yaklaşım, pH dinamiklerini ölçmek için akış sitometrisi ile birlikte pH'a duyarlı kalıtsal bir protein sensörünü hem zaman seyri tahlili olarak hem de yüksek verimli bir ekran formatında içerir.
Özet
Glikoz metabolizması, Afrika tripanozomu, Trypanosoma brucei, temel bir metabolik süreç ve parazit gelişiminin düzenleyicisi olarak kritik öneme sahiptir. Çevresel glikoz seviyeleri değiştiğinde oluşan hücresel tepkiler hakkında çok az şey bilinmektedir. Hem kan dolaşımında hem de prosiklik formda (böcek evresi) parazitlerde, glikozomlar glikolizin çoğunu barındırır. Bu organeller, glikoz yoksunluğuna yanıt olarak hızla asitleştirilir, bu da muhtemelen hekzokinaz gibi glikolitik enzimlerin allosterik regülasyonuna neden olur. Önceki çalışmalarda, pH ölçümleri yapmak için kullanılan kimyasal probun lokalizasyonu zordu ve diğer uygulamalardaki kullanımını sınırlıyordu.
Bu makale, kalıtsal bir protein pH biyosensörü olan glikozomal olarak lokalize pHluorin2'yi eksprese eden parazitlerin gelişimini ve kullanımını açıklamaktadır. pHluorin2, 395 nm'de uyarmada pH'a (asit) bağlı bir azalma gösteren ve aynı anda 475 nm'de uyarmada bir artış sağlayan bir oransal pHluorin varyantıdır. Transgenik parazitler, pHluorin2 açık okuma çerçevesinin tripanozom ekspresyon vektörü pLEW100v5'e klonlanmasıyla üretildi ve her iki yaşam döngüsü aşamasında da indüklenebilir protein ekspresyonu sağlandı. pHluorin2 biyosensörünün glikozomal lokalizasyonunu doğrulamak için immünofloresan kullanıldı ve biyosensörün lokalizasyonunu glikozomal yerleşik protein aldolaz ile karşılaştırdı. Sensörün yanıt verme hızı, daha önce floresein bazlı bir pH sensörünü kalibre etmek için kullandığımız bir yaklaşım olan pH değeri 4 ile 8 arasında değişen bir dizi tamponda hücrelerin inkübe edilmesiyle farklı pH seviyelerinde kalibre edildi. Daha sonra glikozomal pH'ı belirlemek için akış sitometrisi kullanarak 405 nm ve 488 nm'de pHluorin2 floresansını ölçtük. PF parazitlerinde bilinen bir glikozomal asitleşme tetikleyicisi olan glikoz yoksunluğuna yanıt olarak zaman içinde pH'ı izleyerek canlı transgenik pHluorin2 eksprese eden parazitlerin performansını doğruladık. Bu araç, potansiyel olarak yüksek verimli ilaç taramasında kullanılmak da dahil olmak üzere bir dizi potansiyel uygulamaya sahiptir. Sensör, glikozomal pH'ın ötesinde, canlı hücre ortamındaki pH dinamiklerini anlamak için diğer organellere uyarlanabilir veya diğer tripanosomatidlerde kullanılabilir.
Giriş
Parazitik kinetoplastidler, çoğu canlı organizma gibi, merkezi karbon metabolizmasının temel bir bileşeni olarak glikoza güvenir. Bu grup, Afrika tripanozomu, Trypanosoma brucei gibi tıbbi açıdan önemli organizmaları içerir;Amerikan tripanozomu, T. cruzi; ve Leishmania cinsinin parazitleri. Glikoz metabolizması, patojenik yaşam döngüsü aşamalarında parazit büyümesi için kritik öneme sahiptir. Örneğin, glikozdan yoksun bırakıldığında, Afrika tripanozomunun kan dolaşımı formu (BSF) hızla ölür. Özellikle, glikoliz, enfeksiyonun bu aşamasında ATP'nin tek kaynağı olarak hizmet eder1. Leishmania parazitleri de aynı şekilde insan konakçıdaki glikoza bağımlıdır, konakçı makrofajlarda bulunan amastigot yaşam döngüsü aşaması büyüme için bu karbon kaynağına bağımlıdır2.
Bu parazitler, farklı böcek vektörlerini içeren farklı yaşam tarzlarına sahip olsalar da, glikoza nasıl tepki verdikleri ve tükettikleri konusunda birçok ortak noktayı paylaşırlar. Örneğin, bu parazitler çoğu glikolitik enzimi glikozom adı verilen modifiye peroksizomlara lokalize eder. Bu kinetoplastide spesifik organel, korunmuş biyosentetik mekanizmalara vemorfolojiye dayalı memeli peroksizomları ile ilişkilidir 3,4,5,6.
Glikolitik yol enzimlerinin çoğunun glikozoma bölümlendirilmesi, yolun düzenlenmesi için parazite özgü araçlar sunar. Kimyasal bir pH probu kullanarak, besin yoksunluğunun, anahtar glikolitik enzim hekzokinaz 7,8 üzerindeki bir allosterik düzenleyici bağlanma bölgesine maruz kalma yoluyla glikolitik enzim aktivitesinin değişmesine neden olan prosiklik form (PF) parazit glikozomlarının hızlı bir asitlenmesini tetiklediğini belirledik. Önceki çalışmamızda, kimyasal probun kullanım için sürekli teslimat gerektirmesi ve diğer uygulamalardaki faydasını sınırlaması gerekiyordu. Ek olarak, BSF'deki glikozomdaki prob dağılımını sürdürme zorlukları, bu yaşam evresinde glikozomal pH'ı araştırma yaklaşımının faydasını sınırladı.
Bu çalışmada, glikoz açlığı9 dahil olmak üzere çevresel ipuçlarına yanıt olarak BSF T. brucei'deki glikozomal pH değişimini izlemek için floresan protein biyosensörü pHluorin2'yi kullandık (Şekil 1). Bu çalışmadan elde edilen sonuçlar, BSF T. brucei'nin, PF parazitlerinde gözlemlediğimiz tepkilere benzer şekilde, açlığa yanıt olarak glikozomları geri dönüşümlü bir şekilde hızla asitleştirdiğini göstermektedir. Bu biyosensörün T. brucei ve ilgili parazitlerdeki glikolitik regülasyon anlayışımızı geliştireceğini umuyoruz.
Protokol
Monomorfik bir parazit hattı olan T. brucei brucei 90-13 BSF tripanozomlarının kullanılması, biyogüvenlik seviyesi 2 tesislerinde ele alınması gereken Risk Grubu 2 organizmaları olarak kabul edildiğinden güvenliğin dikkate alınmasını gerektirir.
1. Tripanozom kültürü ve transfeksiyonu
- Kültür T. brucei brucei 90-13 BSF tripanozomları, HMI-9 ortamında% 10 ısıyla inaktive edilmiş FBS ve% 10 Nu-Serum ile% 5 CO210 içinde 37 ° C'de.
NOT: Kültürü sağlıklı tutmak için hücre yoğunluğunu 2 × 104 ve 5 × 106 hücre/mL arasında tutun. - pHluorin2-PTS1'in pLEW100v5'e klonlanması
- İki glisin bağlayıcıyı kodlayan bir 3' uzantı ve ardından bir PTS1 lokalizasyon etiketi olan tripeptit AKL'yi içeren geni elde etmek için pHluorin2 açık okuma çerçevesini ticari olarak sentezleyin.
- Bu yapıyı, kısıtlama özeti ile indüklenebilir tripanozom ekspresyon vektörü pLEW100v5'e klonlayın. HindIII ve BamHI11 kullanarak hem pHluorin2-PTS1 hem de pLEW100v5 içeren klonlama vektörünü çift sindirin. Restriksiyon enzimlerini, istenmeyen klonlama vektörü omurgasını ve eksize edilen lusiferaz geni içeren fragmanı çıkarmak için tercihen agaroz jel saflaştırması ile bir temizleme adımı gerçekleştirin.
- pHluorin2 içeren eki T4 DNA Ligaz12 ile sindirilmiş pLEW100v5'e bağlayın. (klonlama şeması için Ek Şekil S1'e bakın).
- Ekin ve vektörün doğru şekilde bağlandığını ve klonlama işlemi sırasında pHluorin2-PTS1 geninde hiçbir mutasyon oluşmadığını doğrulamak için plazmiti yeni nesil tam plazmit dizilimi ile sıralayın.
NOT: Tam plazmit dizisi Addgene.org'a gönderildi ve #83680 olarak atandı. - 40 birim NotI ile sindirerek 20 μg plazmidi doğrusallaştırın; daha sonra, referans verilen insan T hücresi kitini kullanarak nükleofeksiyon yoluyla BSF 90-13 parazitlerine transfekte edin (bkz. Burkard ve ark.13 tarafından açıklandığı gibi kararlı entegrasyon için seçin.
2. pHlourin2-PTS1'in immünofloresan kolokalizasyonu
- Mikroskopi slaytlarını 10 dakika boyuncaH2O'da% 0.1 (a/h) poli-L-lizin ile işleyerek hazırlayın. Poli-L-lizin çözeltisinin çıkarılmasından sonra, slaytı bir kez PBS ile yıkayın.
- pHluorin2-PTS1 ekspresyonunu indüklemek için, hasattan 24 saat önce 2 × 105 hücre/mL'deki hücreleri tetrasiklin veya doksisiklin (1 μg/mL) ile tedavi edin. Pelet 2 × 106 ebeveyn ve indüklenmiş pLEWpHluorin2-PTS1 (pHL) parazitlerini santrifüjleme ile (oda sıcaklığı [RT], 10 dakika, 1.000 × g) ve PBS ile bir kez yıkayın.
- Hücreleri, ticari olarak tedarik edilen% 16 EM dereceli çözeltiden yapılan PBS'de 200 μL taze hazırlanmış% 2 paraformaldehit içinde yeniden süspanse edin. Sabitleyicideki hücreleri slayta uygulayın ve hücrelerin 30 dakika oturmasına izin verin. Yapışan hücreleri 2 kez yıkama solüsyonu ile yıkayın (PBS'de% 0.1 normal keçi serumu).
- Geçirgenlik çözeltisini (PBS'de% 0.5 Triton X-100) hücrelere uygulayın ve tam olarak 30 dakika inkübe edin. Geçirgenlik solüsyonunu çıkarın ve bol miktarda yıkama solüsyonu ile bir kez yıkayın.
- Blok çözeltisini uygulayın (PBS'de% 10 normal keçi serumu ve% 0.1 Triton X-100) ve 30 dakika inkübe edin.
- T. brucei aldolase 1:500'e karşı yükseltilen antiserumları blok solüsyon içinde seyreltin ve hücrelereuygulayın 14. RT'de 1 saat inkübe edin. Slaytları 5x için 3-5 dakika boyunca yıkama solüsyonu ile yıkayın.
- Keçi tavşan önleyici Alexa fluor 568 1: 1.000'i blok çözelti içinde seyreltin ve hücrelere uygulayın. RT'de 1 saat inkübe edin. Slaytları 5x için 3-5 dakika yıkama solüsyonu ile yıkayın.
- Montaj ortamı uygulayın ve slayta bir lamel kapatın.
- Hücreleri 100x objektifle (NA 1.4-0.7) görüntüleyin ve görüntüleri ImageJ kullanarak analiz edin. ImageJ için 'Coloc 2' eklentisini kullanarak Pearson'ın yerelleştirme analizini gerçekleştirin. Temsili hücreler alanı için Ek Şekil S2'ye bakın. )
- Bunu tamamlamak için görüntü dosyasını Fiji'ye ekleyin ve Görüntüler'i seçin.
- Her kanalın parlaklığını ve kontrastını, arka planın görünmeyeceği bir noktaya ayarlayın.
- Görüntüleri 16 bit'ten 8 bit'e değiştirin, görüntüleri birleştirin ve ardından bölünmüş kanallarla tek bir hücreye kırpın.
- Analiz ve Birlikte Yerelleştirme altında, Coloc2 eklentisini seçin. Kanal 1 olarak aldolaz (kırmızı kanal) ve Kanal 2 olarak pHL'yi (yeşil kanal) seçin ve Pearson korelasyonunun hesaplanmasını başlatmak için Tamam'a tıklayın.
3. Akış sitometrisi için numune hazırlama
- Gece boyunca tetrasiklin veya doksisiklin (1 μg/mL) ile pHL hücrelerini indükleyin.
- Hücreleri (~4 × 107 pHL ve ~1 × 106 ebeveyn) santrifüjleme (RT, 10 dk, 1.000 × g) ile pelet haline getirin. Süpernatanı çıkarın ve numunenin aç bırakılıp bırakılmadığına bağlı olarak 10 mM glikozlu veya glikozsuz 1 mL PBS'deki hücreleri yeniden süspanse edin. Zaman seyri tahlilleri için, yıkamalar tamamlanana kadar hücrelerin aç kalmasını önlemek için 10 mM glikoz ile takviye edilmiş PBS'de yeniden süspanse edin. Yüksek verimli ekran (HTS) testi için, glikozun taşınmasını en aza indirmek için glikoz olmadan PBS'de yeniden süspanse edin; Yıkamaları iki kez daha tekrarlayın.
- Hücreleri dördüncü kez santrifüjleyin, süpernatanı çıkarın ve tedaviye bağlı olarak hücre peletini PBS, PBS artı 5 mM glikoz veya PBS artı 10 mM glikozda yeniden süspanse edin. Canlı/ölü tayini için numuneleri 1 μg/mL propidyum iyodür (PI) veya 100 nM tiazol kırmızısı (TR) ile destekleyin. Her numuneyi akış sitometresi ile uyumlu 5 mL'lik tüplere aktarın.
4. Akış sitometrisi
NOT: Deneyi aşağıdaki lazerleri içeren bir akış sitometresinde hazırlayın: 405 nm (mor), 488 nm (mavi) ve 561 nm (sarı) veya 638 nm (kırmızı). Aşağıda tartışılan kanalların ortak adları için Ek Tablo S1'e bakın.
- pHL floresansını ölçmek için KO525 (VL2-H, uyarma 405 nm, emisyon 542/27 nm) ve FITC (BL1-H, uyarma 488 nm, emisyon 530/30 nm) kanallarını kullanın. Canlı hücreleri ölü hücrelerden ayırt etmek için PI veya TR kullanın; YL2-H kanalında PI'yi ölçün (uyarma 561 nm, emisyon 620/25 nm). RL1-H kanalında TR'yi ölçün (638 nm uyarma, 660/10 BP).
- Deneyi akış sitometresi yazılımında kurmak için aşağıdaki grafikleri oluşturun: 1) YL2-H kanal histogramı (PI kullanılıyorsa) veya bir RL1-H kanal histogramı (TR kullanılıyorsa), 2) FSC-A ve SSC-A nokta grafiği, 3) FSC-A ve FSC-H nokta grafiği ve 4) BL1-H ile VL2-H kanal nokta grafiği.
- Boyanmamış WT (ebeveyn hücre hattı) kontrolünü önce numune enjeksiyon portuna (SIP) yerleştirin ve s'yi kaldırıntage yerine yerleştirin. Gerekli ayarlamaları yapmak için zaman tanımak için sitometre hakkında en düşük akış hızında veri toplamaya başlayın. Sahte döküntülerin ve ölü hücrelerin puanlanmasını önlemek için, numune alımı başladıktan 5 saniye sonra olayları kaydetmeye başlayın.
- YL2 veya RL1 voltajını, ana tepe noktası 103-10 4 bağıl floresan yoğunluğu (RFI) birimi içinde olacak şekilde ayarlayın. FSC ve SSC voltajlarını, olayların %>90'ı nokta grafiğine sığacak şekilde ayarlayın. Enkaz popülasyonunu hariç tutmak için FSC eşiğini ayarlayın, ancak olası hücreleri değil.
- VL2 ve BL1 kanallarını, boyanmamış WT kontrolü için birincil tepe noktası 103-10 4 RFI birimi içinde olacak şekilde ayarlayın.
- PI veya TR ile boyanmış indüklenmiş pHL içeren ilk numuneyi SIP'ye yerleştirin ve sahneyi konumuna kaldırın. En düşük akış hızında veri toplamaya başlayın ve her grafikteki olayları dikkatlice gözlemleyin. Olayların %>90'ının her çizimde olduğundan ve VL2-H ve BL1-H kanallarını hiçbir olayın doygun hale getirmediğinden emin olun.
- Örnekleri çalıştırmaya devam edin. Örnek başına en az 10.000 olay kaydettiğinizden emin olun.
- Örneklerdeki verileri .fcs dosya biçiminde kaydedin ve analiz için dışa aktarın.
5. Akım sitometri sonuçlarının veri analizi
NOT: Bu veri analizi iş akışı, FlowJo yazılımını kullanır. Başka bir akış sitometrisi analiz yazılımı kullanılıyorsa, yazılıma uygun araçları kullanarak aşağıda açıklanan temel adımları izlemeye devam edin. Grafikleri ve kapıları görselleştirmek için Ek Şekil S3 ve Ek Şekil S4'e bakın.
- Yeni bir düzen açın ve adım 4.3'te alınan .fcs dosyalarını açın. .fcs dosyalarını düzen penceresine sürükleyip bırakın.
- Canlı hücreler için kapı.
- Bu örnek için bir pencere açmak üzere boyanmamış WT denetimine çift tıklayın.
- Verileri YL2-H kanalında (PI kullanılıyorsa) veya RL2-H (TR kullanılıyorsa) kanalında histogram olarak görüntüleyin. Canlı ve ölü popülasyonları tanımlamak için bununla canlılık boyası ile boyanmış numuneler arasında geçiş yapın.
NOT: Bu numuneye bir canlılık boyası eklenmediği için tüm olaylar boyanmamalıdır. - Canlı ve ölü popülasyonları bölen bir açıortay kapısı oluşturun; Sol kapıyı Canlı ve sağ kapıyı Ölü olarak adlandırın. Bu kapıyı tüm numunelere uygulayın, ardından bu kapının tüm numuneler için uygun şekilde çizildiğinden emin olmak için numuneler arasında geçiş yapın. Kapıyı gerektiği gibi ayarlayın.
- Hücreler için kapı.
- Boyanmamış WT kontrolünde, o geçitteki olayları görüntülemek için Canlı geçide çift tıklayın. Nokta grafiği x eksenini FSC-A ve y eksenini SSC-A olarak değiştirin.
- Hücre popülasyonunun etrafına bir geçit çizmek ve onu Hücreler olarak adlandırmak için çokgen kapısı aracını kullanın. Enkaz/ölmekte olan hücreleri (genellikle nokta grafiğinin en solunda ve altında) ve kümeleri (nokta grafiğinin en sağında ve üstünde) hariç tutmaya dikkat edin.
- Bu kapıyı tüm numuneler için Canlı kapının altına uygulayın. Geçidin tüm numuneler için olası hücre popülasyonunu kapsadığından emin olmak için numuneler arasında geçiş yapın ve gerekli ayarlamaları yapın. Kapıyı değiştirdikten sonra tüm örneklere yeniden uyguladığınızdan emin olun.
NOT: Hücre popülasyonu dağılımı, FSC ve SSC'de aç ve aç bırakılmamış koşullar arasında belirgin şekilde değişir; Hücre kapısının her koşulda hücre popülasyonunu kapsadığından emin olun.
- pH ölçümlerinin kalitesini artırmak için tek hücreler için kapı.
- Boyanmamış WT kontrolünde, bu geçitteki olayları görüntülemek için Hücre geçidine çift tıklayın. Nokta grafiği x eksenini FSC-A ve y eksenini FSC-H olarak değiştirin.
- Bu nokta grafiğinde, tekli popülasyonun sağ alt köşesinde ikincil bir popülasyon oluşturan çiftlerle tek hücrelerin çapraz dağılımını arayın (bkz. Ek Şekil S1 üçüncü çizim). Poligon kapısı aracını kullanarak, doublet popülasyonu hariç olmak üzere singlet olaylarının etrafına bir geçit çizin. Bu kapıya Singlets adını verin.
- Tüm numuneler için Hücre kapısının altına Singlets kapısını uygulayın. Yine, tek popülasyonu dahil ederken geçidin ikili popülasyonu düzgün bir şekilde hariç tuttuğundan emin olmak için örnekler arasında geçiş yapın. Gerektiği gibi ayarlayın.
- Floresan pHL hücreleri için kapı.
- Boyanmamış WT denetim örneğinde, bu popülasyon için bir nokta grafiği açmak için Singlets geçidine çift tıklayın. X eksenini BL1-H ve y eksenini VL2-H olarak değiştirin.
- pH sensörü pHluorin2 hem VL2 hem de BL1'de floresandır. Nokta grafiğinin sol alt kısmındaki otomatik floresan popülasyonun üstüne ve sağına uzanan çapraz şekilli bir kapı çizmek için çokgen geçit aracını kullanın. Bu geçidi pHL+ olarak adlandırın.
- Tüm numuneler için Singlets kapısının altına pHL+ kapısını uygulayın. Bir pHL örneğine geçin ve kapıyı hem VL2-H hem de BL1-H'de WT kontrolünden daha yüksek floresan yoğunluğuna sahip olayları içerecek şekilde ayarlayın. Bu geçidin tüm numuneler için bu floresan popülasyonunu kapsadığından emin olun, çünkü bu popülasyonun konumu glikozomal pH değiştikçe değişecektir.
NOT: pHL+ popülasyonundaki bu küçük ama gözle görülür değişim, floroforun uyarma spektrumundaki pH'a bağlı değişikliklerden kaynaklanmaktadır.
- İstatistikleri dışa aktarın.
- Tablo Düzenleyici | Düzenleme çubuğu | Dışa aktarılacak yeni istatistikler eklemek için Sütun Ekle'yi tıklayın.
NOT: Dışa aktarılacak her istatistik için, ilgili istatistiği ve hangi popülasyondan dışa aktarılacağını seçin. Medyan gibi geçerli istatistikler için uygun parametreyi seçtiğinizden emin olun. Örneği değiştirmeden bırakın. - Şu istatistiklere sahip sütunlar ekleyin: Toplam (açılmamış) Sayım, pHL+ Sayımı, Toplamın Canlı Frekansı (toplam olaylara göre yüzde), pHL+ Üst Frekansı (üst kapıya göre yüzde), pHL+ Medyan VL2-H ve pHL+ Medyan BL1-H.
- Tablo Düzenleyici'ye tıklayın ve aşağıdaki dışa aktarma ayarlarını değiştirin: Dosyaya'ya ve Metin'e CSV'ye görüntüleyin ve ardından dosya hedefini ve adını seçin. Tablo Oluştur'a tıklayın.
- Tablo Düzenleyici | Düzenleme çubuğu | Dışa aktarılacak yeni istatistikler eklemek için Sütun Ekle'yi tıklayın.
- Floresan oranını hesaplayın.
- Dışa aktarılan .csv dosyasını elektronik tablo dosyası olarak kaydedin.
- Deneydeki tüm örneklerde aşağıdakileri karşılaştırarak kalite kontrol analizi gerçekleştirin: örnek başına olay sayısı, canlı olayların yüzdesi ve pHL+ olaylarının yüzdesi. Deneye bağlı olarak bunları çubuk veya dağılım grafiklerinde görsel olarak karşılaştırın.
- Yeni bir sütunu pHL+ Medyan VL2/BL1 olarak etiketleyin. Her numune için, denklem (2)'de gösterildiği gibi medyan VL1-H değerini medyan BL1-H değerine bölün.
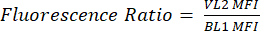 (1)
(1)
- Floresan oranını kullanarak istatistiksel analiz yapmak için istatistiksel analiz yazılımı kullanın.
6. pH biyosensör kalibrasyonu
NOT: Ölçülen floresan oranlarını pH birimlerine dönüştürmek için, nigerisin ve valinomisin kullanarak pHL eksprese eden hücreleri kalibre edin. Nigerisin, tamponda yeterli K+ olduğunda membranlar arasında pH'ı dengeleyebilen bir iyonofor olan bir K+/H+ antiporterdir15. Nigerisin, pHluorin ve diğer pH sensörlerini kalibre etmek için yaygın olarak kullanılmıştır16,17. Peroksizomal olarak lokalize pHluorin daha önce 10 μM nigericin18 kullanılarak kalibre edildiğinden, bu konsantrasyonla tedavi etmeyi seçtik. Valinomisin bir potasyum iyonofordur ve mitokondriyal membranlar19 boyunca pH'ı dengelemek için (4 μM'de) kullanılmıştır. K+ iyonlarının membranlar boyunca dengelenmesini sağlayarak nigerisinin pH dengeleme aktivitesine yardımcı olmak için 10 μM valinomisin kullandık. Bir nigerisin-valinomisin kombinasyonu kullanırken, nigerisin organel pH'ı dengelemek için yeterli olabilir.
- Her biri 5 ila 8,5 arasında değişen farklı bir pH'ta sekiz evrensel kalibrasyon tamponu çözeltisi (UCB; 15 mM MES, 15 mM HEPES ve 130 mM KCl) hazırlayın.
- Santrifüj (RT, 10 dakika, 800-1.000 × g) 2 mL pHL eksprese eden BSF kültüründen (her biri ~ 4 × 106 hücre) sekiz ayrı tüp.
- Süpernatanı çıkarın ve ardından UCB'deki her hücre peletini farklı pH değerlerinde yeniden süspanse edin.
- Her biri 10 μM'ye kadar nigerisin ve valinomisin ekleyin. PI'de 1 μg / mL'ye kadar yükselin.
- Her çözeltideki hücreleri 15 dakika inkübe edin.
- 4-5. adımlarda açıklandığı gibi floresan oranını ölçmek için her numuneyi bir akış sitometresinde çalıştırın.
- Her pH değeri için üç biyolojik kopya elde etmek için bu deneyi iki kez daha tekrarlayın. Verileri .fcs biçiminde dışa aktarın.
- .fcs dosyalarını 5.1 ile 5.8 arasındaki adımlarda açıklandığı gibi çözümleyin. Denklem (2) kullanılarak gelecekteki deneylerde glikozomal pH'ı enterpolasyon yapmak için her pH için ölçülen floresan oranını kullanın.
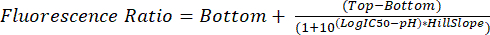 (2)
(2)
NOT: Ek Şekil S3 , nokta grafiklerini ve geçit şemasını gösterir. Sonuçlar Ek Tablo S2'de bulunabilir. Aşağıda, GraphPad Prism kullanılarak floresan oranından pH'ın nasıl enterpolasyon yapılacağı açıklanmaktadır. Başka bir istatistik yazılımı kullanıyorsanız, aynı temel adımları izleyin.- GraphPad Prism'i açın ve üç y kopyası içeren bir XY tablosu oluşturun. pH değerlerini x sütununa ve bunlarla ilişkili floresan oranı değerlerini y-çoğaltma sütunlarına yapıştırın.
- Tabloyla ilişkili grafiğe tıklayın. Grafiği görüntülerken, Analiz şeridinin altındaki Analiz | XY analizleri altında standart bir eğriyi enterpolasyon yapın.
- pH birimleri logaritmik bir ölçekte olduğu için Sigmoidal, 4PL, X'i seçin logdur (konsantrasyon). Üst ve Alt parametreler, tahmini üst ve alt platolardır. Aykırı değerlerin özel olarak ele alınmaması'nı seçin.
NOT: Yazılım, verileri denklem (2) ve adım 6.9.3'te açıklanan modele uydurmaya çalışacaktır. Sonuç tablosunda ve grafikteki eğride uyum eksikliğine dair kanıt arayın. - Diğer deneylerde floresan oranlarından pH'ı enterpolasyon yapmak için, pHL kalibrasyon verilerini içeren tabloya gidin. Floresan oranı değerlerini y sütun(lar)ındaki kalibrasyon verilerinin altına yapıştırın. Her y değerine bir başlık verin, ancak bilinmediği için x değerini (pH) boş bırakın.
- Sonuçlar galerisinde, enterpolasyon analizine tıklayın ve ardından Enterpolasyonlu X çoğaltmaları sekmesine gidin. Girilen floresan oranı değerlerinin yanında listelenecek enterpolasyonlu pH değerlerine bakın.
NOT: Yazılım, pH'ın bilinmediği deneyler için floresan oranlarından pH'ı enterpolasyon yapmak için kalibrasyon verilerinden bulunan modeli ve en uygun parametre değerlerini kullanır.
7. Glikoz açlığı ve geri dönüş süreleri
- Adım 1.1'de açıklandığı gibi 37 ° C'de inkübe edilmiş 1 μg / mL doksisiklin ile gece boyunca 15 mL BSF pHL parazitlerini indükleyin.
- 10 mM glikoz ile desteklenmiş PBS'de 15 mL indüklenmiş pHL kültürünü yıkayın. Bu adımı 3 kez tekrarlayın.
- Aynı zamanda, adım 3.2'de açıklandığı gibi PBS 3x'te 3 mL WT kültürünü yıkayın.
- İlk yıkamadan sonra, pHL numunesi 1 mL PBS içinde yeniden süspanse edildiğinde, aç bırakılmamış bir kontrol olarak 10 mM glikozda tutmak için 0.1 mL'lik bir pHL hücre süspansiyonu alikotunu çıkarın.
- Son yıkamadan sonra, pHL örneğini 1 μg / mL PI ile desteklenmiş PBS'de yeniden süspanse edin.
- Akış sitometrisi verilerinin elde edilmesi
- Deneye ve numuneye bağlı olarak her bir numuneyi her 5, 10, 30 veya 90 dakikada bir akış sitometresinde ölçerek hem aç hem de aç olmayan numuneler için glikozomal pH'ı izlemeye başlayın. 4.1'den 4.3'e kadar olan adımlarda açıklandığı gibi akış sitometrisi verilerini alın, voltajların ve grafiklerin önceden hazırlandığından emin olun.
- Boyanmamış WT kontrolünü önce 0 dakikada çalıştırın.
- Aç bırakılmamış kontrol örneğini 0 dakikadan başlayarak her 90 dakikada bir sitometrede çalıştırın. Açlık zaman kursu testi için, aç bırakılmış numuneyi 0 dakikadan başlayarak her 10 dakikada bir çalıştırın. Glikoz Geri Ekleme testi için, aç bırakılmış numuneyi 0, 5, 10, 20, 30, 60 ve 90 dakikada çalıştırın; Ardından, glikoz ekledikten sonra tekrarlayın.
- Numuneleri 90 dakikalık açlık süresi ve 180 dakikalık Glikoz Geri Ekleme süresi boyunca oda sıcaklığında inkübe edin.
- .fcs dosyalarını 5.1 ile 5.8 arasındaki adımlarda açıklandığı gibi çözümleyin.
NOT: Ek Şekil S4 , geçitlemenin nasıl gerçekleştirileceğini ve nokta grafiklerinin nasıl görünmesi gerektiğini gösterir. Ek Tablo S3 ve Ek Tablo S4 , sırasıyla glikoz açlık süresi kursu testinin ve glikoz ekleme süresi seyri testinin sonuçlarını göstermektedir.
8. İlaç taraması için tahlilin optimize edilmesi
- Her ikisi de daha önce tarif edildiği gibi PBS'de yaklaşık 2 × 106 hücre / mL'de yaklaşık 32 mL pHL eksprese eden BSF parazitlerini ve 2 mL WT hücresini yıkayın.
NOT: Ölçülen floresan oranlarının değişkenliğini en aza indirmek ve Z faktörü istatistiğini doğru bir şekilde ölçmek için kuyu başına 10.000'den fazla olayın kaydedilmesi gerekir. Bunu başarmak için gereken minimum kültür yaklaşık 26 mL'dir, ancak kullanım kolaylığı için 32 mL öneriyoruz.- İlk yıkamadan sonra, pHL örneğini iki mikrosantrifüj tüpüne eşit olarak ayırın.
- Yıkamalardan sonra, 5 mM glikoz,% 0.1 DMSO ve TR içeren 18 mL PBS'de bir pHL örneğini yeniden süspanse edin.
NOT: DMSO, bileşikler tipik olarak DMSO içinde çözüldüğü için bir ilaç ekranındaki tampon bileşimini taklit etmek için kullanılır. - Bu iki hücre çözeltisini, kuyu başına 9 mL olmak üzere 12 oyuklu bir rezervuara aktarın.
- Hücre çözeltilerini, oyuk başına 80 μL olacak şekilde 384 oyuklu bir plakanın ayrı yarısına pipetlemek için bir pipetleme robotu kullanın.
- Plakayı oda sıcaklığında 1,5 saat inkübe edin, hafifçe sallayın ve floroforları ışıktan korumak için alüminyum folyoya sarın.
- Plakayı 384 oyuklu plakaları çalıştırabilen bir akış sitometresinde çalıştırın.
NOT: Aşağıdaki iş akışı, Cytkick Max Otomatik Örnekleyici ile bir Attune NxT'ye uyarlanmıştır. Başka bir akış sitometresi kullanılıyorsa, temel adımları izlemeye devam edin.- Plaka için en hızlı akış hızında (1.000 uL/dk) çalıştırın ve güçlendirme modunu etkinleştirin. 20 μL / kuyu elde edin. Her kuyucuk arasına bir karıştırma döngüsü ve bir durulama döngüsü ekleyin.
- Adım 4.1.3'te açıklandığı gibi grafikler oluşturun.
- Boyanmamış bir WT tüp kontrolü çalıştırın ve voltajları 4.1.3 ve 4.1.4 adımlarında açıklandığı gibi optimize edin. Aç bırakılmış bir pHL tüpü numunesi çalıştırın ve VL2 ve BL1 voltajlarını adım 4.1'de açıklandığı gibi optimize edin.
- Plakayı akış sitometresinde almaya başlayın. Plakayı yatay olarak çalıştırın, böylece aç ve aç olmayan numune kuyucukları arasında önemli bir alım süresi farkı olmaz. Plaka alımının ~1,5 saat içinde tamamlandığından emin olun.
- .fcs dosyalarını dışarı aktarın ve 5.1 ile 5.8 arasındaki adımlarda açıklandığı gibi verileri analiz edin. Glikoz (Glc) ile muamele edilen veya glikoz içermeyen (Aç bırakılmış) numuneler için floresan oranlarının ortalamasını (AVG) ve standart sapmasını (SD) bulun.
NOT: Z faktörü deneylerimizden elde edilen veriler Ek Tablo S5'te bulunabilir. - Denklem (3)'ü kullanarak Z faktörü20 istatistiğini hesaplayın.
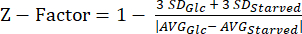 (3)
(3)
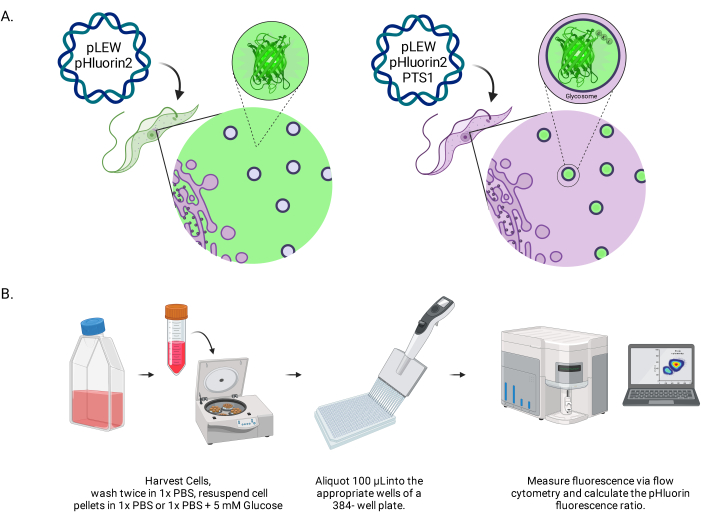
Şekil 1: Canlı BSF tripanozomlarında glikozomal pH'ı puanlama yönteminin diyagramı. (A) Glikozomal olarak yerleştirilmiş pHluorin2 sensörünü ifade eden hücre çizgilerinin gösterimi. Bir peroksizomal hedefleme dizisinin dahil edilmesi, lokalizasyon üzerinde kontrol sağlar. NOT: PTS-1'in ortadan kaldırılmasının sitozolik lokalizasyona yol açacağını ve bu hücre altı bölmede gelecekteki pH analizine izin vereceğini tahmin ediyoruz. (B) Sensör doğrulama testinin tasviri. Kısaltma: BSF = kan dolaşımı formu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
NOT: Z faktörü istatistiği, bir testin HTS için ne kadar uygun olduğunu belirlemek için kullanılır. 0.5 ile 1.0 arasındaki değerler genellikle test kalitesinin HTS için kabul edilebilir olduğu anlamına gelir.
Sonuçlar
BSF T. brucei'de glikozomlara pHLuorin2-PTS1 lokalizasyonu
pHluorin2-PTS1'in hücre altı lokalizasyonunu değerlendirmek için parazitler immünofloresan testlerine tabi tutuldu. Glikozomda yerleşik bir protein olan aldolaza (TbAldolaz) karşı yükselen anti-serumlarla birlikte lokalize olan transgenden gelen sinyal (Şekil 2A). Anti-TbAldolaz ve pHluorin2-PTS1 arasındaki ortalama Pearson korelasyon katsayısı 0.895 idi, bu da pHluorin2-PTS1'in öncelikle gl...
Tartışmalar
Afrika tripanozomundaki çevresel algı ve tepki mekanizmaları tam olarak anlaşılamamıştır. Besin mevcudiyetindeki değişikliklerin, glikozomların asitlenmesi de dahil olmak üzere parazitte çeşitli tepkileri tetiklediği bilinmektedir. Burada, kalıtsal bir protein sensörü, pHluorin2 ve akış sitometrisi kullanarak canlı hücrelerdeki çevresel bozulmalara glikozomal pH tepkisini incelemek için bir yöntem tanımladık.
Sensörün kullanımında birkaç kritik adım vardır. İ...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
pHluorin2-PTS1, yapıyı yüksek kopyalı bir klonlama vektöründe sağlayan Twist Bioscience tarafından pLEW100v5'e klonlandı; pLEW100v5, Dr. George Cross'un hediyesiydi. T. brucei aldolase'ye karşı yetiştirilen antiserum, talep üzerine Clemson Üniversitesi'nden Dr. Meredith T. Morris'ten temin edilebilir. JCM ve KAC laboratuvarlarından yapılan çalışmalar, Ulusal Sağlık Enstitüleri'nden (R01AI156382) bir ödülle kısmen desteklenmiştir. SSP, NIH 3R01AI156382 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 50 mL Tissue Culture Flasks (Non-treated, sterile) | VWR | 10861-572 | |
| 75 cm2 Tissue Culture Flask (Non-Treated, sterile) | Corning | 431464U | |
| 80 µL flat-bottom 384-well plate | BrandTech | 781620 | |
| Amaxa Human T Cell Nucleofector Kit | Lonza | VPA-1002 | |
| Attune NxT Flow Cytometer | invitrogen by Thermo Fisher Scientific | A24858 | FlowJo software |
| BRANDplates 96-Well, flat bottom plate | Millipore Sigma | BR781662 | |
| Coloc 2 plugin of ImageJ | https://imagej.net/plugins/coloc-2 | ||
| CytKick Max Auto Sampler | invitrogen by Thermo Fisher Scientific | A42973 | |
| CytoFLEX Flow Cytometer | Beckman-Coulter | ||
| Electron Microscopy Sciences 16% Paraformaldehyde Aqueous Solution, EM Grade, 10 mL Ampoule | Fisher Scientific | 50-980-487 | |
| GraphPad Prism | statistical software | ||
| Nigericin (sodium salt) | Cayman Chemical | 11437 | |
| Nucleofector 2b | Lonza | Discontinued Product | |
| OP2 Liquid Handler | opentrons | OP2 | |
| poly-L-lysine, 0.1% (w/v) in H2O | Sigma Life Science | CAS:25988-63-0 | Pipetting robot for HTS assay |
| Thiazole Red (TO-PRO-3) | biotium | #40087 | We machined a custom acrylic plate stand so this brand of plate could be detected and used on our CytKick Max Auto Sampler |
| valinomycin | Cayman Chemical | 10009152 | Pipetting robot for HTS assay |
| For pH calibration | |||
| For pH calibration |
Referanslar
- Coley, A. F., Dodson, H. C., Morris, M. T., Morris, J. C. Glycolysis in the African trypanosome: Targeting enzymes and their subcellular compartments for therapeutic development. Molecular Biology International. 2011, 123702 (2011).
- Mcconville, M. J., Saunders, E. C., Kloehn, J., Dagley, M. J. Leishmania carbon metabolism in the macrophage phagolysosome- feast or famine. F1000Res. 4, 938 (2015).
- Parsons, M. Glycosomes: Parasites and the divergence of peroxisomal purpose. Molecular Microbiology. 53 (3), 717-724 (2004).
- Parsons, M., Furuya, T., Pal, S., Kessler, P. Biogenesis and function of peroxisomes and glycosomes. Molecular and Biochemical Parasitology. 115 (1), 19-28 (2001).
- Haanstra, J. R., Gonzalez-Marcano, E. B., Gualdron-Lopez, M., Michels, P. A. Biogenesis, maintenance and dynamics of glycosomes in trypanosomatid parasites. Biochimica et Biophysica Acta. 1863 (5), 1038-1048 (2016).
- Allmann, S., Bringaud, F. Glycosomes: A comprehensive view of their metabolic roles in t. Brucei. International Journal of Biochemistry and Cell Biology. 85, 85-90 (2017).
- Dodson, H. C., Morris, M. T., Morris, J. C. Glycerol 3-phosphate alters Trypanosoma brucei hexokinase activity in response to environmental change. The Journal of Biological Chemistry. 286 (38), 33150-33157 (2011).
- Lin, S., Morris, M. T., Ackroyd, P. C., Morris, J. C., Christensen, K. A. Peptide targeted delivery of pH sensor for quantitative measurements of intraglycosomal pH in live Trypanosoma brucei. Biochemistry. 52 (21), 3629-3637 (2013).
- Mahon, M. J. Phluorin2: An enhanced, ratiometric, pH-sensitive green florescent protein. Advances in Bioscience and Biotechnology. 2 (3), 132-137 (2011).
- Wirtz, E., Leal, S., Ochatt, C., Cross, G. A. A tightly regulated inducible expression system for conditional gene knock-outs and dominant-negative genetics in Trypanosoma brucei. Molecular and Biochemical Parasitology. 99 (1), 89-101 (1999).
- . Restriction digest v.2 Available from: https://www.protocols.io/view/restriction-digest-nkqdg33pg25z/v2 (2018)
- . Ligation protocol with t4 DNA ligaase (m0202) v.3 Available from: https://www.protocols.io/view/ligation-protocol-with-t4-dna-ligase-m0202-95qpvorzv4o1/v3 (2021)
- Burkard, G., Fragoso, C. M., Roditi, I. Highly efficient stable transformation of bloodstream forms of Trypanosoma brucei. Molecular and Biochemical Parasitology. 153 (2), 220-223 (2007).
- Crowe, L. P., Wilkinson, C. L., Nicholson, K. R., Morris, M. T. Trypanosoma brucei pex13.2 is an accessory peroxin that functions in the import of peroxisome targeting sequence type 2 proteins and localizes to subdomains of the glycosome. mSphere. 5 (1), e00744 (2020).
- Kucejova, B., Kucej, M., Petrezselyova, S., Abelovska, L., Tomaska, L. A screen for nigericin-resistant yeast mutants revealed genes controlling mitochondrial volume and mitochondrial cation homeostasis. Genetics. 171 (2), 517-526 (2005).
- Huynh, M. H., Carruthers, V. B. Toxoplasma gondii excretion of glycolytic products is associated with acidification of the parasitophorous vacuole during parasite egress. PLoS Pathogens. 18 (5), e1010139 (2022).
- Lehoux, S., Abe, J., Florian, J. A., Berk, B. C. 14-3-3 binding to Na+/H+ exchanger isoform-1 is associated with serum-dependent activation of Na+/H+ exchange. TheJournal of Biological Chemistry. 276 (19), 15794-15800 (2001).
- Jankowski, A., et al. In situ measurements of the ph of mammalian peroxisomes using the fluorescent protein phluorin. The Journal of Biological Chemistry. 276 (52), 48748-48753 (2001).
- Jankowski, A., Grinstein, S. A. A noninvasive fluorimetric procedure for measurement of membrane potential. Quantification of the NADPH oxidase-induced depolarization in activated neutrophils. The Journal of Biological Chemistry. 274 (37), 26098-26104 (1999).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Lin, S., et al. Ph regulation in glycosomes of procyclic form Trypanosoma brucei. The Journal of Biological Chemistry. 292 (19), 7795-7805 (2017).
- Ha, D. S., Schwarz, J. K., Turco, S. J., Beverley, S. M. Use of the green fluorescent protein as a marker in transfected Leishmania. Molecular and Biochemical Parasitology. 77 (1), 57-64 (1996).
- Kelly, J. M., Ward, H. M., Miles, M. A., Kendall, G. A shuttle vector which facilitates the expression of transfected genes in Trypanosoma cruzi and Leishmania. Nucleic Acids Research. 20 (15), 3963-3969 (1992).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır