A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحاليل عدوى الخلايا الظهارية مع الشيغيلة
In This Article
Summary
يصف البروتوكول الحالي مقايسات العدوى لاستجواب الالتزام بالشيغيلا والغزو والتكاثر داخل الخلايا باستخدام خطوط الخلايا الظهارية في المختبر .
Abstract
يسبب العامل الممرض البكتيري المعوي المتكيف مع الإنسان Shigella ملايين الإصابات كل عام ، ويخلق تأثيرات نمو طويلة الأجل بين مرضى الأطفال ، وهو سبب رئيسي لوفيات الإسهال في جميع أنحاء العالم. تسبب العدوى الإسهال المائي أو الدموي نتيجة لعبور العامل الممرض للجهاز الهضمي وإصابة الخلايا الظهارية المبطنة للقولون. مع الزيادات المذهلة في مقاومة المضادات الحيوية والنقص الحالي في اللقاحات المعتمدة ، تعد بروتوكولات البحث الموحدة ضرورية لدراسة هذا العامل الممرض الهائل. هنا ، يتم تقديم منهجيات لفحص التسبب الجزيئي للشيغيلا باستخدام التحليلات المختبرية للالتصاق البكتيري والغزو والتكاثر داخل الخلايا في الخلايا الظهارية القولونية. قبل تحليلات العدوى ، تم التحقق من النمط الظاهري للضراوة لمستعمرات الشيغيلا من خلال امتصاص صبغة الكونغو الحمراء على ألواح الآجار. يمكن أيضا اعتبار الوسائط المختبرية المكملة أثناء الزراعة البكتيرية لتقليد الظروف في الجسم الحي . ثم تستخدم الخلايا البكتيرية في بروتوكول موحد لإصابة الخلايا الظهارية القولونية في لوحات زراعة الأنسجة في تعدد ثابت من العدوى مع التكيفات لتحليل كل مرحلة من مراحل العدوى. لمقايسات الالتصاق ، يتم تحضين خلايا الشيغيلا بمستويات وسائط منخفضة لتعزيز الاتصال البكتيري بالخلايا الظهارية. لكل من مقايسات الغزو والتكرار داخل الخلايا ، يتم تطبيق الجنتاميسين لفترات زمنية مختلفة للقضاء على البكتيريا خارج الخلية وتمكين تقييم الغزو و / أو القياس الكمي لمعدلات النسخ المتماثل داخل الخلايا. تعدد جميع بروتوكولات العدوى البكتيريا الملتصقة و / أو الغازية و / أو داخل الخلايا عن طريق التخفيف المتسلسل لمحللات الخلايا الظهارية المصابة وطلاء وحدات تشكيل المستعمرة البكتيرية المتعلقة بإصابة التتر على ألواح أجار الكونغو الحمراء. تتيح هذه البروتوكولات معا توصيفا ومقارنات مستقلة لكل مرحلة من مراحل عدوى الشيغيلة للخلايا الظهارية لدراسة هذا العامل الممرض بنجاح.
Introduction
تشكل أمراض الإسهال التي تسببها مسببات الأمراض البكتيرية المعوية عبئا صحيا عالميا كبيرا. في عام 2016 ، كانت أمراض الإسهال مسؤولة عن 1.3 مليون حالة وفاة في جميع أنحاء العالم وكانت السبب الرئيسي الرابع للوفاة بين الأطفال الذين تقل أعمارهم عن خمس سنوات من سن 1,2. الممرض البكتيري المعوي سلبي الجرام Shigella هو العامل المسبب لداء الشيغيلات ، وهو سبب رئيسي لوفيات الإسهال في جميع أنحاء العالم3. يسبب داء الشيغيلات معدلات اعتلال ووفيات كبيرة كل عام لدى الأطفال من البلدان المنخفضة والمتوسطة الدخل 4,5 ، بينما ترتبط العدوى في البلدان المرتفعة الدخل بمراكز الرعاية النهارية ، والأمراض المنقولة بالأغذية ، والفاشيات المنقولة بالمياه6،7،8،9. أدى تطوير لقاحغير فعال 10 وارتفاع معدلات مقاومة مضادات الميكروبات (AMR)11,12 إلى تعقيد إدارة فاشيات الشيغيلا على نطاق واسع. تظهر بيانات مراكز السيطرة على الأمراض والوقاية منها الحديثة أن ما يقرب من 46٪ من إصابات الشيغيلا في الولايات المتحدة أظهرت مقاومة للأدوية في عام 202013,14 ، بينما أعلنت منظمة الصحة العالمية أن الشيغيلة من مسببات الأمراض ذات الأولوية في مقاومة مضادات الميكروبات والتي تحتاج إلى علاجات جديدةبشكل عاجل 15.
تنتقل عدوى الشيغيلا بسهولة عن طريق البراز الفموي عند تناول طعام أو ماء ملوث ، أو من خلال الاتصال البشري المباشر. تطورت الشيغيلا لتصبح ممرضة فعالة ومتكيفة مع الإنسان ، مع جرعة معدية من 10-100 بكتيريا كافية للتسبب في المرض16. أثناء العبور المعوي الصغير ، تتعرض الشيغيلة لإشارات بيئية ، مثل ارتفاع درجة الحرارة والصفراء17. يؤدي اكتشاف هذه الإشارات إلى تغييرات نسخية للتعبير عن عوامل الفوعة التي تعزز قدرة البكتيريا على إصابة القولون البشري17،18،19. لا تغزو الشيغيلة ظهارة القولون من السطح القمي ، بل تنتقل عبر الطبقة الظهارية بعد الامتصاص إلى خلايا ميكروطية متخصصة تقدم المستضد (خلايا M) داخل الظهارة المرتبطة بالجريب20،21،22. بعد انتقال الخلايا ، يتم البلعمة خلايا الشيغيلة بواسطة الضامة المقيمة. تهرب الشيغيلة بسرعة من البلعمة وتؤدي إلى موت خلايا البلاعم ، مما يؤدي إلى إطلاق السيتوكينات المؤيدة للالتهابات5،23،24. ثم تغزو الشيغيلة الخلايا الظهارية القولونية من الجانب القاعدي ، وتحلل الفجوة العصارية الكبيرة ، وتنشئ مكانا متماثلا في السيتوبلازم 5,25. تقوم السيتوكينات المؤيدة للالتهابات ، وخاصة إنترلوكين -8 (IL-8) ، بتجنيد كريات الدم البيضاء متعددة الأشكال النووية (PMNs) إلى موقع العدوى ، مما يضعف الوصلات الضيقة الظهارية ، ويمكن من تسلل البكتيريا للبطانة الظهارية إلى تفاقم العدوى القاعدية5. تدمر PMNs البطانة الظهارية المصابة لاحتواء العدوى ، مما يؤدي إلى الأعراض المميزة للزحار العصوي (الدموي)5. على الرغم من أن آليات الغزو والتكاثر داخل الخلايا قد تم توصيفها بدقة ، إلا أن الأبحاث الجديدة تظهر مفاهيم جديدة مهمة في عدوى الشيغيلا ، بما في ذلك تنظيم الفوعة أثناء عبور الجهاز الهضمي (GI)17 ، والالتزام19 ، وتحسين الوصول القاعدي الجانبي من خلال نفاذية الحاجز26 ، والنقل بدون أعراض في الأطفال الذين يعانون من سوء التغذية27.
تقتصر قدرة الشيغيلة على التسبب في مرض الإسهال على البشر والرئيسيات غير البشرية (NHP)28. تم تطوير نماذج عدوى الشيغيلا المعوية لسمك الزرد29 والفئران30 وخنازير غينيا31 والأرانب21،32،33 والخنازير34،35. ومع ذلك ، لا يمكن لأي من هذه الأنظمة النموذجية تكرار خصائص المرض التي لوحظت أثناء العدوى البشريةبدقة 36. على الرغم من إنشاء نماذج NHP لداء الشيغيلات لدراسة التسبب في الشيغيلة ، إلا أن هذه الأنظمة النموذجية مكلفة في التنفيذ وتتطلب جرعات معدية عالية بشكل مصطنع ، تصل إلى تسعة أوامر من حيث الحجم أعلى من الجرعة المعدية للبشر37،38،39،40،41،42. وبالتالي ، فإن التكيف الملحوظ للشيغيلا لعدوى المضيفين البشريين يستلزم استخدام مزارع الخلايا المشتقة من الإنسان لإعادة إنشاء نماذج ذات صلة من الناحية الفسيولوجية للاستجواب الدقيق لتسبب الشيغيلا.
هنا ، يتم وصف الإجراءات التفصيلية لقياس معدلات الالتزام بالشيغيلة وغزوها وتكرارها داخل الخلايا الظهارية القولونية HT-29. باستخدام هذه البروتوكولات الموحدة ، يمكن استجواب الآليات الجزيئية التي تؤثر بها جينات الفوعة البكتيرية والإشارات البيئية على كل خطوة من خطوات عدوى الشيغيلا لفهم علاقة التفاعل الديناميكية بين المضيف والممرض بشكل أفضل.
Protocol
1. تحضير الكواشف والمواد
ملاحظة: تتوافق جميع وحدات التخزين مع الفحص باستخدام لوحين من 6 آبار.
- وسط TSB: أضف 0.5 لتر من الماء منزوع الأيونات (DI) إلى 15 جم من مرق الصويا التربتيك (TSB ، انظر جدول المواد) والأوتوكلاف. يحفظ في درجة حرارة الغرفة.
- وسط الأملاح الصفراوية (TSB + BS): لتحضير مكتب تقييس الاتصالات الذي يحتوي على 0,4٪ (وزن/حجم) من الأملاح الصفراوية، أعد تعليق 0,06 غرام من الأملاح الصفراوية (BS، انظر جدول المواد) في 15 مل من TSB المعقم. تعقيم المرشح باستخدام مرشح PES 0.22 ميكرومتر.
ملاحظة: تتكون الأملاح الصفراوية من خليط 1: 1 من كولات الصوديوم وديوكسي كولات الصوديوم. قم بإعداد وسائط جديدة مباشرة قبل الاستخدام. - DMEM + 10٪ (v / v) FBS: أضف 5 مل من مصل الأبقار الجنينية (FBS) إلى 45 مل من وسط النسر المعدل من Dulbecco (DMEM). يحفظ في درجة حرارة 4 درجة مئوية.
- DMEM + جنتاميسين: إلى أنبوب 50 مل ، أضف 50 مل من DMEM و 50 ميكرولتر من 50 مجم / مل جنتاميسين (انظر جدول المواد).
ملاحظة: اصنع قسمة طازجة ودافئة في حمام مائي بدرجة حرارة 37 درجة مئوية قبل كل تجربة. - PBS + 1٪ (v / v) Triton X-100: أضف 150 ميكرولتر من Triton X-100 إلى 15 مل من محلول ملحي مخزن بالفوسفات (PBS).
ملاحظة: اصنع قسمة طازجة ودافئة في حمام مائي بدرجة حرارة 37 درجة مئوية قبل كل تجربة. - لوحات مؤشر TSB + Congo الحمراء: أضف 15 غراما من TSB و7,5 غراما من أجار محدد و0.125 غراما من صبغة الكونغو الحمراء (انظر جدول المواد) إلى زجاجة سعة 1 لتر. أضف 0.5 لتر من ماء DI والأوتوكلاف. صب 10-20 مل من الوسائط في أطباق بتري المعقمة الفردية (100 مم × 15 مم) واتركها تتصلب.
تنبيه: الكونغو الأحمر مادة مسرطنة وسامة تناسلية. تأكد من أن التعامل مع الكونغو الأحمر يتم باستخدام معدات الحماية الشخصية المناسبة. راجع ورقة بيانات سلامة المنتج للحصول على معلومات إضافية.
ملاحظة: ما يقرب من 20 لوحة مصنوعة من وسائط الكونغو الحمراء سعة 0.5 لتر. يمكن تحضير الألواح قبل 2-3 أيام وتركها مقلوبة في درجة حرارة الغرفة حتى الاستخدام. للتخزين طويل الأجل ، ضع الألواح المقلوبة في أكمام بلاستيكية عند 4 درجات مئوية لمدة تصل إلى 3 أشهر. - DMEM + 10٪ (v / v) FBS و 5٪ (v / v) ثنائي ميثيل سلفوكسيد (DMSO): أضف 42.5 مل من DMEM و 5 مل من FBS و 2.5 مل من DMSO إلى أنبوب 50 مل. يحفظ في درجة حرارة 4 درجة مئوية.
2. إعداد البكتيريا
ملاحظة: جميع بروتوكولات زراعة وتخزين مختبر الشيغيلا مقتبسة من Payne، S. M.43.
تنبيه: الشيغيلة spp. هي مسببات الأمراض من مجموعة المخاطر2 44. أداء جميع الأعمال المختبرية في بيئة BSL-2 ، مع اتخاذ تدابير أمان إضافية للحد من التعرض العرضي بسبب الجرعة المعدية المنخفضة من Shigella spp.
- نمو الشيغيلا من المخزونات المجمدة
- انقل كمية صغيرة من المستنبتة المجمدة من القارورة المبردة إلى صفيحة أجار حمراء TSB + Congo باستخدام قضيب معقم.
- اللهب تعقيم حلقة التلقيح والسماح لها لتبرد. خط اللقاح ذهابا وإيابا عبر ربع واحد من اللوحة. قم بإشعال الحلقة ، واتركها لتبرد ، ثم خط من الربع الأول إلى الربع الثاني من اللوحة. كرر لخط اللقاح في الربعين الثالث والرابع من اللوحة.
ملاحظة: بدلا من ذلك ، قم بخط اللقاح باستخدام قضيب معقم جديد بين كل ربع. - اقلب اللوحة واحتضنها عند 37 درجة مئوية طوال الليل.
ملاحظة: الحضانة عند درجات حرارة ≥37 درجة مئوية مطلوبة للتعبير عن عوامل ضراوة الشيغيلا اللازمة لمراقبة النمط الظاهري45 الإيجابي لحمى الكونغو (CR +). سيكون للمستعمرات Avirulent مظهر أبيض ولن تكون غازية. - أغلق الطبق بغشاء البارافين واحفظه في الثلاجة على حرارة 4 درجات مئوية.
ملاحظة: ستبقى المستعمرات البكتيرية قابلة للحياة على ألواح أجار لمدة 1-2 أسابيع.
- نمو الشيغيلا بين عشية وضحاها في الثقافة السائلة
- قسمة 3 مل من وسائط مكتب تقييس الاتصالات في أنابيب استزراع معقمة سعة 14 مل.
- اختر مستعمرة حمراء واحدة معزولة جيدا (CR +) باستخدام قضيب معقم وأعد تعليقها في الوسائط السائلة.
- احتضان الثقافات بين عشية وضحاها (16-18 ساعة) عند 37 درجة مئوية مع الاهتزاز عند 250 دورة في الدقيقة (rpm).
3. إعداد خلايا حقيقية النواة HT-29
ملاحظة: تتوافق جميع وحدات التخزين مع الفحص باستخدام لوحين من 6 آبار. تم الحصول على خطوط خلايا HT-29 من مجموعة ثقافة النوع الأمريكية (ATCC). تم تكييف بروتوكولات الصيانة HT-29 من توصيات ATCC46. يجب تسخين جميع الوسائط مسبقا في حمام مائي عند 37 درجة مئوية قبل الاستخدام. يجب تنفيذ جميع بروتوكولات الصيانة HT-29 في خزانة السلامة البيولوجية. الامتناع عن إنتاج فقاعات عند الخلط / العمل مع خلايا HT-29 في الوسائط لتجنب التغيرات الدراماتيكية في درجة الحموضة.
- إذابة خلايا HT-29 من المخزون المجمد
- قم بإذابة قارورة خلايا HT-29 في حمام مائي بدرجة حرارة 37 درجة مئوية.
ملاحظة: تأكد من بقاء الغطاء فوق الماء بالكامل لتجنب التلوث. يجب أن يستغرق ذوبان الجليد أقل من 2 دقيقة. - قم بإزالة القارورة من الماء فور إذابة المزرعة بالكامل وتطهيرها بنسبة 70٪ من الإيثانول. تأكد من تنفيذ جميع الخطوات من هذه النقطة باستخدام تقنيات التعقيم.
- أضف جميع محتويات القارورة إلى أنبوب طرد مركزي سعة 15 مل يحتوي على 9 مل من DMEM + 10٪ FBS. أجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- صب المادة الطافية في حاوية نفايات وأعد تعليق الحبيبات في 10 مل من DMEM الدافئ + 10٪ FBS. انقل الخلايا المعاد تعليقها إلى دورق زراعة الأنسجة 75 سم2 (T75) يحتوي على 10 مل من DMEM الدافئ + 10٪ FBS (الحجم الإجمالي 20 مل).
- احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO2 حتى تصل الخلايا إلى التقاء 90٪ (حوالي 6-7 أيام).
ملاحظة: يتم تقدير الالتقاء من خلال التقريب البصري.
- قم بإذابة قارورة خلايا HT-29 في حمام مائي بدرجة حرارة 37 درجة مئوية.
- بذر خلايا HT-29
- قم بالتسخين المسبق 20 مل من PBS و 50 مل من DMEM + 10٪ FBS في حمام مائي 37 درجة مئوية و 3 مل من 0.25٪ (وزن / حجم) Trypsin-EDTA إلى درجة حرارة الغرفة.
- بمجرد أن تصل خلايا HT-29 (من الخطوة 3.1) إلى التقاء 90٪ ، صب وسائط زراعة الخلايا HT-29 من قارورة T75 في حاوية نفايات. صب ~ 10 مل من برنامج تلفزيوني دافئ في القارورة وحركه برفق لغسله. صب برنامج تلفزيوني في حاوية نفايات. تغسل مع برنامج تلفزيوني دافئ مرة أخرى وصب.
- أضف 2-3 مل من 0.25٪ (وزن / حجم) Trypsin-EDTA وقم بتدوير بلطف عبر مساحة السطح بأكملها. احتضان في 37 درجة مئوية مع 5٪ CO2 لمدة 4 دقائق.
- قم بإزالة القارورة من الحاضنة وقم بتدوير Trypsin-EDTA برفق ، مما يضمن بصريا فصل جميع الخلايا عن السطح.
- أضف على الفور 6 مل من DMEM الدافئ + 10٪ FBS لإلغاء تنشيط التربسين. ماصة صعودا وهبوطا لخلط جيدا.
- انقل جميع المحتويات إلى أنبوب طرد مركزي سعة 15 مل وقم بتدويره عند 500 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- صب المادة الطافية برفق في حاوية نفايات وأعد تعليق الحبيبات في 6 مل من DMEM الدافئ + 10٪ FBS.
- مباشرة بعد التعليق ، انقل 10 ميكرولتر من خلايا HT-29 المعلقة من منتصف المزرعة إلى أنبوب PCR سعة 0.2 مل. أضف 10 ميكرولتر من صبغة تريبان الزرقاء إلى أنبوب تفاعل البوليميراز المتسلسل واخلطها.
- أضف 10 ميكرولتر من خلية HT-29 / مزيج Trypan الأزرق إلى شريحة غرفة عداد خلايا الكونتيسة التي يمكن التخلص منها (انظر جدول المواد). تعداد عدد الخلايا الحية وحساب صلاحية الخلية.
ملاحظة: عند توثيق عدد الخلايا في العينة، اقرأ الرقم الموجود أسفل عدد الخلايا "الحية"، وليس إجمالي عدد الخلايا. بدلا من ذلك ، يمكن إجراء تعداد الخلايا يدويا باستخدام مقياس الدم. - البذور المعاد تعليقها خلايا HT-29 في قارورة T75 جديدة أو لوحة 6 آبار.
- لقارورة T75:
- ماصة بلطف لخلط ، ثم نقل 2.5 × 106 خلايا إلى قارورة T75 جديدة وفقا للمعادلة أدناه:
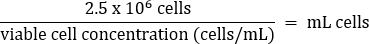
- أضف وسائط DMEM الدافئة + 10٪ FBS إلى حجم نهائي يبلغ 20 مل (التركيز النهائي 1.25 × 105 خلايا / مل).
- قم بتفريق الخلايا بالتساوي عبر القارورة عن طريق التأرجح برفق ذهابا وإيابا.
- احتضان عند 37 درجة مئوية مع 5٪ CO2 حتى تصل الخلايا إلى التقاء 80٪.
ملاحظة: لتحقيق النمو الأمثل ، استبدل وسائط DMEM + 10٪ FBS في دورق T75 كل ~ 3 أيام. صب الوسائط في حاوية نفايات وأضف 10 مل من PBS الدافئ إلى القارورة. قم بتدوير PBS برفق وصبه في حاوية النفايات. ثم أضف 20 مل من DMEM الطازج والدافئ + 10٪ FBS إلى القارورة والعودةإلى حاضنة CO 2 37 درجة مئوية ، 5٪.
- ماصة بلطف لخلط ، ثم نقل 2.5 × 106 خلايا إلى قارورة T75 جديدة وفقا للمعادلة أدناه:
- للوحة 6 آبار:
- ماصة بلطف لخلط ، ثم نقل 5.85 × 106 خلايا إلى أنبوب مخروطي جديد 50 مل وفقا للمعادلة أدناه:
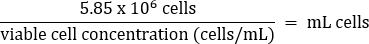
- أضف وسائط DMEM + 10٪ FBS إلى حجم نهائي يبلغ 26 مل (التركيز النهائي 2.25 × 105 خلايا / مل).
- ماصة لخلط بلطف ، ثم الاستغناء عن 2 مل (4.5 × 105 خلايا) في آبار فردية من ألواح 6 آبار.
- قم بتفريق الخلايا بالتساوي عبر البئر عن طريق التأرجح برفق لأعلى / لأسفل ولليسار / لليمين 2-3x.
- احتضان عند 37 درجة مئوية مع 5٪ CO2 حتى تصل الخلايا إلى التقاء 80٪ -95٪ (حوالي 3-4 أيام).
ملاحظة: يوصى بالتقاء 85٪ لمقايسات الغزو والتكرار داخل الخلايا ، بينما يوصى بالتقاء 90٪ -95٪ لمقايسات الالتزام. يجب أن تصل الخلايا إلى التقاء ~ 85٪ بعد حضانة 48 ساعة بتركيز نهائي يبلغ حوالي 1 × 106 خلايا / بئر. قد تكون هناك حاجة إلى تعديلات على عدد الخلايا المصنفة وطول الحضانة.
- ماصة بلطف لخلط ، ثم نقل 5.85 × 106 خلايا إلى أنبوب مخروطي جديد 50 مل وفقا للمعادلة أدناه:
- لقارورة T75:
- صنع مخزون HT-29 المجمد
- القسمة 1 مل من DMEM + 10٪ FBS + 5٪ وسائط DMSO في قوارير مبردة فردية.
- أضف 1 × 106 خلايا HT-29 من الخطوة 3.2.7 إلى كل قارورة. احسب حجم الخلايا وفقا للصيغة أدناه:
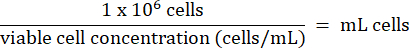
- قم بتخزين خلايا HT-29 على المدى الطويل تحت -130 درجة مئوية في مجمد تخزين بخار النيتروجين السائل.
4. مقايسة الالتزام
ملاحظة: تتوافق جميع وحدات التخزين مع الفحص باستخدام لوحين من 6 آبار.
- الثقافة الفرعية بين عشية وضحاها ثقافات الشيغيلا عبر التخفيف 1:50 إلى وسائط جديدة.
- دوامة ، ثم أضف 100 ميكرولتر من كل مزرعة ليلية إلى 5 مل من TSB أو TSB + BS الطازج في أنبوب استزراع بحجم مناسب.
ملاحظة: الحد من حجم الثقافة إلى <20٪ من دورق الثقافة أو حجم الأنبوب لضمان التهوية المناسبة. - احتضان عند 37 درجة مئوية مع الاهتزاز عند 250 دورة في الدقيقة حتى تصل الخلايا إلى كثافة بصرية (OD600) تبلغ 0.7 (مرحلة منتصف اللوغاريتم من نمو الشيغيلا ) ؛ حوالي 2-2.5 ساعة.
ملاحظة: خلال الاستزراع الفرعي ، قسمة 50 مل من DMEM وحجم كاف من PBS لجميع خطوات الغسيل ووضعها في حمام مائي 37 درجة مئوية. اترك الوسائط تصل إلى 37 درجة مئوية قبل الاستخدام.
- دوامة ، ثم أضف 100 ميكرولتر من كل مزرعة ليلية إلى 5 مل من TSB أو TSB + BS الطازج في أنبوب استزراع بحجم مناسب.
- نقل 2 × 108 وحدات تشكيل مستعمرة (CFUs) الشيغيلة المستزرعة إلى أنابيب طرد مركزي دقيقة فردية سعة 2 مل.
ملاحظة: 2 × 108 CFUs يتوافق مع حوالي 1 مل من الخلايا البكتيرية عند OD600 من 0.7. استخدم قراءات OD600 لتقريب CFU / mL وفقا لمعايرة كل مقياس طيف ضوئي فردي. - اغسل كل عينة من الشيغيلا 2x باستخدام برنامج تلفزيوني.
- خلايا الحبيبات عن طريق الطرد المركزي عند 17000 × جم لمدة 2 دقيقة في درجة حرارة الغرفة. نضح المادة الطافية ، ثم أضف 1 مل من برنامج تلفزيوني دافئ وأعد تعليق الحبيبات جيدا ، وقم بسحب العينة برفق لأعلى ولأسفل حتى يصبح الخليط متجانسا تماما (8-10x).
- كرر الخطوة 4.3.1 1x وقت إضافي.
- خلايا الحبيبات عن طريق الطرد المركزي عند 17000 × جم لمدة دقيقتين في درجة حرارة الغرفة ، ونضح المادة الطافية ، وإعادة تعليق الكريات في 2 مل من DMEM الدافئ.
ملاحظة: سيكون التركيز النهائي للبكتيريا المعلقة 1 × 108 CFU / مل.
- دوامة ، ثم أضف 1 مل (1 × 108 CFUs) من الشيغيلة المعاد تعليقها إلى كل بئر من الطبقات الظهارية القولونية HT-29 المحضرة في ألواح ذات 6 آبار (من الخطوة 3.2.10.2).
ملاحظة: يتم إجراء العدوى عادة عند تعدد العدوى (MOI ؛ نسبة الخلايا البكتيرية إلى الخلايا الظهارية) من 100. لاختبار MOIs المختلفة ، قم بتخفيف الشيغيلة المعاد تعليقها في DMEM الدافئ إلى التركيز المطلوب ، ثم أضف 1 مل من البكتيريا المخففة إلى طبقة HT-29 أحادية. على سبيل المثال ، لاختبار MOI من 10 ، قم بتخفيف البكتيريا 1:10 بإضافة 150 ميكرولتر من 1 × 108 CFU / mL بكتيريا إلى 1.35 مل من DMEM الدافئ ، ثم ضع 1 مل (1 × 107 CFUs) على خلايا HT-29. - احتضان الألواح المكونة من 6 آبار عند 37 درجة مئوية مع 5٪ CO2 لمدة 3 ساعات.
- أثناء الحضانة ، حدد عيار العدوى البكتيرية.
- تحضير التخفيفات التسلسلية 10 أضعاف لخلايا الشيغيلا المعاد تعليقها (من الخطوة 4.3.3) إلى برنامج تلفزيوني.
- صفيحة 100 ميكرولتر من التخفيفات 1 × 10-5 و 1 × 10-6 على لوحات TSB + الكونغو الحمراء واحتضانها طوال الليل عند 37 درجة مئوية.
ملاحظة: طلاء 100 ميكرولتر من التخفيفات 1 × 10-5 و 1 × 10-6 يتوافق مع عامل تخفيف نهائي قدره 1 × 10-6 و 1 × 10-7 ، على التوالي.
- بعد الحضانة ، اغسل الطبقات الأحادية 4-5x باستخدام برنامج تلفزيوني.
- نضح الوسائط من كل بئر.
ملاحظة: عند شفط الوسائط من ألواح ذات 6 آبار ، قم بتوجيه طرف الشافطة على طول الجانب السفلي من الآبار ، في محاولة لتجنب ملامسة خلايا HT-29. - أضف 1 مل من برنامج تلفزيوني دافئ إلى كل بئر واغسله بلطف.
ملاحظة: لغسل 6 طبقات أحادية اللون برفق باستخدام PBS ، حرك اللوحة لأعلى ولأسفل ومن جانب إلى آخر على سطح الطاولة. يمكن أن يؤدي غسل الألواح بحركة دائرية و / أو إزالة اللوحة من سطح الطاولة إلى الإزالة الميكانيكية للخلايا من البلاستيك. - كرر الخطوتين 4.7.1 و 4.7.2 4 مرات إضافية.
- نضح الوسائط من كل بئر.
- قم بإزالة PBS عن طريق الشفط وتحلل خلايا HT-29 بإضافة 1 مل من PBS + 1٪ Triton X-100 إلى كل بئر.
- احتضان 6 أطباق عند 37 درجة مئوية لمدة 5 دقائق.
- استخدم مكشطة خلية أو طرف ماصة منحني لكشط الخلايا المحللة من قاع البئر ونقل 1 مل بالكامل إلى أنبوب طرد مركزي دقيق جديد سعة 1.7 مل.
- تحديد عدد البكتيريا المرتبطة بالخلايا.
- دوامة كل أنبوب (من الخطوة 4.10) لمدة 30 ثانية على الأقل لإزاحة الشيغيلة من الخلايا حقيقية النواة المحللة.
- إعداد التخفيفات التسلسلية 10 أضعاف من المحللين في برنامج تلفزيوني.
- صفيحة 100 ميكرولتر من التخفيفات 1 × 10-2 و 1 × 10-3 و 1 × 10-4 على لوحات TSB + الكونغو الحمراء واحتضانها طوال الليل عند 37 درجة مئوية.
ملاحظة: طلاء 100 ميكرولتر من التخفيفات 1 × 10-2 و 1 × 10-3 و 1 × 10-4 يتوافق مع عامل تخفيف نهائي يبلغ 1 × 10-3 و 1 × 10-4 و 1 × 10-5 على التوالي.
5. مقايسة الغزو
ملاحظة: تتوافق جميع وحدات التخزين مع الفحص باستخدام لوحين من 6 آبار.
- الثقافة الفرعية بين عشية وضحاها ثقافات الشيغيلا عبر التخفيف 1:50 إلى وسائط جديدة.
- دوامة ، ثم أضف 100 ميكرولتر من كل مزرعة ليلية إلى 5 مل من TSB أو TSB + BS الطازج في أنبوب استزراع بحجم مناسب.
ملاحظة: الحد من حجم الثقافة إلى <20٪ من دورق الثقافة أو حجم الأنبوب لضمان التهوية المناسبة. - احتضان عند 37 درجة مئوية مع الرج عند 250 دورة في الدقيقة حتى تصل الخلايا إلىOD 600 من 0.7 (مرحلة منتصف السجل من نمو الشيغيلا ) ؛ حوالي 2-2.5 ساعة.
ملاحظة: خلال الاستزراع الفرعي ، قسمة 50 مل من DMEM + 50 ملغ / مل جنتاميسين وحجم كاف من PBS لجميع خطوات الغسيل ووضعها في حمام مائي 37 درجة مئوية. اترك الوسائط تصل إلى 37 درجة مئوية قبل الاستخدام.
- دوامة ، ثم أضف 100 ميكرولتر من كل مزرعة ليلية إلى 5 مل من TSB أو TSB + BS الطازج في أنبوب استزراع بحجم مناسب.
- نقل 2 × 108 CFUs الشيغيلة المستزرعة إلى أنابيب طرد مركزي دقيقة فردية سعة 2 مل.
ملاحظة: 2 × 108 CFUs يتوافق مع حوالي 1 مل من الخلايا البكتيرية عند OD600 من 0.7. استخدم قراءات OD600 لتقريب CFU / mL وفقا لمعايرة كل مقياس طيف ضوئي فردي. - اغسل عينات الشيغيلا 1x باستخدام برنامج تلفزيوني.
- خلايا الحبيبات عن طريق الطرد المركزي عند 17000 × جم لمدة 2 دقيقة في درجة حرارة الغرفة. نضح المادة الطافية ، ثم أضف 1 مل من برنامج تلفزيوني دافئ وأعد تعليق الحبيبات جيدا ، وقم بسحب العينة برفق لأعلى ولأسفل حتى يصبح الخليط متجانسا تماما (8-10x).
- كرر الخطوة 5.3.1. 1x وقت إضافي.
- خلايا الحبيبات عن طريق الطرد المركزي عند 17000 × جم لمدة دقيقتين في درجة حرارة الغرفة ، ونضح المادة الطافية ، وإعادة تعليق الكريات في 2 مل من DMEM الدافئ.
ملاحظة: سيكون التركيز النهائي للبكتيريا المعلقة 1 × 108 CFU / مل.
- دوامة ، ثم أضف 1 مل (1 × 108 CFUs) من الشيغيلة المعاد تعليقها بالإضافة إلى 1 مل من DMEM إلى كل بئر من الطبقات الظهارية القولونية HT-29 المحضرة في ألواح 6 آبار (من الخطوة 3.2.10.2).
ملاحظة: يتم إجراء العدوى عادة عند تعدد العدوى (MOI ؛ نسبة الخلايا البكتيرية إلى الخلايا الظهارية) من 100. لاختبار MOIs المختلفة ، قم بتخفيف الشيغيلة المعاد تعليقها في DMEM إلى التركيز المطلوب ، ثم أضف 1 مل من البكتيريا المخففة إلى طبقة HT-29 أحادية. على سبيل المثال ، لاختبار MOI من 10 ، قم بتخفيف البكتيريا 1:10 بإضافة 150 ميكرولتر من 1 × 108 CFU / mL بكتيريا إلى 1.35 مل من DMEM ، ثم أضف 1 مل (1 × 107 CFUs) إلى خلايا HT-29. - لتعزيز التلامس البكتيري مع خلايا HT-29 ، قم بطرد مركزي لألواح 6 آبار عند 2000 × جم لمدة 10 دقائق في درجة حرارة الغرفة أو 37 درجة مئوية إذا كان من الممكن ضبط إعداد درجة الحرارة.
ملاحظة: يعزز الطرد المركزي الاتصال البكتيري بخلايا HT-29 ، مما يتجاوز الحاجة إلى عوامل الالتصاق ويسمح للبكتيريا بغزو الخلايا بسرعة. - احتضان 6 ألواح آبار عند 37 درجة مئوية مع 5٪ CO2 لمدة 45 دقيقة.
- أثناء الحضانة ، حدد عيار العدوى البكتيرية.
- تحضير التخفيفات التسلسلية 10 أضعاف لخلايا الشيغيلا المعلقة (من الخطوة 5.3.3) إلى برنامج تلفزيوني.
- صفيحة 100 ميكرولتر من التخفيفات 1 × 10-5 و 1 × 10-6 على لوحات TSB + الكونغو الحمراء واحتضانها طوال الليل عند 37 درجة مئوية.
ملاحظة: طلاء 100 ميكرولتر من التخفيفات 1 × 10-5 و 1 × 10-6 يتوافق مع عامل تخفيف نهائي قدره 1 × 10-6 و 1 × 10-7 ، على التوالي.
- اغسل جيدا خلايا HT-29 المصابة 3x مع 1 مل من PBS.
- نضح الوسائط من كل بئر.
ملاحظة: عند شفط الوسائط من ألواح ذات 6 آبار ، قم بتوجيه طرف الشافطة على طول الجانب السفلي من الآبار ، في محاولة لتجنب ملامسة خلايا HT-29. - أضف 1 مل من برنامج تلفزيوني دافئ إلى كل بئر واغسله بلطف.
ملاحظة: لغسل 6 طبقات أحادية اللون برفق باستخدام PBS ، حرك اللوحة لأعلى ولأسفل ومن جانب إلى آخر على سطح الطاولة. يمكن أن يؤدي غسل الألواح بحركة دائرية و / أو إزالة اللوحة من سطح الطاولة إلى الإزالة الميكانيكية للخلايا من البلاستيك. - كرر الخطوتين 5.8.1 و 5.8.2 مرتين إضافيتين.
- نضح الوسائط من كل بئر.
- قم بإزالة PBS عن طريق الشفط ، ثم أضف 2 مل من DMEM الدافئ المكمل ب 50 ميكروغرام / مل جنتاميسين إلى كل بئر واحتضانه لمدة 30 دقيقة عند 37 درجة مئوية مع 5٪ CO2.
- اغسل جيدا خلايا HT-29 المصابة 3x مع 1 مل من PBS.
- كرر خطوة الغسيل 5.8.
- قم بإزالة PBS عن طريق الشفط ، ثم أضف 2 مل من DMEM الدافئ المكمل ب 50 ميكروغرام / مل جنتاميسين إلى كل بئر واحتضانه لمدة 60 دقيقة عند 37 درجة مئوية مع 5٪ CO2.
- اغسل جيدا خلايا HT-29 المصابة 3x مع 1 مل من PBS.
- كرر خطوة الغسيل 5.8.
- قم بإزالة PBS عن طريق الشفط وتحلل خلايا HT-29 بإضافة 1 مل من PBS + 1٪ Triton X-100 إلى كل بئر.
- احتضان 6 أطباق عند 37 درجة مئوية لمدة 5 دقائق.
- استخدم مكشطة خلية أو طرف ماصة منحني لكشط الخلايا المحللة من قاع البئر ونقل 1 مل بالكامل إلى أنبوب طرد مركزي دقيق جديد سعة 1.7 مل.
- تحديد عدد البكتيريا داخل الخلايا.
- دوامة كل أنبوب (من الخطوة 5.15) لمدة 30 ثانية على الأقل لإزاحة الشيغيلة من الخلايا حقيقية النواة المحللة.
- إعداد التخفيفات التسلسلية 10 أضعاف من المحللين في برنامج تلفزيوني.
- صفيحة 100 ميكرولتر من التخفيفات 1 × 10-2 و 1 × 10-3 على لوحات TSB + الكونغو الحمراء واحتضانها طوال الليل عند 37 درجة مئوية.
ملاحظة: طلاء 100 ميكرولتر من التخفيفات 1 × 10-2 و 1 × 10-3 يتوافق مع عامل تخفيف نهائي قدره 1 × 10-3 و 1 × 10-4 ، على التوالي.
6. مقايسة النسخ المتماثل داخل الخلايا
ملاحظة: تتوافق جميع وحدات التخزين مع الفحص باستخدام لوحين من 6 آبار.
- الثقافة الفرعية بين عشية وضحاها ثقافات الشيغيلا عبر التخفيف 1:50 إلى وسائط جديدة.
- دوامة ، ثم أضف 100 ميكرولتر من كل مزرعة ليلية إلى 5 مل من TSB أو TSB + BS الطازج في أنبوب استزراع بحجم مناسب.
ملاحظة: الحد من حجم الثقافة إلى <20٪ من دورق الثقافة أو حجم الأنبوب لضمان التهوية المناسبة. - احتضان عند 37 درجة مئوية مع الرج عند 250 دورة في الدقيقة حتى تصل الخلايا إلىOD 600 من 0.7 (مرحلة منتصف السجل من نمو الشيغيلا ) ؛ حوالي 2-2.5 ساعة.
ملاحظة: خلال الاستزراع الفرعي ، قسمة 50 مل من DMEM + 50 ملغ / مل جنتاميسين وحجم كاف من PBS لجميع خطوات الغسيل ووضعها في حمام مائي 37 درجة مئوية. اترك الوسائط تصل إلى 37 درجة مئوية قبل الاستخدام.
- دوامة ، ثم أضف 100 ميكرولتر من كل مزرعة ليلية إلى 5 مل من TSB أو TSB + BS الطازج في أنبوب استزراع بحجم مناسب.
- نقل 2 × 108 CFUs الشيغيلة المستزرعة إلى أنابيب طرد مركزي دقيقة فردية سعة 2 مل.
ملاحظة: 2 × 108 CFUs يتوافق مع حوالي 1 مل من الخلايا البكتيرية عند OD600 من 0.7. استخدم قراءات OD600 لتقريب CFU / mL وفقا لمعايرة كل مقياس طيف ضوئي فردي. - اغسل عينات الشيغيلا 1x باستخدام برنامج تلفزيوني.
- خلايا الحبيبات عن طريق الطرد المركزي عند 17000 × جم لمدة 2 دقيقة في درجة حرارة الغرفة. نضح المادة الطافية ، ثم أضف 1 مل من برنامج تلفزيوني دافئ وأعد تعليق الحبيبات جيدا ، وقم بسحب العينة برفق لأعلى ولأسفل حتى يصبح الخليط متجانسا تماما (8-10x).
- كرر الخطوة 6.3.1. 1x وقت إضافي.
- خلايا الحبيبات عن طريق الطرد المركزي عند 17000 × جم لمدة دقيقتين في درجة حرارة الغرفة ، ونضح المادة الطافية ، وإعادة تعليق الكريات في 2 مل من DMEM الدافئ.
ملاحظة: سيكون التركيز النهائي للبكتيريا المعلقة 1 × 108 CFU / مل.
- دوامة ، ثم أضف 1 مل (1 × 108 CFUs) من الشيغيلة المعاد تعليقها بالإضافة إلى 1 مل من DMEM إلى كل بئر من الطبقات الظهارية القولونية HT-29 المحضرة في ألواح 6 آبار (من الخطوة 3.2.10.2).
ملاحظة: يتم إجراء العدوى عادة عند تعدد العدوى (MOI ؛ نسبة الخلايا البكتيرية إلى الخلايا الظهارية) من 100. لاختبار MOIs المختلفة ، قم بتخفيف الشيغيلة المعاد تعليقها في DMEM إلى التركيز المطلوب ، ثم أضف 1 مل من البكتيريا المخففة إلى طبقة HT-29 أحادية. على سبيل المثال ، لاختبار MOI من 10 ، قم بتخفيف البكتيريا 1:10 بإضافة 150 ميكرولتر من 1 × 108 CFU / mL بكتيريا إلى 1.35 مل من DMEM ، ثم ضع 1 مل (1 × 107 CFUs) على خلايا HT-29. - لتعزيز التلامس البكتيري مع خلايا HT-29 ، قم بطرد مركزي لألواح 6 آبار عند 2000 × جم لمدة 10 دقائق في درجة حرارة الغرفة أو 37 درجة مئوية إذا كان من الممكن ضبط إعداد درجة الحرارة.
ملاحظة: يعزز الطرد المركزي الاتصال البكتيري بخلايا HT-29 ، مما يتجاوز الحاجة إلى عوامل الالتصاق ويسمح للبكتيريا بغزو الخلايا بسرعة. - احتضان 6 ألواح آبار عند 37 درجة مئوية مع 5٪ CO2 لمدة 45 دقيقة.
- أثناء الحضانة ، حدد عيار العدوى البكتيرية.
- تحضير التخفيفات التسلسلية 10 أضعاف لخلايا الشيغيلا المعاد تعليقها (من الخطوة 6.3.3) إلى برنامج تلفزيوني.
- صفيحة 100 ميكرولتر من التخفيفات 1 × 10-5 و 1 × 10-6 على لوحات TSB + الكونغو الحمراء واحتضانها طوال الليل عند 37 درجة مئوية.
ملاحظة: طلاء 100 ميكرولتر من التخفيفات 1 × 10-5 و 1 × 10-6 يتوافق مع عامل تخفيف نهائي قدره 1 × 10-6 و 1 × 10-7 ، على التوالي.
- اغسل جيدا خلايا HT-29 المصابة 3x مع 1 مل من PBS.
- نضح الوسائط من كل بئر.
ملاحظة: عند شفط الوسائط من ألواح ذات 6 آبار ، قم بتوجيه طرف الشافطة على طول الجانب السفلي من الآبار ، في محاولة لتجنب ملامسة خلايا HT-29. - أضف 1 مل من برنامج تلفزيوني دافئ إلى كل بئر واغسله بلطف.
ملاحظة: لغسل 6 طبقات أحادية اللون برفق باستخدام PBS ، حرك اللوحة لأعلى ولأسفل ومن جانب إلى آخر على سطح الطاولة. يمكن أن يؤدي غسل الألواح بحركة دائرية و / أو إزالة اللوحة من سطح الطاولة إلى الإزالة الميكانيكية للخلايا من البلاستيك. - كرر الخطوتين 6.8.1 و 6.8.2 مرتين إضافيتين.
- نضح الوسائط من كل بئر.
- قم بإزالة PBS عن طريق الشفط ، ثم أضف 2 مل من DMEM الدافئ المكمل ب 50 ميكروغرام / مل جنتاميسين إلى كل بئر واحتضانه لمدة 30 دقيقة عند 37 درجة مئوية مع 5٪ CO2.
- اغسل جيدا خلايا HT-29 المصابة 3x مع 1 مل من PBS.
- كرر خطوة الغسيل 6.8.
- قم بإزالة PBS عن طريق الشفط ، ثم أضف 2 مل من DMEM الدافئ مع 50 ميكروغرام / مل جنتاميسين إلى كل بئر من الألواح المكونة من 6 آبار واحتضانها عند 37 درجة مئوية مع 5٪ CO2 لطول الوقت المطلوب للسماح بالنسخ المتماثل داخل الخلايا (حتى 24 ساعة).
- اغسل الخلايا جيدا 2x مع 1 مل من PBS.
- كرر خطوة الغسيل 6.8.
- قم بإزالة PBS عن طريق الشفط وتحلل خلايا HT-29 بإضافة 1 مل من PBS + 1٪ Triton X-100 إلى كل بئر.
- احتضان 6 أطباق عند 37 درجة مئوية لمدة 5 دقائق.
- استخدم مكشطة الخلايا أو طرف الماصة المثني لكشط الخلايا المحللة من قاع البئر ونقل 1 مل بالكامل إلى أنبوب طرد مركزي جديد سعة 1.7 مل.
- تحديد عدد البكتيريا داخل الخلايا.
- دوامة كل أنبوب (من الخطوة 6.15) لمدة 30 ثانية على الأقل لإزاحة الشيغيلة من الخلايا حقيقية النواة المحللة.
- إعداد التخفيفات التسلسلية 10 أضعاف من المحللين في برنامج تلفزيوني.
- صفيحة 100 ميكرولتر من التخفيفات 1 × 10-2 و 1 × 10-3 و 1 × 10-4 على ألواح TSB + Congo Red واحتضانها طوال الليل عند 37 درجة مئوية.
ملاحظة: طلاء 100 ميكرولتر من التخفيفات 1 × 10-2 و 1 × 10-3 و 1 × 10-4 يتوافق مع عامل تخفيف نهائي يبلغ 1 × 10-3 و 1 × 10-4 و 1 × 10-5 على التوالي.
النتائج
تم إجراء فحوصات الالتصاق والغزو والتكرار داخل الخلايا بمقارنة النوع البري S. flexneri 2457T (WT) إلى S. flexneri ΔVF (ΔVF) ، وهو متحولة يفترض أنها تنظم ضراوة الشيغيلا بشكل سلبي. وبما أن الشيغيلا تستخدم الأملاح الصفراوية كإشارة لتنظيم الفوعة17،18،
Discussion
يصف هذا البروتوكول مجموعة من ثلاثة مقايسات موحدة لدراسة التصاق الشيغيلة وغزوها وتكرارها داخل الخلايا للخلايا الظهارية المعوية. على الرغم من أن هذه الطرق هي مجرد نسخ معدلة من مقايسات الجنتاميسين الكلاسيكية المستخدمة لدراسة الغزو والتكاثر داخل الخلايا لمختلف مسببات الأمراض البكتير?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يشمل دعم المؤلفين قسم طب الأطفال في مستشفى ماساتشوستس العام ، وجائزة اللجنة التنفيذية لتمويل الدعم المؤقت للأبحاث (ISF) 2022A009041 ، ومنحة المعهد الوطني للحساسية والأمراض المعدية R21AI146405 ، والمعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى منحة مركز أبحاث السمنة الغذائية في جامعة هارفارد (NORCH) 2P30DK040561-26. لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو قرار النشر أو إعداد المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm PES filter | Millipore-Sigma | SCGP00525 | Sterile, polyethersulfone filter for sterilizing up to 50 mL media |
| 14 mL culture tubes | Corning | 352059 | 17 mm x 100 mm polypropylene test tubes with cap |
| 50 mL conical tubes | Corning | 430829 | 50 mL clear polypropylene conical bottom centrifuge tubes with leak-proof cap |
| 6-well tissue culture plates | Corning | 3516 | Plates are treated for optimal cell attachment |
| Bile salts | Sigma-Aldrich | B8756 | 1:1 ratio of cholate to deoxycholate |
| Congo red dye | Sigma-Aldrich | C6277 | A benzidine-based anionic diazo dye, >85% purity |
| Countess cell counting chamber slide | Invitrogen | C10283 | To be used with the Countess Automated Cell Counter |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | A a highly polar organic reagent |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 10569-010 | DMEM is supplemented with high glucose, sodium pyruvate, GlutaMAX, and Phenol Red |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F4135 | Heat-inactivated, sterile |
| Gentamicin | Sigma-Aldrich | G3632 | Stock concentration is 50 mg/mL |
| HT-29 cell line | ATCC | HTB-38 | Adenocarcinoma cell line; colorectal in origin |
| Paraffin film | Bemis | PM999 | Laboratory sealing film |
| Petri dishes | Thermo Fisher Scientific | FB0875713 | 100 mm x 15 mm Petri dishes for solid media |
| Phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 10010049 | 1x concentration; pH 7.4 |
| Select agar | Invitrogen | 30391023 | A mixture of polysaccharides extracted from red seaweed cell walls to make bacterial plating media |
| T75 flasks | Corning | 430641U | Tissue culture flasks |
| Triton X-100 | Sigma-Aldrich | T8787 | A common non-ionic surfactant and emulsifier |
| Trypan blue stain | Invitrogen | T10282 | A dye to detect dead tissue culture cells; only live cells can exclude the dye |
| Trypsin-EDTA | Gibco | 25200-056 | Reagent for cell dissociation for cell line maintenance and passaging |
| Tryptic Soy Broth (TSB) | Sigma-Aldrich | T8907 | Bacterial growth media |
References
- Karambizi, N. U., McMahan, C. S., Blue, C. N., Temesvari, L. A. Global estimated Disability-Adjusted Life-Years (DALYs) of diarrheal diseases: A systematic analysis of data from 28 years of the global burden of disease study. PloS one. 16 (10), e0259077 (2021).
- WHO. WHO methods and data sources for country-level causes of death 2000-2016. World Health Organization. , (2018).
- Kotloff, K. L. Shigella infection in children and adults: a formidable foe. Lancet Glob Health. 5 (12), e1166-e1167 (2017).
- Kotloff, K. L., et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): A prospective, case-control study. Lancet. 382 (9888), 209-222 (2013).
- Schroeder, G. N., Hilbi, H. Molecular pathogenesis of Shigella spp.: Controlling host cell signaling, invasion, and death by type III secretion. Clin Microbiol Rev. 21 (1), 134-156 (2008).
- Arvelo, W., et al. Transmission risk factors and treatment of pediatric shigellosis during a large daycare center-associated outbreak of multidrug resistant shigella sonnei: Implications for the management of shigellosis outbreaks among children. Pediatr Infect Dis J. 28 (11), 976-980 (2009).
- Kozyreva, V. K., et al. Recent outbreaks of Shigellosis in California caused by two distinct populations of Shigella sonnei with either increased virulence or fluoroquinolone resistance. mSphere. 1 (6), 1-18 (2016).
- Bowen, A., et al. Importation and domestic transmission of Shigella sonnei resistant to ciprofloxacin - United States, May 2014-February 2015. MMWR Morb Mortal Wkly Rep. 64 (12), 318-320 (2015).
- Tansarli, G. S., et al. Genomic reconstruction and directed interventions in a multidrug-resistant Shigellosis outbreak in Seattle, WA, USA: a genomic surveillance study. Lancet. 3099 (22), 1-11 (2023).
- Barry, E. M., et al. Progress and pitfalls in Shigella vaccine research. Nat Rev Gastroenterol Hepatol. 10 (4), 245-255 (2013).
- Increase in Extensively Drug-Resistant Shigellosis in the United States. CDC Health Alert Network. Centers for Disease Control and Prevention Available from: https://emergency.cdc.gov/han/2023/han00486.asp?ACSTrackingID=USCDC_511-DM100260&ACSTrackingLabel=HAN%20486%20-%20General%20Public&deliveryName=USCDC_511-DM100260 (2023)
- Shiferaw, B., et al. Antimicrobial susceptibility patterns of Shigella isolates in Foodborne Diseases Active Surveillance Network (FoodNet) sites, 2000-2010. Clin Infect Dis. 54, S458-S463 (2012).
- Centers for Disease Control and Prevention. COVID-19: U.S. Impact on Antimicrobial Resistance, Special Report 2022. Atlanta, GA: U.S. Department of Health and Human Services. CDC. , (2022).
- Centers for Disease Control and Prevention. Antibiotic resistance threats in the United States, 2019. CDC. 10 (1), (2019).
- WHO. Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. WHO. , (2017).
- DuPont, H. L., Levine, M. M., Hornick, R. B., Formal, S. B. Inoculum size in shigellosis and implications for expected mode of transmission. J Infect Dis. 159 (6), 1126-1128 (1989).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), 1-18 (2017).
- Faherty, C. S., Redman, J. C., Rasko, D. A. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Chanin, R. B., et al. Shigella flexneri adherence factor expression in in vivo-like conditions. mSphere. 4 (6), e00751 (2019).
- Baranov, V., Hammarström, S. Carcinoembryonic antigen (CEA) and CEA-related cell adhesion molecule 1 (CEACAM1), apically expressed on human colonic M cells, are potential receptors for microbial adhesion. Histochem Cell Biol. 121 (2), 83-89 (2004).
- Wassef, J. S., Keren, D. F., Mailloux, J. L. Role of M cells in initial antigen uptake and in ulcer formation in the rabbit intestinal loop model of shigellosis. Infect Immun. 57 (3), 858-863 (1989).
- Sansonetti, P. J., Arondel, J., Cantey, J. R., Prévost, M. C., Huerre, M. Infection of rabbit Peyer's patches by Shigella flexneri: Effect of adhesive or invasive bacterial phenotypes on follicle-associated epithelium. Infect Immun. 64 (7), 2752-2764 (1996).
- Sansonetti, P. J., et al. Caspase-1 activation of IL-1beta and IL-18 are essential for Shigella flexneri-induced inflammation. Immunity. 12 (5), 581-590 (2000).
- Zychlinsky, A., Fitting, C., Cavaillon, J. M., Sansonetti, P. J. Interleukin 1 is released by murine macrophages during apoptosis induced by Shigella flexneri. J Clin Invest. 94 (3), 1328-1332 (1994).
- Sansonetti, P. J., Ryter, A., Clerc, P., Maurelli, A. T., Mounier, J. Multiplication of Shigella flexneri within HeLa cells: lysis of the phagocytic vacuole and plasmid-mediated contact hemolysis. Infect Immun. 51 (2), 461-469 (1986).
- Maldonado-Contreras, A., et al. Shigella depends on SepA to destabilize the intestinal epithelial integrity via cofilin activation. Gut Microbes. 8 (6), 544-560 (2017).
- Collard, J. -. M., et al. High prevalence of small intestine bacteria overgrowth and asymptomatic carriage of enteric pathogens in stunted children in Antananarivo, Madagascar. PLoS Negl Trop Dis. 16 (5), e0009849 (2022).
- Mattock, E., Blocker, A. J. How do the virulence factors of shigella work together to cause disease. Front Cell Infect Microbiol. 7, 1-24 (2017).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. PLoS Pathog. 9 (9), e1003588 (2013).
- Martinez-Becerra, F. J., et al. Parenteral immunization with IpaB/IpaD protects mice against lethal pulmonary infection by Shigella. Vaccine. 31 (24), 2667-2672 (2013).
- Shim, D. -. H., et al. New animal model of shigellosis in the Guinea pig: its usefulness for protective efficacy studies. J Immunol. 178 (4), 2476-2482 (2007).
- Marteyn, B., et al. Modulation of Shigella virulence in response to available oxygen in vivo. Nature. 465 (7296), 355-358 (2010).
- West, N. P., et al. Optimization of virulence functions through glucosylation of Shigella LPS. Science. 307 (5713), 1313-1317 (2005).
- Maurelli, A. T., et al. Shigella infection as observed in the experimentally inoculated domestic pig, Sus scrofa domestica. Microbial Pathog. 25 (4), 189-196 (1998).
- Jeong, K. -. I., Zhang, Q., Nunnari, J., Tzipori, S. A piglet model of acute gastroenteritis induced by Shigella dysenteriae Type 1. J Infect Dis. 201 (6), 903-911 (2010).
- Kim, Y. -. J., Yeo, S. -. G., Park, J. -. H., Ko, H. -. J. Shigella vaccine development: prospective animal models and current status. Curr Pharm Biotechnol. 14 (10), 903-912 (2013).
- Kent, T. H., Formal, S. B., LaBrec, E. H., Sprinz, H., Maenza, R. M. Gastric shigellosis in rhesus monkeys. Am J Pathol. 51 (2), 259-267 (1967).
- Shipley, S. T., et al. A challenge model for Shigella dysenteriae 1 in cynomolgus monkeys (Macaca fascicularis). Comp Med. 60 (1), 54-61 (2010).
- Higgins, R., Sauvageau, R., Bonin, P. Shigella flexneri Type 2 Infection in captive nonhuman primates. Can Vet J. 26 (12), 402-403 (1985).
- Oaks, E. V., Hale, T. L., Formal, S. B. Serum immune response to Shigella protein antigens in rhesus monkeys and humans infected with Shigella spp. Infect Immun. 53 (1), 57-63 (1986).
- Formal, S. B., et al. Protection of monkeys against experimental shigellosis with a living attenuated oral polyvalent dysentery vaccine. J Bacteriol. 92 (1), 17-22 (1966).
- Levine, M. M., Kotloff, K. L., Barry, E. M., Pasetti, M. F., Sztein, M. B. Clinical trials of Shigella vaccines: two steps forward and one step back on a long, hard road. Nat Rev Microbiol. 5 (7), 540-553 (2007).
- Payne, S. M. Laboratory cultivation and storage of Shigella. Curr Protoc Microbiol. 55 (1), 93 (2019).
- NIH Guidelines. NIH guidelines for research involving recombinant or synthetic nucleic acid molecules. NIH Guidelines. 2, 142 (2019).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- HT-29 cell line product sheet. ATCC Available from: https://www.atcc.org/products/htb-38 (2023)
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), 819-836 (2016).
- Stensrud, K. F., et al. Deoxycholate interacts with IpaD of Shigella flexneri in inducing the recruitment of IpaB to the type III secretion apparatus needle tip. J Biol Chem. 283 (27), 18646-18654 (2008).
- Mandell, G. L. Interaction of intraleukocytic bacteria and antibiotics. J Clin Invest. 52 (7), 1673-1679 (1973).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymo. 236 (1979), 405-420 (1994).
- Elsinghorst, E. A., Weitz, J. A. Epithelial cell invasion and adherence directed by the enterotoxigenic Escherichia coli tib locus is associated with a 104-kilodalton outer membrane protein. Infect Immun. 62 (8), 3463-3471 (1994).
- Dorman, C. J., McKenna, S., Beloin, C. Regulation of virulence gene expression in Shigella flexneri, a facultative intracellular pathogen. Int J Med Microbiol. 291 (2), 89-96 (2001).
- Porter, M. E., Dorman, C. J. Positive regulation of Shigella flexneri virulence genes by integration host factor. J Bacteriol. 179 (21), 6537-6550 (1997).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Temperature-dependent expression of virulence genes in Shigella species. Infect Immun. 43 (1), 195-201 (1984).
- Schuch, R., Maurelli, A. T. Virulence plasmid instability in Shigella flexneri 2a is induced by virulence gene expression. Infect Immun. 65 (9), 3686-3692 (1997).
- Formal, S. B., Hale, T. L., Sansonetti, P. J. Invasive enteric pathogens. Rev Infect Dis. 5, S702-S707 (1983).
- Pál, T., Hale, T. L. Plasmid-associated adherence of Shigella flexneri in a HeLa cell model. Infect Immun. 57 (8), 2580-2582 (1989).
- Noben, M., et al. Human intestinal epithelium in a dish: Current models for research into gastrointestinal pathophysiology. United European Gastroenterol J. 5 (8), 1073-1081 (2017).
- Liévin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: lessons from cultured, fully differentiated human colon cancer cell lines. Microbiol Mol Biol Rev R. 77 (3), 380-439 (2013).
- Mitchell, D. M., Ball, J. M. Characterization of a spontaneously polarizing HT-29 cell line, HT-29/cl.f8. In Vitro Cell Dev Biol - Anim. 40 (10), 297-302 (2004).
- Gagnon, M., Zihler Berner, A., Chervet, N., Chassard, C., Lacroix, C. Comparison of the Caco-2, HT-29 and the mucus-secreting HT29-MTX intestinal cell models to investigate Salmonella adhesion and invasion. J Microbiol Methods. 94 (3), 274-279 (2013).
- Koestler, B. J., et al. Human intestinal enteroids as a model system of Shigella pathogenesis. Infect Immun. 87 (4), 00733 (2019).
- Ranganathan, S., et al. Evaluating Shigella flexneri pathogenesis in the human enteroid model. Infect Immun. 87 (4), (2019).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), 1-17 (2021).
- Perlman, M., Senger, S., Verma, S., Carey, J., Faherty, C. S. A foundational approach to culture and analyze malnourished organoids. Gut Microbes. 15 (2), 2248713 (2023).
- Pope, L. M., Reed, K. E., Payne, S. M. Increased protein secretion and adherence to HeLa cells by Shigella spp. following growth in the presence of bile salts. Infect Immun. 63 (9), 3642-3648 (1995).
- Faherty, C. S., et al. The synthesis of OspD3 (ShET2) in Shigella flexneri is independent of OspC1. Gut Microbes. 7 (6), 486-502 (2016).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Köseoğlu, V. K., Hall, C. P., Rodríguez-López, E. M., Agaisse, H. The Autotransporter IcsA promotes Shigella flexneri biofilm formation in the presence of bile salts. Infect Immun. 87 (7), 1-14 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved