Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ инфекции эпителиальных клеток с помощью шигелл
В этой статье
Резюме
В настоящем протоколе описаны тесты на инфекции для исследования приверженности шигелл , инвазии и внутриклеточной репликации с использованием эпителиальных клеточных линий in vitro .
Аннотация
Адаптированный к человеку кишечный бактериальный патоген шигелла вызывает миллионы инфекций каждый год, создает долгосрочные эффекты роста среди педиатрических пациентов и является основной причиной смерти от диареи во всем мире. Инфекция вызывает водянистую или кровавую диарею в результате того, что патоген проходит через желудочно-кишечный тракт и инфицирует эпителиальные клетки, выстилающие толстую кишку. В условиях ошеломляющего роста устойчивости к антибиотикам и отсутствия в настоящее время одобренных вакцин стандартизированные протоколы исследований имеют решающее значение для изучения этого грозного патогена. Представлены методики изучения молекулярного патогенеза шигелл с использованием in vitro анализа бактериальной адгезии, инвазии и внутриклеточной репликации в эпителиальных клетках толстой кишки. Перед проведением анализа инфекции фенотип вирулентности колоний шигелл был проверен путем поглощения красного красителя Конго на агаровых пластинах. Во время бактериального культивирования также можно рассмотреть возможность использования дополнительных лабораторных сред для имитации условий in vivo . Затем бактериальные клетки используются в стандартизированном протоколе для инфицирования эпителиальных клеток толстой кишки в тканевых культуральных планшетах при установленной множественности инфекции с адаптацией для анализа каждой стадии инфекции. Для анализа на адгезию клетки шигелл инкубируют с пониженными уровнями среды, чтобы способствовать контакту бактерий с эпителиальными клетками. Как для инвазий, так и для внутриклеточной репликации гентамицин применяется в течение различных временных интервалов для уничтожения внеклеточных бактерий и обеспечения возможности оценки инвазии и/или количественной оценки скорости внутриклеточной репликации. Во всех протоколах инфекции перечисляются адгезивные, инвазированные и/или внутриклеточные бактерии путем последовательного разбавления лизатов инфицированных эпителиальных клеток и нанесения бактериальных колониеобразующих единиц относительно титров инфекции на пластинах из конголезского красного агара. Вместе эти протоколы позволяют проводить независимые характеристики и сравнения для каждой стадии инфекции эпителиальных клеток шигеллами для успешного изучения этого патогена.
Введение
Диарейные заболевания, вызываемые кишечными бактериальными патогенами, представляют собой серьезное глобальное бремя для здравоохранения. В 2016 г. диарейные заболевания стали причиной 1,3 миллиона случаев смерти во всем мире и были четвертой по значимости причиной смерти детей в возрасте до пяти лет. Грамотрицательный кишечный бактериальный патоген шигелла является возбудителем шигеллеза, основной причины смерти от диареи во всем мире3. Шигеллез ежегодно вызывает значительную заболеваемость и смертность среди детей из стран с низким и средним уровнем дохода 4,5, в то время как инфекции в странах с высоким уровнем дохода связаны со вспышками в детских садах, пищевых продуктах и водным путем 6,7,8,9. Неэффективная разработкавакцин10 и растущие показатели устойчивости к противомикробным препаратам (УПП)11,12 осложняют борьбу с крупномасштабными вспышками шигеллы. Последние данные Центров по контролю и профилактике заболеваний показывают, что почти 46% инфекций шигелл в Соединенных Штатах проявили лекарственную устойчивость в 2020 году13,14, в то время как Всемирная организация здравоохранения объявила шигеллы приоритетным патогеном УПП, для которого срочно необходимы новые методылечения15.
Шигелла-инфекции легко передаются фекально-оральным путем при употреблении зараженной пищи или воды или при прямом контакте с человеком. Шигеллы эволюционировали, чтобы стать эффективным, адаптированным к человеку патогеном, с инфекционной дозой 10-100 бактерий, достаточной для того, чтобы вызвать заболевание16. Во время транзита в тонком кишечнике шигеллы подвергаются воздействию сигналов окружающей среды, таких как повышенная температура и желчь17. Обнаружение этих сигналов индуцирует транскрипционные изменения для экспрессии факторов вирулентности, которые усиливают способность бактерий инфицировать толстую кишку человека 17,18,19. Шигеллы не проникают в эпителий толстой кишки с апикальной поверхности, а проходят через эпителиальный слой после поглощения в специализированные антигенпрезентирующие микроскладчатые клетки (М-клетки) в фолликул-ассоциированном эпителии 20,21,22. После трансцитоза клетки шигелл фагоцитируются резидентными макрофагами. Шигеллы быстро ускользают из фагосомы и запускают гибель клеток макрофагов, что приводит к высвобождению провоспалительных цитокинов 5,23,24. Затем шигеллы вторгаются в эпителиальные клетки толстой кишки с базолатеральной стороны, лизируют макропиноцитарную вакуоль и создают репликативную нишу в цитоплазме 5,25. Провоспалительные цитокины, особенно интерлейкин-8 (IL-8), рекрутируют полиморфноядерные нейтрофильные лейкоциты (ПМН) к месту инфекции, что ослабляет эпителиальные плотные соединения и позволяет бактериальной инфильтрации эпителиальной выстилки усугублять базолатеральную инфекцию5. ПМН разрушают инфицированную эпителиальную выстилку, чтобы сдержать инфекцию, что приводит к характерным симптомам бациллярной (кровяной) дизентерии5. Несмотря на то, что механизмы инвазии и внутриклеточной репликации были тщательно охарактеризованы, новые исследования демонстрируют важные новые концепции в отношении инфекции шигелл, включая регуляцию вирулентности во время желудочно-кишечного транзита (ЖКТ)17, приверженность к лечению19, улучшенный базолатеральный доступ через барьерную проницаемость26 и бессимптомное носительство у детей с недостаточностью питания27.
Способность Shigella spp. вызывать диарейные заболевания ограничена людьми и нечеловекообразными приматами (NHP)28. Были разработаны модели кишечных инфекций шигелл для рыбок данио29, мышей30, морских свинок31, кроликов 21,32,33 и свиней34,35. Однако ни одна из этих модельных систем не может точно воспроизвести характеристики заболевания, наблюдаемые при инфицировании человека36. Несмотря на то, что для изучения патогенеза шигелл были созданы NHP-модели, эти модельные системы являются дорогостоящими в реализации и требуют искусственно высоких инфекционных доз, на девять порядков превышающих инфекционную дозу человека 37,38,39,40,41,42. Таким образом, замечательная адаптация шигелл к инфекции человека-хозяина обусловливает необходимость использования культур клеток человеческого происхождения для воссоздания физиологически релевантных моделей для точного исследования патогенеза шигелл.
Здесь подробно описаны процедуры для измерения скорости адгезии шигелл , инвазии и репликации в эпителиальных клетках толстой кишки HT-29. Используя эти стандартизированные протоколы, можно исследовать молекулярные механизмы, с помощью которых гены вирулентности бактерий и сигналы окружающей среды влияют на каждый этап инфекции шигелл , чтобы лучше понять динамическую взаимосвязь между хозяином и патогеном.
протокол
1. Подготовка реагентов и материалов
ПРИМЕЧАНИЕ: Все объемы соответствуют анализу с использованием двух 6-луночных планшетов.
- Среда TSB: Добавьте 0,5 л деионизированной (DI) воды к 15 г среды триптического соевого бульона (TSB, см. Таблицу материалов) и автоклав. Хранить при комнатной температуре.
- Среда желчных солей (БСЭ + БС): Для приготовления БСЭ, содержащего 0,4% (по массе) желчных солей, ресуспендировать 0,06 г желчных солей (БС, см. Таблицу материалов) в 15 мл автоклавного БСЭ. Фильтр стерилизовать с помощью фильтра PES 0,22 мкм.
ПРИМЕЧАНИЕ: Желчные соли состоят из смеси холата натрия и дезоксихолата натрия в соотношении 1:1. Готовьте свежие средства непосредственно перед использованием. - DMEM + 10% (v/v) FBS: добавьте 5 мл фетальной бычьей сыворотки (FBS) к 45 мл модифицированной орлиной среды (DMEM) Dulbecco. Хранить при температуре 4 °C.
- ДМЕМ + гентамицин: В пробирку объемом 50 мл добавьте 50 мл ДМЕМ и 50 мкл гентамицина 50 мг/мл (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перед каждым экспериментом готовьте свежую, аликвотную и теплую на водяной бане с температурой 37 °C. - PBS + 1% (v/v) Triton X-100: добавьте 150 мкл Triton X-100 к 15 мл фосфатно-солевого буфера (PBS).
ПРИМЕЧАНИЕ: Перед каждым экспериментом готовьте свежую, аликвотную и теплую на водяной бане с температурой 37 °C. - Красные индикаторные пластины TSB + Congo: Добавьте в бутылку объемом 1 л 15 г TSB, 7,5 г отборного агара и 0,125 г красного красителя Congo (см. Таблицу материалов). Добавьте 0,5 л деионизированной воды и автоклав. Налейте 10-20 мл среды в отдельные стерильные чашки Петри (100 мм x 15 мм) и дайте застыть.
ВНИМАНИЕ: Конголезский красный является канцерогеном и репродуктивным токсином. Убедитесь, что обращение с конголезским красным осуществляется с использованием соответствующих средств индивидуальной защиты. Дополнительную информацию см. в паспорте безопасности продукта.
ПРИМЕЧАНИЕ: Около 20 пластин изготовлены из 0,5 л красной среды Конго. Тарелки можно подготовить за 2-3 дня и оставить перевернутыми при комнатной температуре до использования. Для длительного хранения поместите перевернутые пластины в пластиковые гильзы при температуре 4 °C на срок до 3 месяцев. - DMEM + 10% (v/v) FBS и 5% (v/v) диметилсульфоксида (DMSO): добавьте 42,5 мл DMEM, 5 мл FBS и 2,5 мл DMSO в пробирку объемом 50 мл. Хранить при температуре 4 °C.
2. Подготовка бактерий
ПРИМЕЧАНИЕ: Все протоколы лабораторного культивирования и хранения шигелл адаптированы из Payne, S. M.43.
ВНИМАНИЕ: Shigella spp. относятся к группе риска2 44. Выполняйте все лабораторные работы в среде BSL-2 с принятием дополнительных мер безопасности для ограничения случайного воздействия из-за низкой инфекционной дозы Shigella spp.
- Рост шигелл из замороженных запасов
- Переложите небольшое количество замороженной культуры из криогенного флакона на планшет с красным агаром TSB + Congo с помощью стерильного аппликатора.
- Пламенем простерилизуйте инокуляционный контур и дайте ему остыть. Проведите посевной материалом вперед и назад по одному квадранту пластины. Зажгите петлю, дайте ей остыть, затем проведите из первого квадранта во второй квадрант пластины. Повторите то же самое, чтобы распределить посевной материал по третьему и четвертому квадрантам пластины.
ПРИМЕЧАНИЕ: В качестве альтернативы можно прорисовать посевной материал с помощью свежего стерильного аппликатора между каждым квадрантом. - Переверните планшет и инкубируйте при температуре 37 °C в течение ночи.
ПРИМЕЧАНИЕ: Инкубация при температуре ≥37 °C необходима для экспрессии факторов вирулентности шигелл , необходимых для наблюдения конголезского красноположительного (CR+) фенотипа45. Колонии авирулентов будут иметь белый вид и не будут инвазивными. - Закройте пластину парафиновой пленкой и храните в холодильнике при температуре 4 °C.
ПРИМЕЧАНИЕ: Колонии бактерий остаются жизнеспособными на агаровых пластинах в течение 1-2 недель.
- Ночное выращивание шигелл в жидкой культуре
- Аликвоту 3 мл среды TSB в стерильные культуральные пробирки по 14 мл.
- Выберите одиночную, хорошо изолированную красную (CR+) колонию с помощью стерильного аппликатора и ресуспендируйте в жидкой среде.
- Инкубируют культуры в течение ночи (16-18 ч) при 37 °C при встряхивании со скоростью 250 оборотов в минуту (об/мин).
3. Подготовка эукариотических клеток HT-29
ПРИМЕЧАНИЕ: Все объемы соответствуют анализу с использованием двух 6-луночных планшетов. Клеточные линии HT-29 были получены из Американской коллекции типовых культур (ATCC). Протоколы технического обслуживания HT-29 адаптированы из рекомендаций46 ATCC. Перед использованием все среды должны быть предварительно прогреты на водяной бане при температуре 37 °C. Все протоколы технического обслуживания HT-29 должны выполняться в шкафу биобезопасности. Воздерживайтесь от образования пузырьков при смешивании/работе с клетками HT-29 в среде, чтобы избежать резких изменений pH.
- Размораживание ячеек HT-29 из замороженного сырья
- Разморозьте флакон с ячейками HT-29 на водяной бане с температурой 37 °C.
ПРИМЕЧАНИЕ: Убедитесь, что колпачок полностью находится над водой, чтобы избежать загрязнения. Размораживание должно занять не более 2 минут. - Выньте флакон из воды сразу после того, как культура полностью оттает, и обеззаражьте 70% этиловым спиртом. Убедитесь, что все шаги, начиная с этого момента, выполняются с использованием асептических методов.
- Добавьте все содержимое флакона в центрифужную пробирку объемом 15 мл, содержащую 9 мл DMEM + 10% FBS. Центрифуга при 125 x g в течение 5 мин при комнатной температуре.
- Сцедите надосадочную жидкость в контейнер для отходов и повторно суспендируйте гранулу в 10 мл теплого DMEM + 10% FBS. Переносят ресуспендированные клетки в колбу для тканевой культуры 75см2 (Т75), содержащую 10 мл теплого ДМЭМ + 10% FBS (общий объем 20 мл).
- Инкубируют клетки при 37 °C с 5% CO2 до тех пор, пока клетки не достигнут 90% слияния (примерно 6-7 дней).
ПРИМЕЧАНИЕ: Слияние оценивается с помощью визуальной аппроксимации.
- Разморозьте флакон с ячейками HT-29 на водяной бане с температурой 37 °C.
- Посев ячеек HT-29
- Предварительно нагрейте 20 мл PBS и 50 мл DMEM + 10% FBS на водяной бане с температурой 37 °C и предварительно подогрейте 3 мл 0,25% (w/v) трипсина-ЭДТА до комнатной температуры.
- После того, как клетки HT-29 (из шага 3.1) достигнут 90% слияния, сцедите питательную среду для клеток HT-29 из колбы T75 в контейнер для отходов. Налейте ~10 мл теплого PBS в колбу и осторожно перемешайте, чтобы промыть. Слейте PBS в контейнер для отходов. Еще раз промойте теплым PBS и сцедите.
- Добавьте 2-3 мл 0,25% (по массе) трипсина-ЭДТА и аккуратно взболтайте по всей площади поверхности. Инкубировать при 37 °C с 5%СО2 в течение 4 мин.
- Извлеките колбу из инкубатора и аккуратно взболтайте Трипсин-ЭДТА, визуально убедившись, что все клетки отделились от поверхности.
- Немедленно добавьте 6 мл теплого DMEM + 10% FBS, чтобы деактивировать трипсин. Пипеткой вверх и вниз тщательно перемешать.
- Переложите все содержимое в центрифужную пробирку объемом 15 мл и вращайте ее при 500 x g в течение 5 минут при комнатной температуре.
- Аккуратно сцедите надосадочную жидкость в контейнер для отходов и повторно суспендируйте гранулу в 6 мл теплого DMEM + 10% FBS.
- Сразу после ресуспензии переносят 10 мкл взвешенных клеток HT-29 из середины культуры в ПЦР-пробирку объемом 0,2 мл. Добавьте в ПЦР-пробирку 10 мкл красителя трипанового синего и перемешайте.
- Добавьте 10 мкл смеси клеток HT-29 и трипанового синего в одноразовое предметное стекло камеры счетчика клеток Countess (см. Таблицу материалов). Перечислите количество живых клеток и рассчитайте жизнеспособность клеток.
ПРИМЕЧАНИЕ: При документировании количества клеток в образце считывайте число под «живым» количеством клеток, а не общее количество клеток. В качестве альтернативы подсчет клеток может быть выполнен вручную с помощью гемоцитометра. - Семена ресуспендировали клетки HT-29 в свежую колбу Т75 или 6-луночную пластину.
- Для колбы Т75:
- Пипетку аккуратно перемешать, затем переложить 2,5 x 106 ячеек в свежую колбу Т75 в соответствии с приведенным ниже уравнением:
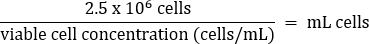
- Добавьте теплую среду DMEM + 10% FBS до конечного объема 20 мл (конечная концентрация 1,25 x 105 клеток/мл).
- Равномерно распределите клетки по колбе, осторожно покачивая вперед и назад.
- Инкубируют при 37 °C с 5%CO2 до тех пор, пока клетки не достигнут 80% слияния.
ПРИМЕЧАНИЕ: Для оптимального роста заменяйте фильтрующий материал DMEM + 10% FBS в колбе T75 каждые ~3 дня. Сцедите среду в контейнер для отходов и добавьте в колбу 10 мл теплого PBS. Осторожно перемешайте PBS и слейте его в контейнер для отходов. Затем добавьте в колбу 20 мл свежего теплого ДМЕМ + 10% FBS и верните в инкубатор с температурой 37 °C, 5% CO2 .
- Пипетку аккуратно перемешать, затем переложить 2,5 x 106 ячеек в свежую колбу Т75 в соответствии с приведенным ниже уравнением:
- Для 6-луночного планшета:
- Пипетку аккуратно перемешать, затем переложить 5,85 x 106 клеток в свежую коническую пробирку объемом 50 мл в соответствии с приведенным ниже уравнением:
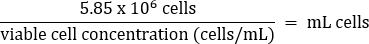
- Добавьте теплую среду DMEM + 10% FBS до конечного объема 26 мл (конечная концентрация 2,25 x 105 клеток/мл).
- Пипетку осторожно перемешать, затем дозировать 2 мл (4,5 x 105 ячеек) в отдельные лунки 6-луночных планшетов.
- Равномерно распределите клетки по лунке, осторожно покачивая вверх/вниз и влево/вправо 2-3 раза.
- Инкубируют при 37 °C с 5% CO2 до тех пор, пока клетки не достигнут слияния 80%-95% (примерно 3-4 дня).
ПРИМЕЧАНИЕ: 85% конфлюэнтность рекомендуется для инвазий и внутриклеточной репликации, в то время как 90%-95% конфлюэнтность рекомендуется для анализов адгезии. Клетки должны достичь ~85% слияния после 48 ч инкубации с конечной концентрацией примерно 1 x 106 клеток/лунку. Может потребоваться корректировка количества засеянных клеток и продолжительности инкубации.
- Пипетку аккуратно перемешать, затем переложить 5,85 x 106 клеток в свежую коническую пробирку объемом 50 мл в соответствии с приведенным ниже уравнением:
- Для колбы Т75:
- Изготовление замороженных бульонов HT-29
- Аликвоту 1 мл ДМЭМ + 10% ФБС + 5% ДМСО среды в индивидуальные криогенные флаконы.
- Добавьте 1 x 106 клеток HT-29 из шага 3.2.7 в каждый флакон. Рассчитайте объем ячеек по следующей формуле:
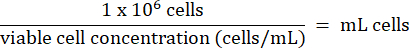
- Храните ячейки HT-29 при температуре ниже -130 °C в морозильной камере для хранения паров жидкого азота.
4. Анализ на адгезию
ПРИМЕЧАНИЕ: Все объемы соответствуют анализу с использованием двух 6-луночных планшетов.
- Субкультурные культуры с однодневным разведением шигелл в соотношении 1:50 в свежих средах.
- Встряхните, затем добавьте 100 мкл каждой ночной культуры к 5 мл свежего БСЭ или БСЭ + БС в пробирку для культивирования подходящего размера.
ПРИМЕЧАНИЕ: Ограничьте объем культуры до <20% от объема колбы или пробирки для культуры, чтобы обеспечить надлежащую аэрацию. - Инкубируют при 37 °C при встряхивании при 250 об/мин до тех пор, пока клетки не достигнут оптической плотности (OD600) 0,7 (средняя логарифмическая фаза роста шигеллы ); около 2-2,5 ч.
ПРИМЕЧАНИЕ: Во время субкультивирования прибавьте 50 мл DMEM и достаточный объем PBS для всех этапов стирки и поместите на водяную баню с температурой 37 °C. Перед использованием дайте среде нагреться до 37 °C.
- Встряхните, затем добавьте 100 мкл каждой ночной культуры к 5 мл свежего БСЭ или БСЭ + БС в пробирку для культивирования подходящего размера.
- Переложите 2 x 10 колониеобразующих единиц (КОЕ) субкультивируемых шигелл в отдельные микроцентрифужные пробирки объемом 2 мл.
ПРИМЕЧАНИЕ: 2 x 108 КОЕ соответствует примерно 1 мл бактериальных клеток при наружном диаметре600 0,7. Используйте показания OD600 для аппроксимации КОЕ/мл в соответствии с калибровкой каждого отдельного спектрофотометра. - Промойте каждый образец шигеллы 2 раза PBS.
- Грануляторы центрифугируют при 17 000 x g в течение 2 мин при комнатной температуре. Отсасывайте надосадочную жидкость, затем добавьте 1 мл теплого PBS и хорошо ресуспендируйте гранулы, осторожно пипетируя образец вверх и вниз до тех пор, пока смесь не станет полностью однородной (8-10x).
- Повторите шаг 4.3.1 1 дополнительное время.
- Гранулированные клетки центрифугируют при 17 000 x g в течение 2 мин при комнатной температуре, аспирируют надосадочную жидкость и ресуспендируют гранулы в 2 мл теплого DMEM.
ПРИМЕЧАНИЕ: Конечная концентрация ресуспендированных бактерий составляет 1 x 108 КОЕ/мл.
- Затем добавьте 1 мл (1 x 10,8 КОЕ) ресуспендированной шигеллы в каждую лунку подготовленных монослоев эпителия толстой кишки HT-29 в 6-луночных планшетах (начиная с шага 3.2.10.2).
ПРИМЕЧАНИЕ: Инфекции обычно проводятся при кратности инфекции (MOI; соотношение бактериальных и эпителиальных клеток) равной 100. Чтобы протестировать различные MOI, разбавьте ресуспендированную шигеллу в теплом DMEM до желаемой концентрации, затем добавьте 1 мл разбавленных бактерий к монослоям HT-29. Например, чтобы проверить MOI, равный 10, разбавьте бактерии в соотношении 1:10, добавив 150 мкл бактерий 1 x 108 КОЕ/мл к 1,35 мл теплого DMEM, затем нанесите 1 мл (1 x 107 КОЕ) на клетки HT-29. - Инкубируйте 6-луночные планшеты при 37 °C с 5%CO2 в течение 3 ч.
- Во время инкубации определяют титр бактериальной инфекции.
- Приготовьте 10-кратные серийные разведения ресуспендированных клеток шигелл (из шага 4.3.3) в PBS.
- Распределите 100 мкл разведения 1 x 10-5 и 1 x 10-6 на красные планшеты TSB + Congo и инкубируйте в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Нанесение 100 мкл из разведений 1 x 10-5 и 1 x 10-6 соответствует конечному коэффициенту разбавления 1 x 10-6 и 1 x 10-7 соответственно.
- После инкубации промыть монослои 4-5 раз ПБС.
- Отсасывайте среду из каждой лунки.
ПРИМЕЧАНИЕ: При аспирации среды из 6-луночных планшетов направляйте наконечник аспиратора вдоль нижней стороны лунок, стараясь избегать контакта с ячейками HT-29. - Добавьте 1 мл теплого PBS в каждую лунку и аккуратно промойте.
ПРИМЕЧАНИЕ: Чтобы аккуратно промыть 6-луночные монослои с помощью PBS, перемещайте пластину вверх-вниз и из стороны в сторону на столешнице. Мытье пластин круговыми движениями и/или снятие пластины с поверхности стола может привести к механическому удалению ячеек из пластика. - Повторите шаги 4.7.1 и 4.7.2 еще 4 раза.
- Отсасывайте среду из каждой лунки.
- Удалить PBS путем аспирации и лизировать клетки HT-29, добавив 1 мл PBS + 1% Triton X-100 в каждую лунку.
- Инкубируйте 6-луночные планшеты при температуре 37 °C в течение 5 минут.
- Используйте скребок для клеток или изогнутый наконечник пипетки, чтобы соскоблить лизированные клетки со дна лунки и переложить полный 1 мл в свежую пробирку микроцентрифуги объемом 1,7 мл.
- Определите количество клеточно-ассоциированных бактерий.
- Встряхивайте каждую пробирку (начиная с шага 4.10) в течение не менее 30 с, чтобы еще больше вытеснить шигеллы из лизированных эукариотических клеток.
- Готовят 10-кратные последовательные разведения лизатов в ПБС.
- Проложите 100 мкл разведения 1 x 10-2, 1 x 10-3 и 1 x 10-4 на красные планшеты TSB + Congo и инкубируйте в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Нанесение 100 мкл из разведения 1 x 10-2, 1 x 10-3 и 1 x 10-4 соответствует конечному коэффициенту разбавления 1 x 10-3, 1 x 10-4 и 1 x 10-5 соответственно.
5. Инвазионный анализ
ПРИМЕЧАНИЕ: Все объемы соответствуют анализу с использованием двух 6-луночных планшетов.
- Субкультурные культуры с однодневным разведением шигелл в соотношении 1:50 в свежих средах.
- Встряхните, затем добавьте 100 мкл каждой ночной культуры к 5 мл свежего БСЭ или БСЭ + БС в пробирку для культивирования подходящего размера.
ПРИМЕЧАНИЕ: Ограничьте объем культуры до <20% от объема колбы или пробирки для культуры, чтобы обеспечить надлежащую аэрацию. - Инкубируют при 37 °C при встряхивании при 250 об/мин до тех пор, пока клетки не достигнут наружного диаметра600 0,7 (средняя логарифмическая фаза роста шигеллы ); около 2-2,5 ч.
ПРИМЕЧАНИЕ: Во время субкультивирования прибавьте 50 мл DMEM + 50 мг/мл гентамицина и достаточный объем PBS для всех этапов промывки и поместите на водяную баню с температурой 37 °C. Перед использованием дайте среде нагреться до 37 °C.
- Встряхните, затем добавьте 100 мкл каждой ночной культуры к 5 мл свежего БСЭ или БСЭ + БС в пробирку для культивирования подходящего размера.
- Переложите 2 x 108 КОЕ субкультивированных шигелл в отдельные микроцентрифужные пробирки объемом 2 мл.
ПРИМЕЧАНИЕ: 2 x 108 КОЕ соответствует примерно 1 мл бактериальных клеток при наружном диаметре600 0,7. Используйте показания OD600 для аппроксимации КОЕ/мл в соответствии с калибровкой каждого отдельного спектрофотометра. - Промыть образцы шигелл 1 раз с помощью PBS.
- Грануляторы центрифугируют при 17 000 x g в течение 2 мин при комнатной температуре. Отсасывайте надосадочную жидкость, затем добавьте 1 мл теплого PBS и хорошо ресуспендируйте гранулы, осторожно пипетируя образец вверх и вниз до тех пор, пока смесь не станет полностью однородной (8-10x).
- Повторите шаг 5.3.1. 1x дополнительное время.
- Гранулированные клетки центрифугируют при 17 000 x g в течение 2 мин при комнатной температуре, аспирируют надосадочную жидкость и ресуспендируют гранулы в 2 мл теплого DMEM.
ПРИМЕЧАНИЕ: Конечная концентрация ресуспендированных бактерий составляет 1 x 108 КОЕ/мл.
- Затем добавьте 1 мл (1 x 108 КОЕ) ресуспендированной шигеллы плюс 1 мл DMEM в каждую лунку подготовленных монослоев эпителия толстой кишки HT-29 в 6-луночных планшетах (начиная с шага 3.2.10.2).
ПРИМЕЧАНИЕ: Инфекции обычно проводятся при кратности инфекции (MOI; соотношение бактериальных и эпителиальных клеток) равной 100. Чтобы протестировать различные MOI, разбавьте ресуспендированную шигеллу в DMEM до желаемой концентрации, затем добавьте 1 мл разбавленных бактерий к монослоям HT-29. Например, чтобы проверить MOI 10, разбавьте бактерии в соотношении 1:10, добавив 150 мкл бактерий 1 x 108 КОЕ/мл к 1,35 мл DMEM, а затем добавьте 1 мл (1 x 107 КОЕ) к клеткам HT-29. - Чтобы способствовать контакту бактерий с клетками HT-29, центрифугируйте 6-луночные планшеты при 2 000 x g в течение 10 минут при комнатной температуре или 37 °C, если настройка температуры может быть отрегулирована.
ПРИМЕЧАНИЕ: Центрифугирование способствует контакту бактерий с клетками HT-29, что позволяет избежать необходимости в факторах адгезии и позволяет бактериям быстро проникать в клетки. - Инкубируют 6-луночные планшеты при 37 °C с 5%CO2 в течение 45 мин.
- Во время инкубации определяют титр бактериальной инфекции.
- Приготовьте 10-кратные серийные разведения ресуспендированных клеток шигелл (из шага 5.3.3) в PBS.
- Распределите 100 мкл разведения 1 x 10-5 и 1 x 10-6 на красные планшеты TSB + Congo и инкубируйте в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Нанесение 100 мкл из разведений 1 x 10-5 и 1 x 10-6 соответствует конечному коэффициенту разбавления 1 x 10-6 и 1 x 10-7 соответственно.
- Тщательно промыть инфицированные клетки HT-29 3 раза 1 мл PBS.
- Отсасывайте среду из каждой лунки.
ПРИМЕЧАНИЕ: При аспирации среды из 6-луночных планшетов направляйте наконечник аспиратора вдоль нижней стороны лунок, стараясь избегать контакта с ячейками HT-29. - Добавьте 1 мл теплого PBS в каждую лунку и аккуратно промойте.
ПРИМЕЧАНИЕ: Чтобы аккуратно промыть 6-луночные монослои с помощью PBS, перемещайте пластину вверх-вниз и из стороны в сторону на столешнице. Мытье пластин круговыми движениями и/или снятие пластины с поверхности стола может привести к механическому удалению ячеек из пластика. - Повторите шаги 5.8.1 и 5.8.2 еще 2 раза.
- Отсасывайте среду из каждой лунки.
- Удалите PBS путем аспирации, затем добавьте 2 мл теплого DMEM с добавлением 50 мкг/мл гентамицина в каждую лунку и инкубируйте в течение 30 мин при 37 °C с 5%CO2.
- Тщательно промыть инфицированные клетки HT-29 3 раза 1 мл PBS.
- Повторите шаг стирки 5.8.
- Удалить PBS путем аспирации, затем добавить 2 мл теплого DMEM с добавлением 50 мкг/мл гентамицина в каждую лунку и инкубировать в течение 60 мин при 37 °C с 5% CO2.
- Тщательно промыть инфицированные клетки HT-29 3 раза 1 мл PBS.
- Повторите шаг стирки 5.8.
- Удалить PBS путем аспирации и лизировать клетки HT-29, добавив 1 мл PBS + 1% Triton X-100 в каждую лунку.
- Инкубируйте 6-луночные планшеты при температуре 37 °C в течение 5 минут.
- Используйте скребок для клеток или изогнутый наконечник пипетки, чтобы соскоблить лизированные клетки со дна лунки и переложить полный 1 мл в свежую пробирку микроцентрифуги объемом 1,7 мл.
- Определяют количество внутриклеточных бактерий.
- Встряхивайте каждую пробирку (начиная с шага 5.15) в течение не менее 30 с для дальнейшего вытеснения шигелл из лизированных эукариотических клеток.
- Готовят 10-кратные последовательные разведения лизатов в ПБС.
- Проложите 100 мкл разведения 1 x 10-2 и 1 x 10-3 на красные планшеты TSB + Congo и инкубируйте в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Нанесение 100 мкл из разведений 1 x 10-2 и 1 x 10-3 соответствует конечному коэффициенту разбавления 1 x 10-3 и 1 x 10-4 соответственно.
6. Анализ внутриклеточной репликации
ПРИМЕЧАНИЕ: Все объемы соответствуют анализу с использованием двух 6-луночных планшетов.
- Субкультурные культуры с однодневным разведением шигелл в соотношении 1:50 в свежих средах.
- Встряхните, затем добавьте 100 мкл каждой ночной культуры к 5 мл свежего БСЭ или БСЭ + БС в пробирку для культивирования подходящего размера.
ПРИМЕЧАНИЕ: Ограничьте объем культуры до <20% от объема колбы или пробирки для культуры, чтобы обеспечить надлежащую аэрацию. - Инкубируют при 37 °C при встряхивании при 250 об/мин до тех пор, пока клетки не достигнут наружного диаметра600 0,7 (средняя логарифмическая фаза роста шигеллы ); около 2-2,5 ч.
ПРИМЕЧАНИЕ: Во время субкультивирования прибавьте 50 мл DMEM + 50 мг/мл гентамицина и достаточный объем PBS для всех этапов промывки и поместите на водяную баню с температурой 37 °C. Перед использованием дайте среде нагреться до 37 °C.
- Встряхните, затем добавьте 100 мкл каждой ночной культуры к 5 мл свежего БСЭ или БСЭ + БС в пробирку для культивирования подходящего размера.
- Переложите 2 x 108 КОЕ субкультивированных шигелл в отдельные микроцентрифужные пробирки объемом 2 мл.
ПРИМЕЧАНИЕ: 2 x 108 КОЕ соответствует примерно 1 мл бактериальных клеток при наружном диаметре600 0,7. Используйте показания OD600 для аппроксимации КОЕ/мл в соответствии с калибровкой каждого отдельного спектрофотометра. - Промыть образцы шигелл 1 раз с помощью PBS.
- Грануляторы центрифугируют при 17 000 x g в течение 2 мин при комнатной температуре. Отсасывайте надосадочную жидкость, затем добавьте 1 мл теплого PBS и хорошо ресуспендируйте гранулы, осторожно пипетируя образец вверх и вниз до тех пор, пока смесь не станет полностью однородной (8-10x).
- Повторите шаг 6.3.1. 1x дополнительное время.
- Гранулированные клетки центрифугируют при 17 000 x g в течение 2 мин при комнатной температуре, аспирируют надосадочную жидкость и ресуспендируют гранулы в 2 мл теплого DMEM.
ПРИМЕЧАНИЕ: Конечная концентрация ресуспендированных бактерий составляет 1 x 108 КОЕ/мл.
- Затем добавьте 1 мл (1 x 10,8 КОЕ) ресуспендированной шигеллы плюс 1 мл DMEM в каждую лунку подготовленных монослоев эпителия толстой кишки HT-29 в 6-луночных планшетах (начиная с шага 3.2.10.2).
ПРИМЕЧАНИЕ: Инфекции обычно проводятся при кратности инфекции (MOI; соотношение бактериальных и эпителиальных клеток) равной 100. Чтобы протестировать различные MOI, разбавьте ресуспендированную шигеллу в DMEM до желаемой концентрации, затем добавьте 1 мл разбавленных бактерий к монослоям HT-29. Например, чтобы протестировать MOI 10, разбавьте бактерии в соотношении 1:10, добавив 150 мкл бактерий 1 x 108 КОЕ/мл к 1,35 мл DMEM, затем нанесите 1 мл (1 x 107 КОЕ) на клетки HT-29. - Чтобы способствовать контакту бактерий с клетками HT-29, центрифугируйте 6-луночные планшеты при 2 000 x g в течение 10 минут при комнатной температуре или 37 °C, если настройка температуры может быть отрегулирована.
ПРИМЕЧАНИЕ: Центрифугирование способствует контакту бактерий с клетками HT-29, что позволяет избежать необходимости в факторах адгезии и позволяет бактериям быстро проникать в клетки. - Инкубируют 6-луночные планшеты при 37 °C с 5%CO2 в течение 45 мин.
- Во время инкубации определяют титр бактериальной инфекции.
- Приготовьте 10-кратные серийные разведения ресуспендированных клеток шигелл (из шага 6.3.3) в PBS.
- Распределите 100 мкл разведения 1 x 10-5 и 1 x 10-6 на красные планшеты TSB + Congo и инкубируйте в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Нанесение 100 мкл из разведений 1 x 10-5 и 1 x 10-6 соответствует конечному коэффициенту разбавления 1 x 10-6 и 1 x 10-7 соответственно.
- Тщательно промыть инфицированные клетки HT-29 3 раза 1 мл PBS.
- Отсасывайте среду из каждой лунки.
ПРИМЕЧАНИЕ: При аспирации среды из 6-луночных планшетов направляйте наконечник аспиратора вдоль нижней стороны лунок, стараясь избегать контакта с ячейками HT-29. - Добавьте 1 мл теплого PBS в каждую лунку и аккуратно промойте.
ПРИМЕЧАНИЕ: Чтобы аккуратно промыть 6-луночные монослои с помощью PBS, перемещайте пластину вверх-вниз и из стороны в сторону на столешнице. Мытье пластин круговыми движениями и/или снятие пластины с поверхности стола может привести к механическому удалению ячеек из пластика. - Повторите шаги 6.8.1 и 6.8.2 еще 2 раза.
- Отсасывайте среду из каждой лунки.
- Удалите PBS путем аспирации, затем добавьте 2 мл теплого DMEM с добавлением 50 мкг/мл гентамицина в каждую лунку и инкубируйте в течение 30 мин при 37 °C с 5%CO2.
- Тщательно промыть инфицированные клетки HT-29 3 раза 1 мл PBS.
- Повторите шаг стирки 6.8.
- Удаляют PBS путем аспирации, затем добавляют 2 мл теплого ДМЭМ с 50 мкг/мл гентамицина в каждую лунку 6-луночных планшетов и инкубируют при 37 °C с 5%CO2 в течение желаемого периода времени, чтобы обеспечить внутриклеточную репликацию (до 24 ч).
- Тщательно промойте клетки 2 раза 1 мл PBS.
- Повторите шаг стирки 6.8.
- Удалить PBS путем аспирации и лизировать клетки HT-29, добавив 1 мл PBS + 1% Triton X-100 в каждую лунку.
- Инкубируйте 6-луночные планшеты при температуре 37 °C в течение 5 минут.
- Используйте скребок для клеток или изогнутый наконечник пипетки, чтобы соскоблить лизированные клетки со дна лунки и переложить полный 1 мл в свежую пробирку микроцентрифуги объемом 1,7 мл.
- Определяют количество внутриклеточных бактерий.
- Встряхивайте каждую пробирку (начиная с шага 6.15) в течение не менее 30 с для дальнейшего вытеснения шигелл из лизированных эукариотических клеток.
- Готовят 10-кратные последовательные разведения лизатов в ПБС.
- Протаплируйте 100 мкл разведений 1 x 10-2, 1 x 10-3 и 1 x 10-4 на тарелки TSB + Congo Red и инкубируйте в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: Нанесение 100 мкл из разведения 1 x 10-2, 1 x 10-3 и 1 x 10-4 соответствует конечному коэффициенту разбавления 1 x 10-3, 1 x 10-4 и 1 x 10-5 соответственно.
Результаты
Анализы приверженности, инвазии и внутриклеточной репликации были проведены, сравнивая S. flexneri 2457T дикого типа (WT) с S. flexneri ΔVF (ΔVF), мутантом, который, как предполагается, отрицательно регулирует вирулентность шигелл. Поскольку шигеллы используют желчные соли в ка?...
Обсуждение
Этот протокол описывает набор из трех стандартизированных анализов для изучения адгезии шигелл, инвазии и внутриклеточной репликации эпителиальных клеток кишечника. Несмотря на то, что эти методы являются всего лишь модифицированными версиями классических гентамициновых анали...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Поддержку авторам оказывают Отделение педиатрии Массачусетской больницы общего профиля, грант Исполнительного комитета по временному финансированию исследований (ISF) 2022A009041, грант Национального института аллергии и инфекционных заболеваний R21AI146405 и грант Национального института диабета и заболеваний пищеварительной системы и почек Исследовательский центр питания и ожирения в Гарварде (NORCH) 2P30DK040561-26. Спонсоры не играли никакой роли в планировании исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 μm PES filter | Millipore-Sigma | SCGP00525 | Sterile, polyethersulfone filter for sterilizing up to 50 mL media |
| 14 mL culture tubes | Corning | 352059 | 17 mm x 100 mm polypropylene test tubes with cap |
| 50 mL conical tubes | Corning | 430829 | 50 mL clear polypropylene conical bottom centrifuge tubes with leak-proof cap |
| 6-well tissue culture plates | Corning | 3516 | Plates are treated for optimal cell attachment |
| Bile salts | Sigma-Aldrich | B8756 | 1:1 ratio of cholate to deoxycholate |
| Congo red dye | Sigma-Aldrich | C6277 | A benzidine-based anionic diazo dye, >85% purity |
| Countess cell counting chamber slide | Invitrogen | C10283 | To be used with the Countess Automated Cell Counter |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | A a highly polar organic reagent |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 10569-010 | DMEM is supplemented with high glucose, sodium pyruvate, GlutaMAX, and Phenol Red |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F4135 | Heat-inactivated, sterile |
| Gentamicin | Sigma-Aldrich | G3632 | Stock concentration is 50 mg/mL |
| HT-29 cell line | ATCC | HTB-38 | Adenocarcinoma cell line; colorectal in origin |
| Paraffin film | Bemis | PM999 | Laboratory sealing film |
| Petri dishes | Thermo Fisher Scientific | FB0875713 | 100 mm x 15 mm Petri dishes for solid media |
| Phosphate-buffered saline (PBS) | Thermo Fisher Scientific | 10010049 | 1x concentration; pH 7.4 |
| Select agar | Invitrogen | 30391023 | A mixture of polysaccharides extracted from red seaweed cell walls to make bacterial plating media |
| T75 flasks | Corning | 430641U | Tissue culture flasks |
| Triton X-100 | Sigma-Aldrich | T8787 | A common non-ionic surfactant and emulsifier |
| Trypan blue stain | Invitrogen | T10282 | A dye to detect dead tissue culture cells; only live cells can exclude the dye |
| Trypsin-EDTA | Gibco | 25200-056 | Reagent for cell dissociation for cell line maintenance and passaging |
| Tryptic Soy Broth (TSB) | Sigma-Aldrich | T8907 | Bacterial growth media |
Ссылки
- Karambizi, N. U., McMahan, C. S., Blue, C. N., Temesvari, L. A. Global estimated Disability-Adjusted Life-Years (DALYs) of diarrheal diseases: A systematic analysis of data from 28 years of the global burden of disease study. PloS one. 16 (10), e0259077 (2021).
- WHO. WHO methods and data sources for country-level causes of death 2000-2016. World Health Organization. , (2018).
- Kotloff, K. L. Shigella infection in children and adults: a formidable foe. Lancet Glob Health. 5 (12), e1166-e1167 (2017).
- Kotloff, K. L., et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): A prospective, case-control study. Lancet. 382 (9888), 209-222 (2013).
- Schroeder, G. N., Hilbi, H. Molecular pathogenesis of Shigella spp.: Controlling host cell signaling, invasion, and death by type III secretion. Clin Microbiol Rev. 21 (1), 134-156 (2008).
- Arvelo, W., et al. Transmission risk factors and treatment of pediatric shigellosis during a large daycare center-associated outbreak of multidrug resistant shigella sonnei: Implications for the management of shigellosis outbreaks among children. Pediatr Infect Dis J. 28 (11), 976-980 (2009).
- Kozyreva, V. K., et al. Recent outbreaks of Shigellosis in California caused by two distinct populations of Shigella sonnei with either increased virulence or fluoroquinolone resistance. mSphere. 1 (6), 1-18 (2016).
- Bowen, A., et al. Importation and domestic transmission of Shigella sonnei resistant to ciprofloxacin - United States, May 2014-February 2015. MMWR Morb Mortal Wkly Rep. 64 (12), 318-320 (2015).
- Tansarli, G. S., et al. Genomic reconstruction and directed interventions in a multidrug-resistant Shigellosis outbreak in Seattle, WA, USA: a genomic surveillance study. Lancet. 3099 (22), 1-11 (2023).
- Barry, E. M., et al. Progress and pitfalls in Shigella vaccine research. Nat Rev Gastroenterol Hepatol. 10 (4), 245-255 (2013).
- Increase in Extensively Drug-Resistant Shigellosis in the United States. CDC Health Alert Network. Centers for Disease Control and Prevention Available from: https://emergency.cdc.gov/han/2023/han00486.asp?ACSTrackingID=USCDC_511-DM100260&ACSTrackingLabel=HAN%20486%20-%20General%20Public&deliveryName=USCDC_511-DM100260 (2023)
- Shiferaw, B., et al. Antimicrobial susceptibility patterns of Shigella isolates in Foodborne Diseases Active Surveillance Network (FoodNet) sites, 2000-2010. Clin Infect Dis. 54, S458-S463 (2012).
- Centers for Disease Control and Prevention. COVID-19: U.S. Impact on Antimicrobial Resistance, Special Report 2022. Atlanta, GA: U.S. Department of Health and Human Services. CDC. , (2022).
- Centers for Disease Control and Prevention. Antibiotic resistance threats in the United States, 2019. CDC. 10 (1), (2019).
- WHO. Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. WHO. , (2017).
- DuPont, H. L., Levine, M. M., Hornick, R. B., Formal, S. B. Inoculum size in shigellosis and implications for expected mode of transmission. J Infect Dis. 159 (6), 1126-1128 (1989).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), 1-18 (2017).
- Faherty, C. S., Redman, J. C., Rasko, D. A. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Chanin, R. B., et al. Shigella flexneri adherence factor expression in in vivo-like conditions. mSphere. 4 (6), e00751 (2019).
- Baranov, V., Hammarström, S. Carcinoembryonic antigen (CEA) and CEA-related cell adhesion molecule 1 (CEACAM1), apically expressed on human colonic M cells, are potential receptors for microbial adhesion. Histochem Cell Biol. 121 (2), 83-89 (2004).
- Wassef, J. S., Keren, D. F., Mailloux, J. L. Role of M cells in initial antigen uptake and in ulcer formation in the rabbit intestinal loop model of shigellosis. Infect Immun. 57 (3), 858-863 (1989).
- Sansonetti, P. J., Arondel, J., Cantey, J. R., Prévost, M. C., Huerre, M. Infection of rabbit Peyer's patches by Shigella flexneri: Effect of adhesive or invasive bacterial phenotypes on follicle-associated epithelium. Infect Immun. 64 (7), 2752-2764 (1996).
- Sansonetti, P. J., et al. Caspase-1 activation of IL-1beta and IL-18 are essential for Shigella flexneri-induced inflammation. Immunity. 12 (5), 581-590 (2000).
- Zychlinsky, A., Fitting, C., Cavaillon, J. M., Sansonetti, P. J. Interleukin 1 is released by murine macrophages during apoptosis induced by Shigella flexneri. J Clin Invest. 94 (3), 1328-1332 (1994).
- Sansonetti, P. J., Ryter, A., Clerc, P., Maurelli, A. T., Mounier, J. Multiplication of Shigella flexneri within HeLa cells: lysis of the phagocytic vacuole and plasmid-mediated contact hemolysis. Infect Immun. 51 (2), 461-469 (1986).
- Maldonado-Contreras, A., et al. Shigella depends on SepA to destabilize the intestinal epithelial integrity via cofilin activation. Gut Microbes. 8 (6), 544-560 (2017).
- Collard, J. -. M., et al. High prevalence of small intestine bacteria overgrowth and asymptomatic carriage of enteric pathogens in stunted children in Antananarivo, Madagascar. PLoS Negl Trop Dis. 16 (5), e0009849 (2022).
- Mattock, E., Blocker, A. J. How do the virulence factors of shigella work together to cause disease. Front Cell Infect Microbiol. 7, 1-24 (2017).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. PLoS Pathog. 9 (9), e1003588 (2013).
- Martinez-Becerra, F. J., et al. Parenteral immunization with IpaB/IpaD protects mice against lethal pulmonary infection by Shigella. Vaccine. 31 (24), 2667-2672 (2013).
- Shim, D. -. H., et al. New animal model of shigellosis in the Guinea pig: its usefulness for protective efficacy studies. J Immunol. 178 (4), 2476-2482 (2007).
- Marteyn, B., et al. Modulation of Shigella virulence in response to available oxygen in vivo. Nature. 465 (7296), 355-358 (2010).
- West, N. P., et al. Optimization of virulence functions through glucosylation of Shigella LPS. Science. 307 (5713), 1313-1317 (2005).
- Maurelli, A. T., et al. Shigella infection as observed in the experimentally inoculated domestic pig, Sus scrofa domestica. Microbial Pathog. 25 (4), 189-196 (1998).
- Jeong, K. -. I., Zhang, Q., Nunnari, J., Tzipori, S. A piglet model of acute gastroenteritis induced by Shigella dysenteriae Type 1. J Infect Dis. 201 (6), 903-911 (2010).
- Kim, Y. -. J., Yeo, S. -. G., Park, J. -. H., Ko, H. -. J. Shigella vaccine development: prospective animal models and current status. Curr Pharm Biotechnol. 14 (10), 903-912 (2013).
- Kent, T. H., Formal, S. B., LaBrec, E. H., Sprinz, H., Maenza, R. M. Gastric shigellosis in rhesus monkeys. Am J Pathol. 51 (2), 259-267 (1967).
- Shipley, S. T., et al. A challenge model for Shigella dysenteriae 1 in cynomolgus monkeys (Macaca fascicularis). Comp Med. 60 (1), 54-61 (2010).
- Higgins, R., Sauvageau, R., Bonin, P. Shigella flexneri Type 2 Infection in captive nonhuman primates. Can Vet J. 26 (12), 402-403 (1985).
- Oaks, E. V., Hale, T. L., Formal, S. B. Serum immune response to Shigella protein antigens in rhesus monkeys and humans infected with Shigella spp. Infect Immun. 53 (1), 57-63 (1986).
- Formal, S. B., et al. Protection of monkeys against experimental shigellosis with a living attenuated oral polyvalent dysentery vaccine. J Bacteriol. 92 (1), 17-22 (1966).
- Levine, M. M., Kotloff, K. L., Barry, E. M., Pasetti, M. F., Sztein, M. B. Clinical trials of Shigella vaccines: two steps forward and one step back on a long, hard road. Nat Rev Microbiol. 5 (7), 540-553 (2007).
- Payne, S. M. Laboratory cultivation and storage of Shigella. Curr Protoc Microbiol. 55 (1), 93 (2019).
- NIH Guidelines. NIH guidelines for research involving recombinant or synthetic nucleic acid molecules. NIH Guidelines. 2, 142 (2019).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- HT-29 cell line product sheet. ATCC Available from: https://www.atcc.org/products/htb-38 (2023)
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), 819-836 (2016).
- Stensrud, K. F., et al. Deoxycholate interacts with IpaD of Shigella flexneri in inducing the recruitment of IpaB to the type III secretion apparatus needle tip. J Biol Chem. 283 (27), 18646-18654 (2008).
- Mandell, G. L. Interaction of intraleukocytic bacteria and antibiotics. J Clin Invest. 52 (7), 1673-1679 (1973).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymo. 236 (1979), 405-420 (1994).
- Elsinghorst, E. A., Weitz, J. A. Epithelial cell invasion and adherence directed by the enterotoxigenic Escherichia coli tib locus is associated with a 104-kilodalton outer membrane protein. Infect Immun. 62 (8), 3463-3471 (1994).
- Dorman, C. J., McKenna, S., Beloin, C. Regulation of virulence gene expression in Shigella flexneri, a facultative intracellular pathogen. Int J Med Microbiol. 291 (2), 89-96 (2001).
- Porter, M. E., Dorman, C. J. Positive regulation of Shigella flexneri virulence genes by integration host factor. J Bacteriol. 179 (21), 6537-6550 (1997).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Temperature-dependent expression of virulence genes in Shigella species. Infect Immun. 43 (1), 195-201 (1984).
- Schuch, R., Maurelli, A. T. Virulence plasmid instability in Shigella flexneri 2a is induced by virulence gene expression. Infect Immun. 65 (9), 3686-3692 (1997).
- Formal, S. B., Hale, T. L., Sansonetti, P. J. Invasive enteric pathogens. Rev Infect Dis. 5, S702-S707 (1983).
- Pál, T., Hale, T. L. Plasmid-associated adherence of Shigella flexneri in a HeLa cell model. Infect Immun. 57 (8), 2580-2582 (1989).
- Noben, M., et al. Human intestinal epithelium in a dish: Current models for research into gastrointestinal pathophysiology. United European Gastroenterol J. 5 (8), 1073-1081 (2017).
- Liévin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: lessons from cultured, fully differentiated human colon cancer cell lines. Microbiol Mol Biol Rev R. 77 (3), 380-439 (2013).
- Mitchell, D. M., Ball, J. M. Characterization of a spontaneously polarizing HT-29 cell line, HT-29/cl.f8. In Vitro Cell Dev Biol - Anim. 40 (10), 297-302 (2004).
- Gagnon, M., Zihler Berner, A., Chervet, N., Chassard, C., Lacroix, C. Comparison of the Caco-2, HT-29 and the mucus-secreting HT29-MTX intestinal cell models to investigate Salmonella adhesion and invasion. J Microbiol Methods. 94 (3), 274-279 (2013).
- Koestler, B. J., et al. Human intestinal enteroids as a model system of Shigella pathogenesis. Infect Immun. 87 (4), 00733 (2019).
- Ranganathan, S., et al. Evaluating Shigella flexneri pathogenesis in the human enteroid model. Infect Immun. 87 (4), (2019).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), 1-17 (2021).
- Perlman, M., Senger, S., Verma, S., Carey, J., Faherty, C. S. A foundational approach to culture and analyze malnourished organoids. Gut Microbes. 15 (2), 2248713 (2023).
- Pope, L. M., Reed, K. E., Payne, S. M. Increased protein secretion and adherence to HeLa cells by Shigella spp. following growth in the presence of bile salts. Infect Immun. 63 (9), 3642-3648 (1995).
- Faherty, C. S., et al. The synthesis of OspD3 (ShET2) in Shigella flexneri is independent of OspC1. Gut Microbes. 7 (6), 486-502 (2016).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Köseoğlu, V. K., Hall, C. P., Rodríguez-López, E. M., Agaisse, H. The Autotransporter IcsA promotes Shigella flexneri biofilm formation in the presence of bile salts. Infect Immun. 87 (7), 1-14 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены