A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تخطيط كهربية العضل أحادي الألياف المحفز (SFEMG) لتقييم انتقال الوصلات العصبية العضلية في نماذج القوارض
In This Article
Summary
في هذه الدراسة ، نعرض بروتوكول تخطيط كهربية العضل أحادي الألياف (SFEMG) المكرر للسماح بالقياس في الجسم الحي لانتقال الوصلات العصبية العضلية (NMJ) في نماذج القوارض. يتم وصف نهج خطوة بخطوة لتقنية SFEMG للسماح بقياس تباين انتقال NMJ وفشله في عضلة المعدة الفئرانية.
Abstract
باعتباره الرابط النهائي بين الجهاز العصبي والعضلات، فإن الانتقال عند الوصلة العصبية العضلية (NMJ) أمر بالغ الأهمية للوظيفة الحركية الطبيعية. تخطيط كهربية العضل أحادي الألياف (SFEMG) هو تقنية ذات صلة سريريا وحساسة تقيس الاستجابات المحتملة لعمل ألياف العضلات المفردة أثناء الانقباضات الإرادية أو التحفيز العصبي لتقييم انتقال NMJ. يتضمن تقييم وقياس انتقال NMJ معلمتين: الارتعاش والانسداد. يشير الارتعاش إلى التباين في التوقيت (زمن الوصول) بين إمكانات العمل أحادية الألياف المتتالية (SFAPs). يشير الحجب إلى فشل إرسال NMJ في بدء استجابة SFAP. على الرغم من أن SFEMG هو اختبار راسخ وحساس في البيئات السريرية ، إلا أن تطبيقه في الأبحاث قبل السريرية كان نادرا نسبيا. يحدد هذا التقرير الخطوات والمعايير المستخدمة في أداء SFEMG المحفز لتحديد الارتعاش والحجب في نماذج القوارض. يمكن استخدام هذه التقنية في الدراسات قبل السريرية والسريرية لاكتساب رؤى حول وظيفة NMJ في سياق الصحة والشيخوخة والمرض.
Introduction
تم تطوير تخطيط كهربية العضل أحادي الألياف (SFEMG) في البداية بواسطة Stålberg و Ekstedt في الستينيات لتحديد وتحليل إمكانات العمل من ألياف العضلات الفردية ، في المقام الأول لدراسة إجهادالعضلات 1. SFEMG هي التقنية السريرية الأكثر حساسية لتقييم انتقال الوصلة العصبية العضلية (NMJ)2. يتم إجراء SFEMG عن طريق تسجيل إمكانات عمل الألياف المفردة (SFAPs) بشكل انتقائي 3. يمكن أن يتعرض انتقال NMJ للخطر بسبب عوامل مثل الشيخوخة 4,5 والاضطرابات العصبية العضلية المختلفة مثل الوهن العضلي الوبيل والتصلب الجانبيالضموري 6. علاوة على ذلك ، يمكن أن تؤدي حالات مثل نقص التروية والتقلبات في درجة الحرارة واستخدام عوامل الحجب العصبية العضلية إلى أوجه قصور في انتقال NMJ ، يتجلى ذلك في زيادة تباين انتقال NMJ وحدوث فشل NMJ2.
هناك طريقتان لتسجيل SFEMG: SFEMG المحفز والطوعي. يتضمن SFEMG الطوعي تسجيل SFAPs من اثنين من NMJs التي يتم توفيرها بواسطة نفس المحور العصبي الحركي باستخدام قطب إبرة متحد المركز يتم إدخاله في العضلات التي يتم اختبارها أثناء التنشيطالطوعي 7. وفقا لذلك ، يتطلب SFEMG الطوعي تعاونا من الموضوع ويمكنه فقط تقييم الوحدات الحركية منخفضة العتبة (تلك التي يتم تنشيطها أثناء الانقباضات الضعيفة)3. يستخدم SFEMG المحفز زوجا من الأقطاب الكهربائية المحفزة لتحفيز المحاور الحركية أثناء تسجيل SFAPs باستخدام قطب إبرة SFEMG يتم إدخاله في العضلات التي يتماختبارها 7.
في كل من SFEMG الطوعي والمحفز ، فإن الارتعاش والانسداد هما المعلمتان المستخدمتان لتقييم وقياس انتقال NMJ8. يصف Jitter التباين في التوقيت (زمن الوصول) بين SFAPs المتتالية. أثناء SFEMG الطوعي ، يتم قياس الارتعاش من خلال تقييم اختلافات الكمون بين زوج من SFAPs (يتم توفيره بواسطة نفس المحور العصبي الحركي) خلال 50 إلى 100 تفريغ متتالي. أثناء تحفيز SFEMG ، يتم قياس الارتعاش من خلال تقييم اختلافات الكمون بين توقيت التحفيز وبداية SFAP خلال 50 إلى 100 تفريغ متتالي. يشير الحجب إلى فشل انتقال NMJ في تحفيز استجابة SFAP ، ويمكن قياسه كميا على أنه وجود أو عدم وجود كل زوج من SFAPs أثناء SFEMG الطوعي أو لكل NMJ أثناء تحفيز SFEMG2،7.
في حين أنه اختبار راسخ وحساس في البيئة السريرية ، إلا أنه لم يتم تطبيقه إلا بشكل غير متكرر في الأبحاث قبل السريرية4،5،9،10،11،12،13،14،15،16،17،18. في هذا التقرير ، نوضح نهج أداء وتحليل تسجيلات SFEMG في نماذج القوارض قبل السريرية. علاوة على ذلك ، نقدم بيانات تمثيلية تسلط الضوء على النتائج التمثيلية حول SFEMG التي تشير إلى ضعف انتقال NMJ بعد إعطاء عامل حجب عصبي عضلي غير مزيل للاستقطاب ، rocuronium.
Protocol
تمت الموافقة على جميع البروتوكولات وتنفيذها وفقا للوائح التي وضعتها اللجنة المؤسسية لرعاية واستخدامه في جامعة ميسوري.
1. تحضير وإدارتها
- ارتد معدات الحماية الشخصية المناسبة.
- قبل الإجراء ، قم بقياس وزن الجرذ لتحديد الجرعة المناسبة للأدوية القائمة على الوزن وإعدادات جهاز التنفس الصناعي.
- تحفيز التخدير مع استنشاق 3٪ -5٪ من الأيزوفلوران. بمجرد تحديد مستوى مناسب من التخدير ، ضع الجرذ في وضع الانبطاح وحافظ على التخدير مع استنشاق 1٪ -3٪ من الأيزوفلوران.
- تحقق من كفاية عمق التخدير عن طريق الضغط برفق على وسادة القدم الخلفية بالملقط لملاحظة عدم وجود استجابة للانسحاب.
- حافظ على درجة حرارة الجسم عند 37 درجة مئوية.
- ضع مرهما بترولي معتمد من الطبيب البيطري على العينين لمنع الجفاف. مراقبة عمق التخدير من خلال مراقبة معدل التنفس وتقييم استجابات الانسحاب عند الضغط على وسادة القدم باستخدام الملقط.
- احلق الطرف الخلفي ليتم تقييمه باستخدام المقص. بعد إزالة الشعر بشكل كاف ، باستخدام شريط لاصق ، ضع الطرف المراد دراسته مع تثبيت الكاحل عند حوالي 90 درجة من الانثناء الظهري ، والركبة في التمديد ، والورك في حالة الاختطاف.
- راقب باستمرار تنفس الفئران ومعدل ضربات قلبها خلال التجربة بأكملها.
ملاحظة: تستخدم الزيادة في معدل ضربات القلب بشكل شائع كمؤشر على عدم كفاية عمق التخدير. - قم بإعطاء الأيزوفلوران للقتل الرحيم للجرذ، بجرعة 5٪ أو أكثر، حتى يتوقف التنفس لمدة 3 دقائق على الأقل. تأكد من القتل الرحيم بقطع الرأس.
2. وضع القطب الكهربائي وإعداده
ملاحظة: يتم تقييم انتقال NMJ للعصب الوركي والعضلة المعدية باستخدام تخطيط كهربية العضل (EMG). راجع جدول المواد.
- أدخل زوجا من الإبر أحادية القطب المعزولة 28 G لتحفيز العصب الوركي مع الكاثود في منطقة الطرف الخلفي القريب ، في حين أن الأنود يكون أكثر تقريبا داخل الأنسجة تحت الجلد التي تتراكب مع العجز.
- تأكد من عدم وضع الأقطاب الكهربائية المحفزة على مقربة مباشرة من العصب الوركي أو عميقة بشكل مفرط لتجنب الضرر المباشر للعصب الوركي أو الهياكل المجاورة الأخرى.
- ضع قطبا كهربائيا أرضيا يمكن التخلص منه على الطرف الخلفي أو الذيل المقابل.
- ضع بعناية قطب إبرة قياس 27 مقاس 25 مم مصمم خصيصا لمخطط كهربية العضل أحادي الألياف ، ويتميز بسطح تسجيل مصنوع من مادة البلاتين والإيريديوم في عضلة المعدة اليمنى. تأكد من تعقيم أقطاب SFEMG قبل كل استخدام للحفاظ على العقم.
- أدخل قطب إبرة SFEMG بالتوازي مع ألياف عضلات المعدة لالتقاط إمكانات عمل أحادية الألياف (SFAPs).
- تجنب تلف العضلات أثناء إدخال ومناورة إبرة SFEMG داخل العضلات.
3. إجراء تخطيط كهربية العضل أحادي الألياف (SFEMG)
- تطبيق تحفيز تيار مستمر على العصب الوركي الأيمن بتردد 10 هرتز باستخدام نطاق شدة من 0.3-10 مللي أمبير ومدة نبضة 0.1 مللي ثانية.
- قم بتكوين إعدادات المرشح داخل مرشح منخفض التردد بقدرة 1 كيلو هرتز ومرشح عالي التردد بقدرة 10 كيلو هرتز. اضبط الكسب من 200 ميكرو فولت إلى 1000 ميكرو فولت لكل قسم لتسهيل تصور الإمكانات. اضبط سرعة الاجتياح على 500 ميكرو ثانية لكل قسم.
- اضبط شدة التحفيز لتشغيل وعزل SFAPs للتسجيل والتحليل اللاحق.
- لتحديد وتحليل الاستجابة على أنها SFAP ، تأكد من استيفاء المعايير المحددة المذكورة أدناه: تأكد من أن وقت الصعود من ذروة خط الأساس إلى المرحلة السلبية أقل من 500 ميكرو ثانية ، والحد الأدنى للسعة (ذروة خط الأساس إلى سالب) لا يقل عن 200 ميكرو فولت ، وتظهر الاستجابة باستمرار سلوك الكل أو لا شيء (حجم وشكل مستقرين بين الاستجابات).
ملاحظة: من الضروري أن تظهر الاستجابات المتكررة مراحل تصاعدية متسقة دون أي شقوق أو نقاط انعطاف. لاحظ أن المعيار الأخير حاسم للتمييز بين إشارة الجودة ومجموع الإشارات المتعددة.
- لتحديد وتحليل الاستجابة على أنها SFAP ، تأكد من استيفاء المعايير المحددة المذكورة أدناه: تأكد من أن وقت الصعود من ذروة خط الأساس إلى المرحلة السلبية أقل من 500 ميكرو ثانية ، والحد الأدنى للسعة (ذروة خط الأساس إلى سالب) لا يقل عن 200 ميكرو فولت ، وتظهر الاستجابة باستمرار سلوك الكل أو لا شيء (حجم وشكل مستقرين بين الاستجابات).
- احسب الارتعاش ، أو تباين زمن انتقال SFAP (الوقت بين التحفيز ومرحلة الارتفاع من الذروة السلبية ل SFAP) بين التصريفات المتتالية ، بعد ما لا يقل عن 50 تحفيزا (50-100 تحفيز) ، وقم بتقييم الحظر وتحديده كميا.
ملاحظة: يمكن تقييم الحجب على أنه وجود أو غياب في كل مشبك أو كنسبة مئوية من المحفزات التي تفشل في تحفيز توليد جهد عمل ألياف واحدة. يتم حساب الارتعاش باستخدام المعادلةالتالية 7 (عادة ما يتم حساب الارتعاش تلقائيا بواسطة أنظمة تخطيط كهربية العضل في العيادة):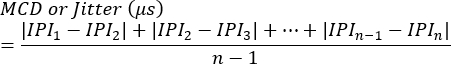
MCD = متوسط قيمة الفرق المتتالي
IPI = الفاصل الزمني بين الجهد - كرر العملية للحصول على استجابات SFAP إضافية. في المتوسط ، قم بتقييم 10 نقاط عصبي من كل لحساب الارتعاش ثم تحديد متوسط القيم لكل.
- استبعاد SFAPs مع ارتعاش أقل من 4 ميكرو ثانية من التحليلات لمنع إدراج الإمكانات التي ربما تكون قد أثيرت عن طريق التحفيز المباشر للعضلات11.
- عند تسجيل الإمكانات التي تظهر حجب متقطع ، قم بزيادة شدة التحفيز للتحقق من أن فشل SFAP لا يعزى إلى التحفيز دون الحد الأقصى.
النتائج
لإثبات زيادة الارتعاش والانسداد في سياق فشل انتقال NMJ ، تم إجراء SFEMG المحفز مع وبدون إعطاء الروكورونيوم عن طريق الوريد. Rocuronium هو عامل مانع عصبي عضلي متوسط المفعول وغير مزيل للاستقطاب يستخدم على نطاق واسع في الإعدادات السريرية للحث على شلل العضلات أثناء العمليات الجراحية...
Discussion
يستخدم SFEMG بشكل شائع للاختبارات التشخيصية في المرضى الذين يشتبه في أنهم مناعون ذاتي ، مكتسبون ، وأشكال وراثية لمرض NMJ. يعتبر SFEMG الاختبار الأكثر حساسية لتشخيص اضطراب NMJ ، الوهن العضلي الوبيل20،21. تحفيز الأعصاب المتكرر (RNS) هو طريقة أخرى تستخد...
Disclosures
تلقى دبليو ديفيد أرنولد تمويلا بحثيا من NMD Pharma و Avidity Biosciences وهو يقدم استشارات لشركة NMD Pharma و Avidity Biosciences و Dyne Therapeutics و Novartis و Design Therapeutics و Catalyst Pharmaceuticals.
Acknowledgements
يود المؤلفون أن يشكروا الدكتور مارتن براندهوج سكوف من NMD Pharma على نصيحته القيمة بشأن جرعات الروكورونيوم وآرش كريمي من قسم الهندسة الطبية الحيوية بجامعة ستوني بروك لمساعدته في الحسابات. تم دعم هذه الدراسة جزئيا من خلال التمويل من المعاهد الوطنية للصحة إلى WDA (R01AG067758 و R01AG078129).
Materials
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
References
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved