Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kemirgen Modellerinde Nöromüsküler Kavşak İletimini Değerlendirmek için Uyarılmış Tek Fiber Elektromiyografisi (SFEMG)
Bu Makalede
Özet
Bu çalışmada, kemirgen modellerinde nöromüsküler kavşak (NMJ) iletiminin in vivo ölçümüne izin vermek için rafine edilmiş bir tek lif elektromiyografi (SFEMG) protokolü gösteriyoruz. Sıçan gastroknemius kasında NMJ iletim değişkenliğinin ve başarısızlığının nicelleştirilmesine izin vermek için SFEMG tekniğine adım adım bir yaklaşım tanımlanmıştır.
Özet
Sinir sistemi ve kas arasındaki son bağlantı olarak, nöromüsküler kavşaktaki (NMJ) iletim normal motor fonksiyon için çok önemlidir. Tek lif elektromiyografisi (SFEMG), NMJ iletimini değerlendirmek için istemli kasılmalar veya sinir stimülasyonları sırasında tek kas lifi aksiyon potansiyeli tepkilerini ölçen klinik olarak ilgili ve hassas bir tekniktir. NMJ iletiminin değerlendirilmesi ve miktarının belirlenmesi iki parametreyi içerir: titreşim ve engelleme. Jitter, ardışık tek fiber aksiyon potansiyelleri (SFAP'ler) arasındaki zamanlama (gecikme) değişkenliğini ifade eder. Engelleme, NMJ iletiminin bir SFAP yanıtı başlatmadaki başarısızlığını belirtir. SFEMG, klinik ortamlarda iyi bilinen ve hassas bir test olmasına rağmen, klinik öncesi araştırmalarda uygulaması nispeten seyrek olmuştur. Bu rapor, kemirgen modellerinde titreme ve blokajı ölçmek için uyarılmış SFEMG'nin gerçekleştirilmesinde kullanılan adımları ve kriterleri özetlemektedir. Bu teknik, sağlık, yaşlanma ve hastalık bağlamında NMJ işlevi hakkında bilgi edinmek için klinik öncesi ve klinik çalışmalarda kullanılabilir.
Giriş
Tek lif elektromiyografisi (SFEMG) ilk olarak 1960'larda Stålberg ve Ekstedt tarafından, öncelikle kas yorgunluğunu incelemek için bireysel kas liflerinden aksiyon potansiyellerini belirlemek ve analiz etmek için geliştirilmiştir1. SFEMG, nöromüsküler kavşak (NMJ) iletiminin değerlendirilmesi için en hassas klinik tekniktir2. SFEMG, tek fiber aksiyon potansiyellerinin (SFAP'ler) seçici olarak kaydedilmesiyle gerçekleştirilir3. Yaşlanma 4,5 ve miyastenia gravis ve amyotrofik lateral skleroz6 gibi çeşitli nöromüsküler bozukluklar gibi faktörler nedeniyle NMJ iletimi tehlikeye girebilir. Ayrıca, iskemi, sıcaklıktaki dalgalanmalar ve nöromüsküler bloke edici ajanların kullanımı gibi durumlar, NMJ iletim değişkenliğinin artması ve NMJ yetmezliği2 oluşumu ile kendini gösteren NMJ iletiminde eksikliklere neden olabilir.
SFEMG'yi kaydetmek için iki yaklaşım vardır: uyarılmış ve gönüllü SFEMG. Gönüllü SFEMG, istemli aktivasyon7 sırasında test edilen kasın içine yerleştirilen konsantrik bir iğne elektrot kullanılarak aynı motor akson tarafından sağlanan iki NMJ'den SFAP'lerin kaydedilmesini içerir. Buna göre, gönüllü SFEMG, denek tarafından işbirliği gerektirir ve yalnızca düşük eşikli motor üniteleri (zayıf kasılmalar sırasında aktive olanlar) değerlendirebilir3. Uyarılmış SFEMG, test edilen kas içine yerleştirilen bir SFEMG iğne elektrotu ile SFAP'leri kaydederken motor aksonları uyarmak için bir çift uyarıcı elektrot kullanır7.
Hem gönüllü hem de uyarılmış SFEMG'de, titreme ve blokaj, NMJ iletimini değerlendirmek ve ölçmek için kullanılan iki parametredir8. Jitter, ardışık SFAP'ler arasındaki zamanlama (gecikme) değişkenliğini tanımlar. Gönüllü SFEMG sırasında, titreme, 50 ila 100 ardışık deşarj sırasında bir çift SFAP (aynı motor akson tarafından sağlanır) arasındaki gecikme farklarının değerlendirilmesiyle ölçülür. Uyarılmış SFEMG sırasında, titreme, 50 ila 100 ardışık deşarj sırasında stimülasyon zamanlaması ile SFAP'nin başlangıcı arasındaki gecikme farkları değerlendirilerek ölçülür. Engelleme, NMJ iletiminin bir SFAP yanıtını tetiklemedeki başarısızlığını gösterir ve gönüllü SFEMG sırasında veya uyarılmış SFEMG2,7 sırasında her bir NMJ için her bir SFAP çiftinin varlığı veya yokluğu olarak ölçülebilir.
Klinik ortamda yerleşik ve hassas bir test olmasına rağmen, SFEMG klinik öncesi araştırmalarda nadiren uygulanmaktadır 4,5,9,10,11,12,13,14,15,16,17,18 . Bu raporda, klinik öncesi kemirgen modellerinde SFEMG kayıtlarının gerçekleştirilmesi ve analiz edilmesine yönelik yaklaşımın ana hatlarını çiziyoruz. Ayrıca, depolarize olmayan bir nöromüsküler bloke edici ajan olan roküronyumun uygulanmasını takiben NMJ iletiminin bozulmasını gösteren SFEMG ile ilgili temsili bulguları vurgulayan temsili veriler sunuyoruz.
Protokol
Tüm protokoller, Missouri Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından belirlenen düzenlemelere uygun olarak onaylandı ve uygulandı.
1. Hayvan hazırlama ve anestezi uygulaması
- Uygun kişisel koruma ekipmanı giyin.
- İşlemden önce, kilo bazlı ilaçlar ve ventilatör ayarları için uygun dozu belirlemek için farenin ağırlığını ölçün.
- % 3 -% 5 inhale izofluran ile anesteziyi indükleyin. Yeterli bir anestezi seviyesi oluşturulduktan sonra, fareyi yüzüstü pozisyonda konumlandırın ve% 1 -% 3 inhale izofluran ile anesteziyi sürdürün.
- Geri çekilme yanıtının olmadığını gözlemlemek için arka bacak ayak pedine forseps ile hafifçe bastırarak anestezi derinliğinin yeterliliğini doğrulayın.
- Vücut ısısını 37 °C'de tutun.
- Kuruluğu önlemek için gözlere veteriner onaylı petrol bazlı merhem sürün. Forseps kullanarak ayak pedine baskı uygularken solunum hızını gözlemleyerek ve geri çekilme tepkilerini değerlendirerek anestezi derinliğini izleyin.
- Değerlendirilecek arka ayağı makas kullanarak tıraş edin. Yeterli epilasyondan sonra, yapışkan bant kullanarak, çalışılacak uzuvu, ayak bileği yaklaşık 90° dorsifleksiyonda sabitlenmiş, diz ekstansiyonda ve kalça abdüksiyonda olacak şekilde konumlandırın.
- Tüm deney boyunca farenin solunumunu ve kalp atış hızını sürekli olarak izleyin.
NOT: Kalp atış hızındaki artış, yetersiz anestezik derinliğin bir göstergesi olarak yaygın olarak kullanılır. - Solunum en az 3 dakika durana kadar,% 5 veya daha yüksek bir dozla sıçanı ötenazi yapmak için izofluran uygulayın. Ötenaziyi dekapitasyon ile onaylayın.
2. Elektrot yerleşimi ve kurulumu
NOT: Siyatik sinir ve gastroknemius kasının NMJ iletimi elektromiyografi (EMG) sistemi kullanılarak değerlendirilir. Malzeme tablosuna bakın.
- Siyatik siniri katot ile proksimal arka bacak bölgesine uyarmak için bir çift yalıtılmış 28 G monopolar iğne yerleştirin, anot ise sakrumu kaplayan deri altı dokusu içinde daha proksimal olarak bulunur.
- Siyatik sinire veya diğer bitişik yapılara doğrudan zarar vermemek için uyarıcı elektrotların siyatik sinirin hemen yakınına veya aşırı derine yerleştirilmediğinden emin olun.
- Kontralateral arka bacak veya kuyruğa tek kullanımlık bir toprak elektrodu yerleştirin.
- Tek lifli EMG için özel olarak tasarlanmış, platin-iridyum malzemeden yapılmış bir kayıt yüzeyine sahip 27 gauge, 25 mm'lik bir iğne elektrodu sağ gastroknemius kasına dikkatlice yerleştirin. Steriliteyi korumak için SFEMG elektrotlarının her kullanımdan önce otoklavlandığından emin olun.
- Tek lif aksiyon potansiyellerini (SFAP'ler) yakalamak için SFEMG iğne elektrodunu gastroknemius kas liflerine paralel olarak yerleştirin.
- SFEMG iğnesini kas içine sokarken ve manevra yaparken kas hasarından kaçının.
3. Uyarılmış tek lifli elektromiyografi (SFEMG) prosedürü
- Sağ siyatik sinire 0.3-10 mA yoğunluk aralığı ve 0.1 ms darbe süresi kullanarak 10 Hz frekansında sabit akım stimülasyonu uygulayın.
- Filtre ayarlarını 1 kHz'lik düşük frekans filtresinde ve 10 kHz'lik yüksek frekans filtresinde yapılandırın. Potansiyellerin görselleştirilmesini kolaylaştırmak için Kazancı bölme başına 200 μV ila 1000 μV arasında ayarlayın. Süpürme hızını bölme başına 500 μs'ye ayarlayın.
- Kayıt ve sonraki analiz için SFAP'leri tetiklemek ve izole etmek için uyaran yoğunluğunu ayarlayın.
- Bir yanıtı SFAP olarak tanımlamak ve analiz etmek için aşağıda belirtilen belirli kriterlerin karşılandığından emin olun: Başlangıç zirvesinden negatif faza yükselme süresinin 500 μs'den az olduğundan, minimum genliğin (temel tepe noktasından negatife) en az 200 μV olduğundan ve yanıtın sürekli olarak ya hep ya hiç davranışı (yanıtlar arasında kararlı boyut ve şekil) sergilediğinden emin olun.
NOT: Yinelenen yanıtların, herhangi bir çentik veya bükülme noktası olmadan tutarlı yukarı doğru aşamalar sergilemesi önemlidir. Kaliteli bir sinyali birden çok sinyalin toplamından ayırt etmek için son kriterin çok önemli olduğunu unutmayın.
- Bir yanıtı SFAP olarak tanımlamak ve analiz etmek için aşağıda belirtilen belirli kriterlerin karşılandığından emin olun: Başlangıç zirvesinden negatif faza yükselme süresinin 500 μs'den az olduğundan, minimum genliğin (temel tepe noktasından negatife) en az 200 μV olduğundan ve yanıtın sürekli olarak ya hep ya hiç davranışı (yanıtlar arasında kararlı boyut ve şekil) sergilediğinden emin olun.
- En az 50 stimülasyonun (50-100 stimülasyon) ardından ardışık deşarjlar arasındaki Jitter'ı veya SFAP gecikmesinin değişkenliğini (SFAP'nin negatif zirvesinin yükselen fazı arasındaki süre) hesaplayın ve blokajı değerlendirin ve ölçün.
NOT: Blokaj, her sinapsta varlığı veya yokluğu veya tek lif aksiyon potansiyeli oluşumunu tetikleyemeyen stimülasyonların yüzdesi olarak değerlendirilebilir. Jitter, aşağıdaki denklem7 kullanılarak hesaplanır (Jitter tipik olarak klinik elektromiyografi sistemleri tarafından otomatik olarak hesaplanır):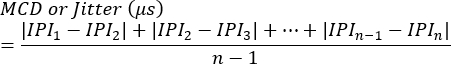
MCD = Ardışık Farkın Ortalama Değeri
IPI = Potansiyeller Arası Aralık - Ek SFAP yanıtları için işlemi tekrarlayın. Ortalama olarak, titreşimi hesaplamak için her hayvandan 10 sinaps değerlendirin ve ardından hayvan başına ortalama değerleri belirleyin.
- Doğrudan kas stimülasyonu ile uyarılmış olabilecek potansiyellerin dahil edilmesini önlemek için 4 μs'den daha az titreşimli SFAP'leri analizlerden hariç tutun11.
- Aralıklı blokaj gösteren potansiyelleri kaydederken, SFAP arızasının submaksimal stimülasyona atfedilemediğini doğrulamak için uyaran yoğunluğunu artırın.
Sonuçlar
NMJ iletim arızası bağlamında artan jitter ve blokajı göstermek için, intravenöz roküronyum uygulaması ile ve intravenöz uygulama olmadan uyarılmış SFEMG gerçekleştirildi. Roküronyum, ameliyatlar veya tıbbi prosedürler sırasında kas felcini indüklemek için klinik ortamlarda yaygın olarak kullanılan, orta etkili, depolarize olmayan bir nöromüsküler bloke edici ajandır. NMJ19'daki nikotinik asetilkolin reseptörlerine rekabetçi bir şek...
Tartışmalar
SFEMG, NMJ hastalığının otoimmün, edinilmiş ve genetik formlarından şüphelenilen hastalarda tanısal testler için yaygın olarak kullanılır. SFEMG, NMJ bozukluğu, myastenia gravis20,21'in tanısı için en hassas test olarak kabul edilir. Tekrarlayan sinir stimülasyonu (RNS), klinik tanı testlerinde daha yaygın olarak kullanılan ve bir periferik sinirin bir dizi uyaranla uyarılmasını ve innerve kasın toplam b...
Açıklamalar
W. David Arnold, NMD Pharma ve Avidity Biosciences'tan araştırma fonu aldı ve NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics ve Catalyst Pharmaceuticals için danışmanlık yapıyor.
Teşekkürler
Yazarlar, roküronyum dozu konusundaki değerli tavsiyeleri için NMD Pharma'dan Dr. Martin Brandhøj Skov'a ve hesaplamalardaki yardımları için Stony Brook Üniversitesi Biyomedikal Mühendisliği Bölümü'nden Arash Karimi'ye teşekkür eder. Bu çalışma kısmen NIH'den WDA'ya (R01AG067758 ve R01AG078129) sağlanan fonlarla desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Referanslar
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır