JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
설치류 모델에서 신경근 접합 전달을 평가하기 위한 자극 단일 섬유 근전도(SFEMG)
요약
이 연구에서는 설치류 모델에서 신경근 접합부(NMJ) 전달의 생체 내 측정을 가능하게 하는 정교한 단일 섬유 근전도(SFEMG) 프로토콜을 시연합니다. 쥐 비복근의 NMJ 전달 변동성 및 실패를 정량화할 수 있도록 SFEMG 기술에 대한 단계별 접근 방식이 설명되어 있습니다.
초록
신경계와 근육 사이의 최종 연결인 신경근 접합부(NMJ)에서의 전달은 정상적인 운동 기능에 매우 중요합니다. 단일 섬유 근전도(SFEMG)는 NMJ 전달을 평가하기 위해 자발적 수축 또는 신경 자극 중 단일 근섬유 활동 전위 반응을 측정하는 임상적으로 관련성이 있고 민감한 기술입니다. NMJ 전송의 평가 및 정량화에는 지터와 차단의 두 가지 매개변수가 포함됩니다. 지터는 연속적인 SFAP(Single-Fiber Action Potential) 간의 타이밍(대기 시간)의 변동성을 나타냅니다. 차단은 NMJ 전송이 SFAP 응답을 시작하지 못했음을 의미합니다. SFEMG는 임상 환경에서 잘 정립되고 민감한 검사이지만 전임상 연구에서의 적용은 상대적으로 드뭅니다. 이 보고서는 설치류 모델에서 지터 및 차단을 정량화하기 위해 자극 SFEMG를 수행하는 데 사용되는 단계와 기준을 간략하게 설명합니다. 이 기법은 전임상 및 임상 연구에서 건강, 노화 및 질병의 맥락에서 NMJ 기능에 대한 통찰력을 얻는 데 사용할 수 있습니다.
서문
단일 섬유 근전도(SFEMG)는 1960년대에 Stålberg와 Ekstedt에 의해 주로 근육 피로를 연구하기 위해 개별 근육 섬유의 활동 전위를 식별하고 분석하기 위해 처음 개발되었습니다1. SFEMG는 신경근 접합부(NMJ) 전달을 평가하기 위한 가장 민감한 임상 기법입니다2. SFEMG는 단일 광섬유 활동 전위(SFAP)3를 선택적으로 기록하여 수행됩니다. NMJ 전염은 노화4,5와 같은 요인과 중증 근무력증 및 근위축성 측삭경화증6과 같은 다양한 신경근 질환으로 인해 손상될 수 있다. 또한, 허혈, 온도 변동 및 신경근 차단제의 사용과 같은 조건은 NMJ 전달 변동성 증가 및 NMJ 실패의 발생으로 나타나는 NMJ 전달의 결함을 초래할 수 있습니다2.
SFEMG를 기록하는 방법에는 자극 SFEMG와 자발적 SFEMG의 두 가지 방법이 있습니다. 자발적 SFEMG는 자발적 활성화7 동안 테스트 중인 근육에 삽입된 동심원 바늘 전극을 사용하여 동일한 운동 축삭에 의해 공급되는 두 개의 NMJ로부터 SFAP를 기록하는 것을 포함한다. 따라서 자발적 SFEMG는 피험자의 협력이 필요하며 역치가 낮은 운동 단위(약한 수축 중에 활성화되는 단위)만 평가할 수 있습니다3. 자극된 SFEMG는 한 쌍의 자극 전극을 사용하여 운동 축삭을 자극하는 동시에 테스트 중인 근육에 삽입된 SFEMG 바늘 전극으로 SFAP를 기록합니다7.
자발적 SFEMG와 자극 SFEMG 모두에서 지터와 차단은 NMJ 전송을 평가하고 정량화하는 데 사용되는 두 가지 매개변수입니다8. 지터는 연속적인 SFAP 간의 타이밍(대기 시간)의 가변성을 설명합니다. 자발적 SFEMG 동안 지터는 50-100회 연속 방전 중 한 쌍의 SFAP(동일한 모터 축삭에 의해 공급됨) 간의 대기 시간 차이를 평가하여 정량화됩니다. 자극된 SFEMG 동안, 지터는 50-100회 연속 방전 동안 자극 타이밍과 SFAP 시작 사이의 지연 시간 차이를 평가하여 정량화됩니다. 차단은 NMJ 전송이 SFAP 응답을 트리거하지 못하는 것을 의미하며, 자발적 SFEMG 동안 또는 자극된 SFEMG 2,7 동안 각 NMJ에 대한 각 SFAP 쌍의 존재 또는 부재로 정량화할 수 있습니다.
SFEMG는 임상 환경에서 확립되고 민감한 검사이지만 전임상 연구에서는 드물게 적용되었습니다 4,5,9,10,11,12,13,14,15,16,17,18 . 이 보고서에서는 전임상 설치류 모델에서 SFEMG 기록을 수행하고 분석하는 접근 방식을 간략하게 설명합니다. 또한, 비탈분극 신경근 차단제인 로쿠로늄(rocuronium) 투여 후 NMJ 전달의 손상을 나타내는 SFEMG의 대표적인 결과를 강조하는 대표적인 데이터를 제시합니다.
프로토콜
모든 프로토콜은 미주리 대학교의 기관 동물 보호 및 사용 위원회(Institutional Animal Care and Use Committee)에서 정한 규정에 따라 승인되고 수행되었습니다.
1. 동물 준비 및 마취 투여
- 적절한 개인 보호 장비를 착용하십시오.
- 시술 전에 쥐의 체중을 측정하여 체중 기반 약물 및 인공호흡기 설정에 적합한 복용량을 결정하십시오.
- 3%-5% 흡입 이소플루란으로 마취를 유도합니다. 적절한 수준의 마취가 이루어지면 쥐를 엎드린 자세로 놓고 1%-3% 흡입 이소플루란으로 마취를 유지합니다.
- 뒷다리 발패드를 집게로 부드럽게 눌러 금단 반응이 없는지 관찰하여 마취 깊이의 적절성을 확인합니다.
- 체온을 37 °C로 유지하십시오.
- 수의사가 승인한 석유 성분의 연고를 눈에 바르면 눈이 건조해지는 것을 방지할 수 있습니다. 호흡수를 관찰하고 집게를 사용하여 발패드에 압력을 가할 때 금단 반응을 평가하여 마취 깊이를 모니터링합니다.
- 이발기를 사용하여 평가할 뒷다리를 면도합니다. 제모를 충분히 한 후 접착 테이프를 사용하여 발목을 약 90° 배측굴곡으로, 무릎을 펴고, 엉덩이를 외전으로 고정하여 연구할 팔다리를 배치합니다.
- 전체 실험 동안 쥐의 호흡과 심박수를 지속적으로 모니터링합니다.
알림: 심박수의 증가는 일반적으로 부적절한 마취 깊이의 지표로 사용됩니다. - 최소 3분 동안 호흡이 멈출 때까지 5% 이상의 용량으로 쥐를 안락사시키기 위해 이소플루란을 투여합니다. 참수로 안락사를 확정한다.
2. 전극 배치 및 설정
참고: 좌골 신경과 비복근의 NMJ 전달은 근전도(EMG) 시스템을 사용하여 평가됩니다. 재료 표를 참조하십시오.
- 음극이 있는 좌골 신경을 근위 뒷다리 영역으로 자극하기 위해 절연된 28G 단극 바늘 한 쌍을 삽입하고, 양극은 천골을 덮고 있는 피하 조직 내에 더 근접하게 있습니다.
- 좌골 신경이나 기타 인접 구조물에 직접적인 해를 입히지 않도록 자극 전극이 좌골 신경에 바로 근접하거나 과도하게 깊게 배치되지 않도록 하십시오.
- 반대쪽 뒷다리 또는 꼬리에 일회용 접지 전극을 놓습니다.
- 백금-이리듐 소재로 만들어진 기록 표면이 있는 단일 섬유 EMG용으로 특별히 설계된 27게이지, 25mm 바늘 전극을 오른쪽 비복근에 조심스럽게 배치합니다. 멸균 상태를 유지하기 위해 매번 사용하기 전에 SFEMG 전극을 고압멸균해야 합니다.
- SFEMG 바늘 전극을 비복근 섬유와 평행하게 삽입하여 단일 섬유 활동 전위(SFAP)를 캡처합니다.
- 근육 내에 SFEMG 바늘을 삽입하고 조작하는 동안 근육 손상을 피하십시오.
3. 자극 단일 섬유 근전도(SFEMG) 절차
- 0.3-10mA의 강도 범위와 0.1ms의 펄스 지속 시간을 사용하여 10Hz 주파수로 오른쪽 좌골 신경에 정전류 자극을 적용합니다.
- 1kHz의 저주파 필터와 10kHz의 고주파 필터 내에서 필터 설정을 구성합니다. 전위의 시각화를 용이하게 하기 위해 분할당 200 μV에서 1000 μV로 이득을 조정합니다. 스윕 속도를 분할당 500μs로 설정합니다.
- 자극 강도를 조정하여 기록 및 후속 분석을 위해 SFAP를 트리거하고 격리합니다.
- 응답을 SFAP로 식별하고 분석하려면 아래에 언급된 특정 기준이 충족되는지 확인하십시오. 기준선 피크에서 음의 위상까지의 상승 시간이 500μs 미만이고, 최소 진폭(기준선 피크에서 음수까지)이 200μV 이상이며, 응답이 일관되게 전부 또는 전무 동작(응답 간의 안정적인 크기 및 모양)을 나타내는지 확인합니다.
참고: 반복되는 응답은 노치나 변곡점 없이 일관된 상승 단계를 나타내는 것이 중요합니다. 마지막 기준은 여러 신호의 합과 품질 신호를 구별하는 데 중요합니다.
- 응답을 SFAP로 식별하고 분석하려면 아래에 언급된 특정 기준이 충족되는지 확인하십시오. 기준선 피크에서 음의 위상까지의 상승 시간이 500μs 미만이고, 최소 진폭(기준선 피크에서 음수까지)이 200μV 이상이며, 응답이 일관되게 전부 또는 전무 동작(응답 간의 안정적인 크기 및 모양)을 나타내는지 확인합니다.
- 최소 50번의 자극(50-100번의 자극) 후 연속 방전 사이의 SFAP 대기 시간(SFAP의 음의 피크 자극과 상승 단계 사이의 시간) 지터 또는 변동성을 계산하고 차단을 평가 및 정량화합니다.
참고: 차단은 각 시냅스의 존재 또는 부재 또는 단일 섬유 활동 전위 생성을 트리거하지 못하는 자극의 백분율로 평가할 수 있습니다. 지터는 다음 방정식7 을 사용하여 계산됩니다(지터는 일반적으로 클리닉 근전도 시스템에 의해 자동으로 계산됨).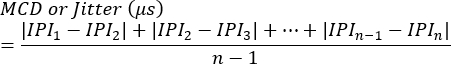
MCD = 연속 차이의 평균값
IPI = 전위 간격 - 추가 SFAP 응답에 대해 프로세스를 반복합니다. 평균적으로 각 동물에서 10개의 시냅스를 평가하여 지터를 계산한 다음 동물당 평균값을 결정합니다.
- 직접적인 근육 자극에 의해 유발되었을 수 있는 전위가 포함되지 않도록 하기 위해 지터가 4μs 미만인 SFAP를 분석에서 제외한다11.
- 간헐적 차단을 나타내는 전위를 기록할 때 자극 강도를 높여 SFAP 실패가 최대값 이하의 자극에 기인하지 않는지 확인합니다.
결과
NMJ 전송 실패의 맥락에서 증가된 지터 및 차단을 입증하기 위해, 자극 SFEMG는 로쿠로늄의 정맥 투여 유무에 관계없이 수행되었습니다. 로쿠로늄(Rocuronium)은 수술 또는 의료 시술 중 근육 마비를 유발하기 위해 임상 환경에서 널리 사용되는 중간 작용, 비분극 신경근 차단제입니다. NMJ19에서 니코틴성 아세틸콜린 수용체에 경쟁적으로 결합하여 작동합니다...
토론
SFEMG는 NMJ 질환의 자가면역, 후천성 및 유전적 형태가 의심되는 환자의 진단 검사에 일반적으로 사용됩니다. SFEMG는 NMJ 장애, 중증 근무력증20,21의 진단을 위한 가장 민감한 검사로 간주됩니다. 반복 신경 자극 (RNS)은 임상 진단 검사에서 더 일반적으로 사용되는 또 다른 방법이며, 자극의 훈련으로 말초 신경을 자극하고 신경 자?...
공개
W. David Arnold는 NMD Pharma 및 Avidity Biosciences로부터 연구 자금을 지원받았으며 NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics 및 Catalyst Pharmaceuticals에 컨설팅을 제공하고 있습니다.
감사의 말
저자들은 로쿠로늄 투여에 대한 귀중한 조언을 해준 NMD Pharma의 Martin Brandhøj Skov 박사와 계산에 도움을 준 Stony Brook University 생물의학공학과의 Arash Karimi에게 감사의 뜻을 전합니다. 이 연구는 NIH에서 WDA(R01AG067758 및 R01AG078129)에 대한 자금 지원으로 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
참고문헌
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유