Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Stimulierte Einzelfaser-Elektromyographie (SFEMG) zur Beurteilung der Übertragung neuromuskulärer Verbindungen in Nagetiermodellen
In diesem Artikel
Zusammenfassung
In dieser Studie demonstrieren wir ein verfeinertes Single Fiber Electromyography (SFEMG)-Protokoll, um in vivo die Übertragung der neuromuskulären Verbindung (NMJ) in Nagetiermodellen zu messen. Es wird ein schrittweiser Ansatz für die SFEMG-Technik beschrieben, um die Quantifizierung der NMJ-Übertragungsvariabilität und des NMJ-Transmissionsversagens im Gastrocnemius-Muskel der Ratte zu ermöglichen.
Zusammenfassung
Als letzte Verbindung zwischen dem Nervensystem und den Muskeln ist die Übertragung an der neuromuskulären Verbindung (NMJ) entscheidend für die normale motorische Funktion. Die Einzelfaser-Elektromyographie (SFEMG) ist eine klinisch relevante und empfindliche Technik, die die Reaktionen des Aktionspotentials einzelner Muskelfasern während willkürlicher Kontraktionen oder Nervenstimulationen misst, um die NMJ-Übertragung zu beurteilen. Die Bewertung und Quantifizierung der NMJ-Übertragung umfasst zwei Parameter: Jitter und Blocking. Jitter bezieht sich auf die Variabilität des Timings (Latenz) zwischen aufeinanderfolgenden Einzelfaser-Aktionspotentialen (SFAPs). Blockieren bedeutet, dass die NMJ-Übertragung keine SFAP-Antwort initiieren kann. Obwohl SFEMG ein gut etablierter und sensitiver Test im klinischen Umfeld ist, ist seine Anwendung in der präklinischen Forschung bisher relativ selten. Dieser Bericht beschreibt die Schritte und Kriterien, die bei der Durchführung von stimuliertem SFEMG zur Quantifizierung von Jitter und Blockierung in Nagetiermodellen angewendet werden. Diese Technik kann in präklinischen und klinischen Studien eingesetzt werden, um Einblicke in die NMJ-Funktion im Kontext von Gesundheit, Altern und Krankheit zu gewinnen.
Einleitung
Die Einzelfaser-Elektromyographie (SFEMG) wurde ursprünglich in den 1960er Jahren von Stålberg und Ekstedt entwickelt, um Aktionspotentiale von einzelnen Muskelfasern zu identifizieren und zu analysieren, vor allem zur Untersuchung der Muskelermüdung1. SFEMG ist die sensitivste klinische Technik zur Beurteilung der Übertragung der neuromuskulären Verbindung (NMJ)2. Die SFEMG wird durch selektive Aufzeichnung von Einzelfaser-Aktionspotentialen (SFAPs) durchgeführt3. Die NMJ-Übertragung kann aufgrund von Faktoren wie dem Altern 4,5 und verschiedenen neuromuskulären Erkrankungen wie Myasthenia gravis und amyotropher Lateralsklerose beeinträchtigt sein6. Darüber hinaus können Erkrankungen wie Ischämie, Temperaturschwankungen und die Verwendung von neuromuskulären Blockern zu Mängeln in der NMJ-Übertragung führen, die sich in einer erhöhten NMJ-Übertragungsvariabilität und dem Auftreten von NMJ-Versagen äußern2.
Für die Erfassung von SFEMG gibt es zwei Ansätze: stimulierte und freiwillige SFEMG. Bei der freiwilligen SFEMG werden SFAPs von zwei NMJs aufgezeichnet, die vom selben motorischen Axon versorgt werden, wobei eine konzentrische Nadelelektrode verwendet wird, die in den zu testenden Muskel während der freiwilligen Aktivierung eingeführt wird7. Dementsprechend erfordert die freiwillige SFEMG die Mitarbeit des Probanden und kann nur niedrigschwellige motorische Einheiten (die während schwacher Kontraktionen aktiviert werden) beurteilen3. Stimulierte SFEMG verwendet ein Paar stimulierender Elektroden, um motorische Axone zu stimulieren, während SFAPs mit einer SFEMG-Nadelelektrode aufgezeichnet werden, die in den zu testenden Muskel eingeführt wird7.
Sowohl bei der freiwilligen als auch bei der stimulierten SFEMG sind Jitter und Blocking die beiden Parameter, die zur Beurteilung und Quantifizierung der NMJ-Übertragung herangezogen werden8. Jitter beschreibt die Variabilität im Timing (Latenz) zwischen aufeinanderfolgenden SFAPs. Während des freiwilligen SFEMG wird der Jitter quantifiziert, indem die Latenzunterschiede zwischen einem Paar von SFAPs (die vom selben motorischen Axon geliefert werden) während 50 bis 100 aufeinanderfolgender Entladungen bewertet werden. Während der stimulierten SFEMG wird der Jitter quantifiziert, indem die Latenzunterschiede zwischen dem Stimulationszeitpunkt und dem Beginn des SFAP während 50 bis 100 aufeinanderfolgender Entladungen bewertet werden. Die Blockierung zeigt an, dass die NMJ-Übertragung nicht in der Lage ist, eine SFAP-Reaktion auszulösen, und kann als das Vorhandensein oder Fehlen jedes SFAP-Paares während der freiwilligen SFEMG oder für jedes NMJ während der stimulierten SFEMGquantifiziert werden 2,7.
Obwohl SFEMG im klinischen Umfeld ein etablierter und sensitiver Test ist, wurde er in der präklinischen Forschung nur selten angewendet 4,5,9,10,11,12,13,14,15,16,17,18 . In diesem Bericht skizzieren wir den Ansatz zur Durchführung und Analyse von SFEMG-Aufzeichnungen in präklinischen Nagetiermodellen. Darüber hinaus präsentieren wir repräsentative Daten, die repräsentative Befunde zu SFEMG hervorheben, die auf eine Beeinträchtigung der NMJ-Übertragung nach Verabreichung eines nicht-depolarisierenden neuromuskulären Blockers, Rocuronium, hinweisen.
Protokoll
Alle Protokolle wurden genehmigt und in Übereinstimmung mit den Vorschriften des Institutional Animal Care and Use Committee an der University of Missouri durchgeführt.
1. Vorbereitung der Tiere und Verabreichung der Anästhesie
- Ziehen Sie geeignete persönliche Schutzausrüstung an.
- Messen Sie vor dem Eingriff das Gewicht der Ratte, um die geeignete Dosis für gewichtsbasierte Medikamente und Beatmungsgeräteeinstellungen zu bestimmen.
- Induzieren Sie eine Anästhesie mit 3%-5% inhaliertem Isofluran. Sobald ein angemessenes Anästhesieniveau erreicht ist, positionieren Sie die Ratte in Bauchlage und halten Sie die Narkose mit 1 % bis 3 % inhaliertem Isofluran aufrecht.
- Überprüfen Sie die Angemessenheit der Anästhesietiefe, indem Sie vorsichtig mit einer Zange auf das Fußpolster der Hintergliedmaßen drücken, um das Fehlen einer Entzugsreaktion zu beobachten.
- Halten Sie die Körpertemperatur bei 37 °C.
- Tragen Sie eine vom Tierarzt zugelassene Salbe auf Erdölbasis auf die Augen auf, um Trockenheit zu verhindern. Überwachen Sie die Narkosetiefe, indem Sie die Atemfrequenz beobachten und die Entzugsreaktionen beurteilen, wenn mit einer Pinzette Druck auf das Fußpolster ausgeübt wird.
- Rasieren Sie die zu beurteilende Hintergliedmaße mit einer Haarschneidemaschine. Positionieren Sie die zu untersuchende Extremität nach adäquater Haarentfernung mit Klebeband mit dem Knöchel in einem Winkel von etwa 90° Dorsalflexion, dem Knie in Streckung und der Hüfte in Abduktion.
- Überwachen Sie kontinuierlich die Atmung und die Herzfrequenz der Ratte während des gesamten Experiments.
HINWEIS: Ein Anstieg der Herzfrequenz wird häufig als Indikator für eine unzureichende Anästhesietiefe verwendet. - Verabreichen Sie Isofluran, um die Ratte einzuschläfern, mit einer Dosis von 5% oder mehr, bis die Atmung für mindestens 3 Minuten aufgehört hat. Bestätige die Euthanasie durch Enthauptung.
2. Platzierung und Einrichtung der Elektrode
HINWEIS: Die NMJ-Übertragung des Ischiasnervs und des Musculus gastrocnemius wird mit Hilfe des Elektromyographie-Systems (EMG) beurteilt. Weitere Informationen finden Sie in der Materialtabelle.
- Führen Sie ein Paar isolierte monopolare Nadeln 28 G zur Stimulation des Ischiasnervs mit der Kathode in den Bereich der proximalen Hintergliedmaße ein, während sich die Anode proximal innerhalb des Unterhautgewebes befindet, das das Kreuzbein überlagert.
- Stellen Sie sicher, dass die Stimulationselektroden nicht in unmittelbarer Nähe des Ischiasnervs oder zu tief platziert werden, um eine direkte Schädigung des Ischiasnervs oder anderer benachbarter Strukturen zu vermeiden.
- Platzieren Sie eine Einweg-Erdungselektrode an der kontralateralen Hintergliedmaße oder am Schwanz.
- Platzieren Sie eine 25-mm-Nadelelektrode mit 27 Gauge, die speziell für das Einzelfaser-EMG entwickelt wurde und über eine Aufzeichnungsoberfläche aus Platin-Iridium-Material verfügt, vorsichtig in den rechten Gastrocnemius-Muskel. Stellen Sie sicher, dass die SFEMG-Elektroden vor jedem Gebrauch autoklaviert werden, um die Sterilität zu erhalten.
- Führen Sie die SFEMG-Nadelelektrode parallel zu den Gastrocnemius-Muskelfasern ein, um Einzelfaser-Aktionspotentiale (SFAPs) zu erfassen.
- Vermeiden Sie Muskelschäden beim Einführen und Manövrieren der SFEMG-Nadel im Muskel.
3. Verfahren der stimulierten Einzelfaser-Elektromyographie (SFEMG)
- Wenden Sie eine Konstantstromstimulation auf den rechten Ischiasnerv bei einer Frequenz von 10 Hz mit einem Intensitätsbereich von 0,3-10 mA und einer Impulsdauer von 0,1 ms an.
- Konfigurieren Sie die Filtereinstellungen innerhalb eines Niederfrequenzfilters von 1 kHz und eines Hochfrequenzfilters von 10 kHz. Passen Sie die Verstärkung von 200 μV bis 1000 μV pro Teilung an, um die Visualisierung von Potentialen zu erleichtern. Stellen Sie die Sweep-Geschwindigkeit auf 500 μs pro Teilung ein.
- Passen Sie die Stimulusintensität an, um SFAPs auszulösen und für die Aufzeichnung und anschließende Analyse zu isolieren.
- Um eine Antwort als SFAP zu identifizieren und zu analysieren, stellen Sie sicher, dass die unten genannten spezifischen Kriterien erfüllt sind: Stellen Sie sicher, dass die Anstiegszeit von der Baseline-Spitze bis zur negativen Phase weniger als 500 μs beträgt, die minimale Amplitude (Baseline-Peak zu negativ) mindestens 200 μV beträgt und die Reaktion konsistent ein Alles-oder-Nichts-Verhalten aufweist (stabile Größe und Form zwischen den Antworten).
HINWEIS: Es ist wichtig, dass die wiederkehrenden Antworten konsistente Aufwärtsphasen ohne Kerben oder Wendepunkte aufweisen. Beachten Sie, dass das letzte Kriterium entscheidend ist, um ein Qualitätssignal von der Summierung mehrerer Signale zu unterscheiden.
- Um eine Antwort als SFAP zu identifizieren und zu analysieren, stellen Sie sicher, dass die unten genannten spezifischen Kriterien erfüllt sind: Stellen Sie sicher, dass die Anstiegszeit von der Baseline-Spitze bis zur negativen Phase weniger als 500 μs beträgt, die minimale Amplitude (Baseline-Peak zu negativ) mindestens 200 μV beträgt und die Reaktion konsistent ein Alles-oder-Nichts-Verhalten aufweist (stabile Größe und Form zwischen den Antworten).
- Berechnen Sie den Jitter oder die Variabilität der SFAP-Latenz (Zeit zwischen der Stimulation und der steigenden Phase des negativen SFAP-Spitzenwerts) zwischen aufeinanderfolgenden Entladungen nach mindestens 50 Stimulationen (50-100 Stimulationen) und beurteilen und quantifizieren Sie die Blockierung.
HINWEIS: Die Blockierung kann als das Vorhandensein oder Fehlen an jeder Synapse oder als Prozentsatz der Stimulationen beurteilt werden, die die Erzeugung eines Aktionspotentials für einzelne Fasern nicht auslösen. Der Jitter wird anhand der folgenden Gleichung7 berechnet (Jitter wird in der Regel automatisch von Elektromyographiesystemen in Kliniken berechnet):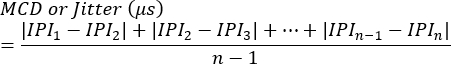
MCD = Mittelwert der konsekutiven Differenz
IPI = Interpotential-Intervall - Wiederholen Sie den Vorgang für weitere SFAP-Antworten. Bewerten Sie im Durchschnitt 10 Synapsen von jedem Tier, um den Jitter zu berechnen und anschließend die Durchschnittswerte pro Tier zu bestimmen.
- SFAPs mit einem Jitter von weniger als 4 μs sind aus den Analysen auszuschließen, um die Einbeziehung von Potenzialen zu verhindern, die durch direkte Muskelstimulation hervorgerufen worden sein könnten11.
- Wenn Sie Potentiale aufzeichnen, die eine intermittierende Blockierung aufweisen, erhöhen Sie die Stimulusintensität, um sicherzustellen, dass das SFAP-Versagen nicht auf eine submaximale Stimulation zurückzuführen ist.
Ergebnisse
Um einen erhöhten Jitter und eine erhöhte Blockierung im Zusammenhang mit einem NMJ-Übertragungsversagen zu demonstrieren, wurde eine stimulierte SFEMG mit und ohne intravenöse Verabreichung von Rocuronium durchgeführt. Rocuronium ist ein intermediär wirkendes, nicht depolarisierendes neuromuskuläres Blockierungsmittel, das in klinischen Umgebungen häufig verwendet wird, um Muskellähmungen bei Operationen oder medizinischen Eingriffen zu induzieren. Es wirkt, indem es kompetitiv...
Diskussion
SFEMG wird häufig für diagnostische Tests bei Patienten mit Verdacht auf autoimmune, erworbene und genetische Formen der NMJ-Erkrankung eingesetzt. SFEMG gilt als der sensitivste Test für die Diagnose der NMJ-Störung Myasthenia gravis20,21. Die repetitive Nervenstimulation (RNS) ist eine weitere Methode, die häufiger in der klinischen Diagnostik verwendet wird und die Stimulation eines peripheren Nervs mit einer Reihe von Re...
Offenlegungen
W. David Arnold erhielt Forschungsgelder von NMD Pharma und Avidity Biosciences und ist als Berater für NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics und Catalyst Pharmaceuticals tätig.
Danksagungen
Die Autoren danken Dr. Martin Brandhøj Skov von NMD Pharma für seine wertvollen Ratschläge zur Rocuronium-Dosierung und Arash Karimi vom Biomedical Engineering Department der Stony Brook University für seine Unterstützung bei den Berechnungen. Diese Studie wurde teilweise durch Mittel der NIH an die WDA (R01AG067758 und R01AG078129) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Referenzen
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten