Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Вынужденная электромиография с одним волокном (SFEMG) для оценки передачи нервно-мышечных соединений на моделях грызунов
В этой статье
Резюме
В этом исследовании мы демонстрируем усовершенствованный протокол одноволоконной электромиографии (SFEMG), позволяющий in vivo измерять передачу нервно-мышечного соединения (NMJ) на моделях грызунов. Описан пошаговый подход к методу SFEMG, позволяющий количественно оценить вариабельность и сбой передачи NMJ в икроножной мышце крысы.
Аннотация
Являясь конечным связующим звеном между нервной системой и мышцами, передача в нервно-мышечном соединении (НМЖ) имеет решающее значение для нормальной двигательной функции. Электромиография одного волокна (SFEMG) является клинически значимым и чувствительным методом, который измеряет потенциальные реакции одного мышечного волокна во время произвольных сокращений или стимуляции нервов для оценки передачи NMJ. Оценка и количественная оценка передачи NMJ включает в себя два параметра: джиттер и блокировку. Джиттер относится к изменчивости во времени (задержке) между последовательными потенциалами действия одного волокна (SFAP). Блокировка означает неспособность передачи NMJ инициировать ответ SFAP. Несмотря на то, что SFEMG является хорошо зарекомендовавшим себя и чувствительным тестом в клинических условиях, его применение в доклинических исследованиях было относительно редким. В этом отчете изложены шаги и критерии, используемые при выполнении стимулированного SFEMG для количественной оценки джиттера и блокировки в моделях грызунов. Этот метод может быть использован в доклинических и клинических исследованиях для получения представления о функции NMJ в контексте здоровья, старения и болезней.
Введение
Одноволоконная электромиография (SFEMG) была первоначально разработана Столбергом и Экстедтом в 1960-х годах для идентификации и анализа потенциалов действия отдельных мышечных волокон, в первую очередь для изучения мышечнойусталости. SFEMG является наиболее чувствительным клиническим методом для оценки передачи нервно-мышечного соединения (NMJ)2. SFEMG проводится путем селективной регистрации потенциалов действия одного волокна (SFAP)3. Передача NMJ может быть нарушена из-за таких факторов, как старение 4,5 и различные нервно-мышечные расстройства, такие как миастения и боковой амиотрофический склероз6. Кроме того, такие состояния, как ишемия, колебания температуры и использование нервно-мышечных блокаторов, могут привести к дефициту передачи NMJ, проявляющемуся в повышенной вариабельности передачи NMJ и возникновении неудачи NMJ2.
Существует два подхода к регистрации SFEMG: стимулированный и добровольный SFEMG. Добровольная SFEMG включает в себя регистрацию SFAP от двух NMJ, подаваемых одним и тем же моторным аксоном, с помощью концентрического игольчатого электрода, вводимого в исследуемую мышцу во время произвольной активации7. Соответственно, добровольная СФЭМГ требует сотрудничества со стороны испытуемого и может оценить только низкопороговые двигательные единицы (активизируемые при слабых сокращениях)3. Стимулированный SFEMG использует пару стимулирующих электродов для стимуляции моторных аксонов во время регистрации SFAP с помощью игольчатого электрода SFEMG, вставленного в исследуемую мышцу7.
Как в произвольном, так и в вынужденном SFEMG джиттер и блокировка являются двумя параметрами, используемыми для оценки и количественного определения передачи NMJ8. Джиттер описывает изменчивость во времени (задержке) между последовательными SFAP. Во время добровольного SFEMG джиттер количественно оценивается путем оценки разницы в латентности между парой SFAP (подаваемых одним и тем же моторным аксоном) в течение от 50 до 100 последовательных разрядов. Во время стимулированной SFEMG джиттер количественно оценивается путем оценки разницы в латентности между временем стимуляции и началом SFAP в течение от 50 до 100 последовательных разрядов. Блокировка указывает на неспособность передачи NMJ вызвать ответ SFAP, и ее можно количественно оценить как наличие или отсутствие каждой пары SFAP во время добровольного SFEMG или для каждого NMJ во время стимулированного SFEMG 2,7.
Несмотря на то, что SFEMG является признанным и чувствительным тестом в клинических условиях, он лишь изредка применяется в доклинических исследованиях 4,5,9,10,11,12,13,14,15,16,17,18 . В этом отчете мы описываем подход к выполнению и анализу записей SFEMG на доклинических моделях грызунов. Кроме того, мы представляем репрезентативные данные, которые подчеркивают репрезентативные данные по SFEMG, указывающие на ухудшение передачи NMJ после введения недеполяризующего нервно-мышечного блокатора, рокурония.
протокол
Все протоколы были утверждены и выполнены в соответствии с правилами, установленными Комитетом по уходу за животными и их использованию в Университете штата Миссури.
1. Подготовка животных и введение анестезии
- Наденьте соответствующие средства индивидуальной защиты.
- Перед процедурой измерьте вес крысы, чтобы определить подходящую дозу для лекарств с учетом веса и настроек аппарата искусственной вентиляции легких.
- Вызвать анестезию с помощью 3%-5% ингаляционного изофлурана. Как только будет установлен адекватный уровень анестезии, поместите крысу в положение лежа и поддерживайте анестезию с помощью 1%-3% ингаляционного изофлурана.
- Проверьте адекватность глубины анестезии, аккуратно надавливая щипцами на подушечку задней конечности для наблюдения за отсутствием реакции отмены.
- Поддерживайте температуру тела на уровне 37 °C.
- Наносите на глаза одобренную ветеринарами мазь на нефтяной основе, чтобы предотвратить сухость. Контролируйте глубину анестезии, наблюдая за частотой дыхания и оценивая реакцию отмены при надавливании на подушечку стопы с помощью щипцов.
- Побрейте оцениваемую заднюю конечность с помощью машинки для стрижки. После адекватного удаления волос с помощью клейкой ленты расположите исследуемую конечность так, чтобы лодыжка была зафиксирована под углом около 90° тыльного сгибания, колено было вытянуто, а бедро отведено.
- Непрерывно контролируйте дыхание и частоту сердечных сокращений крысы в течение всего эксперимента.
ПРИМЕЧАНИЕ: Увеличение частоты сердечных сокращений обычно используется в качестве индикатора недостаточной глубины анестезии. - Введите изофлуран для усыпления крысы в дозе 5% или более до тех пор, пока дыхание не прекратится по крайней мере на 3 минуты. Подтвердите эвтаназию обезглавливанием.
2. Установка и настройка электродов
ПРИМЕЧАНИЕ: Передача NMJ седалищного нерва и икроножной мышцы оценивается с помощью системы электромиографии (ЭМГ). Обратитесь к Таблице материалов.
- Введите пару изолированных монополярных игл 28 G для стимуляции седалищного нерва с катодом в область проксимального отдела задней конечности, при этом анод находится более проксимально в пределах подкожной клетчатки, перекрывающей крестец.
- Убедитесь, что стимулирующие электроды не расположены в непосредственной близости от седалищного нерва или слишком глубоко, чтобы избежать прямого повреждения седалищного нерва или других прилегающих структур.
- Поместите одноразовый заземляющий электрод на контралатеральную заднюю конечность или хвост.
- Осторожно поместите игольчатый электрод 27 калибра 25 мм, специально предназначенный для одноволоконной ЭМГ, с записывающей поверхностью из платино-иридиевого материала, в правую икроножную мышцу. Перед каждым использованием электроды SFEMG должны быть автоклавированы для поддержания стерильности.
- Введите игольчатый электрод SFEMG параллельно волокнам икроножной мышцы, чтобы захватить потенциалы действия одного волокна (SFAP).
- Избегайте повреждения мышц при введении и маневрировании иглой SFEMG внутри мышцы.
3. Процедура вынужденной одноволоконной электромиографии (SFEMG)
- Применяйте стимуляцию постоянным током к правому седалищному нерву с частотой 10 Гц, используя диапазон интенсивности 0,3-10 мА и длительность импульса 0,1 мс.
- Настройте параметры фильтра в пределах низкочастотного фильтра 1 кГц и высокочастотного фильтра 10 кГц. Отрегулируйте коэффициент усиления в диапазоне от 200 мкВ до 1000 мкВ на деление для упрощения визуализации потенциалов. Установите скорость развертки на уровне 500 μс на деление.
- Отрегулируйте интенсивность стимула для запуска и изоляции SFAP для записи и последующего анализа.
- Чтобы идентифицировать и проанализировать отклик в качестве SFAP, убедитесь, что выполняются конкретные критерии, упомянутые ниже: убедитесь, что время нарастания от базового пика до отрицательной фазы составляет менее 500 μс, минимальная амплитуда (от исходного пика до отрицательного) составляет не менее 200 μВ, а отклик постоянно демонстрирует поведение «все или ничего» (стабильный размер и форма между откликами).
Примечание: Важно, чтобы повторяющиеся реакции демонстрировали последовательные восходящие фазы без каких-либо зазубрин или точек перегиба. Обратите внимание, что последний критерий имеет решающее значение для отличия качественного сигнала от суммы нескольких сигналов.
- Чтобы идентифицировать и проанализировать отклик в качестве SFAP, убедитесь, что выполняются конкретные критерии, упомянутые ниже: убедитесь, что время нарастания от базового пика до отрицательной фазы составляет менее 500 μс, минимальная амплитуда (от исходного пика до отрицательного) составляет не менее 200 μВ, а отклик постоянно демонстрирует поведение «все или ничего» (стабильный размер и форма между откликами).
- Рассчитайте джиттер, или вариабельность задержки SFAP (время между стимуляцией и фазой нарастания отрицательного пика SFAP) между последовательными разрядами после не менее 50 стимуляций (50–100 стимуляций), а также оцените и количественно оцените блокировку.
Блокировка может быть оценена как наличие или отсутствие в каждом синапсе или как процент стимуляций, которые не запускают генерацию потенциала действия одного волокна. Джиттер рассчитывается с помощью следующего уравнения7 (Джиттер обычно автоматически рассчитывается клиническими электромиографическими системами):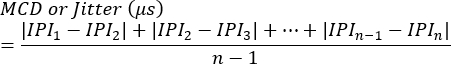
MCD = Среднее значение последовательной разницы
IPI = межпотенциальный интервал - Повторите этот процесс для получения дополнительных ответов SFAP. В среднем оцените 10 синапсов от каждого животного, чтобы рассчитать джиттер и впоследствии определить средние значения на животное.
- Исключите из анализа SFAP с дрожанием менее 4 μс, чтобы предотвратить включение потенциалов, которые могли быть вызваны прямой стимуляцией мышц11.
- При регистрации потенциалов, демонстрирующих прерывистую блокировку, увеличьте интенсивность стимула, чтобы убедиться, что неудача SFAP не связана с субмаксимальной стимуляцией.
Результаты
Чтобы продемонстрировать повышенное джиттер и блокировку в контексте сбоя передачи NMJ, стимулированное SFEMG проводили с внутривенным введением рокурония и без него. Рокуроний является недеполяризующим нервно-мышечным блокатором промежуточного действия, широко испо?...
Обсуждение
SFEMG обычно используется для диагностического тестирования у пациентов с подозрением на аутоиммунные, приобретенные и генетические формы заболевания NMJ. SFEMG считается наиболее чувствительным тестом для диагностики расстройства NMJ, миастении20,21
Раскрытие информации
У. Дэвид Арнольд получал финансирование на исследования от NMD Pharma и Avidity Biosciences и консультирует NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics и Catalyst Pharmaceuticals.
Благодарности
Авторы хотели бы поблагодарить доктора Мартина Брандхёя Скова из NMD Pharma за его ценные советы по дозированию рокурония и Араша Карими из факультета биомедицинской инженерии Университета Стоуни-Брук за помощь в расчетах. Это исследование было частично поддержано финансированием со стороны NIH для WDA (R01AG067758 и R01AG078129).
Материалы
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Ссылки
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены