Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Electromiografía de fibra única estimulada (SFEMG) para evaluar la transmisión de la unión neuromuscular en modelos de roedores
En este artículo
Resumen
En este estudio, demostramos un protocolo refinado de electromiografía de fibra única (SFEMG) para permitir la medición in vivo de la transmisión de la unión neuromuscular (NMJ) en modelos de roedores. Se describe un enfoque paso a paso de la técnica SFEMG para permitir la cuantificación de la variabilidad y el fracaso de la transmisión de NMJ en el músculo gastrocnemio de rata.
Resumen
Como conexión final entre el sistema nervioso y el músculo, la transmisión en la unión neuromuscular (NMJ) es crucial para la función motora normal. La electromiografía de fibra única (SFEMG) es una técnica clínicamente relevante y sensible que mide las respuestas potenciales de acción de una sola fibra muscular durante las contracciones voluntarias o las estimulaciones nerviosas para evaluar la transmisión de la NMJ. La evaluación y cuantificación de la transmisión de NMJ implica dos parámetros: fluctuación de fase y bloqueo. La fluctuación se refiere a la variabilidad en el tiempo (latencia) entre potenciales de acción consecutivos de una sola fibra (SFAP). El bloqueo significa el fracaso de la transmisión NMJ para iniciar una respuesta SFAP. Aunque el SFEMG es una prueba bien establecida y sensible en entornos clínicos, su aplicación en la investigación preclínica ha sido relativamente poco frecuente. Este informe describe los pasos y criterios empleados en la realización de SFEMG estimulado para cuantificar la fluctuación y el bloqueo en modelos de roedores. Esta técnica se puede utilizar en estudios preclínicos y clínicos para obtener información sobre la función de la NMJ en el contexto de la salud, el envejecimiento y la enfermedad.
Introducción
La electromiografía de fibra única (SFEMG) fue desarrollada inicialmente por Stålberg y Ekstedt en la década de 1960 para identificar y analizar los potenciales de acción de las fibras musculares individuales, principalmente para estudiar la fatigamuscular. El SFEMG es la técnica clínica más sensible para la evaluación de la transmisión de la unión neuromuscular (NMJ)2. El SFEMG se lleva a cabo mediante el registro selectivo de potenciales de acción de una sola fibra (SFAP)3. La transmisión de la NMJ puede verse comprometida debido a factores como el envejecimiento 4,5 y diversos trastornos neuromusculares como la miastenia gravis y la esclerosis lateral amiotrófica6. Además, condiciones como la isquemia, las fluctuaciones de temperatura y el uso de agentes bloqueantes neuromusculares pueden dar lugar a deficiencias en la transmisión de la NMJ, que se manifiestan por una mayor variabilidad de la transmisión de la NMJ y la aparición de fallos de la NMJ2.
Hay dos enfoques para registrar la SFEMG: la estimulada y la voluntaria. El SFEMG voluntario consiste en el registro de SFAPs de dos NMJs suministrados por el mismo axón motor utilizando un electrodo de aguja concéntrico insertado en el músculo que se está probando durante la activación voluntaria7. En consecuencia, el SFEMG voluntario requiere la cooperación del sujeto y solo puede evaluar unidades motoras de bajo umbral (las que se activan durante contracciones débiles)3. El SFEMG estimulado utiliza un par de electrodos estimulantes para estimular los axones motores mientras se registran los SFAP con un electrodo de aguja SFEMG insertado en el músculo que se está probando7.
Tanto en la SFEMG voluntaria como en la estimulada, la fluctuación de fase y el bloqueo son los dos parámetros utilizados para evaluar y cuantificar la transmisión de NMJ8. La fluctuación describe la variabilidad en el tiempo (latencia) entre SFAP consecutivos. Durante la SFEMG voluntaria, la fluctuación de fase se cuantifica evaluando las diferencias de latencia entre un par de SFAP (suministrados por el mismo axón motor) durante 50 a 100 descargas consecutivas. Durante la SFEMG estimulada, la fluctuación se cuantifica evaluando las diferencias de latencia entre el momento de la estimulación y el inicio del SFAP durante 50 a 100 descargas consecutivas. El bloqueo indica el fracaso de la transmisión de NMJ para desencadenar una respuesta SFAP, y se puede cuantificar como la presencia o ausencia de cada par de SFAP durante el SFEMG voluntario o para cada NMJ durante el SFEMG estimulado 2,7.
Si bien es una prueba establecida y sensible en el entorno clínico, la SFEMG solo se ha aplicado con poca frecuencia en la investigación preclínica 4,5,9,10,11,12,13,14,15,16,17,18 . En este informe, describimos el enfoque para realizar y analizar registros de SFEMG en modelos preclínicos de roedores. Además, presentamos datos representativos que destacan hallazgos representativos en SFEMG que indican un deterioro de la transmisión de NMJ después de la administración de un agente bloqueante neuromuscular no despolarizante, el rocuronio.
Protocolo
Todos los protocolos fueron aprobados y realizados de acuerdo con las regulaciones establecidas por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Missouri.
1. Preparación animal y administración de anestesia
- Póngase el equipo de protección personal adecuado.
- Antes del procedimiento, mida el peso de la rata para determinar la dosis adecuada para los medicamentos basados en el peso y la configuración del ventilador.
- Inducir la anestesia con isoflurano inhalado al 3%-5%. Una vez que se haya establecido un nivel adecuado de anestesia, coloque a la rata en posición prona y mantenga la anestesia con isoflurano inhalado al 1%-3%.
- Verifique la adecuación de la profundidad de la anestesia presionando suavemente la almohadilla del pie de la extremidad posterior con pinzas para observar la ausencia de una respuesta de retirada.
- Mantener la temperatura corporal a 37 °C.
- Aplique un ungüento a base de petróleo aprobado por un veterinario en los ojos para prevenir la sequedad. Controle la profundidad de la anestesia observando la frecuencia respiratoria y evaluando las respuestas de retirada al aplicar presión sobre la almohadilla para los pies con fórceps.
- Afeitar la extremidad trasera para ser evaluada con una maquinilla. Después de una depilación adecuada, con cinta adhesiva, coloque la extremidad a estudiar con el tobillo fijo a aproximadamente 90° de dorsiflexión, la rodilla en extensión y la cadera en abducción.
- Monitorea continuamente la respiración y la frecuencia cardíaca de la rata durante todo el experimento.
NOTA: Un aumento en la frecuencia cardíaca se usa comúnmente como un indicador de una profundidad anestésica inadecuada. - Administre isoflurano para eutanasiar a la rata, con una dosis de 5% o más, hasta que la respiración haya cesado durante al menos 3 minutos. Confirmar la eutanasia por decapitación.
2. Colocación y configuración de electrodos
NOTA: La transmisión de la NMJ del nervio ciático y el músculo gastrocnemio se evalúa mediante el sistema de electromiografía (EMG). Consulte la tabla de materiales.
- Inserte un par de agujas monopolares aisladas de 28 G para estimular el nervio ciático con el cátodo en la región de la extremidad posterior proximal, mientras que el ánodo está más proximalmente dentro del tejido subcutáneo que recubre el sacro.
- Asegúrese de que los electrodos estimulantes no estén colocados en proximidad inmediata del nervio ciático o excesivamente profundos para evitar daños directos al nervio ciático u otras estructuras adyacentes.
- Coloque un electrodo de tierra desechable en la extremidad posterior contralateral o en la cola.
- Coloque con cuidado un electrodo de aguja de 25 mm de calibre 27 diseñado específicamente para EMG de una sola fibra, con una superficie de grabación hecha de material de platino-iridio en el músculo gastrocnemio derecho. Asegúrese de que los electrodos SFEMG se corten en autoclave antes de cada uso para mantener la esterilidad.
- Inserte el electrodo de aguja SFEMG en paralelo con las fibras musculares gastrocnemias para capturar los potenciales de acción de una sola fibra (SFAP).
- Evite el daño muscular mientras inserta y maniobra la aguja SFEMG dentro del músculo.
3. Procedimiento de electromiografía de fibra única estimulada (SFEMG)
- Aplique estimulación de corriente constante al nervio ciático derecho a una frecuencia de 10 Hz utilizando un rango de intensidad de 0,3-10 mA y una duración de pulso de 0,1 ms.
- Configure los ajustes del filtro dentro de un filtro de baja frecuencia de 1 kHz y un filtro de alta frecuencia de 10 kHz. Ajuste la ganancia de 200 μV a 1000 μV por división para facilitar la visualización de los potenciales. Establezca la velocidad de barrido en 500 μs por división.
- Ajuste la intensidad del estímulo para activar y aislar los SFAP para su registro y posterior análisis.
- Para identificar y analizar una respuesta como SFAP, asegúrese de que se cumplan los criterios específicos que se mencionan a continuación: Asegúrese de que el tiempo de aumento desde el pico de referencia hasta la fase negativa sea inferior a 500 μs, que la amplitud mínima (pico de referencia a negativo) sea de al menos 200 μV y que la respuesta exhiba sistemáticamente un comportamiento de todo o nada (tamaño y forma estables entre las respuestas).
NOTA: Es esencial que las respuestas recurrentes exhiban fases ascendentes consistentes sin muescas ni puntos de inflexión. Tenga en cuenta que el último criterio es crucial para distinguir una señal de calidad de la suma de múltiples señales.
- Para identificar y analizar una respuesta como SFAP, asegúrese de que se cumplan los criterios específicos que se mencionan a continuación: Asegúrese de que el tiempo de aumento desde el pico de referencia hasta la fase negativa sea inferior a 500 μs, que la amplitud mínima (pico de referencia a negativo) sea de al menos 200 μV y que la respuesta exhiba sistemáticamente un comportamiento de todo o nada (tamaño y forma estables entre las respuestas).
- Calcular la fluctuación de fase o la variabilidad de la latencia de la SFAP (tiempo entre la estimulación y la fase ascendente del pico negativo de la SFAP) entre descargas consecutivas, después de al menos 50 estimulaciones (50-100 estimulaciones), y evaluar y cuantificar el bloqueo.
NOTA: El bloqueo puede evaluarse como la presencia o ausencia en cada sinapsis o como el porcentaje de estimulaciones que no logran desencadenar la generación de potencial de acción de una sola fibra. La fluctuación de fase se calcula utilizando la siguiente ecuación7 (la fluctuación de fase suele calcularse automáticamente mediante los sistemas de electromiografía clínica):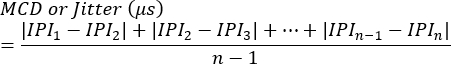
MCD = Valor medio de la diferencia consecutiva
IPI = Intervalo Interpotencial - Repita el proceso para obtener respuestas SFAP adicionales. En promedio, evalúe 10 sinapsis de cada animal para calcular el jitter y posteriormente determine los valores promedio por animal.
- Excluir de los análisis los SFAP con fluctuación de fase inferior a 4 μs para evitar la inclusión de potenciales que podrían haber sido evocados por la estimulación muscular directa11.
- Al registrar potenciales que muestran bloqueo intermitente, aumente la intensidad del estímulo para verificar que el fracaso del SFAP no sea atribuible a la estimulación submáxima.
Resultados
Para demostrar el aumento de la fluctuación de fase y el bloqueo en el contexto de la falla de la transmisión de NMJ, se realizó SFEMG estimulado con y sin administración intravenosa de rocuronio. El rocuronio es un agente bloqueante neuromuscular no despolarizante de acción intermedia ampliamente utilizado en entornos clínicos para inducir parálisis muscular durante cirugías o procedimientos médicos. Opera uniéndose competitivamente a los receptores nicotínicos de acetilcolin...
Discusión
El SFEMG se usa comúnmente para pruebas diagnósticas en pacientes con sospecha de formas autoinmunes, adquiridas y genéticas de la enfermedad NMJ. La SFEMG es considerada la prueba más sensible para el diagnóstico del trastorno de la NMJ, miastenia gravis20,21. La estimulación nerviosa repetitiva (RNS) es otro método que se utiliza con mayor frecuencia en las pruebas diagnósticas clínicas y consiste en estimular un nervi...
Divulgaciones
W. David Arnold recibió fondos de investigación de NMD Pharma y Avidity Biosciences y es consultor para NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics y Catalyst Pharmaceuticals.
Agradecimientos
Los autores desean agradecer al Dr. Martin Brandhøj Skov de NMD Pharma por sus valiosos consejos sobre la dosificación de rocuronio y a Arash Karimi del Departamento de Ingeniería Biomédica de la Universidad de Stony Brook por su ayuda en los cálculos. Este estudio fue financiado en parte por los NIH y la WDA (R01AG067758 y R01AG078129).
Materiales
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Referencias
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados