A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אלקטרומיוגרפיה מגורה של סיב יחיד (SFEMG) להערכת העברת צומת עצבית-שרירית במודלים של מכרסמים
In This Article
Summary
במחקר זה, אנו מדגימים פרוטוקול אלקטרומיוגרפיה מעודן של סיב יחיד (SFEMG) כדי לאפשר מדידה in vivo של העברת צומת עצבית-שרירית (NMJ) במודלים של מכרסמים. גישה שלב אחר שלב לטכניקת SFEMG מתוארת כדי לאפשר כימות של השתנות העברת NMJ וכישלון בשריר גסטרוקנמיוס חולדה.
Abstract
כחיבור הסופי בין מערכת העצבים לשריר, העברה בצומת הנוירומוסקולרית (NMJ) חיונית לתפקוד מוטורי תקין. אלקטרומיוגרפיה של סיב יחיד (SFEMG) היא טכניקה רלוונטית ורגישה מבחינה קלינית המודדת תגובות פוטנציאליות לפעולה של סיבי שריר בודדים במהלך התכווצויות רצוניות או גירויים עצביים כדי להעריך את העברת NMJ. ההערכה והכימות של שידור NMJ כוללים שני פרמטרים: ריצוד וחסימה. ריצוד מתייחס לשונות בתזמון (השהיה) בין פוטנציאלי פעולה עוקבים של סיב יחיד (SFAPs). חסימה מסמלת את הכישלון של שידור NMJ ליזום תגובת SFAP. למרות SFEMG הוא מבחן מבוסס ורגיש היטב במסגרות קליניות, היישום שלה במחקר פרה-קליני היה נדיר יחסית. דו"ח זה מתאר את השלבים והקריטריונים המשמשים בביצוע SFEMG מגורה לכימות ריצוד וחסימה במודלים של מכרסמים. ניתן להשתמש בטכניקה זו במחקרים פרה-קליניים וקליניים כדי לקבל תובנות לגבי תפקוד NMJ בהקשר של בריאות, הזדקנות ומחלות.
Introduction
אלקטרומיוגרפיה של סיב יחיד (SFEMG) פותחה לראשונה על ידי Stålberg ו-Ekstedt בשנות ה-60 של המאה ה-20 כדי לזהות ולנתח פוטנציאלי פעולה מסיבי שריר בודדים, בעיקר כדי לחקור עייפות שרירים1. SFEMG היא הטכניקה הקלינית הרגישה ביותר להערכת העברת צומת נוירומוסקולרית (NMJ)2. SFEMG מתבצע על ידי רישום סלקטיבי של פוטנציאלי פעולה של סיב יחיד (SFAPs)3. העברת NMJ יכולה להיפגע עקב גורמים כמו הזדקנות 4,5 והפרעות נוירומוסקולריות שונות כגון myasthenia gravis וטרשת אמיוטרופית צידית6. יתר על כן, מצבים כגון איסכמיה, תנודות בטמפרטורה ושימוש בחומרים חוסמים עצביים-שריריים יכולים לגרום לליקויים בהעברת NMJ, המתבטאים בהשתנות מוגברת של שידור NMJ והתרחשויות של כשל NMJ2.
ישנן שתי גישות להקלטת SFEMG: SFEMG מגורה ומרצון. SFEMG מרצון כרוך ברישום SFAPs משני NMJs שסופקו על ידי אותו אקסון מנוע באמצעות אלקטרודת מחט קונצנטרית המוחדרת לשריר הנבדק במהלך הפעלה רצונית7. בהתאם לכך, SFEMG מרצון דורש שיתוף פעולה מצד הנבדק ויכול להעריך רק יחידות מוטוריות בסף נמוך (אלה המופעלות במהלך צירים חלשים)3. SFEMG מגורה משתמש בזוג אלקטרודות מעוררות כדי לעורר אקסונים מוטוריים תוך הקלטת SFAPs עם אלקטרודת מחט SFEMG המוחדרת לשריר הנבדק7.
הן ב- SFEMG מרצון והן ב- gremulated, ריצוד וחסימה הם שני הפרמטרים המשמשים להערכה וכימות של שידור NMJ8. Jitter מתאר את השונות בתזמון (השהיה) בין SFAPs עוקבים. במהלך SFEMG מרצון, הריצוד מכומת על ידי הערכת הבדלי ההשהיה בין זוג SFAPs (המסופקים על ידי אותו אקסון מנועי) במהלך 50 עד 100 פריקות רצופות. במהלך SFEMG מגורה, הריצוד מכומת על ידי הערכת הבדלי ההשהיה בין תזמון הגירוי לבין תחילת SFAP במהלך 50 עד 100 פריקות רצופות. חסימה מצביעה על כישלון של שידור NMJ להפעיל תגובת SFAP, וניתן לכמת אותה כנוכחות או היעדר של כל זוג SFAPs במהלך SFEMG מרצון או עבור כל NMJ במהלך SFEMGמגורה 2,7.
בעוד בדיקה מבוססת ורגישה במסגרת הקלינית, SFEMG יושמה רק לעתים רחוקות במחקר פרה-קליני 4,5,9,10,11,12,13,14,15,16,17,18 . בדו"ח זה אנו מתארים את הגישה לביצוע וניתוח רישומי SFEMG במודלים פרה-קליניים של מכרסמים. יתר על כן, אנו מציגים נתונים מייצגים המדגישים ממצאים מייצגים על SFEMG המצביעים על פגיעה בהעברת NMJ בעקבות מתן חומר חוסם נוירומוסקולרי שאינו מקטב, רוקורוניום.
Protocol
כל הפרוטוקולים אושרו ובוצעו בהתאם לתקנות שנקבעו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מיזורי.
1. הכנת בעלי חיים ומתן הרדמה
- לבשו ציוד מיגון אישי מתאים.
- לפני ההליך, מדדו את משקל החולדה כדי לקבוע את המינון המתאים לתרופות מבוססות משקל ולמכונות הנשמה.
- יש להשרות הרדמה עם איזופלורן בשאיפה של 3%-5%. לאחר שנקבעה רמת הרדמה נאותה, מקמו את החולדה במצב נוטה ושמרו על הרדמה עם איזופלורן בשאיפה של 1%-3%.
- ודא את הלימות עומק ההרדמה על ידי לחיצה עדינה על כרית כף הרגל האחורית עם מלקחיים כדי לבחון היעדר תגובת נסיגה.
- שמור על טמפרטורת הגוף ב 37 °C (77 °F).
- יש למרוח משחה על בסיס נפט המאושרת על ידי וטרינר על העיניים כדי למנוע יובש. עקוב אחר עומק ההרדמה על ידי התבוננות בקצב הנשימה והערכת תגובות נסיגה בעת הפעלת לחץ על כרית כף הרגל באמצעות מלקחיים.
- לגלח את הגפה האחורית כדי להיות מוערך באמצעות קוצץ. לאחר הסרת שיער נאותה, באמצעות סרט הדבקה, מקם את האיבר שיש לחקור כאשר הקרסול מקובע על 90° dorsiflexion בקירוב, הברך בהארכה, ואת הירך בחטיפה.
- עקוב ברציפות אחר הנשימה וקצב הלב של החולדה במהלך כל הניסוי.
הערה: עלייה בקצב הלב משמשת בדרך כלל כאינדיקטור לעומק הרדמה לא מספיק. - מתן isoflurane כדי להרדים את החולדה, עם מינון של 5% או יותר, עד הנשימה נפסק לפחות 3 דקות. אשר את המתת החסד על ידי עריפת ראש.
2. מיקום אלקטרודות והגדרתן
הערה: שידור NMJ של העצב הסיאטי ושריר הגסטרוקנמיוס מוערכים באמצעות מערכת אלקטרומיוגרפיה (EMG). עיין בטבלת החומרים.
- הכנס זוג מחטים מונופולריות מבודדות 28 G לגירוי העצב הסיאטי עם הקתודה לאזור הגפה האחורית הפרוקסימלית, בעוד האנודה קרובה יותר בתוך הרקמה התת עורית המכסה את העצה.
- ודא שהאלקטרודות המעוררות אינן ממוקמות בסמיכות מיידית לעצב הסיאטי או עמוק מדי כדי למנוע נזק ישיר לעצב הסיאטי או למבנים סמוכים אחרים.
- הניחו אלקטרודת טחון חד פעמית על הגפה האחורית או הזנב הנגדית.
- הניחו בזהירות אלקטרודת מחט בקוטר 27 מ"מ בקוטר 25 מ"מ שתוכננה במיוחד עבור EMG סיב יחיד, הכוללת משטח הקלטה עשוי מחומר פלטינה-אירידיום לתוך שריר הגסטרוקנמיוס הימני. ודא כי אלקטרודות SFEMG autoclaved לפני כל שימוש כדי לשמור על סטריליות.
- הכנס את אלקטרודת מחט SFEMG במקביל לסיבי שריר הגסטרוקנמיוס כדי ללכוד פוטנציאלי פעולה של סיב יחיד (SFAPs).
- הימנע מנזק לשרירים בעת החדרה ותמרון של מחט SFEMG בתוך השריר.
3. הליך אלקטרומיוגרפיה מגורה של סיב יחיד (SFEMG)
- יש להפעיל גירוי זרם קבוע על העצב הסיאטי הימני בתדר 10 הרץ באמצעות טווח עוצמה של 0.3-10 mA ומשך דופק של 0.1 ms.
- הגדר את הגדרות המסנן בתוך מסנן בתדר נמוך של 1 kHz ומסנן בתדר גבוה של 10 kHz. התאם את הרווח מ- 200 μV ל- 1000 μV לכל חלוקה כדי להקל על הדמיה של פוטנציאלים. הגדר את מהירות הטאטוא על 500 μs לכל חלוקה.
- התאם את עוצמת הגירוי כדי להפעיל ולבודד SFAPs להקלטה ולניתוח שלאחר מכן.
- כדי לזהות ולנתח תגובה כ- SFAP, ודא שהקריטריונים הספציפיים המוזכרים להלן מתקיימים: ודא שזמן העלייה מהשיא הבסיסי לשלב השלילי קטן מ- 500 μs, המשרעת המינימלית (משיא הבסיס לשלילי) היא לפחות 200 μV, והתגובה מציגה באופן עקבי התנהגות של הכל או אף אחד (גודל וצורה יציבים בין התגובות).
הערה: חיוני שהתגובות החוזרות יציגו שלבים עקביים כלפי מעלה ללא חריצים או נקודות נטייה. שים לב שהקריטריון האחרון הוא קריטי להבחנה בין אות איכות לבין סיכום של אותות מרובים.
- כדי לזהות ולנתח תגובה כ- SFAP, ודא שהקריטריונים הספציפיים המוזכרים להלן מתקיימים: ודא שזמן העלייה מהשיא הבסיסי לשלב השלילי קטן מ- 500 μs, המשרעת המינימלית (משיא הבסיס לשלילי) היא לפחות 200 μV, והתגובה מציגה באופן עקבי התנהגות של הכל או אף אחד (גודל וצורה יציבים בין התגובות).
- חשב ריצוד, או שונות של חביון SFAP (הזמן בין גירוי לשלב עולה של שיא שלילי של SFAP) בין פריקות רצופות, לאחר לפחות 50 גירויים (50-100 גירויים), ולהעריך ולכמת חסימה.
הערה: ניתן להעריך חסימה כנוכחות או היעדר בכל סינפסה או כאחוז הגירויים שאינם מצליחים לעורר פוטנציאל פעולה של סיב יחיד. ריצוד מחושב באמצעות המשוואה הבאה7 (ריצוד מחושב בדרך כלל באופן אוטומטי על ידי מערכות אלקטרומיוגרפיה קליניות):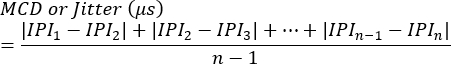
MCD = ערך ממוצע של הפרש עוקב
IPI = מרווח אינטרפוטנציאלי - חזור על התהליך לקבלת תגובות SFAP נוספות. בממוצע, להעריך 10 סינפסות מכל חיה כדי לחשב ריצוד ולאחר מכן לקבוע את הערכים הממוצעים לכל חיה.
- אל תכלול SFAPs עם ריצוד של פחות מ- 4 μs מהניתוחים כדי למנוע הכללה של פוטנציאלים שעשויים היו להתעורר על ידי גירוי שרירים ישיר11.
- בעת רישום פוטנציאלים המציגים חסימה לסירוגין, הגדל את עוצמת הגירוי כדי לוודא שכשל SFAP אינו מיוחס לגירוי תת-מקסימלי.
תוצאות
כדי להדגים ריצוד מוגבר וחסימה בהקשר של כישלון שידור NMJ, SFEMG מגורה בוצע עם וללא מתן תוך ורידי של רוקורוניום. Rocuronium הוא סוכן חוסם נוירומוסקולרי שאינו פועל בפעולה בינונית, ללא דפולריזציה, הנמצא בשימוש נרחב במסגרות קליניות כדי לגרום לשיתוק שרירים במהלך ניתוחים או הליכים רפוא...
Discussion
SFEMG משמש בדרך כלל לבדיקות אבחון בחולים עם חשד לצורות אוטואימוניות, נרכשות וגנטיות של מחלת NMJ. SFEMG נחשב הבדיקה הרגישה ביותר לאבחון של הפרעת NMJ, myasthenia gravis20,21. גירוי עצבי חוזר (RNS) היא שיטה נוספת הנפוצה יותר בבדיקות אבחון קליניות וכוללת גירוי עצב...
Disclosures
דיוויד ארנולד קיבל מימון מחקר מ-NMD Pharma ו-Avidity Biosciences והוא מייעץ ל-NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics ו-Catalyst Pharmaceuticals.
Acknowledgements
המחברים רוצים להודות לד"ר מרטין ברנדהוי סקוב מ-NMD Pharma על עצתו רבת הערך בנושא מינון רוקורוניום ולאראש קארימי מהמחלקה להנדסה ביו-רפואית באוניברסיטת סטוני ברוק על עזרתו בחישובים. מחקר זה נתמך בחלקו על ידי מימון מה-NIH ל-WDA (R01AG067758 ו-R01AG078129).
Materials
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
References
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved