É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Eletromiografia de fibra única estimulada (SFEMG) para avaliação da transmissão da junção neuromuscular em modelos de roedores
Neste Artigo
Resumo
Neste estudo, demonstramos um protocolo refinado de eletromiografia de fibra única (SFEMG) para permitir a medição in vivo da transmissão da junção neuromuscular (NMJ) em modelos de roedores. Uma abordagem passo a passo da técnica SFEMG é descrita para permitir a quantificação da variabilidade e falha da transmissão da JNM no músculo gastrocnêmio de ratos.
Resumo
Como a conexão final entre o sistema nervoso e o músculo, a transmissão na junção neuromuscular (JNM) é crucial para a função motora normal. A eletromiografia de fibra única (SFEMG) é uma técnica clinicamente relevante e sensível que mede as respostas do potencial de ação de uma única fibra muscular durante contrações voluntárias ou estímulos nervosos para avaliar a transmissão da JNM. A avaliação e quantificação da transmissão da JNM, envolve dois parâmetros: jitter e bloqueio. Jitter refere-se à variabilidade no tempo (latência) entre potenciais de ação consecutivos de fibra única (SFAPs). Bloqueio significa a falha da transmissão NMJ em iniciar uma resposta SFAP. Embora o SFEMG seja um teste bem estabelecido e sensível em ambientes clínicos, sua aplicação em pesquisas pré-clínicas tem sido relativamente rara. Este relatório descreve as etapas e critérios empregados na realização de SFEMG estimulado para quantificar o jitter e o bloqueio em modelos de roedores. Essa técnica pode ser usada em estudos pré-clínicos e clínicos para obter informações sobre a função da JNM no contexto da saúde, envelhecimento e doença.
Introdução
A eletromiografia de fibra única (SFEMG) foi inicialmente desenvolvida por Stålberg e Ekstedt na década de 1960 para identificar e analisar potenciais de ação de fibras musculares individuais, principalmente para estudar a fadiga muscular1. A SFEMG é a técnica clínica mais sensível para a avaliação da transmissão da junção neuromuscular (JNM)2. O SFEMG é conduzido pelo registro seletivo de potenciais de ação de fibra única (SFAPs)3. A transmissão da JNM pode ser comprometida devido a fatores como o envelhecimento4,5 e vários distúrbios neuromusculares, como miastenia gravis e esclerose lateral amiotrófica6. Além disso, condições como isquemia, flutuações de temperatura e uso de agentes bloqueadores neuromusculares podem resultar em deficiências na transmissão da JNM, manifestadas pelo aumento da variabilidade da transmissão da JNM2.
Existem duas abordagens para registrar o SFEMG: SFEMG estimulado e voluntário. O SFEMG voluntário envolve o registro de SFAPs de duas JNMs fornecidas pelo mesmo axônio motor usando um eletrodo de agulha concêntrico inserido no músculo que está sendo testado durante a ativação voluntária7. Assim, o SFEMG voluntário requer cooperação do sujeito e só pode avaliar unidades motoras de baixo limiar (aquelas ativadas durante contrações fracas)3. O SFEMG estimulado usa um par de eletrodos estimulantes para estimular os axônios motores durante o registro de SFAPs com um eletrodo de agulha SFEMG inserido no músculo que está sendo testado7.
Tanto no SFEMG voluntário quanto no estimulado, o jitter e o bloqueio são os dois parâmetros usados para avaliar e quantificar a transmissão daJNM8. O jitter descreve a variabilidade no tempo (latência) entre SFAPs consecutivos. Durante o SFEMG voluntário, o jitter é quantificado avaliando as diferenças de latência entre um par de SFAPs (fornecidos pelo mesmo axônio motor) durante 50 a 100 descargas consecutivas. Durante o SFEMG estimulado, o jitter é quantificado avaliando as diferenças de latência entre o tempo de estimulação e o início do SFAP durante 50 a 100 descargas consecutivas. O bloqueio indica falha da transmissão da JNM em desencadear uma resposta de SFAP e pode ser quantificado como a presença ou ausência de cada par de SFAPs durante o SFEMG voluntário ou para cada NMJ durante o SFEMG estimulado 2,7.
Embora seja um teste estabelecido e sensível no ambiente clínico, o SFEMG tem sido aplicado com pouca frequência em pesquisas pré-clínicas 4,5,9,10,11,12,13,14,15,16,17,18 . Neste relatório, descrevemos a abordagem para realizar e analisar registros de SFEMG em modelos pré-clínicos de roedores. Além disso, apresentamos dados representativos que destacam achados representativos sobre SFEMG que indicam comprometimento da transmissão da JNM após a administração de um agente bloqueador neuromuscular não despolarizante, o rocurônio.
Protocolo
Todos os protocolos foram aprovados e realizados de acordo com os regulamentos estabelecidos pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Missouri.
1. Preparação animal e administração anestésica
- Coloque equipamento de proteção individual adequado.
- Antes do procedimento, meça o peso do rato para determinar a dose apropriada para medicamentos baseados no peso e configurações do ventilador.
- Induza a anestesia com isoflurano inalatório a 3% a 5%. Uma vez estabelecido um nível adequado de anestesia, posicione o rato em decúbito ventral e mantenha a anestesia com isoflurano inalatório a 1%-3%.
- Verifique a adequação da profundidade da anestesia pressionando suavemente o coxim do membro posterior com uma pinça para observar a ausência de resposta de retirada.
- Mantenha a temperatura corporal a 37 °C.
- Aplique pomada à base de petróleo aprovada pelo veterinário nos olhos para evitar o ressecamento. Monitore a profundidade da anestesia observando a frequência respiratória e avaliando as respostas de retirada ao aplicar pressão na almofada do pé usando uma pinça.
- Raspe o membro posterior para ser avaliado usando uma tesoura. Após a depilação adequada, com fita adesiva, posicione o membro a ser estudado com o tornozelo fixado em aproximadamente 90° de dorsiflexão, o joelho em extensão e o quadril em abdução.
- Monitore continuamente a respiração e a frequência cardíaca do rato durante todo o experimento.
NOTA: Um aumento na frequência cardíaca é comumente usado como um indicador de profundidade anestésica inadequada. - Administre isoflurano para eutanasiar o rato, com uma dose de 5% ou mais, até que a respiração tenha cessado por pelo menos 3 min. Confirme a eutanásia por decapitação.
2. Colocação e configuração do eletrodo
NOTA: A transmissão do nervo ciático e do músculo gastrocnêmio pela JNM é avaliada usando o sistema de eletromiografia (EMG). Consulte a Tabela de Materiais.
- Insira um par de agulhas monopolares isoladas de 28 G para estimular o nervo ciático com o cátodo na região do membro posterior proximal, enquanto o ânodo está mais proximal dentro do tecido subcutâneo que se sobrepõe ao sacro.
- Certifique-se de que os eletrodos estimulantes não sejam colocados imediatamente próximos ao nervo ciático ou excessivamente profundos para evitar danos diretos ao nervo ciático ou outras estruturas adjacentes.
- Coloque um eletrodo de aterramento descartável no membro posterior ou cauda contralateral.
- Coloque cuidadosamente um eletrodo de agulha de calibre 27 e 25 mm projetado especificamente para EMG de fibra única, com uma superfície de gravação feita de material de platina-irídio no músculo gastrocnêmio direito. Certifique-se de que os eletrodos SFEMG sejam autoclavados antes de cada uso para manter a esterilidade.
- Insira o eletrodo de agulha SFEMG em paralelo com as fibras musculares do gastrocnêmio para capturar potenciais de ação de fibra única (SFAPs).
- Evite danos musculares ao inserir e manobrar a agulha SFEMG dentro do músculo.
3. Procedimento de eletromiografia de fibra única estimulada (SFEMG)
- Aplique estimulação de corrente constante no nervo ciático direito na frequência de 10 Hz usando uma faixa de intensidade de 0,3-10 mA e uma duração de pulso de 0,1 ms.
- Defina as configurações do filtro em um filtro de baixa frequência de 1 kHz e filtro de alta frequência de 10 kHz. Ajuste o ganho de 200 μV a 1000 μV por divisão para facilitar a visualização de potenciais. Defina a velocidade de varredura em 500 μs por divisão.
- Ajuste a intensidade do estímulo para acionar e isolar SFAPs para registro e análise subsequente.
- Para identificar e analisar uma resposta como um SFAP, certifique-se de que os critérios específicos mencionados abaixo sejam atendidos: Certifique-se de que o tempo de subida do pico da linha de base para a fase negativa seja inferior a 500 μs, a amplitude mínima (pico da linha de base para negativo) seja de pelo menos 200 μV e a resposta exiba consistentemente um comportamento de tudo ou nada (tamanho e forma estáveis entre as respostas).
NOTA: É essencial que as respostas recorrentes exibam fases ascendentes consistentes, sem entalhes ou pontos de inflexão. Observe que o último critério é crucial para distinguir um sinal de qualidade da soma de vários sinais.
- Para identificar e analisar uma resposta como um SFAP, certifique-se de que os critérios específicos mencionados abaixo sejam atendidos: Certifique-se de que o tempo de subida do pico da linha de base para a fase negativa seja inferior a 500 μs, a amplitude mínima (pico da linha de base para negativo) seja de pelo menos 200 μV e a resposta exiba consistentemente um comportamento de tudo ou nada (tamanho e forma estáveis entre as respostas).
- Calcule o jitter, ou variabilidade da latência do SFAP (tempo entre a estimulação e a fase ascendente do pico negativo do SFAP) entre descargas consecutivas, após pelo menos 50 estímulos (50-100 estímulos), e avalie e quantifique o bloqueio.
NOTA: O bloqueio pode ser avaliado como a presença ou ausência em cada sinapse ou como a porcentagem de estímulos que não conseguem desencadear a geração de potencial de ação de uma única fibra. O jitter é calculado usando a seguinte equação7 (o jitter é normalmente calculado automaticamente por sistemas de eletromiografia clínica):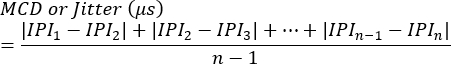
MCD = Valor médio da diferença consecutiva
IPI = Intervalo Interpotencial - Repita o processo para respostas SFAP adicionais. Em média, avalie 10 sinapses de cada animal para calcular o jitter e, posteriormente, determine os valores médios por animal.
- Excluir SFAPs com jitter inferior a 4 μs das análises para evitar a inclusão de potenciais que possam ter sido evocados por estimulação muscular direta11.
- Ao registrar potenciais que exibem bloqueio intermitente, aumente a intensidade do estímulo para verificar se a falha do SFAP não é atribuível à estimulação submáxima.
Resultados
Para demonstrar aumento do jitter e bloqueio no contexto de falha de transmissão da JNM, o SFEMG estimulado foi realizado com e sem administração intravenosa de rocurônio. O rocurônio é um agente bloqueador neuromuscular de ação intermediária e não despolarizante amplamente utilizado em ambientes clínicos para induzir paralisia muscular durante cirurgias ou procedimentos médicos. Ele opera ligando-se competitivamente aos receptores nicotínicos de acetilcolina na NMJ
Discussão
O SFEMG é comumente usado para testes diagnósticos em pacientes com suspeita de formas autoimunes, adquiridas e genéticas da doença da JNM. O SFEMG é considerado o exame mais sensível para o diagnóstico do distúrbio da JNM, miastenia gravis20,21. A estimulação nervosa repetitiva (RNS) é outro método mais comumente usado em testes diagnósticos clínicos e envolve a estimulação de um nervo periférico com uma sequên...
Divulgações
W. David Arnold recebeu financiamento de pesquisa da NMD Pharma e da Avidity Biosciences e é consultor da NMD Pharma, Avidity Biosciences, Dyne Therapeutics, Novartis, Design Therapeutics e Catalyst Pharmaceuticals.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Martin Brandhøj Skov, da NMD Pharma, por seus valiosos conselhos sobre a dosagem de rocurônio, e a Arash Karimi, do Departamento de Engenharia Biomédica da Stony Brook University, por sua assistência nos cálculos. Este estudo foi apoiado em parte por financiamento do NIH para a WDA (R01AG067758 e R01AG078129).
Materiais
| Name | Company | Catalog Number | Comments |
| 27 G Reusable Single Fiber Needle Electrode | Technomed | 202860-000 | singlefiber recording electrode |
| 2 mL Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Detachable Cable | Technomed | 202845-0000 | to connect the recorder electrode to the electrodiagnostic machine |
| Disposable 2" x 2" disc electrode with leads | Cadwell | 302290-000 | ground electrode |
| disposable monopolar needles 28 G | Technomed | 202270-000 | cathode and anode stimulating electrodes |
| EMG needle cable (Amp/stim switch box) | Cadwell | 190266-200 | to connect monopolar electrodes to electrodiagnostic stimulator |
| Helping Hands alligator clip with iron base | Radio Shack | 64-079 | Maintaining recording electrode placement |
| Isoflurane (250 mL bottle) | Piramal Healthcare | NA | |
| monoject curved tip irrigating syringe | Covidien | 81412012 | utilized for application of electrode gel |
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Pro trimmer Pet Grooming Kit | Oster | 078577-010-003 | clippers for hair removal |
| Rat Endotracheal Tubes (16 G) | Kent Scientific Corporation | ||
| Rocoronium Bromide | Sigma | PHR2397-500MG | neuromuscular blocker agent |
| Sierra Summit EMG system | Cadwell Industries, Inc., Kennewick, WA | NA | portable electrodiagnostic system |
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| Veterinarian petroleum-based ophthalmic ointment | Puralube | 26870 | applied during anesthesia to avoid corneal injury |
Referências
- Stalberg, E. Propagation velocity in human muscle fibers in situ. Acta Physiol Scand Suppl. 287, 1-112 (1966).
- Stålberg, E., Trontelj, J. V. The study of normal and abnormal neuromuscular transmission with single fibre electromyography. J Neurosci Methods. 74 (2), 145-154 (1997).
- Sanders, D. B., et al. Guidelines for single fiber EMG. Clin Neurophysiol. 130 (8), 1417-1439 (2019).
- Chugh, D., et al. Neuromuscular junction transmission failure is a late phenotype in aging mice. Neurobiol Aging. 86, 182-190 (2020).
- Padilla, C. J., et al. Profiling age-related muscle weakness and wasting: Neuromuscular junction transmission as a driver of age-related physical decline. GeroScience. 43 (3), 1265-1281 (2021).
- Selvan, V. A. Single-fiber EMG: A review. Ann Indian Acad Neurol. 14 (1), 64-67 (2011).
- Sanders, D. B., Kouyoumdjian, J. A., Stålberg, E. V. Single fiber electromyography and measuring jitter with concentric needle electrodes. Muscle Nerve. 66 (2), 118-130 (2022).
- Juel, V. C. Single fiber electromyography. Handb Clin Neurol. 160, 303-310 (2019).
- Chung, T., et al. Evidence for dying-back axonal degeneration in age-associated skeletal muscle decline. Muscle Nerve. 55 (6), 894-901 (2017).
- Iyer, C. C., et al. Follistatin-induced muscle hypertrophy in aged mice improves neuromuscular junction innervation and function. Neurobiol Aging. 104, 32-41 (2021).
- Meekins, G. D., Carter, G. T., Emery, M. J., Weiss, M. D. Axonal degeneration in the trembler-j mouse demonstrated by stimulated single-fiber electromyography. Muscle Nerve. 36 (1), 81-86 (2007).
- Gooch, C. L., Mosier, D. R. Stimulated single fiber electromyography in the mouse: Techniques and normative data. Muscle Nerve. 24 (7), 941-945 (2001).
- Chung, T., Tian, Y., Walston, J., Hoke, A. Increased single-fiber jitter level is associated with reduction in motor function with aging. Am J Phys Med Rehabil. 97 (8), 551-556 (2018).
- Sokolow, S., et al. Impaired neuromuscular transmission and skeletal muscle fiber necrosis in mice lacking na/ca exchanger 3. J Clin Investig. 113 (2), 265-273 (2004).
- Añor, S., et al. Evaluation of jitter by stimulated single-fiber electromyography in normal dogs. J Vet Intern Med. 17 (4), 545-550 (2003).
- Mizrachi, T., et al. NMO-IgG and AQP4 peptide can induce aggravation of eamg and immune-mediated muscle weakness. J Immunol Res. 2018, 5389282 (2018).
- Lin, T. S., Cheng, T. J. Stimulated single-fiber electromyography in the rat. Muscle Nerve. 21 (4), 482-489 (1998).
- Finley, D. B., Wang, X., Graff, J. E., Herr, D. W. Single fiber electromyographic jitter and detection of acute changes in neuromuscular function in young and adult rats. J Pharmacol Toxicol Methods. 59 (2), 108-119 (2009).
- Khan, Z. H., Hajipour, A., Zebardast, J., Alomairi, S. R. Muscle relaxants in anesthesia practice: A narrative review. Arch Anesthesiol Crit Care. 4 (4), 547-552 (2018).
- Padua, L., Caliandro, P., Stålberg, E. A novel approach to the measurement of motor conduction velocity using a single fibre emg electrode. Clin Neurophysiol. 118 (9), 1985-1990 (2007).
- Khoo, A., Hay Mar, H., Borghi, M. V., Catania, S. Electrophysiologic evaluation of myasthenia gravis and its mimics: Real-world experience with single-fiber electromyography. Hosp Pract. 50 (5), 373-378 (2022).
- Nannan, G., et al. A role of lamin a/c in preventing neuromuscular junction decline in mice. J Neurosci. 40 (38), 7203 (2020).
- Alley, D. E., et al. Grip strength cutpoints for the identification of clinically relevant weakness. J Gerontol A Biol Sci Med Sci. 69 (5), 559-566 (2014).
- Juel, V. C. Clinical Neurophysiology of Neuromuscular Junction Disease. Handbook of Clinical Neurology. 161, 291-303 (2019).
- Rich, M. M. The control of neuromuscular transmission in health and disease. Neuroscientist. 12 (2), 134-142 (2006).
- Juel, V. C. Evaluation of neuromuscular junction disorders in the electromyography laboratory. Neurol Clin. 30 (2), 621-639 (2012).
- Arnold, W. D., Clark, B. C. Neuromuscular junction transmission failure in aging and sarcopenia: The nexus of the neurological and muscular systems. Ageing Res Rev. 89, 101966 (2023).
- Kokubun, N. Reference values for concentric needle single fiber EMG. Rinsho Shinkeigaku. 52 (11), 1246-1248 (2012).
- Testelmans, D., et al. Rocuronium exacerbates mechanical ventilation-induced diaphragm dysfunction in rats. Crit Care Med. 34 (12), 3018-3023 (2006).
- Suzuki, K., et al. Intravenous infusion of rocuronium bromide prolongs emergence from propofol anesthesia in rats. PLoS One. 16 (2), e0246858 (2021).
- Stålberg, E., et al. Reference values for jitter recorded by concentric needle electrodes in healthy controls: A multicenter study. Muscle Nerve. 53 (3), 351-362 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados